 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Proprietatile compusilor covalenti
Substantele covalente se prezinta sub cele trei stari de agregare. Moleculele gazelor sunt formate din doi atomi, moleculele solide sunt poliatomice, de ex. molecula de sulf este formata din 8 atomi (S8), cea de fosfor din 4 atomi (P4) .
q in stare solida, formeaza retele de cristalizare atomica (diamant, grafit, sulf) sau retele moleculare; In cristalele moleculare, fortele de atractie intre molecule sunt foarte slabe, de tip Van der Waals
q au puncte de topire si fierbere coborate;
q solubilitate
Ø substantele formate din molecule nepolare sunt solubile in solventi nepolari (hidrocarburi, derivati halogenati etc.); cele care sunt solubile in apa (cum ar fi ureea, glucidele) formeaza solutii de neelectroliti (nu conduc curentul electric).
Ø substantele covalente polare (acizi, amoniac) sunt solubile in solventi polari, respectiv in apa, formand solutii de electroliti;
q unele substante covalente pot exista in doua sau mai multe structuri moleculare sau cristaline diferite (forme alotropice) : oxigenul (O2 si ozon O3 , sulful (rombic si monoclinic), fosforul (alb, rosu si negru) arsenul (metalic si galben), carbon (diamant - cu retea cubica; - grafit - care cristalizeaza stratificat in sistem hexagonal si carbune).
Legatura coordinativa
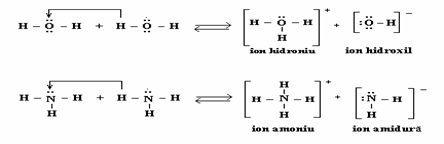
Reprezinta un caz particular al legaturii covalente si se deosebeste de ea prin faptul ca electronii pusi in comun provin numai de la unul din atomii care poseda electroni neparticipanti.:NH3 + HCl (NH4+ + Cl-)
Legatura coordinativa se mai numeste legatura donor - acceptor si se reprezinta printr-o sageata ce pleaca de la atomul ce pune la dispozitie dubletul de electroni (donor) spre atomul care se foloseste de perechea de electroni (acceptor).
Este o legatura semi-ionica sau dativa, datorita polaritatii formal castigata.
De exemplu, atomul de azot din amoniac aditioneaza la perechea de electroni neparticipanti un proton cedat de catre un acid, formandu-se ionul de amoniu
Tot prin legatura coordinativa se formeaza si ionul de hidroniu, prin aditionarea la una din perechile de electroni neparticipanti ai oxigenului din apa a unui proton cedat de un acid: H2O + HCl (H3O+ + Cl-)
1. Interactiuni de dispersie (forte de dispersie London
Actioneaza intre toate tipurile de molecule nepolare (H2, Cl2, CH4). Sunt cauzate de deformari momentane ale invelisurilor electronice in raport cu nucleele.
Aceste fluctuatii din invelis duc la aparitia unor momente de dipol instantanee care induc in moleculele vecine un dipol contrar si astfel apar forte de atractie dipol - dipol. Aceste forte se manifesta doar la molecule din imediata apropiere.
2. Interactiuni electrostatice de orientare
Apar intre molecule cu asimetrie electronica (polare) sau intre ioni si molecule polare. In moleculele polare, centrul sarcinilor pozitive difera de centrul sarcinilor negative.
Un dipol este reprezentat ca o elipsa cu semne diferite in cele doua extremitati . Putem exprima valoarea momentului de dipol ca produs intre sarcina dipolului si distanta dintre cele doua centre de sarcini. μ = e · d .
Fortele de orientare variaza invers proportional cu temperatura. La temperaturi mari, agitatia deranjeaza orientarea optima.
3. Interactiuni prin efecte inductive
Apar intre moleculele polare si nepolare. Moleculele nepolare pot dobandi un moment dipol indus sub actiunea campului electric al moleculei polare.
Momentul indus mi este proportional cu campul inductiv:
mi = e ai ,
unde a este polarizabilitatea sau deformabilitatea moleculei nepolare. Cele doua momente, indus si inductiv (m = e d) se atrag reciproc.
Prin existenta fortelor Van der Waals se explica cresterea temperaturii de topire si fierbere de sus in jos in grupele sistemului periodic ce contin nemetale (gr. VIa si VIIa). Aceste forte imprima substantelor moleculare proprietati caracteristice: cele cu masa moleculara mare si polarizabilitate mare sunt fie lichide (Br2, CS2), fie solide (S8, P4), in timp ce substantele moleculare cu masa mica sunt gaze (H2, N2, O2, CO2).
4. Fortele repulsive
La distante foarte mici intre molecule incep sa se manifeste si forte repulsive intre invelisurile electronice ale moleculelor. Deoarece fortele repulsive cresc mai repede cu micsorarea distantei decat cele atractive, reusesc sa le echilibreze pe acestea din urma si din aceasta cauza moleculele se pot apropia unele de altele numai pana la o anumita distanta.
Aceasta distanta poate fi considerata drept suma razelor Van der Waals ale moleculelor, fiind o distanta de echilibru atunci cand fortele repulsive le egaleaza pe cele atractive. Razele Van der Waals sunt mai mari ca razele atomice si se extind pana in partea exterioara a regiunii ocupate de electronii atomului .
Legatura de hidrogen este o atractie electrostatica de tip special si se figureaza printr-o linie punctata:
Aceasta legatura se explica prin capacitatea atomului de hidrogen, deja implicat intr-o legatura in cadrul unei molecule, de a forma o legatura slaba cu atomul electronegativ al altei molecule vecine, legatura numita punte de hidrogen.
Toate substantele care formeaza asociatii moleculare contin atomul de hidrogen legat covalent de un atom puternic electronegativ: fluor, oxigen, azot si mai rar clor. Conditia necesara formarii legaturilor de hidrogen este ca elementul sa fie electronegativ si sa aiba volum mic.
Explicatie: hidrogenul este legat covalent de unul din atomii electronegativi. El se deosebeste de toti ceilalti atomi prin particularitatea ca norul electronic din jurul sau este foarte subtire si sarcina pozitiva a nucleului este ecranata doar de doi electroni.
In legatura covalenta formata cu atomul electronegativ, norul electronic este deplasat spre acesta, iar atomul de hidrogen saracit in electroni (deci pozitivat) poate exercita o forta de atractie asupra unui atom electronegativ din alta molecula.
Din aceasta cauza legatura de hidrogen este de obicei liniara.
Formarea puntilor de hidrogen explica particularitatile structurale ale apei solide si lichide. In structura cristalina a ghetii, fiecare molecula de apa este inconjurata de alte patru molecule, astfel incat atomii de oxigen ai acestora sa formeze un tetraedru. Fiecare atom de hidrogen al moleculei centrale formeaza o punte de hidrogen cu cate o pereche de electroni neparticipanti ai altor doua molecule de apa.
5. Dupa tipul de particula transferata intre reactanti in timpul transforma rii:
Reactii cu transfer de electroni (redox):
A. reactii de formare a1 - prin combinare;
a2 - prin aditie;
B. reactii de descompunere b1 - electrochimica;
b2 - termica;
b3 - fotochimica;
C. reactii de substitutie c1 - in faza eterogena;
c2 - in faza omogena;
D. reactii de schimb.
Reactii cu transfer de protoni:
Formarea compusilor covalenti
Compusii covalenti au molecule polare sau nepolare.
Din aceasta categorie de reactii fac parte:
Ø formarea hidrurilor covalente (HCl, H2O, NH3, H2S etc.);
Ø formarea oxizilor covalenti (CO, CO2, NO2, SO2, (P2O3)2, (P2O5)2 etc.);
Ø formarea halogenurilor covalente (PCl3, PCl5, Al2I6, Al2Br6 etc.).
Exemplu: H2 + Cl2 (hν) → 2 HCl
- initiere Cl2 (hν) → Cl· + Cl·
- propagare Cl· + H2 → HCl + H·
H· + Cl2 → HCl + Cl·
- blocare H· + Cl· → HCl
Cl· + Cl· → Cl2
H· + H· → H2
Exemplu: S(s) + O2 (g) → SO2
S0 - 4e- → S4+ │ 4 │ 1
2 O0 + 4e- → 2 O2- │ 4 │ 1
Exemplu: PbO2 (s) + SO2 (g) → PbSO4 (s)
Pb4+ + 2e- → Pb2+ │ 1
S4+ - 2e- → S6+ │ 1
a2 Reactii de formare prin aditie
Unii produsi de reactie rezulta in urma aditiei unor radicali liberi (atomi liberi) la molecule.
Exemplu: H· + ·O=O· + ·H → H-O-O-H (H2O2)
Alte reactii redox de acest gen au loc cu formare de combinatii complexe:
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2
(tetrahidroxoaluminatul de sodiu)
In exces de NaOH, se obtine hexahidroxoaluminatul trisodic.:
2 Al + 6 NaOH + 6 H2O → 2 Na3[Al(OH)6] + 3 H2
2 Al0 - 6e- → 2 Al3+
6 H+ + 6e- → 6 H0 │ 1
b1. Descompunerea termica
Exemplu: 2 HI (3600C) → H2 + I2
2 NH3 (7000C) → N2 + 3 H2
Exemplu: descompunerea cloratului de potasiu in perclorat de potasiu si clorura de potasiu.
4 KClO3 → 3 KClO4 + KCl
Cl5+ - 2e- → Cl7+
Cl5+ + 6e- → Cl¯ │ 1
Exemplu: descompunerea percloratului de potasiu in clorura de potasiu si oxigen molecular.
KClO4 → KCl + 2 O2
Cl7+ + 8e → Cl¯
O2- - 2e - → O0 │ 4
Exemplu: descompunerea acizilor azotic si sulfuric in oxizi, apa si oxigen.
4 HNO3 → 4 NO2 + 2 H2O + O2
2 H2SO4 → 2 SO2 + 2 H2O + O2
b2. Descompunerea electrochimica
La trecerea curentului electric prin solutiile sau topiturile electrolitilor au loc procese de electroliza. Aceste procese sunt:
![]() orientarea
ionilor catre electrozi;
orientarea
ionilor catre electrozi;
![]() transformarea
ionilor in atomi sau molecule.
transformarea
ionilor in atomi sau molecule.
Exemplu: descompunerea electrochimica in topitura de NaCl.
In procesul de electroliza, reactiile redox duc la neutralizarea ionilor Na+ si Cl¯ si transformarea lor in atomi, respectiv molecule.
C (−) : 2 Na+ + 2e- → 2 Na
A (+) : 2 Cl¯ − 2e- → Cl
2 (Na+ + Cl¯) → 2 Na + Cl2
Sodiul intra intr-un proces de reducere catodica, iar clorul in procesul de oxidare anodica.
Reactia completa reprezinta insumarea celor doua reactii ce au loc aproape simultan in spatiul anodic si catodic.
Potentialul de electrod
Daca se introduce o placuta metalica in apa, un numar foarte mic de ioni metalici trec in solutie, iar o cantitate echivalenta de electroni ramane la suprafata metalului, deci acesta se incarca negativ.
Aceasta suprafata incarcata negativ atrage din solutie ioni pozitivi. Atunci cand numarul de ioni metalici care trec in solutie este egal cu numarul de ioni ce revin pe placuta, avem o stare de echilibru.
Definitie Trecerea ionilor de metal in solutie si invers creeaza pe suprafata de separare o diferenta de potential numita potential de electrod.
Potentialul de electrod pentru un metal fata de solutia sarii sale in care activitatea ionilor metalici este 1 se numeste potential normal (standard) si se noteaza cu E0.
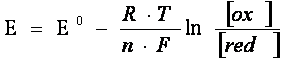 Valoarea potentialului de electrod este
data de relatia lui Nernst:
Valoarea potentialului de electrod este
data de relatia lui Nernst:
b3. Descompunerea fotochimica
Reactiile chimice provocate de lumina se numesc fotochimice.
Moleculele ce absorb o cuanta de energie egala cu energia de disociere a unei legaturi chimice se pot desface in atomi sau radicali liberi.
Exemple: reactii de descompunere ale unor hidruri (NH3), hidracizi (HI, HCl, HBr), halogenuri (AgBr, AgCl, AgI).
Ca mecanism de reactie, descompunerile fotochimice au loc in lant, prin mecanism radicalic.
Descompunerea bromurii de argint este un proces redox aplicat in tehnica fotografica.
2 AgBr (hν) → 2 Ag + Br2
Ag+ + 1e- → Ag0 │ 2
2 Br- - 2e- → Br2
c1. Reactii de substitutie in faza eterogena
a) Metalele din grupa Ia si IIa intra in reactie cu apa. Reactiile sunt de tip redox, de substituire a hidrogenului cu atomi de metal.
2 Me + 2 H2O → 2 MeOH + H2
2 Me - 2e- → 2 Me+
2 H+ + 2e- → H2
Me + 2 H2O → Me(OH)2 + H2
Me - 2e- → Me2+
2 H+ + 2e- → H2
b) Metalele reactioneaza cu acizii si sarurile lor:
2 Al + 6 HCl → 2 AlCl3 + 3 H2
Zn + 2 HCl → ZnCl2 + H2
Reactia este conditionata de taria acizilor si de pozitia metalelor in seria tensiunilor electrochimice.
c) Metalele substituie alte metale din sarurile acestora :
Cu + 2 AgNO3 → Cu(NO3)2 + 2 Ag
c2. Reactii de substitutie in faza omogena
Exemplu: Aluminotermia reprezinta reactia de obtinere a unui metal printr-o inlocuire cu altul cu potential de ionizare mai mic.
Fe2O3 + 2 Al → Al2O3 + 2 Fe
HgS + Fe → FeS + Hg
D. Reactii de schimb
Desi reactiile de schimb au loc in general fara modificarea numarului de oxidare, cazuri izolate se incadreaza in tipul reactiilor cu transfer de electroni.
2 HgCl2 + SnCl2 → Hg2Cl2' + SnCl4
Hg2Cl2 + SnCl2 → 2 Hg + SnCl4
Domenii de utilizare a reactiilor redox:
![]() obtinerea elementelor chimice;
obtinerea elementelor chimice;
![]() purificarea electrochimica a metalelor;
purificarea electrochimica a metalelor;
![]() analiza calitativa si cantitativa;
analiza calitativa si cantitativa;
![]() obtinerea de pile si acumulatori electrici;
obtinerea de pile si acumulatori electrici;
![]() metode de protectie anticorosiva.
metode de protectie anticorosiva.
Conform teoriei lui Brönsted, un acid este o specie chimica in stare sa cedeze protoni, iar o baza este specia chimica ce accepta protoni.
Acizi - neutri: HCl, H2SO4, CH3COOH, H2O etc.
- cationici: H3O+, NH4+ etc.
- anionici: HSO4−, H2PO4−, HPO42− etc.
Baze - neutre: H2O, NH3
- anionice: Cl−, HSO4−, CH3COO−, HO−
- polianionice: SO42−, HPO42−, PO43− etc
`
Amfoliti (substante amfotere)
Substantele care se comporta ca acizi in reactie cu bazele si ca baze in reactie cu acizii au caracter amfiprotic.
In functie de numarul de protoni pe care ii cedeaza, acizii pot fi monoprotici, diprotici, poliprotici.
Ca amfoliti pot functiona apa, hidroxidul de aluminiu, hidroxidul de zinc,care cu acizii formeaza saruri iar cu hidroxizii alcalini formeaza complecsi, de exemplu [Al(OH)4]−, [Zn(OH)4]2−.
Apa este si ea o substanta amfotera (amfiprotica), functionand si ca acid si ca baza. Procesul se mai numeste reactia de autoionizare (autoprotoliza) a apei. Aceasta reactie mai apare si la alte lichide, cum ar fi amoniacul.
Un loc deosebit in categoria amfolitilor il ocupa aminoacizii, substante cu doua grupari functionale distincte: functia carboxil, care imprima caracter acid si functia amino care imprima caracter bazic.
In mediu acid, amfionul se comporta ca o baza, acceptand un proton, iar in mediu bazic se comporta ca un acid, donand un proton.
Gradul de ionizare pentru electrolitii slabi
In cazul electrolitilor slabi, reactia de ionizare este un proces reversibil. Fractiunea de substanta ionizata (transformata in ioni ce pot conduce curentul electric) reprezinta gradul de ionizare al substantei respective. El se noteaza cu si se calculeaza astfel:
![]()
In functie de gradul de ionizare, electrolitii se impart in electroliti tari, atunci cand ionizarea este totala si 1 (sau valori foarte apropiate) si electroliti slabi, la care gradul de ionizare
Prin compararea comportarii acizilor in solutie apoasa poate fi apreciata diferenta de tarie intre acestia, in functie de valorile lui astfel: acizii clorhidric sau azotic sunt acizi tari, acidul fosforic este de tarie mijlocie iar acizii carbonic, acetic, sulfhidric sunt acizi slabi.
Constante de aciditate ale acizilor slabi
Considerand reactia de ionizare a unui acid slab:
HA + H2O H3O+ + A-
constanta de echilibru va avea expresia:
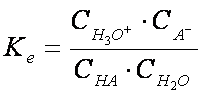
 legea dilutiei a lui Ostwald
legea dilutiei a lui Ostwald
Constante de bazicitate
Bazele, ca si acizii, sunt de doua feluri in functie de valoarea gradului de ionizare: baze tari si baze slabe.
Bazele tari sunt complet ionizate in solutie si din acest punct de vedere sunt comparabile cu sarurile.
Bazele slabe ionizeaza partial in solutie, adica mai raman si molecule neionizate. O baza slaba este amoniacul, a carui reactie de ionizare este:
NH3 + H2O NH4+ + OH-
 Echilibrul reactiei este mult deplasat
spre stanga, iar expresia corespunzatoare legii actiunii maselor este:
Echilibrul reactiei este mult deplasat
spre stanga, iar expresia corespunzatoare legii actiunii maselor este:
Cu cat valoarea constantei de bazicitate este mai mica, cu atat baza este mai slaba.
Produsul ionic al apei
Apa fiind un amfolit (compus amfiprotic), va ioniza astfel:
H2O + H2O H3O+ + OH-
Constanta de echilibru a apei va fi:
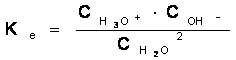
Apa este un electrolit foarte slab, deci echilibrul reactiei de ionizare va fi mult deplasat spre stanga, concentratia apei poate fi considerata constanta si va fi inclusa in constanta de echilibru. Noua constanta se noteaza cu K w
Definitie. Produsul ionic al apei se defineste ca fiind produsul concentratiilor ionilor apei sau produsul activitatilor ionilor apei.
Exponent de hydrogen
Pentru a exprima mai usor concentratia in ioni de hidrogen si mai ales variatiile acestei concentratii, s-a introdus notiunea de exponent de hidrogen, notat cu pH.
Definitie. Exponentul de hidrogen sau pH-ul este logaritmul zecimal cu semn schimbat al concentratiei ionilor de hidrogen (Sörensen, 1909).
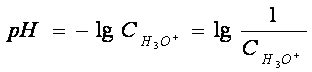
Aplicatii in biologie
![]() multe
reactii biochimice se petrec in solutii neutre, slab acide sau bazice;
multe
reactii biochimice se petrec in solutii neutre, slab acide sau bazice;
![]() pH-ul
sangelui uman este de 7,36 la 250C;
pH-ul
sangelui uman este de 7,36 la 250C;
![]() lichidele
din mediul intern al organismului sunt slab bazice, sucul gastric este puternic
acid (pH = 1,7) iar cel intestinal este bazic (pH
lichidele
din mediul intern al organismului sunt slab bazice, sucul gastric este puternic
acid (pH = 1,7) iar cel intestinal este bazic (pH
![]() dezvoltarea
normala a plantelor nu poate avea loc decat la valori de pH slab acide, neutre
sau slab bazice. In cazul in care solul are o reactie acida sau bazica, i se
corecteaza pH-ul prin aplicare de amendamente.
dezvoltarea
normala a plantelor nu poate avea loc decat la valori de pH slab acide, neutre
sau slab bazice. In cazul in care solul are o reactie acida sau bazica, i se
corecteaza pH-ul prin aplicare de amendamente.
. Reactiile de neutralizare
Ex.: HCl + NaOH = NaCl + H2O
(H+
+ Cl-) + (Na+ +
Un indicator este o substanta organica ce poate exista in doua forme: ca acid (simbol HIA) sau ca baza sa conjugata (simbol IB-). Cele doua forme se deosebesc prin culoarea lor.
Indicatorii se adauga in concentratii foarte mici intr-o solutie de acid sau baza. La un anumit pH, numit punct de viraj, indicatorul isi schimba culoarea.
Schimbarea culorii indicatorului nu se observa la punctul de viraj, ci intr-un interval de valori pH, numit interval de viraj.
Solutii tampon
Solutiile care isi schimba foarte putin pH-ul atunci cand li se adauga (in cantitati limitate) un acid tare sau o baza tare se numesc solutii tampon.
Ele sunt amestecuri echimoleculare formate dintr-un acid slab si baza sa conjugata (sarea acidului cu o baza tare) sau dintr-o baza slaba si acidul sau conjugat (sarea bazei cu un acid tare).
Exemple:
![]() reactiile
catalizate de enzime au loc cu viteze remarcabile la un anumit pH, care este
mentinut constant de catre solutiile tampon din organismele vii;
reactiile
catalizate de enzime au loc cu viteze remarcabile la un anumit pH, care este
mentinut constant de catre solutiile tampon din organismele vii;
![]() in
sange, valoarea pH-ului este mentinuta constanta prin actiunea a doua sisteme
tampon: fosfat monosodic - fosfat disodic si acid carbonic - dicarbonat de
sodiu;
in
sange, valoarea pH-ului este mentinuta constanta prin actiunea a doua sisteme
tampon: fosfat monosodic - fosfat disodic si acid carbonic - dicarbonat de
sodiu;
![]() in
sol, valoarea pH-ului este mentinuta constanta de catre numeroase sisteme
tampon: acizi humici, amestecuri de fosfati, carbonati-dicarbonati.
in
sol, valoarea pH-ului este mentinuta constanta de catre numeroase sisteme
tampon: acizi humici, amestecuri de fosfati, carbonati-dicarbonati.
3. Reactii de hidroliza
MeIR + H2O MeOH + HR
(sare) (baza) (acid)
MeI = ion metalic monovalent; R = radical acid.
Hidroliza unei sari are loc numai daca cel putin una din componentele sarii (acidul sau baza din care a provenit) este un electrolit slab. Sarurile fara hidroliza sunt acelea care provin din reactia unui acid tare cu o baza tare.
3.1. Hidroliza unei sari provenite din reactia unui acid slab cu o baza tare
Reactia de hidroliza se poate reprezenta astfel:
Me+A-+ H2O HA + Me+ +
A- + H2O HA + OH-
Exemplu: (2Na+ + CO32-) + 2H2O H2CO3 + 2(Na+ +
3.2. Hidroliza unei sari provenite din reactia unui acid tare cu o baza slaba
Me+A- + 2H2O MeOH + A- + H3O+
Me+ + 2H2O MeOH + H3O
(NH4+NO3-) + 2H2O NH4OH + H3O+ + NO3-
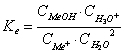
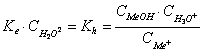
Sarea va hidroliza mai puternic cu cat baza care se formeaza este mai slaba, deci Kb este mai mica. Solutia apoasa a sarii prezinta reactie slab acida.
3.3. Hidroliza unei sari provenite din reactia unui acid slab cu o baza slaba
Me+A- + 3H2O MeOH + H3O+ + OH- + HA
Me+ + 2H2O MeOH + H3O+A- + H2O HA + HO-
Apa - dizolvant universal
In natura, apa se afla sub cele trei stari de agregare: solida, lichida si gazoasa.
![]() in stare gazoasa, sub forma de vapori, apa se
gaseste in atmosfera, in concentratie variabila in functie de temperatura si
presiune;
in stare gazoasa, sub forma de vapori, apa se
gaseste in atmosfera, in concentratie variabila in functie de temperatura si
presiune;
![]() in
stare lichida, apa formeaza hidrosfera (71 % din suprafata globului
pamantesc);
in
stare lichida, apa formeaza hidrosfera (71 % din suprafata globului
pamantesc);
![]() in
stare solida, apa se gaseste in ghetari, volumul lor din regiunea arctica si
antarctica fiind de 2,9 107 km3.
in
stare solida, apa se gaseste in ghetari, volumul lor din regiunea arctica si
antarctica fiind de 2,9 107 km3.
Solubilitatea
Definitie. Prin solubilitate sau grad de solubilitate se intelege cantitatea maxima de substanta care, la o anumita temperatura, se poate dizolva intr-o anumita cantitate de dizolvant.
Solubilitatea variaza in functie de natura substantelor dizolvate. Substantele au solubilitati diferite. Se considera ca solubile substantele care la 200C au solubilitatea mai mare de 1 g / 100 g solvent si insolubile cele cu solubilitatea mai mica de 0,1 g / 100 g solvent. Substantele cu solubilitati cuprinse intre aceste limite sunt considerate greu solubile.
Solubilitatea substantelor solide variaza cu temperatura, la unele substante in limite largi, la altele nesemnificativ.
Ø Sarurile metalelor alcaline si sarurile de amoniu sunt in general solubile. Exceptie fac unii perclorati mai putin solubili (KClO4 - greu solubil in apa rece) si unele combinatii complexe (K2[PtCl6] , (NH4)2[PtCl6] ).
Ø Toti nitratii (NO3-), cloratii (ClO3-) si acetatii (CH3COO-) sunt solubili.
Ø Clorurile (Cl-) sunt solubile exceptand CuCl, AgCl, Hg2Cl2, TiCl2 si PbCl2. Aceeasi regula este valabila si pentru ioduri (I-) si bromuri (Br-) , dar HgBr2, HgI2 si BiI3 sunt insolubile.
Ø Toate fluorurile (F-) sunt solubile cu exceptia celor ale elementelor din grupele IIa, IIb si FeF3, PbF2.
Ø Toti sulfatii (SO42-) sunt solubili cu exceptia celor ai metalelor grupei IIa, ca si sulfatii de Hg2+, Pb2+, Ag+ si Hg+.
Tipuri de combinatii chimice
In principiu, orice element se poate combina cu altul, in diferite proportii simple. Se pot forma combinatii binare (2 elemente), ternare (trei elemente) sau combinatii la care participa mai multe specii de atomi.
Combinatii binare
Definitie. Hidrurile sunt combinatiile atomului de hidrogen cu alte elemente ale sistemului periodic
Enumeram hidrurile carbonului (hidrocarburi), hidrura oxigenului (apa), hidrurile halogenilor (hidracizii) etc.
Definitie. Halogenurile sunt combinatiile halogenilor cu toate elementele , exceptand primele trei gaze rare: He, Ne si Ar.
Halogenurile metalelor sunt combinatii ionice iar cele ale nemetalelor sunt combinatii covalente.
Oxigenul este, dupa fluor, al doilea element in scara electronegativitatii. Oxizii metalelor au structura ionica si in reactie cu apa formeaza hidroxizi, iar cei ai nemetalelor au structura covalenta si sunt anhidridele acizilor oxigenati (oxiacizilor).
Definitie. Sulfurile sunt combinatii ale sulfului cu metalele si cu unele nemetale.
Sulfurile metalelor sunt importante prin aparitia lor frecventa in natura, constituind materia prima pentru obtinerea metalelor respective.
Combinatii ternare
Hidroxizii si oxiacizii sunt combinatii care contin oxigen, hidrogen si metal, respectiv nemetal.
Hidroxizii metalelor din grupele Ia si IIa sunt baze puternice. Formulele brute ale combinatiilor ternare din perioada a III-a sunt prezentate in continuare:
NaOH ; Mg(OH)2 ; Al(OH)3 ; Si(OH)4 ; H3PO4 ; H2SO4 ; HClO4
baze oxiacizi
Prin cedare de protoni, oxiacizii formeaza oxianioni, de exemplu:
SiO44‑ (ortosilicat), PO43- (fosfat sau ortofosfat), SO42- (sulfat), ClO4- (perclorat)
Oxianionii nu pot exista decat alaturi de cationi, cu care formeaza saruri
Combinatii complexe sau coordinative
Combinatiile complexe se formeaza prin reactia unor molecule cu alte molecule sau ioni. De exemplu, ionii de halogen dau ioni complecsi cu multe halogenuri covalente:
BF3 + KF → K+[BF4]- fluoroborat de potasiu
AlF3 + 3 NaF → 3 Na+[AlF6]3- fluoroaluminat de sodiu
In acelasi mod se obtin complecsi din halogenuri cu molecule ca apa sau amoniacul:
BF3 + NH3 → BF3←NH3
AlCl3 + 6 H2O [Al(H2O)6]3+ + 3 Cl-
CaCl2 + 6 NH3 → [Ca(NH3)6]2+ + 2 Cl-
Combinatii chimice ale metalelor si nemetalelor
Oxizii
Elementele din grupele principale formeaza oxizi in starea maxima de oxidare (egala cu numarul grupei din sistemul periodic). Formula generala a acestor oxizi este:
M2+O2- ; M2+O2- ; M23+O32- ; M4+O22- ; M25+O52- ; M6+O32- ; M27+O72-
structuri ionice structuri covalent-ionice structuri covalente
Oxizii metalelor din grupele Ia si IIa reactioneaza cu apa formand baze puternice, cu exceptia Li2O si MgO care reactioneaza mult mai incet:
(2 Na+ + O2-) + H2O 2 (Na+OH-). Reactia este puternic exoterma.
Oxizii nemetalelor reactioneaza si ei cu apa formand oxiacizi, iar cu hidroxizii alcalini formeaza saruri:
CO2 + H2O H2CO3 ; CO2 + Na+OH- Na+HCO3-
N2O5 + H2O 2 HNO3
SO3 + H2O H2SO4
Hidroxizii elementelor din grupele principale
Ionul hidroxil (OH-) se formeaza prin pierderea unui proton din molecula de apa. In apa, ionul hidroxil se afla in cantitate foarte mica.
Solutiile alcaline ale bazelor contin ioni OH- in functie de taria lor:
H2O + B HO- + BH+
H2O + :NH3 HO- + NH4+
Ionul HO- este baza cea mai puternica existenta in solutie apoasa.
Definitie. Hidroxizii sunt compusi care contin gruparea HO- legata de atomul unui element
Dupa structura si proprietati, hidroxizii pot fi grupati in: bazici, amfoteri si oxiacizi.
Cei bazici se obtin prin reactia metalelor alcaline si alcalino-pamantoase sau a oxizilor lor cu apa.
Cei amfoteri se obtin din sarurile metalelor grupei IIIa cu hidroxizi alcalini sau amoniac.
Oxiacizii provin din reactia oxizilor nemetalici cu apa.
Sarurile
Definitie. Sunt compusi chimici proveniti din reactia unui acid cu o baza.
Acizii di- si poliprotici pot forma saruri acide si neutre prin inlocuirea succesiva a protonilor cu alti cationi, de exemplu:
H2CO3 → HCO3- → CO32-
(acid carbonic) (dicarbonat, carbonat acid) (carbonat neutru)
H2S → HS- → S2-
(hidrogen sulfurat) (sulfura acida) (sulfura neutra)
H2SO4 → HSO4- → SO42-
(acid sulfuric) (sulfat acid) (sulfat neutru)
H3PO4 → H2PO4- → HPO42- PO43-
(acid fosforic) (fosfat primar) (fosfat secundar) (fosfat tertiar)
Sarurile acide se pot prepara prin neutralizarea incompleta a acidului, sau prin tratarea sarii neutre cu acidul:
Na2S + H2S 2 NaHS (in solutie)
Na2SO4 + H2SO4 2 NaHSO4 (in topitura)
sau:
H3PO4 + NaOH NaH2PO4 + H2O
(fosfat monosodic, fosfat primar de sodiu)
H3PO4 + 2 NaOH Na2HPO4 + 2 H2O
(fosfat disodic, fosfat secundar de sodiu)
H3PO4 + 3 NaOH Na3PO4 + 3 H2O
(fosfat trisodic, fosfat tertiar de sodiu)
Grupa Ia a sistemului periodic (metale alcaline)
Elementele din grupa metalelor alcaline sunt prezentate in tabel.
|
Element |
Simbol |
Numar atomic |
Invelisul de electroni |
Numar de oxidare |
|
Litiu |
Li |
He 2s1 | ||
|
Sodiu |
Na |
Ne 3s1 | ||
|
Potasiu |
K |
Ar 4s1 | ||
|
Rubidiu |
Rb |
Kr 5s1 | ||
|
Cesiu |
Cs |
Xe 6s1 | ||
|
Franciu |
Fr |
Rn 7s1 |
Metalele alcaline sunt componente importante ale silicatilor naturali, insolubili. Prin degradarea acestora, metalele alcaline trec sub forma de saruri solubile in apa.
Ionii de potasiu raman in cea mai mare parte adsorbiti de componentele coloidale ale solului, unde joaca un rol extrem de important pentru viata solului.
Sodiul este adsorbit mai slab de sol, trece in apele raurilor si se acumuleaza in mari si oceane. Asa se explica faptul ca apa de mare contine ioni de sodiu in proportie mult mai mare decat ioni de potasiu (in raport de 30:1).
Stare naturala:
Li - spodumen LiAl(SiO3)2
Na - halit (NaCl tehnic)
- salpetru de Chile (NaNO3 natural)
K - silvina (KCl natural)
- silvinita (KCl + NaCl)
- shönit (K2SO4 MgSO4 6 H2O
Cs si Rb se gasesc foarte rar, iar Fr se obtine din 22789Ac prin dezintegrare a
Se obtin in general prin electroliza topiturilor clorurilor lor.
Proprietati fizice
Metalele alcaline au consistenta moale, pot fi taiate cu cutitul. In taietura proaspata au luciu alb-argintiu, care dispare dupa scurta vreme din cauza oxidarii.
Densitatea este variabila, crescand cu numarul atomic; sodiul si potasiul plutesc pe apa, iar litiul pe petrol.
Se dizolva in amoniac lichid formand solutii de culoare albastra
Proprietati chimice
Formeaza hidruri, halogenuri, diferiti oxizi, hidroxizi si combinatii complexe.
Din cauza marii reactivitati, metalele alcaline se pastreaza in vase complet inchise, sub un strat de petrol cu ale carui componente nu se combina.
Importanta
Sodiul si potasiul sunt elemente indispensabile organismelor vii; sodiul este necesar animalelor si potasiul plantelor. Sodiul este asimilat de plante numai atunci cand se afla in exces in mediul inconjurator, cum este cazul la plantele marine.
Litiul joaca un rol important in creierul uman; carbonatul de litiu se foloseste in tratamentul starilor maniaco-depresive.
Ionul K+ joaca un rol foarte important in fiziologia vegetala. Este indispensabil in dezvoltarea normala a plantelor. Se aplica in sol sub forma de saruri de potasiu ca ingrasaminte chimice, alaturi de combinatiile cu azot si fosfor.
Sarurile de sodiu sunt folosite in industria fabricarii produselor cloro-sodice.
Copyright © 2025 - Toate drepturile rezervate