 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
 UNIVERSITATEA POLITEHNICA BUCURESTI
UNIVERSITATEA POLITEHNICA BUCURESTI
DEPARTAMENTUL DE BIOINGINERIE SI BIOTEHNOLOGIE
SECTIA SUBSTANTE, MATERIALE SI SISTEME BIOCOMPATIBILE
LUCRARE DE DIZERTATIE
COORDONATOR STIINTIFIC
EVALUAREA STABILITATII UNOR IMPLANTURI PE BAZA DE TITAN IN DIFERITE FLUIDE BIOLOGICE SIMULATE
CUPRINS
I. INTRODUCERE
Necesitatea Materialelor Bioactive
Alternativa bioactiva
Mecanismul de bioactivitate
Factorii care afecteaza dizolvarea bioglassului pentru a putea fi utilizat ca scaffold in ingineria tisulara
Apectele celulare ale materialelor bioactive din clasa A
Controlul genetic prin materiale bioactive
II. TITANUL ACOPERIT CU BIOGLASS
III. DESCRIEREA METODELOR DE ANALIZA
Metode electrochimice de testare a stabilitatii bioaliajelor
Spectofotometria de absorbtie moleculara in vizibil si ultraviolet
Analiza culturii celulare pe produsi
IV. DATE EXPERIMENTALE PROPRII
Obiectiv
Materiale folosite
Medii fiziologice folosite
Pregatirea electrozilor pentru masuratorile electrochimice
Tehnici electrochimice de investigare
Metode Chimice Complementare
Culturi de osteoblaste
V. CONCLUZII
Bibliografie
Anexa
I. INTRODUCERE
Materiale Bioactive folosite pentru Ingineria Tisulara "Scaffold"
Lucrarea isi propune sa aduca contributii in ceea ce priveste proiectarea si dezvoltarea unor materiale noi bioactive, prin caracterizarea comportarii la coroziune electrochimica a interfetei: Ti/ TiO2 / P2O5-CaO-SiO2/fluid fiziologic, tinand cont ca fenomenul de coroziune este un aspect al biocompatibilitatii.
Proiectarea si dezvoltarea implanturilor din biomateriale au ca scop final imbunatatirea si prelungirea vietii pacientilor. In ultimii 50 de ani, prin utilizarea materialelor ceramice s-a produs o noua revolutie in imbunatatirea calitatii vietii. Obtinerea de noi biomateriale reprezinta componentul critic al acestei revolutii. Se pune accentul pe utilizarea materialelor care activeaza mecanismele de reparare ale partilor vatamatoare ale corpului, alogrefelor regenerative si constructiilor ingineriei tisulare. Acest concept combina intelegerea osteogenezei si chondrogenezei la nivel molecular cu proiectarea unor noi materiale bioactive care stimuleaza gene ce activeaza proliferarea si diferentierea celulelor osteoprogenitare si sporeste formarea rapida a matricei extracelulare si cresterea tesutului osos nou in situ. Beneficiile economice si personale ale repararii regenerative in situ a scheletului pacientilor tineri vor fii mult crescute.
De 15 ani milioane de proteze ortopedice realizate din materiale bioinerte au fost implantate cu supravietuire excelenta. Bazele acestui succes sunt utilizarea aliajelor metalice imbunatatite cu materiale polimerice speciale si ceramice care au dus la imbunatatirea vietii a milioane de pacienti. Totusi, aceste dispozitive necesita o supravietuire de peste 30 de ani deoarece procentul de maturizare a populatiei a crescut. S-a propus un model pentru satisfacerea nevoii crescute de reparatii ortopedice pe termen lung, un model pentru accentuarea regenerarii si inlocuirii tesuturilor. Utilizarea unor astfel de materiale si mecanisme pentru repararea tesutului biologic, necesita cunoasterea biologiei moleculare. Se descrie o noua orientare alternativa biologica bazata pe utilizarea materialelor bioactive in ingineria tisulara. Conceptul utilizarii materialelor bioactive din clasa A pentru a stimula regenerarea tesutului, reprezinta fundatia stiintifica pentru crearea de scaffold resorbabile bioactive. Materialele bioactive din clasa A prezinta 11 stagii de reactii care duc la intensificarea proliferarii si diferentierii osteoblastelor si reformarea arhitecturii osului trabecular in situ.
1.1. Necesitatea Materialelor Bioactive
In ultimul secol, implanturile ortopedice au suferit o revolutie in scopul obtinerii unui model de micsorare a infectiilor osului [1,2]. Evolutia dispozitivelor metalice de fixare si dezvoltarea sistematica a protezelor articulare solide au fost critice in aceasta revolutie pentru ingrijirea sanatatii. Dispozitivele si protezele ideale, obtinute din biomateriale ortopedice trebuie sa supravietuiasca pe intreaga viata a pacientului fara sa esueze. Utilizarea acestor materiale au dus la cresterea apreciabila a timpului de viata a pacientilor [3], varsta medie curenta este de 80 ani si creste cu mai mult de 15 ani din 1960 cand pionierul Prof. Sir John Charnley utilizeaza implantul de sold cu frictiune total scazuta.
1.2 Alternativa bioactiva
In ultima decada o atentie deosebita s-a acordat utilizarii unor implanturi cu fixare bioactiva, aceasta fixare fiind definita ca o legatura interfaciala dintre implant si tesut prin formarea unui strat de hidroxiapatita biologic activa pe suprafata implantului [4,5,6]. Avantajul important al fixarii bioactive este acela ca legatura bioactiva formata la interfata implant-os este la fel sau mai puternica decat in os.
Materialele utilizate clinic pot fi clasificate in trei categorii: materiale resorbabile, bioactive si aproape inerte. Un material bioactiv este definit ca fiind un material care produce un raspuns biologic specific la interfata materialului, a carui rezultat duce la formarea unei legaturi intre tesut si material [7]. Nivelul de bioactivitate a materialului poate fii corelat cu timpul in care pentru 50% din suprafata implantului s-a realizat legatura de os (t0,5bb): Indicele de bioactivitate: IB = 100 / t0,5bb
Materialul cu IB > 8 (Clasa A) de ex. 45S5 Bioglass, va forma legaturi atat in tesutul hard cat si soft. Materialul cu IB < 8 >0 (Clasa B), de ex. hidroxiapatita sintetica, se va lega doar de tesutul hard [3]. O sticla bioactiva este acea sticla care sufera o dizolvare a suprafetei intr-un mediu fiziologic, urmata de formarea unui strat de hidroxicarbonat de apatita (HCA) [8]. Cu cat solubilitatea este mai mare a bioglasslui cu atat legatura cu tesutul este mai pronuntata [9].
1.3. Mecanismul de bioactivitate
Structura si compozitia chimica a biosticlei se modifica in timp in urma interactiei dintre biosticla si solutia apoasa [10]. O data cu acumularea de produsi dizolvati la interfata biosticla - solutie se modifica compozitia chimica si pH-ul solutiei. Factorii care contribuie la formarea legaturii rapide dintre sticla si tesut, care stimuleaza cresterea tesutului si este folosit ca dispozitiv scaffold in ingineria tisulara sunt: formarea hidroxicarbonatului (HCA) pe sticla bioactiva in urma dizolvarii silicei solubile si eliberarii ionilor de Ca+2 [11-13].
In procesul de legare completa dintre os si bioglass intervin 11 stagii, dintre care stagiile 1-5 sunt raspunsuri chimice iar stagiile 6-11 sunt raspunsuri biologice.
In primul stagiu are loc schimbul rapid dintre ionii de Na+, Ca+2, PO4-3 din sticla cu ionii
H+ si H3O+ din solutie. Mecanismul are loc prin difuzie, ducand la hidroliza silicei formand silanoli:
Si-O-Na+ + H+ +HO- → Si-OH+ + Na+(aq) + HO-
PH-ul solutiei creste ca rezultat al inlocuirii ionilor de H+ din solutie cu cationi.
Schimbul de cationi creste concentratia de hidroxil din solutie, care se va atasa de reteaua
silicei. Sticla solubila se dizolva sub forma de Si(OH)4 in solutie, ca urmare a ruperii legaturilor Si-O-Si si formarea continua a SiOH (silanoli) la interfata.
Si-O-Si + H2O → Si-OH + OH-Si
Condensarea si repolimerizarea silanolilor si formarea unui strat bogat de SiO2
la suprafata.
Si-OH + OH-Si → Si-O2
Migrarea ionilor Ca+2 si PO4-3 la suprafata stratului bogat de SiO2, formand un
film bogat in CaO-P2O5 prin incorporarea calciului si fosfatului solubili din solutie.
Cristalizarea filmului amorf de CaO-P2O5 prin incorporarea anionilor HO- si CO32- din
solutie formand un strat de hidroxicarbonat de apatita (HCA).
Adsorbtia si desorbtia factorilor de crestere biologici in stratul HCA (in timpul
procesului), pentru a activa diferentierea celulelor stem.
Actiunea macrofagilor de a indeparta resturile, permitand celulelor sa ocupe spatiul.
Atasarea celulelor stem pe suprafata bioactiva.
Diferentierea celulelor stem in osteoblaste.
Generarea matricei extracelulare pentru osteoblaste pentru formarea tesutului.
Cristalizarea matricei fosfatului de calciu anorganic in jurul celulelor osoase formand o
structura compozit.
In cazul osului, legatura interfaciala se realizeaza datorita echivalentului biologic dintre portiunea anorganica a osului si stratul de HCA format pe implantul bioactiv [14]. In cazul tesutului soft, fibrele de colagen sunt chemosorbite electrostatic, ionic si/sau prin legaturi de H2 pe stratul poros de SiO2, iar HCA precipita si cristalizeaza pe fibrele de colagen si pe suprafata bioglasului [15].
Controlul solubilitatii materialului (viteza de dizolvare) este necesar pentru scaffoldurile bioactive. Solubilitatea lenta a materialului este necesara daca scaffordul este proiectat sa aiba o viata lunga. In cazul formarii osului se cere o viteza de solubilitate controlata, ca de ex. pulberile de Bioglass 45S5 pentru grefa osoasa sau pentru formarea rapida a osului in vitro. De altfel, este fundamental intelegerea factorilor care influenteaza solubilitatea si bioreactivitatea pentru obtinerea de materiale noi utilizate in regenerarea tesuturilor in situ si ingineria tisulara.
1.4. Factorii care afecteaza dizolvarea bioglassului pentru a putea fi utilizat ca scaffold in ingineria tisulara
Parametrii solutiei precum: pH-ul initial, concentratia ionilor si temperatura au un mare efect asupra vitezei de dizolvare si chiar de precipitare a fosfatului de calciu [16]. Concentratia de ioni si pH-ul sunt modificate in timpul dizolvarii si in final afecteaza viteza de dizolvare a bioglassului. In cazul in care pH-ul ajunge in jurul unei valori critice se produce citotoxicitatea [17].
In timpul experimentului se folosesc trei tipuri de medii fiziologice:
Tris-buffer este o solutie tampon organica simpla.
SBF (simulated body fluid) este un tris-buffer cu aceeasi concentratie de ioni din sangele uman [18].
![]() α-MEN si D-MEM sunt culturi de celule care
contin ambele tipuri de componente
α-MEN si D-MEM sunt culturi de celule care
contin ambele tipuri de componente
anorganice si organice biologice din sange.
Zhong si Greenspan au aratat ca Bioglass-ul sufera o modificare rapida a suprafetei si se formeaza HCA in cantitate mare in Triss solution decat in SBF sau culturi de celule. Totusi Pereira [19] a descoperit ca nuclearea HCA are loc mai repede in SBF decat in Triss si a considerat concentratia initiala a P (40ppm) in SBF, care sprijina nuclearea HCA. Un rezultat asemanator l-a descoperit si Tsuru si aliatii [20], dar au sugerat ca dizolvarea anionilor de Ca+2 din material va creste gradul de saturatie in solutie (SBF), care este deja suprasaturata datorita precipitarii HCA si face ca precipitare sa fie mult mai usoara.
Pereira si altii [16,17]au aratat ca cresterea pH-ului sau a concentratiei ionilor de Ca+2 in SBF continand gel-glass de silice poroasa reduce timpul de inducere pentru formarea HCA heterogen, fiind in concordanta cu lucrarea lui Wirth si Gieskes [21] despre pulberile de silice anhidra, demonstrand ca viteza de dizolvare a silicei creste cu doua ordine de marime cu fiecare unitate de pH marita. Pereira si Hench au pus in evidenta formarea precipitatul de HCA omogen in SBF ce contine gel-glass silica poroasa, unde continutul de Ca+2 creste peste o valoare critica de 300 ppm [17]. Cineticile de reactie a formarii straturilor de la suprafata se modifica in mediul de cultura (ser) datorita adsorbtiei proteinelor din ser pe suprafata sticlei bioactive formand o bariera pentru nuclearea stratului de HCA [22-24].
Efectele geometrice
O schimbare a geometriei in ingineria tisulara scaffold reprezinta in general modificarea raportului dintre aria suprafetei materialului si volumul solutiei (SA/V), care influenteaza viteza de dizolvare si de asemenea va fi afectata si cantitatea de ioni eliberati din suprafata expusa in solutie.
Elsberg si altii [25] introduce in vitro filamente si cilindri de amestec obtinut din bioglass 45S5 in triss-buffer, in raport de SA/V=0,1, viteza de dizolvare a fost gasita ca fiind invers proportionala cu raza (suprafata) probei, in timp ce cresterea HCA are loc mai devreme cu cresterea razei de curbura. De asemenea, timpul de difuziune depinde de eliberarea ionilor de Ca+2 si Na+ si de modificarile de retea. Dizolvarea silicei pe termen lung manifesta doua regiuni liniare, spre deosebire de altele in care se remarca regiuni parabolic/liniare. Panta functiei este mai mica in cazul stagiilor 1-3 legate de formarea stratului de gel de silice decat cea din stagiile 4-5 referitoare a nuclearea stratului de HCA, determinand accelerarea terminarii ciclului o data cu formarea stratului de HCA.
Greenspan si altii [11] au investigat efectul raportului SA/V asupra dizolvarii pulberilor de sticla bioactiva, utilizand amestec de pulberi derivati din Bioglass 45S5 cu particule de marimi diferite, imersate in solutie tris-buffer la perioade diferite de timp.
In general, la rapoarte de SA/V ridicate, viteza de crestere a pH-ului este mare, iar pH-ul final este mai mare in acest caz decat in cazul rapoartelor SA/V mici. La raport SA/V mare se formeaza rapid stratul de fosfat de calciu dar ramane subtire in timp. La raport SA/V mai mic stratul de fosfat de calciu creste mai greu dar dupa 20 de ore grosimea stratului este mai mare. Stratul subtire la raport SA/V ridicat se poate datora inhibarii schimbului de ioni la suprafata stratului de gel de silice, de asemenea la SA/V mare se favorizeaza dizolvarea initiala, formandu-se rapid un strat initial moale de fosfat de calciu. Cand raportul SA/V se mentine constant, viteza de formare a stratului de HCA este mult mai mica in cazul particulelor mai mici datorita diferentelor fizice ca de exemplu: raza de curbura, raport masa/volum si solutia folosita. Pare a fi vorba despre dizolvare rapida in cazul particulelor de marimi mici si de asemenea de resorbabilitate mai buna, iar in cazul particulelor de dimensiuni mai mari de cresterea in grosime a formatiunii de HCA. Rezulta ca pentru ingineria tisulara scaffold sunt importante pulberile bioactive incorporate, fibrele, plasele sau spumele.
Wilson si Noletti [26] au descoperit ca particulele cu diametre de 100μm sunt mai repede resorbabile sau fagocitate de catre microfagele in vivo, in timp ce particulele de dimensiuni mai mari stimuleaza cresterea osului. Acest lucru poate fii o problema la folosirea particulelor fine, plaselor sau spumelor in scafford pentru a se atinge o dizolvare rapida si biocompatibilitate crescuta in vivo.
Schepers si altii [27] au descoperit de asemenea ca particulele de sticla cu diametrul mai mic de 300μm sunt complet resorbabile in vivo. De aceea, pentru obtinerea unor gradienti necesari disolutiei care sporeste formarea osului in situ sau in ingineria tisulara, este necesar folosirea unor clase de marimi de particule de diametre ale fibrelor sau texturii spumelor.[28, 29]
Efectele compozitiei scaffoldului de sticla bioactiva
Din 1980 sticla bioactiva a fost in general considerata ca fiind un amestec derivat 45S5 Biglass cu compozitia (46,1% SiO2, 24,4% Na2O, 26,9 % CaO si 2,6% P2O5 in procente molare) si ceramica apatita-wollastanit (A / W) [30]. Viteza mare de formare a stratului de HCA aratat in cazul amestecului derivat de sticle bioactive, se datoreaza prezentei Na2O si a altor cationi alcalini prezenti in compozitia sticlei, care duc la cresterea pH-ului solutiei la interfata implant/tesut in timpul disolutiei. Adaugarea de cationi multivalenti, cum ar fi alumina, stabilizeaza structura sticlei prin oxigenul nelegat [31] si de asemenea intarzie formarea stratului de HCA, dar abateri mici in compozitie poate modifica radical cinetica disolutiei sau chiar mecanismul de baza al legarii. [8, 32].
Hill a aratat ca cresterea continutului de SiO2 din sticla duce la scaderea liniara a temperaturii de tranzitie a sticlei, a picului temperaturii de cristalizare, a densitatii oxigenului de sticla, a densitatii sticlei si la cresterea coeficientului de expansiune termica. De asemenea, el a concluzionat ca Na2O este un distrugator de retea si creste bioactivitatea sticlei [33].
Este acceptat faptul ca cresterea continutului de silice din amestecul de sticla derivata scade viteza de dizolutie prin reducerea posibilitatii schimbului de ioni de Ca+2 si HPO-4 in solutie impiedicarea dezvoltarii unui strat de gel de silice pe suprafata sticlei. Rezulta ca continutul de aproximativ 60% de silice reduce si eventual elimina bioactivitatea amestecului derivat de sticle bioactive. Amestecurile de derivate de sticla cu continut mai mare de 60mol% silice nu sunt bioactive. Pentru ca sticlele cu un continut mai mare de 60mol% silice sa fie bioactive trebuie sa se utilizeze procesul sol-gel, care este o tehnica noua de procesare pentru sinteza sticlelor bioactive tertiare.
Sticle bioactive obtinute prin procedeul sol-gel
Li, Clark si Hench considera ca stratul de gel de silice joaca un rol important in nucleerea HCA si in cristalizarea lui, prin obtinerea bioglassului din trei componente bioactive CaO-P2O5- SiO2 prin procesul sol-gel, acest lucru infirma teoria ca Na2O este componentul activ al sticlei bioactive [19].
O solutie este un amestec de particule coloidale dispersate intr-un lichid. Coloizii sunt particule solide cu diametrul cuprins intre 1 si 100μm. Un gel este o retea rigida, interconectata, cu pori de dimensiuni submicroscopice si lanturi polimerice care ating lungimi mai mari de 1μm [30, 32-36].
Sunt cateva avantaje ale sticlei obtinuta prin procedeul sol-gel fata de amestecul derivat de sticla, acestea fiind importante pentru obtinerea tesuturilor scaffold:
Temperatura procesului este mai mica (600-700°C).
Puritate mai ridicata, necesara unei bioactivitati optime, datorita temperaturii scazute a procesului si continutului mare de silice si mic de alcali.
Homogenitatea imbunatita.
Control mai bun al bioactivitatii prin schimbarea compozitiei si a microstructurii.
Variatia structurii poate fi realizata fara modificarea compozitiei, controlul reactiei de hidroliza si policondensare in timpul sintezei.
Se poate folosii un procent mai mare de 90% de SiO2 mentinandu-se in acelasi timp bioactivitatea.
Obtinerea mult mai usoara a pulberilor [11, 30].
Bioactivitatea crescuta [12, 13, 17, 19, 36, 37].
Scala nanometrica interconectata a porozitatii poate fi variata prin controlul cineticii de disolutie sau se poate impregna cu faze active biologice cum ar fi factori de crestere.
Poate fi spongioasa pentru a furniza pori interconectati de 10 - 00 μm, imitand arhitectura osului trabecular.
Mecanismul disolutiei si formarii stratului de HCA pe sticlele bioactive obtinute prin procedeul sol-gel urmareste cele 11 stagii prezente in cazul sticlelor obtinute din amestec. Se compara caracteristicile disolutiei in cele doua cazuri.
Li si altii [38] au aratat ca pentru sticlele obtinute din amestec viteza de formare scade, spre deosebire de gel-glass CaO-P2O5-SiO2 in care compozitia SiO2 creste. Totusi, bioactivitatea sistemului ternar creste la 90mol% silice. Acest lucru se datoreaza pozitiilor de nucleatie concentrate in gel-glass. Aria suprafetei gel-glass creste cu cresterea continutului de silice, care de asemenea sporeste bioactivitatea [19, 39].
Studii in vitro realizate de Greenspan si altii [12, 13] au aratat ca in cazul gel-glass 58S obtinut prin sol-gel (60% SiO2, 36% CaO si 4% P2O5 in procente molare), viteza de disolutie este mai mare si formarea stratului de HCA este mai rapida decat in cazul Bioglass 45S5 (6ore). Acest rezultat a fost confirmat de experimentele in vivo care dupa 12 saptamani aproape toata silicea a fost eliberata din gel-glass 58S observandu-se un reziduu de fosfat de calciu. Implantul 45S5 manifesta o pierdere a ionilor de Na, dar o viteza mai redusa de disolutie a silicei si un strat de HCA mai subtire. Silica a fost eliberata cu o viteza rapida similara in ambele tipuri de materiale, in primele 6 ore. Dupa aceasta perioada viteza de disolutie a silicei este mult mai mare in cazul gel-glass 58S fata de glass 45S5. In cazul 58S dureaza 4 zile eliberarea silicei pana la stabilizare in comparatie cu 45S5. Rezultate similare au fost obtinute in vitro si de catre Hench [36] pentru particule 58S si 45S5 (300 - 710 μm) introduse in SBF, dar rezultatele obtinute in vivo de Greenspan nu arata diferente in formarea osului dupa 12 saptamani. Dimpotriva, Chou [40] a aratat intensificarea formarii osului dupa 4 saptamani a partilor tratate cu materiale obtinute prin procedeul sol-gel comparativ cu partile tratate cu glass derivat din amestec. Aria suprafetei mai mare obtinuta in cazul 58S gel-glass mesoporos, permite prelungirea schimbului de ioni si disolutia mult mai rapida in formarea osului. De altfel, formarea rapida a stratului de HCA si bioactivitate ridicata a bioglassului derivat din sol-gel, se datoreaza eliberarii unei cantitati mai mari de silice solubile care duce la nucleerea cristalelor de HCA in porii nanometrii ai gel-glassului [12].
Efectele texturii
Scala nanometrica a texturii tesutului scaffold obtinut prin tehnica sol-gel este o clasa importanta de variabile in caracterizarea acestor materiale. Structura unica mesoporoasa, interconectata (pori cu diametrul cuprins intre 2 si 50nm) a sol-gel glassului, care duce la cresterea raportului SA/V comparativ cu glass derivat din amestec, a fost gasita ca fiind factorul critic in intensificarea vitezei de disolutie si a formarii stratului de HCA. Studiile in vitro [14, 17] au aratat ca viteza de disolutie a gel-glassului 58S creste cu cresterea porozitatii si cu volumul porilor. Pentru marimi ale porilor mai mari de 2nm este necesar realizarea unei cinetici rapide. Un raport SA/V mare duce la cresterea suprafetei expuse in solutie, imbunatatind schimbul ionic (stagiul 1) si o dizolvare mai rapida a silicei solubile, necesara formarii unui strat bogat de silice poroasa. Porii cu marimi nanometrice ai gel-glassului reprezinta pozitiile de initiere pentru nucleerea cristalelor de HCA [17, 36]. Superpozitia potentialelor de suprafata [37] din interiorul porilor creste concentratia de ioni si gradul de saturare a ionilor de Ca si P, acest precipitat de HCA pare sa se formeze in primul rand in interiorul porilor. Viteza de nucleatie este deci controlata de difuzia ionilor in interiorul porilor.
Structura poroasa a bioglassului creste compozitia silicei de la 60 la 90 mol%. De asemenea, ruperea retelei gel-glass (stagiul 2) se face mult mai greu daca continutul de silice este mare, cresterea raportului SA/V duce la schimb ionic accentuat (stagiu 1). Astfel o concentratie mare de ioni de Ca+2 si HPO-4 este eliberata in solutie crescand volumul porilor [12, 17] si astfel stratul de gel de silice poate sa se formeze foarte rapid pe suprafata sticlei [19, 38].
Sticlele derivate din sol-gel dezvolta o bioresorbitate semnificativa atunci cand porii au o marime caracteristica [25]. Bioresorbtia este definita ca fiind resorbtia unui material in vivo, sub actiunea osteoblastelor, care in acest caz este atribuita retelei cu pori interconectati, ariilor suprafetelor mari si densitatea particulei mica [36]. Este dificil de controlat resorbabilitatea prin schimbarea compozitiei, controland textura poroasa ce influenteaza semnificativ degradarea [12, 16]. Biodegradarea este in primul rand guvernata de structura cristalina, marimea grauntelui, microporozitatea si cristalinitatea materialului [41].
Initial, s-a considerat ca disolutia ionilor de Ca+2 si formarea gruparii silanol pe suprafata sticlei au fost principalele cauze ale formarii stratului de HCA pe material [20]. Totusi, Pereira si Hench [17] au concluzionat ca asa cum hidroxidul de acoperire este independent de caracteristicile texturii, asa si concentratia grupelor de silanol de pe suprafata silicei nu controleaza viteza de formare a stratului de HCA. Aici nu se pune in evidenta ca grupele silanol sunt o cerinta pentru formarea HCA, dar implicarea lor nu poate fi contestata.
Pentru formarea stratului de HCA este necesar atat o suprafata negativa de schimb cat si un substrat poros [18, 17]. Silica este incarcata negativ la pH-ul fiziologic care conduce la formarea unui strat dublu electric cu cresterea numarului de cationi de la suprafata. Acest lucru pune in evidenta faptul ca pentru formarea unui strat de HCA este necesar prezenta unui strat de silice poroasa. Asadar, un strat de HCA se poate forma pe gel de silice pura poroasa intr-o solutie ce contine ioni de Ca+2 si HPO4-4 [16].
1.5. Apectele celulare ale materialelor bioactive din clasa A
Un aspect important al particulelor bioactive din clasa A este acela ca ele sunt osteoproductive cat si osteoconductive. La polul opus, materiale bioactive din clasa B induc doar osteoconductivitate, definita ca o caracteristica a tesutului crescut si legat pe o suprafata, din aceasta categorie face parte hidroxiapatita sintetica. Osteoproductivitatea are loc cand osul prolifereaza pe anumite suprafete datorita intensificarii activitatii osteoblastelor. Resorbtia redusa a particulelor bioactive din clasa A este responsabila pentru osteoproductie prin sporirea proliferarii si diferentierii celulelor osteoblaste.
Raspunsul biologic al gel-glassului, reprezentat de sistemul CaO-P2O5-SiO2, pune in evidenta ca osul se poate regenera. Moleculele biologice pot inlocui straturile hidratate in interiorul porilor de gel-glass si isi pot mentine conformatia si activitatea biologica [8, 35, 42, 43]. Majoritatea enzimelor raman active in interiorul matricei de gel hidratat si in acest caz isi sporeste activitatea. Aceste comportamente si structuri ierarhice depasesc importanta istorica a materialelor ortopedice bioinerte ca PMMA, polietilena de masa moleculara ultrainalta, otel inoxidabil, Co-Cr si aliajele de Ti, in scopul de a obtine ultrastructura si chimia moleculara ale osului.
Capacitatea de regenerare a gel-glassului bioactiv a fost pusa in evidenta prin compararea vitezelor de proliferare ale osului trabecular intr-un defect femural la iepure [44]. Particulele de sticla bioactiva 45S5 din clasa A, derivata din amestec, dezvolta viteze de crestere substantialemai mari a osului trabecular si o cantitate finala mai mare a osului decat HA sintetica din clasa B sau particulele de sticla -ceramica bioactiva. Osul trabecular restituit are o structura morfologica asemanatoare cu a osului normal al gazdei dupa 6 saptamani; totusi osul regenerat inca mai contine cateva particule de sticla bioactiva (>90 micrometrii) [44, 45]. Studii recente au aratat ca utilizarea particulelor de gel-glass bioactive in acelasi model de animal, au viteze mai mari de regenerare a osului trabecular fara particule de gel-glass reziduale sau alte compozitii de 58S sau 77S [45]. Particulele de gel-glass se resorb mult mai repede in timpul proliferarii osului trabecular. Calitatea mecanica a osului regenerat este echivalent cu cel al controlului [46]. Astfel, criterii de alograf regenerativ separe ca s-a indeplinit.
1.6. Controlul genetic prin materiale bioactive
Gene implicate in expresia fenotipului si morfogenezelor osului si articulatiei au fost descoperite, fiind calea de a afla combinatia corecta a gradientilor chimici de concentratie extracelulara si intracelulara, a complecsilor de atasare celulara si a altor stimuli necesari regenerarii tesutului in situ si in ingineria tisulara.
Grupul prof. Julia Polak a aratat recent ca 6 familii de gene sunt reglate cu ajutorul extractelor de sticla bioactiva in timpul proliferarii si diferentierii osteoblastelor primare umane in vitro [47-49]. Aceste lucruri face posibil obtinerea de noi generatii de materiale bioactive necesare pentru regenerarea osoasa si utilizate in ingineria tisulara a osului. Nivelul scazut al dizolvarii particulelor de bioglass active in mediul fiziologic exercita un control genetic asupra ciclului de culturi osteoblaste si exprimarea rapida a genelor care regleaza osteogeneza si productia factorilor de crestere [47-49]. Xynos si altii au aratat ca in 48 de ore au fost activate un grup de gene cuprinzand: factori de transcriptie nucleara si factori de crestere. Aceste rezultate au fost obtinute utilizand culturi de celule osteoblaste umane obtinute prin taierea capului femural al unor pacienti cu varste cuprinse intre 50 si 70 de ani ce au suferit o arteoplezie de sold totala [47].
In particular s-au identificat: insulina ca factor de crestere (IGF II), IGF- proteine de legatura si proteze care separa IGF II de proteinele lor de legatura [49]. Activarea unor numeroase gene de raspuns prematur si sinteza factorilor de crestere a fost aratat pentru modularea raspunsului ciclului de celule al osteoblastelor la sticla bioactiva si la produsii lor ionici de dizolvare. Aceste rezultate indica faptul ca bioglassul activ sporeste osteogeneza printr-un control direct asupra genelor care regleaza inductia si progresia ciclului de celule. De asemenea, aceste rezultate moleculare biologice confirma ca celulele osteoprogenitoare trebuie sa fie intr-un mediu chimic corespunzator pentru trecerea in ciclu celular aproape de fazele de sinteza si mitoza. Doar un numar select de celule dintr-o populatie sunt capabile sa se divida si sa devina osteoblaste mature. Numarul de celule progenitoare capabile sa fie stimulate intr-un mediu bioactiv scade cu varsta pacientului.
In 1993, in SUA, s-a folosit sticla bioactiva particulara, 45S5 bioglass, ca o grefa de os pentru repararea defectelor osului periodontal. De atunci s-au realizat numeroase studii clinice orale si maxilofaciale. Acelasi material s-a folosit in chirurgia ortopedica pentru a umple diferite defecte osoase [46].
II. TITANUL ACOPERIT CU BIOGLASS
Pentru imbunatatirea proprietatilor fiziologice ale filmelor subtiri de bioceramice s-au propus materiale noi obtinute prin combinarea ceramicelor cu componente metalice cum ar fi titanul. Biomaterialele alcatuite din substraturi biocompatibile cu proprietati mecanice corespunzatoare (ex. duritate, rezistenta) acoperite cu sticla bioactiva au capatat un interes special in implanturile de tesut hard datorita performantelor pe termen lung a acestora in corpul uman. Suprafata din sticla bioactiva favorizeaza legarea implantului cu tesutul inconjurator prin formarea unui strat de hidroxiapatita (HA) pe suprafata lor dupa implantare. Mecanismul formarii HA este acceptat [50, 51, 52-59] si implica dizolvarea ionilor de Ca din suprafata sticlei bioactive [60, 61], care suprasatureaza fluidul inconjurator. Simultat are loc dizolvarea silicei cu obtinerea grupelor silanol pe suprafata materialului ce reprezinta zone de nucleare in formarea HA si eventual pentru cristalizarea hidroxicarbonatului de apatita (HCA). Biosticla se deosebeste de sticla traditionala de tip soda- CaO-silice prin trei caracteristici compozitionale: cantitatea de SiO2 este mai mica de 60 mol%, continutul de Na2O si CaO este mai mare, iar raportul CaO/P2O5 este mai ridicat, facand ca suprafata biosticlei sa fie mult mai reactiva. Bioglassul utilizat este o sticla de silice cu continut de calciu, sodiu si fosfat in urmatoarele compozitii masice: 45%SiO2, 6% P2O5, 24,5% CaO, 24,5% Na2O, cunoscuta sub numele de bioglass 45S5. Sticlele bioactive nu se pot folosi in aplicatii care implica comportare sub sarcina deoarece continutul limitat al retelei este foarte slab. De aceea sticla se combina cu o faza dura cum ar fi metalul sau polimerul. In cazul utilizarii metalului ca suport dur, trebuie sa se investigheze comportarea lui in mediul fiziologic (coroziune, proprietatile mecanice).
Titanul si cateva din aliajele sale sunt foarte intalnite ca si biomateriale dominand in momentul de fata piata implanturilor datorita densitatii relativ mici, a proprietarilor mecanice si nu in ultimul rand unei bune biocompatibilitati. Biocompatibilitatea titanului si a aliajelor sale este asociata cu formarea unui film de oxid insolubil la nivelul caruia rezistenta la coroziune a titanului [62, 63] este suficient de mare in sistemele biologice. Dupa cum bine se stie rezistenta la coroziune este indusa de suprafata oxidului si a filmului pasiv ce se formeaza la suprafata titanului in apa [64-69]. Filmul este rapid regenerat chiar daca este distrus. Este foarte important pentru biomaterialele metalice de implant nu numai sa formeze instantaneu un film compact, dar sa-l formeze inainte de a elibera ioni metalici in corpul uman. Cand suprafata pasiva a metalului este atacata, va trece un timp pana cand ea se va regenera. Proprietatilor mecanice si biocompatibilitatea titanului se pot imbunatatii prin tratamente speciale de suprafata fizico-chimice si electrochimice cum ar fi pasivarea si anodizarea [70,71].
S-au propus diferite tehnici de acoperire a Ti cu bioglass, cum ar fi: acoperire prin imersie, depozitare electroforetica, presare electrostatica, pulverizare in flacara si pulverizare in plasma [72,73,74]. Introdusa in fluidele fiziologice, sticla bioactiva, sub actiunea coroziunii elibereaza ionii alcalini in solutie si se formeaza grupe silanol (Si-OH) si un strat de gel de silice (granule poroase de SiO2) pe suprafata sticlei ca urmare a difuziei ionilor de Ca+2 si PO4-3 si formarea unui strat amorf de CaO-P2O5, care in final cristalizeaza si duce la formarea unui strat subtire de carbonat de apatita (HCA) prin incorporarea ionilor de OH- si CO3-2 din mediul inconjurator. Proprietatile de legatura ale acestor bioceramice depind de acest strat subtire de HCA dezvoltat pe suprafata lor. Rezistenta la coroziune a substratului de titan este determinat de formarea unui strat aderent subtire de oxid de titan pe suprafata titanului sau al aliajului de titan. Filmul de oxid este alcatuit in general din TiO2. Bioactivitatea sistemului metalic utilizat ca implant combina in general efectele electrochimice si mecanice. In studiul biocompatibilitatii compozitelor se folosesc binecunoscutele tehnici electrochimice si spectroscopia infrarosu a transformatei Fouriei. In lucrarea de fata se propune sa se investigheze comportarea titanului acoperit cu bioglass in comparatie cu titanul pur in diverse fluide fiziologice. Se pune accentul pe importanta straturilor subtiri de TiO2 si hidroxiapatita asupra bioactivitatii acestor compozite. In investigatie se folosesc metode electrochimice, spectroscopia vibrationala si UV, spectroscopie electronica de baleiaj (SEM) si culturi de celule pentru determinarea citotoxicitatii.
III. DESCRIEREA METODELOR DE ANALIZA
3.1 Metode electrochimice de testare a stabilitatii bioaliajelor
Metodele electrochimice folosite in testarea stabilitatii sunt :
1. Voltametrie ciclica
2. Metoda potentiostatica dinamica (in circuit inchis)
3. Masuratori de potential in circuit deschis
4. Electrogravimetria
5. Metoda galvanostatica
Curbe de polarizare
Curba de polarizare se numeste reprezentarea grafica a dependentei supratensiunii de densitatea de curent. Curbele de polarizare se obtin practic folosind circuite electrice de polarizare. Studiul cineticii de electrod decurge la scoaterea din echilibru a interfetei metal-electrolit, prin una din urmatoarele cai:
- culostatic - cand prin interfata se trece o cantitate constanta de electricitate si se urmareste curentul sau / si potentialul;
- galvanostatic - cand se perturba curentul si se urmareste raspunsul de potential (cronopotentiometrie) si cantitatea de electricitate;
- potentiostatic - cand se perturba potentialul si se urmareste raspunsul sistemului sub forma de curent (cronoampometrie), de sarcina (cronoculometrie) sau impendanta.
O curba tipica de polarizare consta in general dintr-o regiune activa, o regiune pasiva si o regiune transpasiva. In stare activa, densitatea de curent creste rapid cu potentialul, avand ca rezultat formarea unui strat oxidic la suprafata metalului. In starea pasiva, densitatea de curent atinge o valoare limita datorita efectului protector al filmului oxidic format pe suprafata. Prin cresterea valorilor potentialului, filmul incepe sa se distruga, iar densitatea de curent creste din nou. Un film pasiv poate sa se formeze cu usurinta atunci cand densitatea curentului critic de pasivitate este mica si este stabil cand densitatea curentului de pasivitate este joasa. Filmul pasiv este rezistent deci, daca potentialul de transpasivare este mare, iar rezistenta la coroziune se evalueaza din variatia densitatii de curent functie de potential.
Urmarirea variatiei potentialului de coroziune in timp
Evolutia potentialului electrodului in timp se descrie astfel: o deplasare a potentialului de electrod in sens pozitiv poate fi asociata fie cu accelerarea reactiei de reducere (reactia catodica), fie cu inhibarea reactiei de oxidare (reactie anodica). Invers, o deplasare a potentialului de electrod in sens negativ poate corespunde fie accelerarii reactiei de oxidare, fie inhibarii reactiei de reducere. In general se poate spune ca evolutia potentialului in sens pozitiv corespunde cu formarea pe suprafata a unui film de oxid protector, pe cand deplasarea spre valori negative poate fi asociata cu reorganizarea filmului superficial intr-o configuratie mai putin rezistenta ceea ce duce la o marire a vitezei de coroziune. Alura curbelor de evolutie a potentialului de abandon poate da informatii doar calitative despre filmul de oxid existent pe suprafata electrozilor.
Metoda galvanostatica
Metoda galvanostatica (metoda saltului de curent): se aplica intr-un circuit de electroliza un curent constant la electrodul de studiat si se masoara valoarea potentialului de electrod fata de un electrod de referinta. Se polarizeaza electrodul anodic (spre valori pozitive) sau catodic (spre valori negative) impunandu-se densitati de curent de la valori mici (µA) la valori mari pana la 1 A/dm2 si pentru fiecare valoare a densitatii de curent se masoara la un voltmetru electronic potentialul de electrod.
Principiul metodei consta in fixarea in circuitul de polarizatie a unei intensitati de valoare bine determinata si citirea valorii rezultate a potentialului de electrod.
Valorile potentialelor de electrod corespunzatoare intensitatilor de curent aplicate servesc in final la traversarea curbelor de polarizatie, ε - i.
Datele experimentale se obtin cu ajutorul instalatiei prezentate in fig. 1:
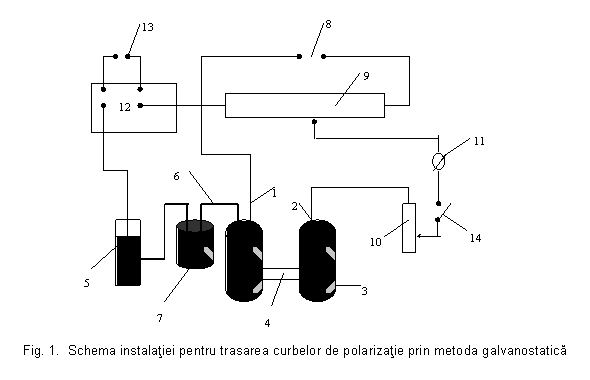
Electrodul de studiat, 1, cufundat in solutia de electrolit, este polarizat cu ajutorul contraelectrodului, 2, (electrod auxiliar) situat in cealalta ramura a celulei de polarizatie, 3. Pentru a evita impurificarea solutiei cu produsele de reactie rezultate la electrodul, 2, celula este prevazuta cu un perete poros, 4, din sticla. In vederea masurarii potentialului electrodului, 1, acesta se combina cu electrodul de comparatie, 5, (electrodul de calomel saturat) prin intermediul sifonului electrolitic, 6, si a vasului, 7. Capatul sifonului aflat in ramura electrodului de studiat este situat cat mai aproape de suprafata acestuia pentru a reduce la minim caderea de tensiune in electrolit. Vasul intermediar, 7, contine solutie saturata de NaCl care inlatura aparitia potentialului de contact lichid. Curentul de polarizare este furnizat de sursa de curent continuu, 8, (bateria de acumulatoare) prin rezistenta variabila, 9, (reostat) montat in paralel (potentiometric), prin ampermetrul, 11, si rezistenta variabila, 10, montata in serie. Reostatul, 9, permite reglarea grosiera a curentului de la valoare 0 pana la valoarea maxima pe care poate sa o furnizeze sursa de curent. Reostatul, 10, este destinat reglarii fine a curentului fixat anterior reostatului, 9. Cu ajutorul rezistentelor 9 si 10 se fixeaza la inceput valoarea cea mai mica a intensitatii curentului dupa care se determina cu ajutorul potentiometrului forta electromotoare, E, a pilei formata din electrodul de lucru, 1, si electrodul de comparatie, 3. Pentru determinari mai putin precise, potentiometrul poate fi inlocuit cu un voltmetru electronic. Se mentioneaza ca citirea tensiunii electromotoare se face numai dupa ce valoarea acesteia a ramas constanta. Dupa aceea se fixeaza o noua valoare a curentului electric si din nou se masoara forta electromotoare. Se continua in felul acesta pana la obtinerea numarului dorit de date experimentale necesare construirii curbei de polarizare potential - densitate de curent (ε - i).
Se obisnuieste ca prima determinare cu instalatia descrisa mai sus sa fie facuta pentru situatia cand electrodul de studiat nu este polarizat, pentru a obtine valoarea potentialului de echilibru (sus mentionat).
Valorile tensiunilor electromotoare, E, reprezinta chiar valorile potentialelor de electrod, ε, si pot fi folosite ca atare la trasarea curbelor de polarizatie, cu conditia sa se precizeze ca ele sunt obtinute in raport cu electrodul saturat de calomel. De obicei, insa, potentialele de electrod cu care se construiesc curbele de polarizatie, se raporteaza la electrodul normal de hidrogen. Valorile potentialului de electrod in raport cu acest electrod se calculeaza cu relatia:
E = ± (ε cal - εx) , V
unde: E - tensiunea electromotoare citita la aparat;
εcal = potentialul electrodului de calomel saturat (~250 V la 20 sC);
ε x = potentialul electrodului de studiat.
Intrucat la curbele de polarizatie se folosesc densitatile de curent, i, acestea se obtin prin impartirea intensitatilor de curent respective, I, la suprafata electrodului studiat, S.
Metoda potentiostatica dinamica (in circuit inchis)
Voltametria ciclica este una din cele mai utilizate metode de caracterizare a sistemelor electrochimice, furnizand atat informatii calitative, cat si cantitative despre sistemul studiat [75]. Prin voltametrie ciclica se pot obtine informatii privind mecanismul de desfasurare a unei reactii chimice, cinetica procesului si permite de asemenea calculul unor marimi ce intervin in proces, cum ar fi de exemplu coeficientii de difuzie ai speciilor electroactive din sistem.
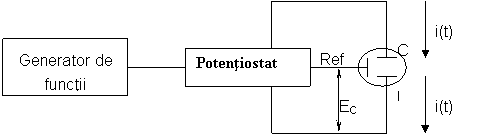 Metoda voltametriei clasice consta in
aplicarea unui semnal triunghiular de potential (fig. 2) si
inregistrarea in timp a raspunsului sistemului, respectiv a curentului
datorat proceselor electrochimice ce au loc in sistem.
Metoda voltametriei clasice consta in
aplicarea unui semnal triunghiular de potential (fig. 2) si
inregistrarea in timp a raspunsului sistemului, respectiv a curentului
datorat proceselor electrochimice ce au loc in sistem.
Fig. 2. Montajul clasic necesar unui experiment de voltametrie ciclica
Ref. - electrod de referinta
EC - potential controlat de potentiostat
C - contraelectrod
L - electrod de lucru
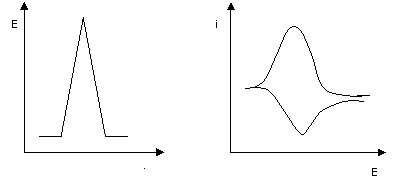 Forma
semnalului aplicat precum si a celui de raspuns sunt prezentate in
figura 3:
Forma
semnalului aplicat precum si a celui de raspuns sunt prezentate in
figura 3:
Fig. 3.
Variatia semnalului in timp este descrisa de o functie liniara de tipul:
E = Ei - v t (0 < t < λ)
E = Ei - (2 v λ + v t) (t > λ)
unde: Ei - valoarea initiala a potentialului;
t - timpul;
v - viteza de baleiaj, (Vs-1);
λ - timpul la care potentialul incepe sa fie baleiat in sens invers, iar valoarea corespunzatoare a potentialului (Eλ) reprezinta potentialul de intoarcere ("switching potential").
In metoda potentiostatica se fixeaza in circuitul de polarizare anumite valori ale potentialului si se citesc valorile corespunzatoare ale intensitatii curentului. Aparatul cu ajutorul caruia se stabileste si se mentine constanta valoarea dorita a potentialului se numeste potentiostat, de unde si denumirea metodei. Si in metoda potentiostatica se asteapta un anumit timp de la aplicarea potentialului pentru stabilizarea valorii intensitatii curentului.
Initial se determina potentialul reversibil al electrodului studiat, dupa care se trece la masurarea intensitatii pentru diferite valori ale potentialului. Valorile pentru, ε, in raport cu electrodul de hidrogen se calculeaza intocmai ca la metoda galvanostatica si servesc la trasarea curbei, ε - i. Se mentioneaza ca daca dependenta curentului de potential are un caracter monoton, atunci curbele de polarizatie potentiostatice coincid cu curbele galvanostatice.
In metoda potentiostatica dinamica se baleaza valoarea potentialului pe un interval stabilit dus - intors urmarindu-se evolutia curbei de hysteresis [76].
Determinarile experimentale se realizeaza cu ajutorul potentiostatului-galvanostatic cu interfata la calculator. Aceasta metoda are ca scop identificarea parametrilor cinetici specifici procesului de coroziune: potential de strapungere, densitatea curentului de pasivare, potential de pasivare, densitatea curentului critic.
Valorile potentialelor de electrod si intensitatile curentului se obtin cu ajutorul instalatiei prezentata schematic in figura 4:
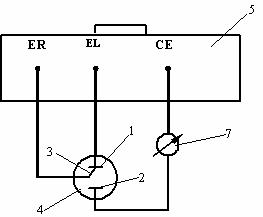 electrodul de studiat (EL)
electrodul de studiat (EL)
contraelectrodul (CE)
electrodul de referinta (ER)
celula de polarizatie
potentiostatul
potentiometrul
ampermetrul
Celula de polarizatie, 4, poate avea aceeasi forma cu cea de la metoda galvanostatica.
Valoarea dorita a potentialului de electrod se stabileste cu ajutorul potentiometrului 6, incorporat in potentiostat. Initial se determina potentialul reversibil al electrodului studiat, dupa care se trece la masurarea intensitatii pentru diferite valori ale potentialului. Valorile pentru, ε, in raport cu electrodul de hidrogen si se calculeaza intocmai ca la metoda galvanostatica si servesc la trasarea curbei, ε-i.
Se mentioneaza ca daca dependenta curentului de potential are un caracter monoton, atunci curbele de polarizatie potentiostatice coincid cu curbele galvanostatice.
Metoda rezistentei de polarizare Rp
Determinarea curentului de coroziune cu ajutorul rezistentei de polarizare are ca suport teoretic relatia lui Butler si Volmer exprimata intr-o forma simpla de tipul [77]:
I=Icor[10 (E − Ecor ) / ba −10 (E − Ecor ) / bc ] unde:
I reprezinta densitatea curentului la potentialul E
Icor este densitatea curentului de coroziune
Ecor este potentialul de coroziune
E reprezinta potentialul aplicat
basi bc sunt pantele anodica si catodica Tafel
Aceasta relatie se verifica pentru cazurile in care solutia este agitata si valorile de curent sunt atat de mici incat concentratia la suprafata electrodului sa nu difere de cea din volumul solutiei de electrolit. Pentru supratensiuni mici: η =E−Ecor relatia de mai sus se simplifica:
I=Icor . η /B unde B=babc / 2,3 (ba + bc)
Raportul η/I =Rp este definit ca rezistenta de polarizare iar Icor =B/Rp
Cu alte cuvinte rezistenta lineara de polarizare este definita ca panta dreptei ce reprezinta dependenta potential de electrod - densitate de curent in punctul corespunzator potentialului de coroziune (i=0)
Rp =ΔE/Δi
unde: ΔE= η =E−Ecor
iar Δi = ia-ic
Rezistenta de polarizare este un alt nume dat rezistentei transferului de sarcina Rct obtinuta din masuratori in curent alternativ de impedanta pentru situatia limita a frecventei unghiulare w=0.
Rezistenta de polarizare Rp este corelata cu relatia lui Stern [78] si Geary care considera reactiile de electrod a caror viteza globala este controlata de etapa transferului de sarcina.
Rp =B / icor= (ΔE/Δi ) ΔE→0 unde B=babc / 2,3 (ba + bc)
Constanta de proportionalitate B, pentru un sistem particular poate fi determinata empiric (din masuratori de pierdere de greutate) sau asa cum arata relatia lui Stern-Geary poate fi calculata din pantele ba si bc. Pantele se evalueaza experimental folosind curbele reale de polarizare. Curentul de coroziune se transforma in indice gravimetric Kg sau indice de penetratie Ip folosind legea lui Faraday.
Pentru obtinerea unor rezultate corecte trebuie tinut seama de urmatoarele dificultati principale:
Viteza de baleere, joaca un rol important in valorile densitatilor de curent corespunzatoare tuturor potentialelor impuse;
Pentru mediile corozive cu rezistenta electrica mare efectul solutiei poate sa fie semnificativ. Rezistenta electrica a mediului coroziv este diminuata cand distanta dintre capilara Haber-Loggin si electrodul de lucru este cat mai mica;
Modificarea suprafetei schimba puternic valoarea potentialului de coroziune Ecor si a pantelor curbelor de polarizare.
Vitezele de coroziune calculate cu metoda rezistentei de polarizare de 3.10-3 mm/an pentru Ti si pentru TiAlNb situeaza aceste materiale de implant in categoria "foarte stabile".
Determinarea curentului de coroziune cu metoda polarizarii lineare (Stern) [79]
Variatia supratensiunii in raport cu densitatea de curent
Rp= Δη / Δi se numeste rezistenta de polarizare Rp
Variatia de curent in jurul potentialului de coroziune obtinuta din curbele de polarizare este: icor =ia+ic Impartind toti termenii cu Δη se obtine:
Di / Δη = Δia / Δη + Δic / Δη.
Raportul Δi / Δη =1/Rp are dimensiuni de conductanta si se poate aproxima cu derivata di/dη. Cum dependenta de tensiune este data de relatia Tafel: η=a+b ln i se obtine:
di/d η= Icor [1/ba+ 1/bc] de unde icor=ba.bc/ Rp.2,303(ba+bc)
Cu icor se calculeaza vcor=36500.AM icor /96500 S [g/m2h]
Ip= Δd/t [mm/an]; d =m/Sd ; m=Ei t/F
Indicele de penetratie va fi: Ip= vcor24.365/1000.d[mm/an]
S este suprafata expusa,
δ este grosimea electrodului metalic,
d este densitatea metalului,
1000 factor de transformare a unitatilor.
Metode de evaluare a vitezei de coroziune
Evaluarea calitativa a coroziunii se face prin urmatoarele metode generale:
Analiza cu ochiul liber sau cu lupa pentru delimitarea si caracterizarea tipurilor de coroziune dupa aspectul exterior al atacului coroziv; permite observatii asupra modului de formare a crustelor, culoare si aspectul produsilor de coroziune, frecventa, distributia in adancimea zonelor corodate.
Cu ajutorul microscopului metalografic se studiaza suprafata expusa mediului coroziv apreciindu-se distributia zonelor de atac la suprafata sau in masa metalului.
Microstructura suprafetei corodate si schimbarile structurii cristalelor poate fi observata cu ajutorul microscopului optic si a altor microscoape electronice mai perfectionate. Cu ajutorul analizei microscopice se masoara adancimea atacului coroziv local si coroziunea in pitting prin detectarea numarului de puncte pe unitatea de suprafata.
Schimbarea proprietarilor fizice evalueaza deteriorarea materialului prin masurarea rezistentei la tractiune, ductibilitatii, rezistentei la soc, duritatii etc
Pentru caracterizarea cantitativa a distrugerilor corozive se efectueaza teste de laborator sau masuratori in instalatii pe baza unor indici de coroziune:
Variatia greutatii probei prin cantariri succesive se foloseste pentru determinarea vitezei coroziunii uniforme. Viteza de coroziune reprezinta variatia de masa a probei ca rezultat al coroziunii (Dm) raportata la unitatea de suprafata (S) si timp de expunere a probei in mediul coroziv (t) exprimata in orice unitati de masura.
![]() (kg/m2h).
(kg/m2h).
Este o metoda simpla, cantitativa si directa. Pentru a avea o precizie buna necesita un mare numar de determinari. Eventualele erori pot aparea datorita curatiri necorespunzatoare a probelor.
Indicele gravimetric (kg), marime standardizata STAS reprezinta viteza de coroziune exprimata obligatoriu in g/m2.zi si se noteaza kg.
![]() (g/m2.zi)
(g/m2.zi)
Indicele de penetratie, reprezinta micsorarea medie a grosimii materialului in unitatea de timp: se noteaza cu Ip si se exprima in (mm/an). Indicele de penetratie, se calculeaza din pierderea de greutate, densitatea metalului si durata expunerii.
![]() sau
sau ![]() (mm/an)
(mm/an)
unde 8760 este numarul de ore dintr-un an; g- densitate, kg- indice gravimetric.
Cu ajutorul indicelui de penetratie se fac aprecieri asupra duratei de utilizare a aliajelor.
Determinarea timpului de corodare urmareste timpul in care se produce un atac coroziv cu o adancime de 1mm.
t=i/Ip t= γ/8,7kg [ani]
Indicele volumetric de hidrogen reprezinta volumul de hidrogen degajat in procesul de coroziune in mediu acid, raportat la unitatea de timp si suprafata. Consta in masurarea volumetrica a cantitatii de hidrogen degajat. Se utilizeaza pentru probele care, in contact cu mediul coroziv, formeaza hidrogen. Volumul de H2 degajat, permite masurarea vitezei de coroziune:
kv =Δv/S.t [cm3/m2h].
Indicele volumetric de oxigen se refera la volumele de oxigen consumat in procesul de reactie, mai ales in medii neutre. Se masoara volumetric cantitatea de O2 degajata, si se efectueaza incercari de laborator in cazurile in care procesul de coroziune are loc cu absorbtie de oxigen.
Kv= Δv/S.t [cm3/m2h]
Indicele volumetric de oxigen poate fi adaptat pentru masurarea vitezei de coroziune. Atat indicele volumetric de hidrogen cat si cel de oxigen nu dau informatii despre distributia si tipul atacului coroziv. Acesti indici necesita analiza produsilor de coroziune.
Pentru formele de coroziune locala, in care pierderile de masa nu se pot pune in evidenta experimental se folosesc criterii legate de modificarea proprietatilor mecanice (rezistenta la rupere, alungire, duritate).
Variatia rezistentei electrice a probelor metalice inainte si dupa corodarea pieselor permite evaluarea coroziunii cu ajutorul relatiei:
Ke = [(R2 - R1 )/R1] .100 [Ω] cunoscand variatia sectiunii transversale ΔS=S1 - S2.
Aceasta metoda nu necesita indepartarea produsilor de coroziune. Cu ajutorul ei se traseaza curbe coroziune Ke - timp cu o singura proba. Este limitata de eventuale erori datorita raportului dintre suprafata si volum.
Masurarea potentialului de coroziune. Potentialul electrodului expus mediului coroziv masurate fata de un electrod de referenta permit trasarea curbelor potential de coroziune-timp. Curbele potential de coroziune timp dau numai informatii despre comportarea la coroziune, nu masoara direct viteza de coroziune. Aceste curbe ofera primele aprecieri asupra controlului anodic sau catodic.
Masurarea tensiunii electromotoare a celulei formate din materialul ce se corodeaza si un electrod de referinta.
Apar erori de masuratori datorita rezistentei electrice a mediului coroziv din spatiul dintre electrozi, depuneri abundente de produsi de coroziune.
Metoda curbelor de polarizare anodica si catodica. Evalueaza curentul de coroziune din reprezentarea grafica a dependentei potentialului de electrod material/mediu coroziv functie de densitatea curentului electric cu ajutorul circuitelor galvanostatice sau potentiostatice.
m=kit [g.A/cm2 sec.]
vcor = m .8760/1000γ [mmm/an]
Curbe de pasivare obtinute cu metoda voltametriei ciclice permite punerea in evidenta a stabilitatii filmelor pasive punand in evidenta potentialul de strapungere.
Metoda coulometrica la curent constant permite calcularea cantitatii de film, facand uz de legea lui Faraday, precum si calcularea grosimii filmului δ, cu ajutorul unei relatii de forma:
δ = 100QM/ FnSd unde S este aria reala a suprafatei, d este densitatea filmului, Q reprezinta cantitatea de electricitate consumata in proces, M greutatea moleculara a oxidului, n este numarul de electroni implicati in proces, F=96500 A.sec. Aceasta metoda este aplicabila numai proceselor ce decurg cu o eficienta a curentului de 100%.
Controlul nedistructiv sau defectoscopie nedistructiva pune in evidenta formele coroziunii locale. In acest scop se utilizeaza urmatoarele metode specifice:
defectoscopia magnetica care pune in evidenta defectele de la suprafata pieselor precum si cele de la mica adancime;
defectoscopia cu ultrasunete pentru detectarea defectelor relativ mari;
defectoscopie cu ajutorul radiatiilor Roentgen, se utilizeaza pentru detectarea defectelor a caror grosime este sub 40mm;
defectoscopia cu ajutorul betatroanelor pentru controlul atacului coroziv al pieselor turnate, suduri, lingouri;
defectoscopia cu ajutorul izotopilor radioactivi masoara radioactivitatea stratului metalic corodat.
Evaluarea vitezei de coroziune in medii ionice (coroziunea electrochimica) se realizeaza cu metode rapide de investigare, cum sunt cele electrochimice. Calculul vitezei de coroziune se face cu ajutorul curentului de coroziune stabilit din curbele de polarizare Reprezentarea grafica a potentialului de electrod φ(v) sau a supratensiunii η(V) functie de densitatea de curent (A/cm2)]. Alegerea metodei folosite depinde de o serie de factori, cum sunt tipul dependentei supratensiune - densitate de curent, natura procesului global de coroziune studiat, aparatura la dispozitie. Indiferent de metoda se recurge la trei electrozi legati in doua circuite separate: circuitul de polarizare cu care se impune fie un curent constant (metoda galvanostatica), fie un potential constant intre electrodul de lucru si cel de referinta (metoda potentiostatica) si alt circuit pentru masurare respectiv a potentialului sau a curentului.
Metoda este ilustrata in fig. 5. unde se trec in ordonata atat valorile potentialului reactiei de dizolvare anodica a metalului cat si cele ale reactiei de depolarizare iar in abscisa valoarea absoluta a logaritmului densitatii de curent (lg i/S) [80]. Curbele de polarizare aratate in fig. 5.
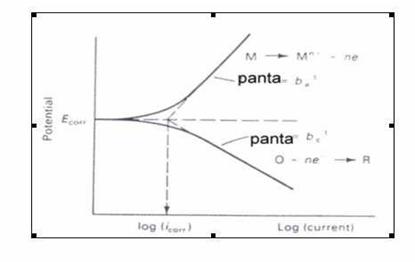
sunt obtinute pe baza datelor
experimentale obtinute cu ajutorul circuitelor de polarizare
galvanostatice sau potentiostatice.
Fig.5. Curbele de polarizare si extrapolarea domeniilor lineare
Coordonatele punctului de intersectie a tangentelor la partea liniara a celor doua curbe de polarizare (anodica si catodica) φ(v)-i/S sau η(V)-i/S reprezinta potentialul de coroziune φcor(v).
Densitatea curentului corespunzator potentialului de coroziune reprezinta chiar densitatea curentul de coroziune.
Relatia dintre viteza de coroziune,
exprimata sub forma de moli transformati pe unitatea de timp
si de suprafata vcor=Δm/St si icor/S,
densitatea curentului de coroziune poate fi exprimata de relatia: ![]() , unde icor reprezenta intensitatea
curentului in amperi, z este numarul de electroni transferati in
reactiile ce intervin in procesul de coroziune.
, unde icor reprezenta intensitatea
curentului in amperi, z este numarul de electroni transferati in
reactiile ce intervin in procesul de coroziune.
Dupa
legea lui Faraday, cantitatea de substanta transformata intr-un
proces electrochimic este egala cu: ![]() sau
sau ![]()
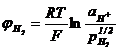 si
si 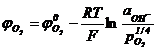
3.2. Spectrofotometria de absorbtie moleculara in vizibil si ultraviolet
Spectrofotometria de absorbtie moleculara in vizibil si ultraviolet prezinta o caracteristica comuna: absorbtia radiatiei provoaca tranzitii electronice cuplate cu tranzitii de vibratie si tranzitii de rotatie. In consecinta spectrul de absorbtie contine benzi largi, ceea ce face ca metoda sa fie susceptibila de interferente. Eliminarea interferentelor se realizeaza fie prin separarea componentilor insotitori, fie prin alegerea adecvata a compozitie probei-martor.
Tot pentru eliminarea interferentelor se utilizeaza frecvent reactiile chimice specifice, prin care analitul este transformat cantitativ intr-o forma mai putin afectata de interferenti. Astfel, pentru determinarea ionilor metalici se utilizeaza, de obicei, reactii chimice cu formare de combinatii coordinative.
Spectrofotometria de absorbtie moleculara (denumita uzual spectofotometrie) poate fi aplicata atat ca metoda directa cat si ca metoda indirecta. In prima varianta determinarea se realizeaza cu ajutorul unui grafic de etalonare construit conform relatiei: A=ε.c.l, iar in cea de-a doua varianta titrantul se alege astfel incat prin reactia lui cu analitul sa se formeze o combinatie cu proprietati absorbante sau, dimpotriva, o astfel de substanta sa dispara din solutie pe masura ce avanseaza titrarea.
Spectrometria de absorbtie moleculara in infrarosu
In domeniul infrarosu energia fotonilor este prea mica pentru a produce tranzitii electronice. De aceea se observa numai tranzitii de vibratie si de rotatie. Absorbtia radiatiei infrarosii este conditionata de modificarea momentului dipol al moleculei in urma schimbarii starii vibrationale sau rotationale. Rezulta ca aproape toate moleculele continand legaturi covalente prezinta anumite benzi specifice de absorbtie in infrarosu. Fac exceptie moleculele diatomice ale elementelor, deoarece nu exista niciun mod de vibratie sau de rotatie care sa produca un moment-dipol.
De obicei, spectrele de absorbtie in infrarosu se prezinta ca transmitanta functie de numarul de unda sau lungimea de unda si benzile de absorbtie apar sub forma unor minime pronuntate. Fiecare banda corespunde unui grup distinct de atomi legati chimic. Astfel de grupare atomica prezinta benzi specifice la aceleasi lungimi de unda indiferent de lungimea moleculei pe care este atasata. Aceasta proprietate importanta permite detectia si identificarea unui compus sau a unei clase de compusi prezenti in proba [81].
Determinarile cantitative se pot realiza pe baza legilor lui Lambert-Beer, dar aplicatiile sunt mai restranse in comparatie cu spectroscopia in ultraviolet-vizibil.
Rezultatele analizelor prin spectroscopia in infrarosu dau informatii utile cu privire la evenimentele ce au loc la interfata si anume fenomenul de absorbtie. Absorbtia anionilor a fost pusa in evidenta in produsii de coroziune de pe suprafata metalica. Probele au fost colectate de pe filmul format pe suprafata bioglassului in biofluide.
3.3. Analiza culturii celulare pe produsi
Biocompatibilitatea este un concept complex care ia in considerare toate procesele care au loc la interactiunea dintre biomaterial si un organism viu.
Termenul de biocompatibilitate se refera la capacitatea unui material de a intra in contact cu un tesut viu fara a produce efecte toxice sau leziuni. Nu exista o biocompatibilitate completa, si aspectele biocompatibilitatii nu trebuie private static atata timp cat de ex. un implant care astazi este osteointegrat poate ca maine nu va mai fi. Este clar deci ca la nivel conceptual, biocompatibilitatea trebuie inteleasa sub aspectul ei dinamic tinand seama ca, asemenea unor altor notiuni stiintifice importante, conceptul de biocompatibilitate a evoluat odata cu dezvoltarea biomaterialelor cu aplicatii medicale specifice. Astfel principiul legat de biomaterialul inert, existent in dictionarul biomaterialelor in care definitia biocompatibilitatii este "calitatea de a nu prezenta efecte toxice sau adverse, asupra sistemelor biologice" [82], este inca in vigoare pentru un material individual, dar s-a extins si conform definitiei lui Williams revizuita, discutiile trebuind mutate de la material la o anume aplicatie [83]. Biocompatibilitatea ar trebui deci definita in mod unic pentru fiecare aplicatie [84].
In prezent exista teste de biocompatibilitate stabilite de ISO [85] (International Organization for Standardization) si FDA (Food Drug Administration) care permit predictii privind modul in care un biomaterial va reactiona la contactul cu un tesut viu. ISO a publicat un ghid ISO al biocompatibilitatii (Biocompatibility Testing Matrix), care cuprinde diferite teste in functie de tipul de contact biomaterial-om, durata contactului si utilizarea clinica. Pentru o anumita categorie de devize se recomanda un numar de teste de biocompatibilitate. Majoritatea testelor sunt realizate in conditii de laborator controlate conform GLP (Good Laboratory Practices).
Standardele ISO prezinta modul in care probele pentru evaluarea biologica trebuie selectate, preparate si supuse extractiei, si subliniaza faptul ca articolul de testat trebuie sa fie un specimen reprezentativ al dispozitivului si deci trebuie tratat (coated or sterilized) in acelasi fel ca dispozitivul.
Deoarece potentialul toxic al materialelor si dispozitivelor depinde intr-un mare grad de solubilizare si de toxicitatea componentelor solubile, extractele sunt utilizate in mod normal in teste. In unele teste, totusi evaluarea se realizeaza in conditii de utilizare a dispozitivului. Ideal, se utilizeaza medii de extractie cu polaritati scazute pentru a asigura extractia componentelor cu diferite solubilitati. Cele mai comune medii de extractie sunt serul fiziologic, uleiuri vegetale, dimetilsulfoxid si etanol. In anumite cazuri se utilizeaza medii de extractie ca polietilenglicol sau solutii apoase de etanol. Pentru testarea citotoxicitatii in vitro sa utilizat mediul de cultura a celulelor.
Extractia poate fi realizata la diferite temperaturi. Unii compusi solubilizati pot fi alterati chimic la temperaturi mari deoarece se recomanda ca temperatura de extractie 37°C-simuland temperatura corpului-timp de 72 ore. Pentru testarea citotoxicitatii in vitro, se recomanda extractia la 37°C timp de 24 ore, unele componente ale mediului fiind termolabile.
Cantitatea de substante solubilizate de un mediu de extractie este raportata la suprafata sau la grosimea produsului supus extractiei. Recomandarile variaza de la 1,25 la 6 cm2 de produs per 1 ml mediu de extractie, in functie de dimensiunile si forma produsului, sau de la 0.1 la 0.2g produs per ml mediu de extractie cand suprafata este dificil de estimat (pulberi, granule). In orice caz, proprietatile specifice ale produsului trebuie luate in consideratie in cazul unor extracte particulare.
In cazul in care dispozitivul este format din diferite biomateriale, se realizeaza extractia si testarea toxicologica a diferitelor materiale in mod separat. In unele situatii acest lucru nu este practic posibil si se realizeaza teste pe extractele intregului dispozitiv.
Teste de control biologic nu sunt descrise de ISO 10993 pentru evaluarea biologica a dispozitivelor medicale, deoarece aceste teste particulare sunt desemnate in principal unor scopuri de control batch. Astfel de teste sunt utilizate si in timpul fazei de productie pentru a identifica surse de contaminare si a stabili procedee care asigura calitatea produsului final.
Teste de control microbiologic - sunt necesare pentru a stabili statusul microbiologic al unui produs final, ca sterilitatea, absenta bacteriilor patologice sau limitele numarului de microbi. Mai mult este necesara monitorizarea incarcarii microbiologice a materialelor brute, produsilor intermediari sau de a urmari eficienta proceselor de sterilizare. Testele sunt realizate prin spalarea materialelor sau produsilor cu o solutie fiziologica si determinarea microbilor in mediul de spalare sau prin incubarea directa a produsilor intr-un mediu de crestere.
Teste pentru endotoxine - Orice dispozitiv medical steril poate contine lipopolizaharide care provin din peretele celular al unor bacterii gram-negative. Astfel, endotoxinele sau compusii pirogeni pot produce o stare febrila dupa contactul direct al bolnavului cu catetere venoase, seringi sau componente de implant.
Exista doua metode biologice diferite pentru evaluarea prezentei endotoxinelor: the rabbit pyrogen test si the Limulus test. In ambele cazuri suprafata produsului a fost spalata cu apa, eluatul fiind folosit pentru testarea endotoxinelor. In «the rabbit pyrogen test», eluatul este injectat intravenos, iar temperatura rectala a animalului este masurata dupa injectie. In «Limulus test», eluatul este incubat cu lizatul sangelui crabului Limulus polyphemus, care contine o substanta care formeaza un gel in prezenta endotoxinelor.
Testul toxicitatii nenspecifice. Testul determina orice efect advers nespecific ce apare ca urmare a injectiei intravenoase a eluatului de pe dispozitiv in soarece. Testul este adesea realizat din acelasi eluat utilizat pentru testul pirogen.
IV. DATE EXPERIMENTALE PROPRII
4.1. Obiectiv
Lucrarea isi propune sa caracterizeze comportarea la coroziune electrochimica a interfetei: Ti/ TiO2 / P2O5-CaO-SiO2/fluid fiziologic, tinand cont ca fenomenul de coroziune este un aspect al biocompatibilitatii. De asemenea in acest studiu se va investiga bioactivitatea si schimbarile structurale ale suprafetei de 45S5, care a fost pulverizata in plasma pe titan, si expusa in fluide fiziologice si analizat, prin metode complementare.
4.2. Materiale folosite
Electrozii de lucru sunt titanul si titanul acoperit cu bioglass, elaborati in forma cilindrica din bare masive ale metalului obtinute prin turnare. Aria expusa solutiilor simulate a fost de 1 cm2. Compozitia chimica a acestor electrozi este urmatoarea:
Electrod de titan (Ti): 0.056% N2, 0.015% Fe, 0.205% O2, 0.015% H2, 0.09% Al, 99.619% Ti;
Electrod de titanul acoperit cu bioglass, cunoscut sub numele de 45S5 (45%SiO2, 6% P2O5, 24.5% CaO si 24.5 % Na2O toate in procente de masa), preparat prin amestecarea la 1400˚C timp de patru ore si imbibat cu apa pentru obtinerea de pudra din sticla. Pulberea a fost macinata intr-o moara cu cutite pentru a se obtine o marime a particule cuprinsa intre +63-212µm care sunt corespunzatoare in aplicatiile de tip pulverizare in plasma. Prin pulverizarea in plasma pe titan se depune pulberea de sticla. Parametrii procesului sunt aceleasi ca in procedeul de depunere existent in literatura [61].
-Raportul CaO/P2O5 = 4.
- Pentru imbunatatirea adeziunii sticlei cu substratul metalic se aplica un strat de oxizi (Al2O3 si TiO2), in concentratii mici.
- Grosimea stratului de biosticla este de 110mm.
4.3. Medii fiziologice folosite
Mediile simulate in care s-au realizat studiile au fost solutii fiziologice de diferite compozitii preparate din retete publicate in literatura de specialitate. In tabelul 1 sunt indicate compozitiile chimice, pH-ul si agresivitatea solutiilor fiziologice folosite, exprimata prin continutul ionilor de Cl-:
|
Solutie |
Substanta |
Compozitia (g/l) |
pH si concentratia ionilor de Cl- |
|
Ringer 2 |
NaCl KCl NaHCO3 MgCl2.6H2O MgSO4.7H2O Na2HPO4.12H2O NaH2PO4.H2O |
1.141.10-1 mol/l |
|
|
Afnor Saliva artificiala |
NaCl KCl Na2HPO4 K2HPO4 NaHCO3 KSCN Ureea |
0.287.10-1 mol/l |
|
|
SBF Mediu fiziologic simulat cel mai agresiv |
NaCl NaHCO3 KCl K2HPO4 MgCl2.6H2O CaCl2.6H2O Na2SO4.10H2O |
1.26.10-1 mol/l |
|
|
Buffer solution |
NaCl NaHCO3 Na2HPO4 NaH2PO4 |
0.053.10-1 mol/l |
Tabel 1. Compozitia chimica a solutiilor de electroliti.
4.4. Pregatirea electrozilor pentru masuratorile electrochimice
Biomaterialele utilizate in analizele experimentale sunt electrozii de Ti cu suprafata foarte neteda si Ti acoperit cu bioglass. Inainte de utilizare, electrodul de Ti este supus la urmatoarele operatii de pregatire a suprafetei:
- indepartarea celor mai mici asperitati ale suprafetei de Ti prin smirgheluire cu hartie metalografica de la cea mai grosiera si pana la cea mai fina, astfel incat sa i se dea un luciu de oglinda;
- biomaterialele metalice, electrodul de Ti si Ti acoperit cu bioglass, sunt imersate in solutie de HNO3(20%)+HF(3%) timp de 15 minute in scopul pasivarii suprafetei acestora;
- pentru indepartarea impuritatilor, a materialelor grase, si anume: grasimi animale, grasimi vegetale sau uleiuri minerale se efectueaza o operatie de degresare a pieselor metalice. Degresarea poate fi realizata fie in solventi organici, fie in solutii alcaline pe cale chimica sau electrochimica.
Degresarea in solventi organici.
Probele de biomaterial metalice sunt imersate in benzen, timp in care se dizolva materialele grase de orice natura. Eficienta degresarii cu solventi organici creste mult prin agitare cu ultrasunete cand are loc indepartarea grasimilor din microadanciturile suprafetei sau din interiorul contururilor complicate;
- degresarea in solventi organici a suprafetelor este urmata de decapare. Acest procedeu de decapare urmareste inlaturarea straturilor de oxizi.
4.5. Tehnici electrochimice de investigare
Determinarile electrochimice pentru evaluarea susceptibilitatii materialelor de implant la coroziunea locala in pitting sau crevasa include: determinari potentiostatice (Metoda Voltametrie ciclica), variatia potentialului in timp si metoda polarizarii lineare (Rp).
Experimentele s-au desfasurat urmand urmatoarele tehnici de lucru:
variatia potentialului de coroziune in circuit deschis. Masuratorile de potential au fost efectuate cu un voltmetru electronic de tip MATRIX 20. Variatia potentialului de coroziune a fost urmarita pe o perioada de 70000 minute. Simultan cu masuratorile de potential in circuit deschis au fost realizate si masuratori ale variatiei pH-ului solutiei cu ajutorul pH conductometrului CONSORT C 830.
metoda polarizarii potentiodinamice a constat in trasarea curbelor de polarizare ciclica obtinute cu ajutorul unui potentiostat/galvanostat PAR, model 273, interfatat la calculator (cu soft de analiza a coroziunii) urmarind atat curba de polarizare anodica, cat si curba de histeresis. Trasarea curbelor ciclice a inceput de la -800 mV pana la 4000 mV, folosind o viteza de baleere de 2 mV/s. Din aceste curbe s-au evaluat principalii parametrii electrochimici care caracterizeaza procesul de coroziune si de pasivare: potential de coroziune (Ecor), potential de pasivare - la care curentul incepe sa scada (Epas), domeniu de pasivitate, curentul critic de coroziune (Icor) si curentul de pasivitate (Ipas). Toate determinarile au fost efectuate in celula electrochimica de sticla cu trei electrozi, ca electrod auxiliar s-a folosit electrod din plasa de platina, iar ca electrod de referinta electrodul de Ag/AgCl, KCl. Curbele de polarizare anodica si catodica realizate pe materialele metalice ne pot da indicii referitoare la domeniul de pasivitate al biomaterialelor, despre curentii de coroziune sau susceptibilitatea la coroziune a materialelor respective.
Datele au fost tratate statistic cu programul MedCalc.
Pentru trasarea curbelor ciclice s-a folosit montajul din figura urmatoare:
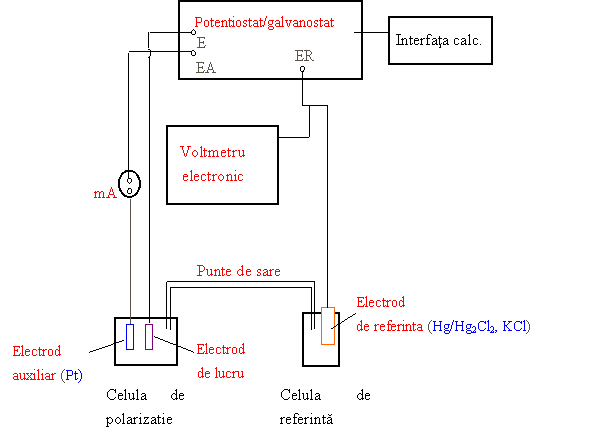
Fig.6. Schema instalatiei pentru trasarea curbelor de polarizare potentiodinamica
REZULTATE SI DISCUTII
A. Variatia potentialului in timp
Este cunoscut ca titanul si aliajele sale prezinta afinitate mare pentru oxigen. Datorita acestei proprietati pe suprafata sa se formeaza filme oxidice protectoare foarte stabile, continue, puternic aderente la suprafata metalului. Natura, compozitia si grosimea suprafetelor oxidice care se formeaza pe titan depind de conditiile de mediu. In cele mai multe medii apoase, oxidul tipic este TiO2, dar pot coexista mai multe specii oxidice, cum ar fi Ti2O3 si TiO.Aceste filme formate in mod natural au o grosime tipica de 3 pana la 10 nm si sunt invizibile.
Din fig. 7 se observa ca in momentul imersarii in SBF, valorile potentialului de coroziune se gasesc in domeniul negativ in toate cazurile, avand valoarea de -309 mV in cazul Ti-bioglass in Buffer solution, -305 mV pentru Ti si -82 mV pentru Ti-bioglass in SBF, datorita dizolvarii anodice a electrodului. La 28 de zile de la imersare in SBF a electrodului de Ti-bioglass, potentialul de coroziune se deplaseaza spre valori pozitive, tinzand sa se stabilizeze dupa 41 de zile de la imersare, in domeniul valorilor pozitive. In cazul aceluiasi electrod imersat in Buffer solution, potentialul de coroziune devine electropozitiv dupa 2 zile de la imersare. In cazul Ti variatia potentialului de coroziune ramane in domeniul valorilor negative pana la timpul de imersare de 25 de zile dupa care ajunge in domeniul valorilor pozitive, ceea ce denota stabilitatea crescuta a stratului de oxid format pe substratul de Ti. Modul de evolutie al potentialului de coroziune in timp in circuit deschis arata ca pe suprafata electrodului de titan stratul de oxid este intr-o continua formare tinzand spre atingerea potentialului stationar pe cand pe suprafata electrodului de Ti-bioglass au loc fenomene de rupere si refacere a filmului de silice mai frecvente la inceputul testarii.
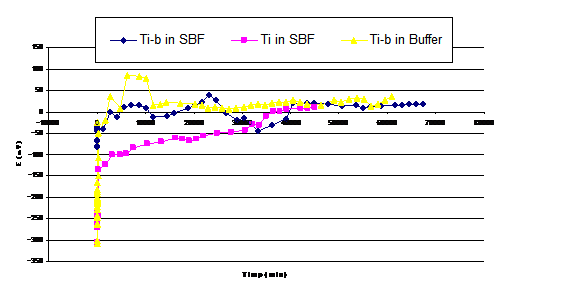
Fig. 7. Variatia Potential-timp pentru Ti si Ti acoperit cu Bioglass in SBF si Buffer solution
In tabelul 1 sunt trecute ecuatiile de regresie calculate cu programul MedCalc pentru variatia in timp a potentialului electrodului de titan si Ti-bioglass in mediile fiziologice studiate:
Tabel 1: Ecuatii de regresie pentru electrozii de Ti si Ti-Bioglass imersati in SBF si Buffer solution
|
Mediu fiziologic |
Electrod |
Ecuatia de regresie |
Coeficientul de determinare |
|
SBF |
Ti |
y = 0.0031x - 253.33 | |
|
Ti-Bioglass |
y =(-98.2120) + 23.4598 log(x) | ||
|
Buffer solution |
Ti-Bioglass |
y = 0.0039x - 141.7 |
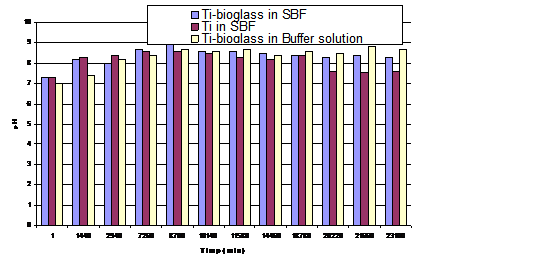
Fig. 8. Variatia pH-timp Ti si Ti acoperit cu Biglass in SBF si Buffer solution
In fig. 8 este descrisa variatia pH-ului in timp in SBF pentru Ti, si pentru Ti-bioglass in SBF si Buffer solution. In momentul imersarii electrodului de Ti-bioglass in solutia fiziologica SBF pH-ul este de 7,3 dupa care tinde sa creasca spre valori mai alcaline ajungand la valoarea maxima de 9,1 dupa 6 zile de la imersare, dupa care pH-ul se stabilizeaza la valoarea de 8,3. In cazul Ti, in momentul imersarii valoarea pH-ului solutiei de SBF este de 7,3 crescand in timp, ajungand sa se stabilizeze la valoarea de 7.6 dupa 14 zile de la imersare. Solutia Buffer are pH-ul in momentul imersarii electrodului de Ti-bioglass de 7, dupa care creste stabilizandu-se in jurul valorii de 8,7 dupa 15 zile de la imersare.
Evolutia pH-ului in timp in toate solutiile simulate indica un trend spre valori mai mari ale pH-ului acesta putandu-se pune pe seama ionilor de H+ rezultati in solutie in urma disocierii ionilor fosfat - prezenti in toate mediile studiate. Echilibrele posibile in vecinatatea electrodului imersat sunt date de ecuatiile:
![]()
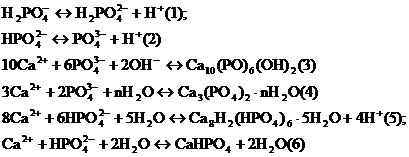
B. Voltametrie ciclica pe probele de Ti si Ti-bioglass imersate in SBF, Ringer 2 si saliva Afnor
Curbele de polarizare ciclica atat pentru Ti cat si pentru Ti-bioglass in solutiile fiziologice simulate:
- nu prezinta regiune de tranzitie activ/pasiv, electrozii fiind pasivi inca de la inceputul polarizarii anodice datorita stratului de oxid primar preexistent si rezistent la reducerea catodica;
- densitati de curent mici (µA); valorile mici ale curentului de pasivare exprima stabilitatea foarte buna a filmelor de pasivitate;
- titanul si Ti-bioglassul nu prezinta coroziune locala in mediile simulate.
Spre deosebire de titanul pur, in cazul Ti-bioglass densitatile de curent sunt cu un ordin de marime mai mari datorita reactiilor de schimb ionic care au loc la interfata bioglass/mediu fiziologic.
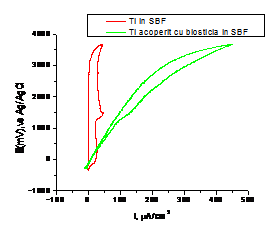
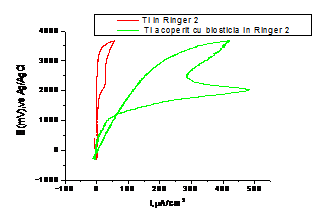
Fig. 9. Ti si Ti acoperit cu biosticla in SBF Fig. 10. Ti si Ti acoperit cu biosticla in Ringer 2
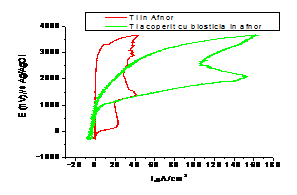
Fig. 11. Ti si Ti acoperit cu biosticla in Afnor
Tabel 2. Parametrii electrochimici ai Ti si Ti-bioglass rezultati din curbele de voltametrie ciclica
|
Sistemul metalic |
Epas (mV) |
Ipas (A) |
Domeniu Pasiv (mV) |
|
Ti in Ringer 2 | |||
|
Ti in SBF | |||
|
Ti in Afnor | |||
|
Ti-bioglass in Ringer 2 | |||
|
Ti-bioglass in SBF | |||
|
Ti-Bioglass in Afnor |
Tabel 3. Parametrii de coroziune
|
Sistemul metalic |
jcor (mV) |
Rp W |
Icor (A) |
|
Ti in Ringer 2 | |||
|
Ti in SBF | |||
|
Ti in Afnor | |||
|
Ti-bioglass in Ringer 2 | |||
|
Ti-bioglass in SBF | |||
|
Ti-Bioglass in Afnor |
Domeniu pasiv in cazul Ti-bioglass este mai mic fata de Ti datorita schimbului ionic care are loc la interfata. Calculul rezistentei de polarizare s-a facut utilizand metoda polarizarii liniare si s-a gasit ca Rp este mai mare in cazul titanului neacoperit, ceea ce indica o stabilitate buna a stratului de TiO2, fata de Titan acoperit cu biosticla, datorita schimbului de ioni care are loc intre biosticla si mediu fiziologic.
4.6. Metode Chimice Complementare
In acest studiu se va investiga bioactivitatea si schimbarile structurale ale suprafetei de 45S5, care a fost pulverizata in plasma pe titan, si expus in Buffer solution si analizat. Pentru analizarea probelor s-au folosit spectroscopia in infrarosu a transformatei Fourier si spectroscopia de absorbtie moleculara in domeniile UV-Vis. Pentru caracterizarea suprafetei s-a utilizat microscopia electronica de baleiaj (SEM).
A. Determinarea spectrofotometrica a fosfatului cu ajutorul vanado-molibdatului [86]
Spectrele de absorbtie moleculara in domeniile UV-Vis ale indicatorilor utilizati s-au inregistrat cu ajutorul unui Spectrofotometru Meterteck SP-850.
- solutia de vanado-molibdat: Intr-un balon cotat de 100 ml se introduc 0,1 g vanadat de amoniu in apa calduta, se adauga 12,5ml acid azotic 70% si 1g molibdat de amoniu si se aduce la semn cu apa distilata.
- Intr-un balon cotat de 100 ml se introduc 0,0716 g KH2PO4 si se aduce la semn cu apa distilata.
Din solutia standard de fosfat se iau 2 ml care se introduc intr-un alt balon cotat de 100 ml si se aduce la semn cu apa distilata. Astfel 1ml din solutia preparata contine 10 μg fosfat.
-In baloane cotate de 25 ml se introduc cantitati cunoscute de solutie standard de fosfat cuprinse intre 0 si 100 μg peste care se adauga 0,5 ml solutie de vanado-molibdat, se aduce la semn cu apa distilata, se amesteca bine, si se lasa 10 minute la temperatura camerei. Se masoara absorbanta fiecarei solutii in celule de cuart de 1cm fata de o proba martor, la lungimea de unda de 370 nm. Curba de etalonare obtinuta ar trebui sa aiba o variatie liniara.
Pentru probele de analizat se citeste absorbanta, iar prin interpolare grafica se determina concentratia de fosfat.
Tabel. 4. Datele experimentale folosite la determinarea dreptei de etalonare
|
ml sol. Standard / 25ml |
Conc µg/l |
A |
REZULTATE SI DISCUTII
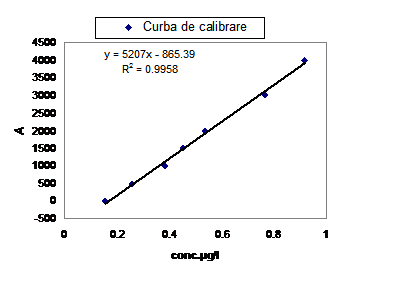
Fig. 12. Dreapta de etalonare folosita la determinarea cantitatii de fosfat din proba
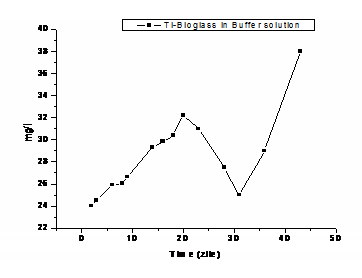
Fig. 13. Variatia concentratiei de fosfat in timp in Buffer solution.
Adsorbtia ionilor fosfat este un proces reversibil, avand loc, daca urmarim comportarea implantului pe termen lung, si desorbtia, lucru care se observa si din reprezentarea grafica a variatiei concentratiei ionilor de fosfat in timp.
Procesul de adsorbtie-desorbtie este influentat, mai mult sau mai putin, de compozitia mediului fiziologic din cavitatea bucala si anume de prezenta anumitor ioni care intervin in acest proces.
B. Spectroscopia FTIR
Sistemul titan acoperit cu bioglass a fost analizat in domeniul infrarosu de 400-4000cm-1 cu ajutorul unui spectrophotometru FTIR JASCO 620.
Cateva micrograme de proba au fost analizate cu FTIR dupa ce in prealabil au fost amestecate cu o concentratie adecvata de KBr si presata intr-o pellet. Fiecare spectrum a fost reprezentat prin trasmitanta (%T). Modificarile structurale ale suprafetei bioglasului a fost observat cu Attenuated Total Reflectance (ATR) atasat la spectrophotometrul FTIR. Este posibil sa se obtina rezultate diferite prin reflectie utilizand ATR si analizele de transmisie directa intrucat starea suprafetei poate fii diferita fata de volumul probei.
REZULTATE SI DISCUTII
In figura 14 este prezentat spectrul inregistrat pentru titan acoperit cu bioglass in SBF prin analiza de transmisie FTIR. Structurile complexe obtinute arata o reactivitate ridicata intre biocompozit - biolichid. Inainte de a intra in detalii, este important de stiut ca banda principala FTIR pentru bioglass pur corespunde silicei amorfe, de exemplu, Si-O-Si cu benzile caracteristice la 1050, 950 si 800 cm-1 si banda de vibratie Si-O-Si la 450 cm-1 [87, 88]. In concluzie, in prezenta unui fluid fiziologic, sticla bioactiva devine hidratata cu formarea grupelor de silanol (Si-OH) pe suprafata si a unui strat de silice care serveste ca centru de nucleare pentru cristalizarea HCAp. Se admite ca formarea HCAp induce reducerea si in final disparitia benzilor corespunzatoare silicei [87,89]. Aceste schimbari sunt observate dupa 48h in SBF [87]. Astfel, de la o luna imersare in SBF, nu se asteapta ca in spectrul FTIR sa mai existe benzi corespunzatoare silicei. Iar picurile la 960 si 550 cm-1, asociate legaturii Si-OH [88], nu sunt observate. Benzi de vibratie corespunzatoare gruparii OH au fost observate la 3200‑3600 cm-1, pentru inceput atentia este focalizata pe benzile posibile datorate stratului de HCAp.
Formarea complexului amorf CaO‑P2O5-, precursor al stratului de HCAp, este evidentiata printr-o banda slaba la~1647 cm-1 corespunzatoare CaO [90] si benzilor caracteristice de fosfat (P=O, P-O) mai ales intre 1200-850 cm-1 si 650-400 cm-1 (Anexa 1). In literatura studiata au fost mentionate urmatoarele benzi: banda de vibratie corespunzatoare gruparii P-O la 1060 si 1035 cm-1; formarea unui dublet P-O la ~600 si 574 cm-1, care arata ca in biosistem se formeaza un strat de HCAp [87,88]. Benzi aditionale la 1440 si 873 cm-1 atribuite legaturilor C-O confirma formarea stratului de HCAp [87]. Este important de specificat ca consumarea unui strat bogat de fosfat creste cristalinitatea apatitei datorita straturilor bogate in calciu si carbonat [87].
Prezenta benzilor datorate legaturilor de carbonat indica faptul ca gruparile CO3-2 nu au fost toate substituite de ionii PO4-3. Pozitia si distributia altor benzi sunt indicate in Anexa 1, spectrul obtinut prin ATR arata benzi aditionale datorate compusilor fosfat la 1206, 1025, 817, 740, 720 si 425 cm-1. Atentia este indreptata spre posibilitatea observarii benzilor de oxid de titan in spectrul infrarosu. Un studiu FTIR pe compozitul titan-bioglass dupa imersare in solutie SBF stabileste prezenta benzilor intre 1000-1050 cm-1 pentru legaturi Ti-O [89]. In lucrarea de fata , se observa ca din suprapunerea benzilor de vibratie pentru fosfat, carbonat si oxid de titan identificarea legaturilor Ti-O este foarte dificila si imprecisa. Cu toate acestea , asocierea compusilor de titan cu alte molecule poate duce la cresterea absorbantei. Deci, nu se poate exclude prezenta benzilor caracteristice dioxidului de titan mult mai importante la frecvente mici. La frecvente mari (>1400 cm-1) nu se observa benzile de fosfat, facand analiza mult mai usoara. Banda la ~1623 cm-1 este atribuita legaturilor Ti-O. Sunt necesare investigatii complementare cu alte tehnici, cum ar fii de exemplu spectroscopia Raman.
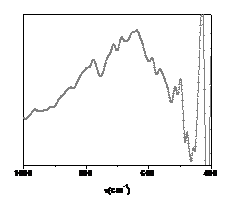
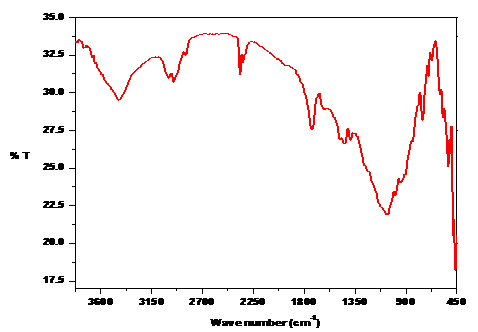
Fig. 14. Spectrul FTIR pentru Titan-bioglass

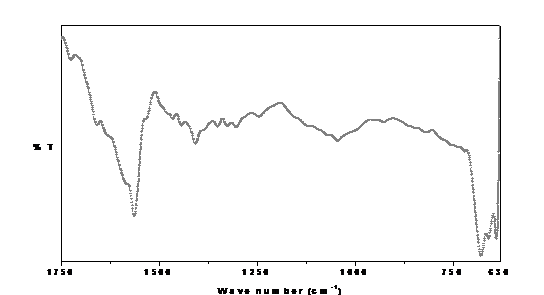
Fig. 15. Spectrul ATR-FTIR pentru Titan-bioglass
C. Microscopie electronica de baleiaj (SEM)
Pentru caracterizarea suprafetei s-a utilizat microscopia electronica de baleiaj si s-a analizat compozitia electrodului de Ti-bioglass dupa ce a fost mentinut in Buffer solution timp de 18 zile. Analizele compozitionale au fost efectuate pe cate 5 campuri pe suprafata corespunzatoare, fiind marite de cate 100 de ori. Achizitia spectrului s-a realizat in mod continuu.
Imaginile S.E.M. indica o modificare a structurii gelului de silice format la interfata bioglass/mediu fiziologic, argument care vine in sprijinul informatiilor obtinute prin analiza FT/IR.
Fig. 16. Ti-bioglass imersat in Buffer solution 18 zile

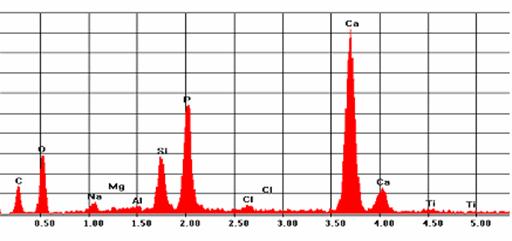
Fig. 17. Spectrul de emisie a radiatiei X
Din spectrul de emisie a radiatiei X se observa ca de la 18 zile de la imersare in Buffer solution raportul Ca/P este mare, pe suprafata electrodului formandu-se stratul de apatita, centrul de nucleare a HA. Aceste rezultate sunt sustinute si de datele din literatura [72] care arata faptul ca 45S5 formeaza un strat de apatita pe suprafata dupa ce a fost imersat in SBF, care confirma caracterul bioactiv al probelor. Este posibil obtinerea stratului de apatita pe suprafata de la o ora de cand a fost imersat. Dupa o perioada mai lunga de imersare grosimea si densitatea stratului creste.
Culturi de osteoblaste
Pentru acest experiment s-au folosit osteoblaste embrionare umane in pasajul VI .
Piesele au fost sterilizate la UV pe ambele parti si ulterior s-au insamantat 300.000 celule pe placa Petri de 4ml. Monitorizarea celulelor s-a realizat la 24 si 48 de ore de la insamantare.
Dupa 48 de ore s-a realizat tratamentul cu hipericina (de la Sigma de conc.2mM) 1mM ( hipericina a fost solubilizata in DMSO - dimetilsulfoxid) si s-au folosit 3-4 microL /placa de 4 ml. Dupa 4-5 ore mediul de cultura care continea substanta fluorescenta a fost inlocuit cu mediu nou, iar celulele si piesele testate au fost observate la microscop in contrast de faza Nikon TS 100 F prevazuta cu o camera foto automata si cu o camera digitala Nikon Cool Pix 4500.
Evaluarea viabilitatii celulare
Testul cu MTT bromura de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium] este o metoda colorimetrica, cantitativa, ce permite aprecierea proliferarii, viabilitatii si citotoxicitatii celulare si se bazeaza pe reducerea unei sari de tetrazoliu galbene MTT la un formazan de culoare albastru-inchis. Reducerea realizata de enzime mitocondriale (in special succinat dehidrogenaza) este un indice al integritatii celulare/mitocondriale. Formazanul insolubil in apa poate fi solubilizat cu izopropanol, dimetil sulfoxid sau alt solvent organic. Densitatea optia a formazanului solubilizat este evaluata spectrofotometric, obtinandu-se o functie absorbanta-concentratie colorant-numar de celule active metabolic din cultura. Metoda este adaptabila determinarii unui numar mare de probe utilizand microplaci 96-well si un spectrofotometru TECAN.
Dozarea se realizeaza pe suspensii celulare obtinute prin tripsinizare care sunt insamantate pe o placa multi-well la o densitate celulara de 1000-100.000 celule/well si incubate intr-o atmosfera umeda cu 5% CO2 si 95% O2 la 37oC. Dupa diferite perioade de timp (6-24 ore) - in mediul de crestere se introduc 200 ml/well solutie MTT (0,5 mg/ml) si suspensia celulara cu MTT se incubeaza timp de 3 ore la 37oC intr-o atmosfera umeda cu 5 % CO2. Apoi se indeparteaza mediul cu MTT si de adauga 200 ml/well izopropanol sau dimetilsulfoxid pentru a dizolva cristalele de formazan. Densitatea optica este citita la 570 nm. Nu s-au semnalat cauze care sa afecteze dozarea cum ar fi: (i) contaminarea cu un agent reducator, bacterii sau drojdii, (ii) expunerea excesiva la lumina, (iii) numar prea mare/mic de celule, (iv) timp de incubare insuficient pentru solubilizarea formazanului iar aspectul morfologic al celulelor este prezentat in urmatoarele figuri:
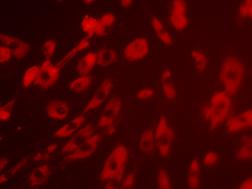
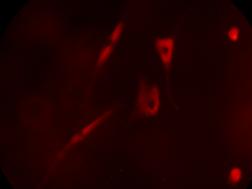
Ti-Bioglass 20x piesa si celule Ti-Bioglass 20x celule pe piesa
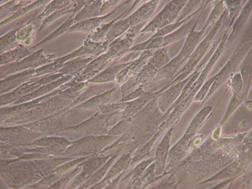
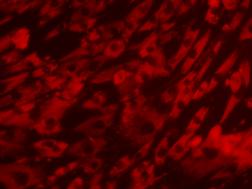
Ti-Bioglass 20x monostrat Ti-Bioglass 20x monostrat
Se observa ca morfologia osteoblastelor nu prezinta schimbari in prezenta biocompozitelor.
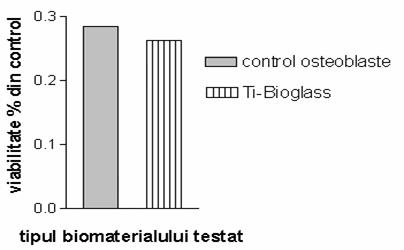
In urma evaluarii viabilitatii osteoblastelor se arata ca valoarea corespunzatoare Ti-bioglass este apropiata de cea a probei control.
VI. CONCLUZII
Rezultatele prezentate contribuie la caracterizarea electrochimica a interfetei sistemelor Ti, Ti+ HA, Ti+ biosticla, in fluide fiziologice simulate.
Variatia potentialului de coroziune in circuit deschis arata o deplasare spre valori pozitive, ceea ce denota formarea, pe suprafata titanului a unui film de oxid protector. In cazul Ti acoperit cu bioglass valorile potentialului sunt in domeniul valorilor pozitive ceea ce indica faptul ca biosticla protejeaza titanul impotriva coroziunii si in acelasi timp creste si biocompatibilitatea implantului.
Variatia de pH se coreleaza cu modificarile de potential. Ti acoperit cu biosticla prezinta pH mai mare decat titanul pur dovedind o alcalinizare a solutiei, fapt sustinut de hidratarea SiO2 cu formarea de gel cu caracter alcalin in preajma electrodului. Cresterea alcalinitatii favorizeaza formarea HA care este responsabila de atragerea celulelor, care participa la osteointegrare.
Curbele de polarizare ciclica atat pentru Ti cat si pentru Ti-bioglass in solutiile fiziologice simulate:
- nu prezinta regiune de tranzitie activ/pasiv, electrozii fiind pasivi inca de la inceputul
polarizarii anodice datorita stratului de oxid primar, respectiv bioglass, preexistent si
rezistent la reducerea catodica;
- densitati de curent mici (µA); valorile mici ale curentului de pasivare exprima
stabilitatea foarte buna a filmelor de pasivitate.
Rp este mai mare in cazul titanului neacoperit, ceea ce indica o stabilitate buna a stratului de TiO2, fata de Titan acoperit cu biosticla, datorita schimbului de ioni care are loc intre biosticla si mediu fiziologic.
Probele acoperite cu bioglass prin pulverizare in plasma duce la formarea pe suprafata a unui strat de apatita atunci cand sunt imersate in Buffer solution, fapt sustinut si de datele din literatura.
Mecanismul de formare a apatitei pe suprafata poate fi interpretat astfel: dizolvarea ionilor de sodiu, calciu, fosfat din sticla, hidratarea silicei pe suprafata sticlelor promovand zone favorabile pentru nucleare apatitei. Afirmatie sustinuta de banda de absorbtie P-O la 1060cm-1.
Odata ce nucleii de apatita s-au format ei cresc spontan prin consumul ionilor de calciu si fosfat din Buffer. Benzile de la 1446 si 875cm-1, care corespund benzilor de absorbtie a carbonatului, de asemenea indica formarea HCA.
Morfologia osteoblastelor (urmarita microscopic) nu prezinta schimbari in prezenta biocompozitelor.
Evaluarea viabilitatii osteoblastelor arata ca valoarea corespunzatoare Ti-bioglass este apropiata de cea a probei control.
Bibliografie
LeFanu J., The Fall and Rise of Modern Medicine, Little Brown, 1999, 104-113.
Simon SR, Orthopaedic Basic Science,
Hench LL, Bioceramics: Fromconcept to clinic, J. American Ceramic Society, 1991,
Hench LL, Wilson J., Introduction to Bioceramics,
World Scientific,
Cao W, Hench LL, Bioactive Materials Ceramics International, 1996;
Hench LL,
Hench LL, Biomaterials: A forecast for the future, Biomaterials, 1998,
Wallace KE, Hill GR, Pembroke JT, Brown CJ, Hatton PV, Influence of sodium oxide content on bioactive glass properties, J. Materials science: Materials in Medicine, 1999,
Decheyne P, Qui Q., Bioactive Ceramics: The effect of surface reactivity on bone formation and bone cele function, Biomaterials, 1999,
Clark AE, Pantano CG, Hench LL, Corrozion of glass,
Magazines for Industry,
Greenspan DC, Zhong JP, LaTorre GP, Effect of surface area to volume ratio on in vitro surface reactions of bioactive glass particulates, In Bioceramics J, eds. OH Andersson, A Yli-Urpo, 1994, pp 28-33.
Greenspan DC, Zhong JP, Chen ZF, La Torre GP, The evolution of degradability of melt an sol-gel derived Bioglass in vitro, In Bioceramics 10, eds. L Sedel, C Rey, 1997, pp. 391-394.
Vidueau JJ, Dupuis V., Phosphates and biomaterials, European Jurnal of Solid State Inorganic Chemistry, 1991,
Zhong JP, La Torre GP, Hench LL, The kinetics of bioactive ceramics part VII: Binding of collagen to hydroxy apatite and bioactive glass, In Bioceramics 7, eds. OH Andersson, A Yli-Urpo, 1994, pp. 61-66.
Pereira MM, Clark AE, Hench LL, Effect of texture on the rate of hydroxyapatite formation on gel-silica surface. J American Ceramic Society, 1995; 78(9): 2463-2468.
Pereira MM, Hench LL, Mechanisms of hydroxyapatite formation on porous gel-silica substrates, J Sol-gel Science and Technology, 1996; 7:59-68.
Zhong JP, Greenspan DC. Bioglass surface reactivity: From in-vitro to in-vivo. In Biomaterials 10, eds. L. Sedel, C. Rey, 1997, pp. 391-394.
Pereira MM, Clark AE, Hench LL. Calcium phosphate formation on sol-gel-derived bioactive glasses in vitro. J Biomedical Material Research 1994; 28:693-698.
Tsuru K, Ohtsuki C,
Wirth G, Gieskes J. J Colloid International Science 1979; 68:492.
Rohanizadeh R, Padrines M, Bouler JM, Couchoural D, Fortun Y, Daculsi G. Apatite precipitation after incubation of biphasic calcium-phosphate ceramic in various solutions: Influence of seed species and protein. J Biomedical Material Research 1998; 42(4):530-539.
Kuijer R, Bouwmeester SJM, Drees MMWE, Surtel DAM, Terwindt-Rouwenhorst EAW, Van Der Linden AJ, Van Blitterswijk CA, Bulstra SK. The polymer polyactive as a bone-filling substance: An experimental study in rabbits. J Materials Science: Materials in Medicine 1998; 9:449-455.
Padrines M, Rohanizadeh R, Damiens C, Heymann D, Fortun Y. Inhibition of apatite formation by vitronectin. Connective Tissue Research 2000; 41(2):101-108.
Elsberg LL, Lobel KD, Hench LL. Geometric effects on the reaction stage of bioactive glasses. (Unpublished).
Wilson J, Noletti D. Bonding of soft tissue to Bioglass. In Bioceramics 3, ed. S hubbert, 1990, pp.283-302.
Schepers E, Ducgheyne P, Barbier L, Achepers S. Bioactive glass particles of narrow size range: A new material for the repair of bony defects. Implant Dentistry 1993; 2(151):156.
Sepulveda P, Jones JR, Hench LL. Effect of particle
size on Bioglass Dissolution. In
Bioceramics 13, eds. S Giannini, A
Stamboulis A, Hench LL. Bioresorbable polymers:
Their potential as scaffolds for Bioglass composites. . In Bioceramics 13, eds.
Hench LL, West JK. The sol-gel process. Chemical Reviews 1990; 90: 33-72.
Andersson OH, Sodergard A. Solubility and film formation of phosphate and alumina containing silica glasses. J Non-Crystalline Solids 1999; 246: 9-15.
Hill RG. J Materials Science Letters 1996; 15:112.
Ishizaki, Komarneni, Nanko. Porous Materials Process Technology and Applications. Kluwer Academic Publishers, 1998, 67.
Livage J, Sanchez C. Sol-gel chemistry. J Non-Crystalline Solids 145:11-19.
Hench LL, Wheeler DL, Greenspan DC. Molecular control of bioreactivity in sol-gel glasses. J Sol-gel Science and Technology 1998; 13:245-250.
Li P, Zhang F. The electrochemistry of a glass-surface and its application to bioactive glass in solution. J Non-Crystalline Solids 1990; 119:112-116.
Li R, Clark AE, Hench LL. Effect of structure and surface area on bioactive powders made by sol-gel process. In Chemical Processing of Advanced Materials, eds. LL Hench, JK West, Wiley, New York, 1992; pp. 627-633.
Perez-Pariente J, Balas F, Poman J, Salinas AJ, Vallet-Regi M. Influence of composition and surface characteristics on the in vitro bioreactivuty of SiO2-CaO-P2O5-MgO sol-gel glasses. J Biomedical Materials Research 1999; 47(2): 170-175.
Al-Bazie S, Chou S. The role of bioglass elements in osteogenesis at implant interface in vivo. J Dental Research 1998; 77(839): 1664. Special Issue B.
Oonishi H, Hench LL, Wilson J, Sugihara F, Tsuji E, Kushitani S, Iwaki H. Comparative bone growth behaviour in granules of bioceramic materials of various sizes. J Biomedical Materials Research 1999; 44 (1): 31-43.
Livage J. Sol-gel processes.
Aksay IA, Wiener S. Biomaterials- Is this really a
field of research?
Oonishi H, Kutrshitani S, Yasukawa E. Particulate Bioglass and hydroxyapatite as a bone graft substitute. J Clinical Orthopedics Related Research 1997; 334:316-325.
Wheeler DJ, Stokes KE. In vitro evaluation of sol-gel Bioglass. Part I: Histological
findings. Trans 23rd Annual
Meeting of the Society for Biomaterials,
Details of the clinical cases are available from US
Biomaterials Inc.,
Xynos ID, Hukkanen MVJ, Batten JJ, Buttery LDK, Hench LL, Polak JM. Bioglass 45S5 stimulates osteoblast turnover and enhances bone formation in vitro: Implications and applications for bone tissue engineering. Calcified Tissue International 2000; pp. 67321-67329.
Hench LL, Xynos ID, Buttery LDK, Polak JM. Bioactive materials to control cell cycle. Materials Research Innovations 2000, (in Press).
Xynos ID, Edgar AJ, Buttery LDK, Hench LL, Polak JM. Ionic dissolution products of bioactive glass increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochemical and Biophysical research Communications 2000, 177: 604-610.
C. Y. Kim, A. E. Clark, L. L. Hench, Early stages of calcium phosphate layer formation in bioglasses. J. Non-Cryst. Sol. 113 (1989) 195-202.
T. Kokubo, Recent progress in glass-based materials for biomedical application. J. Ceram. Soc. Japan 99 (1991) 965-973.
T. Kokubo, H. Kushitani, C. Ohtsuki, S. Sakka, T. Yamamuro, Effects of ions dissolved from bioactive glass-ceramic on surface apatite formation. J. Mater. Sci. Mater. Med. 4 (1993) 1-4.
S. B. Cho, F. Miyaji, T. Kokubo, K. Nakanishi, N. Soda, T. Nakamura, Apatite-forming ability of silicate ion dissolved from silica gel. J. Biomed. Mater. Res. 32 (1996) 375-381.
R. Hill. An alternative view of the degradation of bioglass. J. Mater. Sci. Lett. 15 (1996) 1122-1125.
K. H. Karlsson. Bioactivity of glass and its relation to glass structure. Glass Phys. Chem. 24 (1998) 280-284.
K. H. Karlsson, R. Backman, M. Hupa. An Equilibrium Study of Phosphate Precipitation on
bioactive glass. Key
K. H. Karlsson. Bioactivity of glass and bioactive glasses for bone repair. Glass Techn. 45 (2004) 157-161.
O. A. Salerno, A. Locardi, Biomaterials 19 (1998) 1019-1021.
E. A. B. E. Kaufmann, P. Ducheyne, S. Radin, D. A. Bonnel, R. Compasto, Initial events at the bioactive glass surface in contact with protein-containg solutions, J. Biomed. Mater. Res. (2000) 825-830.
M. Neo, C. F. Voig, H. Herbst, U. M. Gross, Osteoblast reaction at the interface between surface active materials and bone in vivo: A study using in situ hybridization, J. Biomed. Mater. Res. 39 (1998) 1-8.
G. Goller, F. N. Oktar, T. Yazici, S. Gurmer, E. S. Kayali, Characterization of plasma sprayed bioglass coatings on titanium, Key Eng. Mater. 240-242 (2003) 283-286.
Aragon PJ. Hulbert SF. Corrosion of Ti-6Al-4V in simulated body fluids and bovine plasma. J. Biomed Mater Res 1972;6:155-64.
Popa MV. Vasilescu E. Drob P. Demetrescu I. Popescu L. Ionescu D. Vasilescu C. In vitro assessment and monitoring of the implant titanium materials - physiological environment. Mater Corros 2003;54:215-21.
Popa MV. Demetrescu I. Vasilescu E. Drob P. Santana Lopez A. Mirza-Rosca J. Ionita D. Vasilescu C. Corrosion susceptibility of implant materials Ti-5Al-4V and TI-6Al-4Fe in artificial extra-cellular fluids. Electrochim Acta 2004;49:2113-21.
Thomsen P. Larson C. Ericson LE. Sennerby L. Lausama J. Kasemo B. J Mater Sci-Mater Med 1997;8:653-65.
Thair L. Mudali K. Asokamani R. Baldev R. Influence of microstuctural changes on corrosion behaviour of thermally aged Ti-6Al-4V alloy. Mater Corros 2004; 5:358-66.
Khan MA. Williams RL. Williams DF. In-vitro corrosion and wear of titanium alloys in the biological environment. Biomaterials 1996;17:2117-26
Choubey A. Balasubramanian R. Basu B. Effect of replacement of V by Nb and Fe on the electrochemical and corrosion behavior of Ti-6Al-4V in simulated physiological environment. J Alloy Compd 2004;381:288-94.
Oliva FY. Avalle LB. Camara OR. Electrochemical behavior of human serum albumin-TiO2 nanocristalline electrodes studied as a function of pH - Part I - voltametric response. J Electroanal Chem 2002;534:19-29.
J. C. Puippe, Surface treatments of titanium implants, Eur. Cell & Mater. 5 (2003) 32-33.
A. P. Serro, A. C. Fernandes, B. Saramago, J. Lima, M. A. Barbosa, Apatite deposition on titanium surface - the role of albumin adsorption, Biomaterials 18 (1997) 963-968.
G. Goller, , T. Yazici, F. N. Oktar, E. Demirkesen, E.S. Kayali, Analysis of In-vitro reaction layers formed on plasma sprayed bioglass-titanium coatings, Key Eng. Mater. 264-268, 2004 pp.1973-1976.
L. L. Hench, J. Wilson,
An Introduction to Bioceramics, World
Scientific
M. Yoshinari, Y. Ohtsuka, T. Derand, Biomaterials 15 (1994) 529.
T.
Visan, M. Buda,
T. Badea, M. Nicola, Electrochimie si coroziune. Institutul Politehnic Bucuresti, Facultatea de Chimie Industriala, Catedra Chimie fizica Aplicata si Electrochimie, 1993.
Khan MA. Williams RL. Williams DF. In-vitro corrosion and wear of titanium alloys in the biological environment. Biomaterials 1996;17:2117-26.
A. P. Serro, A. C. Fernandes, B. Saramago, J. Lima, M. A. Barbosa, Apatite deposition on titanium surface - the role of albumin adsorption, Biomaterials 18, 1997, 963-968.
D. Ionita, B. Popescu, I. Demetrescu, Electrochemical and Spectroscopic Techniques in the Corrosion Behavior of Ti Alloys in Hank Solution, 13 Romanian International Conference on Chemistry and Chemical Engineering, Bucharest, Romania, September 2003, Vol. 10. p. 80-85.
T. Badea, M. V. Popa, Stiinta si ingineria coroziunii. Ed. Academiei Romane, Bucuresti, 2002.
F.G.Banica, E.Diacu, Metode de analiza instrumentala, Ed. Didactica si Pedagogica, Bucuresti
Williams, D. F. (1999). The Williams Dictionary of Biomaterials, Liverpool Univer sity Press: Liverpool, UK ,245.
Williams, D. (2003). Revisiting definition of biocompatibility. Med Device Technol.,14(8), 10
Ratner, B. D., Hoffman, A. S., Schoen, Q1 J. F., & Lemons, J. E. (1996). Biomaterials Science, An Introduction to Materials in Medicine 1-8, Academic Press San Diego CA
Standardele ISO 10993/EN 30993
W.J. Williams, Handbook of Anion Determination, Butterworth & Co Ltd,
E. Kontonasaki, T. Zorba, L. Papadopoulou, E. Pavlidou, X. Chatzistavrou, K. Paraskevopoulos, P. Koidis, Cryst. Res. Technol.
A. L. Andrade, R. M. M. Turchetti-Maia, M. T. P. Lopes, C. E. Salas, R. Z. Domingues Materials Research, 7, N°4, 635-638, 2004.
D.K. Pattanayak, V. Mathur, B.T. Rao and T.R. Rama Mohan, Trends Biomater. Artif. Organs. Vol. 17 (1) pp 8-12, 2003.
G. T. Tihan, I. Ionescu Bujor, D. Iordachescu, I. Kostrakievici, UPB, sci. Bull., series B, vol. 67, n° 3, p27, (2005).
Kevin D.O. Jackson, A Guide to Identifying Common Inorganic Fillers and Activators Using Vibrational Spectroscopy, The internet journal of vibrational spectroscopy, vol 2, Edition 3.
C. Costa de Almeida, L. Á. Sena, M. Pinto, C. A. Muller, J. H. L. Cavalcanti, G. Soares de Almeida, Braz Dent J (2005) 16(1): 75-81.
M. Elisa, C.E.A. Grigorescu, I. C. Vasiliu, M. Bulinski, V. Kuncser, D. Predoi, G. Filoti, A. Meghea, N. Iftimie, M. Giurginca, H.J. Trodahl, M. Dalley, Rev. Adv. Mater. Sci
B. Karunagaran, D. Mangalaraj, Kyunghae Kim, Byungyou Hong, Yonghan Roh, Cheon, Seok Park, and Junsin Yi*, Cryst. Res. Technol. 40, No. 3, 222 - 225 (2005).
M.F. Maitz, M.T. Pham, W. Matz, H. Reuther, G. Steiner, E. Richter Biomolecular Engineering 19
E. J. Lee, S.H. Lee, H.W. Kim, Y.M. Kong, H. E. Kim, Biomaterials 26 (2005) 3843-3851,
M. Elisa, I. C. Vasiliu, C.E.A. Grigorescu, B. Grigoras, H. Niciu, D. Niciu, A. Meghea, N. Iftimie, M. Giurginca, H.J. Trodahl, M. Dalley, Optical Materials 28 (2006) 621-625.
A. C. Tas, F. Aldinger, J. Mat. Sci.: Materials in medecine 16 (2005) 167- 174.
Anselme K. Linez P. Bigerelle M. Le Maguer D. Le Maguer A. Hardouin P. Hildebrand HF. Iost A. Leroy JM. The relative influence of the topography and chemistry of TiAl6V4 surfaces on osteoblastic cell behaviour. Biomaterials, 2000;21:1567-71.
Anexa 1. Distributia benzile caracteristice in infrarosu pentru Titan-bioglass
|
Ν(cm-1) |
Tipul de benzi |
Referinta |
|
3440 |
υOH | |
|
2955-2848 |
C-H | |
|
2370-2280 |
CO2 | |
|
1732 |
νC-O | |
|
1685 |
νC=O | |
|
1647 |
Ca-O |
[90] |
|
1623 |
Ti-O | |
|
1540-1580 |
CO32- | |
|
1484 |
Mg-O |
[91] |
|
1451 |
νC-O |
[87, 92] |
|
1440 |
νC-O |
[87, 92] |
|
1390 |
P-OH |
[93] |
|
1362 |
P-OH |
[93] |
|
1336 |
CO32- |
[94] |
|
1269 |
νP=O |
[93] |
|
1240 |
νP=O |
[93] |
|
1146 |
νP-O |
[93] |
|
1123 |
PO43- |
[95] |
|
1096 |
PO43- |
[96] |
|
1074 |
PO32- |
[93] |
|
1060 |
νP-O |
[88] |
|
1035 |
νP-O (PO43-) |
[87,96] |
|
996 |
PO43- |
[97] |
|
947 |
νP-O (PO32-) |
[93] |
|
927 |
νP-O |
[97] |
|
905 |
νP-O |
[93] |
|
873 |
δC-O + νP-OH |
[87, 92,95] |
|
842 |
νP-O |
[97] |
|
791 |
νP-O |
[93] |
|
754 |
CO32- νP-O |
[93] |
|
701 |
CO32- νP-O |
[97] |
|
670 |
CO32- + Al-O-Al |
[RamanHCA,88] |
|
647 |
δOH- |
[93,98] |
|
600 |
δP-O (PO43-) |
[87,93] |
|
574 |
δP-O (PO43-) |
[87,93] |
|
530 |
δP-O |
[90,93] |
|
506 |
δP-O |
[90,93] |
|
483 |
δP-O |
[90,93] |
|
464 |
δP-O |
[90,93] |
|
452 |
δP-O (PO43-) +TiO |
[90,93, 94] |
|
411 |
δP-O (PO43-) |
Copyright © 2026 - Toate drepturile rezervate