 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Corelatii etio-patogenice si clinico-terapeutice in criza
convulsiva grand-mal la copil
Introducere
Hippocrate definea epilepsia ca fiind un proces organic al creierului. Cu toate acestea, multi dintre scriitorii acelor vremuri considerau crizele epileptice ca facand parte din supranatural. De fapt, cuvantul epilpsie are origini grecesti, semnificatia acestuia fiind
J. H. Jackson face primul pas spre intelegerea epilepsiei, la sfarsitul secolului al XIX-lea, analizand cazuri individuale. Din observatiile sale, formeaza definitia moderna a epilepsiei: "O descarcare ocazionala, excesiva si dezorganizata a tesutului neuronal."
Termenul de epilepsie se refera la o afectiune cronica caracterizata prin recurenta unor crize care apar spontan, neprovocat, in absenta unor factori declansatori evidentiabili. Epilepsia se mai caracterizeaza printr-un mecanism anume de producere, prin posibile modificari psihice intercritice, printr-o varsta de debut, o evolutie si o sensibilitate la tratament. Tendinta la recurenta poate fi rezultatul unor anomalii structurale cerebrale sau a unei predispozitii constitutionale de a avea crize. Aceasta predispozitie este, cel putin in parte, determinata genetic. De cele mai multe ori cele doua conditii se asociaza in diferite proportii.
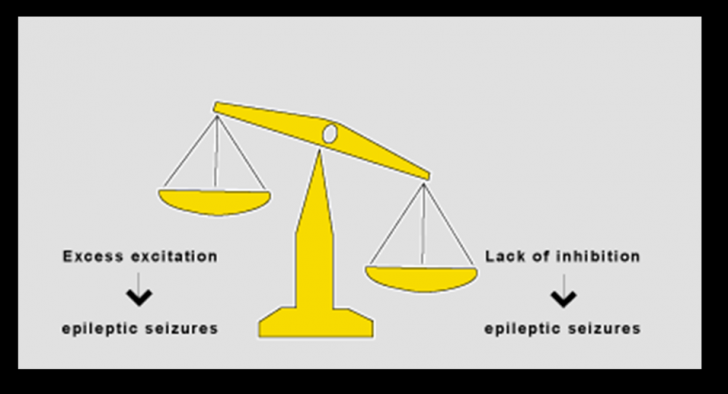
Crizele epileptice reflecta activitatea electrica anormala a neuronilor cerebrali. In timpul convulsiilor, un mare numar de neuroni se descarca sincron si cu frecventa inalta. Este rupt echilibrul normal intre influentele excitatorii si cele inhibitorii ale activitatii celulei nervoase. Are loc o scadere a influentelor inhibitorii, ca factor important al activitatii epileptice. Sunt implicati in mod special neuronii inhibitori care folosesc ca substanta neurotransmitatoare acidul gamma-aminobutiric (GABA). Anomaliile neuronilor GABA-ergici joaca un rol important, dar este putin probabil ca acest sistem sa fie singurul si specific afectat in toate tipurile de convulsii epileptice.
Echilibrul biochimic al neuronilor corticali depinde de aportul nutritiv adecvat si continuu, in special de glucoza si oxigen. Schimburile nutritive sunt conditionate de fluctuatii ale diferentei de potential electric de membrana intre compartimentul intra- si extracelular, diferente de potential dependente de actiunea substantelor neurotransmitatoare. Alterari ale acestui potential de membrana permit influxul ionilor de calciu in interiorul celulei si iesirea potasiului din celula, fenomen care reprezinta substratul hiperexcitabilitatii neuronale si coincide cu debutul atacului convulsiv.
Bolnavii cu convulsii primar generalizate par a avea o crestere a excitabilitatii intregului cortex cerbral. Convulsiile sunt declansate de stimuli aferenti catre cortexul hiperexcitabil, plecati de la centrii din formatiunea reticulata a trunchiului cerebral. La astfel de pacienti, activitatea convulsiva debuteaza sincron, in toate ariile cortexului.
Pentru a dovedi autenticitatea crizei, manifestarile clinice de tip convulsiv trebuie sa aibe corespondent sincron pe inregistarea EEG. Exista convulsii electrice, fara corespondent clinic. Manifestarile clinice sugestive, fara corespondent electric pe EEG, trebuie interpretate ca false convulsii. Absenta grafoelementelor specific epileptice pe o inregistrare EEG semnifica doar ca in momentul acelei inregistrari nu a existat nicio descarcare neuronala. Inregistrarea EEG pe 24 de ore permite surprinderea "evenimentelor" si are o semnificatie mai mare.
Cele mai severe tipuri de convulsii, potential amenintatoare de viata, sunt cele tonico-clonice. Clinic, atacul convulsiv poate debuta brusc, fiind precedat de tipat sau de aura. Bolnavul isi pierde constienta si cade. Faza initiala a convulsiilor consta in contractie musculara sustinuta (faza tonica). Maxilarele sunt puternic stranse si, adesea, bolnavul isi musca limba sau buzele. Salivatia este excesiva, apar varsaturi, pierderea controlului vezical si intestinal. Faza tonica este urmata de contractii musculare intermitente (faza clonica), globii oculari pot fi deviati in sus sau intr-o parte. La sfarsitul unei convulsii, bolnavul se relaxeaza si respiratia revine la normal. Urmeaza o perioada de depresie post-critica de durata variabila cu somn profund. Cand se trezeste, bolnavul acuza adesea cefalee severa si dureri musculare. Convulsiile tonico-clonice prelungite determina tulburari metabolice majore: hipoxemie, hipercapnie, acidoza respiratorie, acidemie lactica. Amnezia crizei este caracteristica.
Convulsiile tonico-clonice care survin repetat, fara perioada de relaxare musculara si fara revenirea constientei poarta denumirea de status epileptic. Acesta reprezinta o mare urgenta medicala, deoarece, in lipsa tratamentului adecvat, poate avea sfarsit letal sau poate determina sechele neurologice permanente, datorita afectarii hipoxice a creierului.
Medicamentele antiepileptice impiedica descarcarea neuronilor patologici din focarul epileptogen si a difuzarii excitatiei in afara acestuia. Actioneaza de obicei asupra canalelor ionice membranare, impiedicand depolarizarea membranei neuronale. Foarte multe medicamenete blocheaza canalele de sodiu, prelungindu-le starea inactiva si oprind descarcarile neuronale repetitive; altele blocheaza canalele de calciu, iar un alt grup deschide canalele de clor, cu influx de ioni de Cl si hiperpolarizare. Un alt mecanism de aci hiperpolarizare. Un alt mecanism de actiune al medicamentelor antiepileptice este mecanismul GABA-ergic. Se produce o inhibitie sinaptica, substanta activa avand analogii de structura cu principalul neurotransmitator inhibitor central, acidul amino-butiric (GABA).
Lipsa de repetabilitate a unor convulsii epileptice se inregistreaza de obicei sub tratament iar reaparitia crizelor la sistarea tratamentului anticonvulsivant este semnalata la 15-50% din cazuri. Durata medie a activitatii epileptice este apreciata in general la 10 ani de la prima criza, dar in 50% dintre cazurile de la copii aceasta este de numai 2-3 ani, dupa care intreruperea tratamentului nu are consecinte negative. Remisia apare la 85% dintre cazurile cu convulsii tonico-clonice.
I.Etiologie
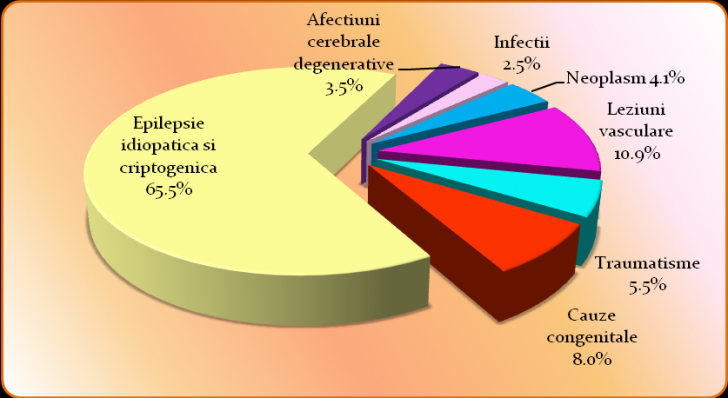
Aparitia epilepsiei este expresia interactiunii dintre factorii genetici si cei dobanditi evidentiabili intr-o mai mica sau mai mare masura. Existenta unor factori familiali care predispun la aparitia acesteia a fost demult intuita, dar in prezent exista studii aprofundate care demonstreaza natura genetica a unor forme de epilepsie care se desprind tot mai mult de plutonul epilepsiilor idiopatice.
Este general admis ca epilepsiile idiopatice au o predispozitie genetica cu determinism multifactorial, in care se conjuga actiunea mai multor gene si a mai multor factori de mediu cu efect delator. Alte forme de epilepsie cunosc un mod de transmitere mult mai complex.
Factorii epileptogeni dobanditi in cursul vietii unui pacient care modifica functiile creierului temporar sau permanent pot fi grupati in:
Factori antenatali:
Displazii corticale sau anomalii de migrare neuronala (heterotipii neuronale,lisencefalia, etc)
Ischemii sau hemoragii cerebrale intrauterine
Infectii(rubeola,toxoplasmoza)
Traumatisme ale uterului,radiatii (radiografii),dismetabolisme
Intoxicatii materno-fetale
Factori neonatali:
Nasteri distocice (prezentatii anormale,placenta praevia,etc) ale caror consecinte ischemice cerebrale determina leziuni cerebrale
Traumatisme obstetricale,incompatibilitati de grupe sanguine
Infectii cerebromeningee
Dismetabolisme (hipocalcemie,hipoglicemie),tulburari hidro-electrolitice
Factori postnatali:
Infectii ale sistemului nervos central (bacteriene, virale, parazitare) parenchimatoase sau meningeene
Tulburari imunologice
Traumatisme craniene
Tumori
Boli si malformatii cerebro-vasculare
Alti factori:
Toxici- alcool,medicamente,droguri
Astel, in functie de varsta, cauzele probabile sunt:
|
Debut (varsta) |
Cauza probabila |
|
NOU-NASCUT |
Malformatii congenitale, hipocalcemie, hipoglicemie, hipo/hipernatremie, infectii postnatale (E. Coli, streptococ -hemolitic), hemoragii intracraniene, traumatisme obstetricale. |
|
SUGAR (1-12 luni) |
Aceleasi ca la nou-nascut, spasme infantile |
|
ANTEPRESCOLAR (1 an-3 ani) |
Spasme infantile, convulsii febrile, traumatisme, anoxie. |
|
COPILARIE (3-10 ani) |
Anoxie perinatala, traumatisme obstetricale sau ulterioare, infectii, tromboze ale venelor sau arterelor cerebrale sau cauze nedeterminate (epilepsie idiopatica). |
|
ADOLESCENT (10-18 ani) |
Epilepsie idiopatica (incluznd tipurile transmise genetic), traumatisme. |
Etiologie
II. Clasificare
II.1 Clasificarea Internationala a Crizelor Epileptice
I. Crize partiale (focale,localizate)
A.Crize partiale simple (fara pierderea cunostintei)
1.Cu simptome motorii
Cu simptome somatosenzoriale sau senzoriale speciale
3. Cu simptome si semne vegetative
4. Cu simptome psihice
B. Crize partiale complexe (cu compromiterea sau pierderea starii de constienta)
1. Crize partiale simple urmate de suspendarea starii de constienta
2.Cu suspendarea starii de constienta de la debut
C. Crize partiale care evolueaza catre crize tonico-clonice secundar generalizate
1.Crize partiale simple care evolueaza catre crize tonico-clonice generalizate
2.Crize partiale complexe care evolueaza catre crize tonico-clonice generalizate
3.Crize partiale simple care evolueaza spre crize partiale complexe si catre crize tonico-clonice generalizate
II. Crize generalizate (convulsive sau neconvulsive)
A. Absente tipice
B. Absente atipice
C. Crize mioclonice
D. Crize clonice
F. Crize tonico-clonice (grand mal)
G. Crize atone (astatice)
III. Crize epileptice neclasificabile
Crizele partiale sunt acele crize epileptice la care descarcarea neuronala excesiva este localizata intr-o anumita structura corticala si au o mare varietate in expresia clinica, legata de originea anatomica.
Crizele partiale simple sau complexe pot ramane ca atare sau pot evolua catre generalizare secundara (este vorba despre crize tonico-clonice generalizate) fie direct, fie prin trecerea partiale simple-complexe generalizate.
Crizele generalizate sunt acele crize epileptice in care, cel putin teoretic sau conform clasificarii actuale, descarcarea neuronala excesiva apare simultan in ambele emisfere cerebrale. Acest concept este valabil in special in cazul crizelor primar generalizate (absente, mioclonii, crize tonice generalizate, tonicoclonice generalizate, crize clonice generalizate).
II.2 Clasificarea internationala a epilepsiilor, sindroamelor epileptice si a tulburarilor epileptice
I. Epilepsii si sindroame epileptice legate de o localizare (focale, locale, partiale)
Idiopatice (debut legat de varsta)
. Epilepsia benigna a copilariei, cu varfuri
centro-temporale
. Epilepsia copilariei cu varfuri occipitale
. Epilepsia primara de lectura
Simptomatice
. Epilepsia partiala continua a copilariei, cronic
progresiva (sindrom Kojewnikow)
. Sindroame caracterizate prin crize cu moduri specifice de precipitare
(include crizele partiale dupa leziuni dobandite, precipitate de
stimuli tactili sau proprioceptivi; crize partiale precipitate de trezirea
brusca sau la emotie)
. Epilepsia de lob temporal
. Epilepsia de lob frontal
. Epilepsia de lob parietal
. Epilepsia de lob occipital
Criptogenice (difera de epilepsiile simptomatice doar prin lipsa evidentelor etiologice).
II. Epilepsii si sindroame generalizate
Idiopatice (debut legat de varsta)
.
Convulsiile neonatale benigne familiale
. Convulsiile neonatale benigne nefamiliale
. Epilepsia mioclonica benigna a sugarului
. Epilepsia absenta a copilului (picnolepsia)
. Epilepsia absenta juvenila
. Epilepsia mioclonica juvenila
. Epilepsia cu crize grand mal la trezire
. Alte epilepsii generalizate idiopatice
. Epilepsii cu crize precipitate de stimuli specifici
Criptogenice sau simptomatice
.
Sindrom West
. Sindrom Lennox-Gastaut
. Epilepsia cu crize mioclono-astatice
. Epilepsia cu absente mioclonice
Simptomatice
.
Etiologie nespecifica
. Encefalopatia mioclonica precoce
. Encefalopatia epileptica infantila precoce cu suppression-burst
Alte epilepsii generalizate simptomatice, nespecificate
. Sindroame specifice (includ bolile in care crizele sunt un simptom de prezentare sau dominant)
III. Epilepsii si sindroame epileptice nedeterminat focale sau generalizate
Cu crize focale si generalizate
.
Crizele neonatale
. Epilepsia mioclonica severa a sugarului
. Epilepsia cu CVU continue in somnul lent
. Alte epilepsii nedeterminate
. Cu crize nedeterminat focale sau generalizate
IV. Sindroame speciale: crize ocazionale (legate de anumite situatii)
.
Crizele febrile
. Crizele izolate sau status-ul epileptic izolat
. Crizele care apar doar in evenimente acute metabolice sau toxice, consecinte
ale unor factori cum ar fi: alcool, medicamente, eclampsie, hiperglicemie
noncetonica .
Clasificarea sindroamelor epileptice are drept scop impartirea crizelor in functie de criteriul enuntat si anterior (epilepsii cu crize partiale sau epilepsii cu crize generalizate) si apoi, in functie de etiologie, in idiopatice (fara o cauza identificabila, presupus genetica), simptomatice (o cauza demonstrabila in general imagistic) sau criptogenice (probabil, simptomatice, cauza "ascunsa' cu posibilitatile actuale de diagnostic imagistic). Epilepsiile cu crize focale simptomatice sunt apoi clasificate si in functie de localizarea topografica (lob frontal, temporal, parietal, occipital).
Exista doua alte categorii:
- a epilepsiilor cu crize neindentificabile (partiale sau generalizate)
-a sindroamelor speciale (asa-numitele crize ocazionale - crizele febrile, crizele datorate unor cauze toxice sau alterari metabolice bruste, crizele izolate).
III. Fiziopatologia crizei convulsive
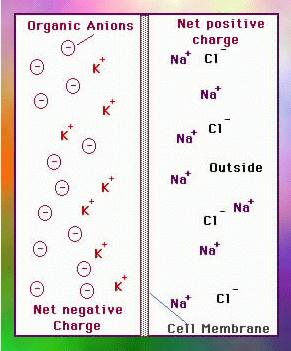
Neuronul reprezinta unitatea structurala si functionala a sistemului nervos.Este alcatuit din 3 parti principale: soma, care reprezinta partea principala a corpului neuronal; o prelungire unica, axonul, si dendritele, prelungiri fine ale somei.
Sinapsele
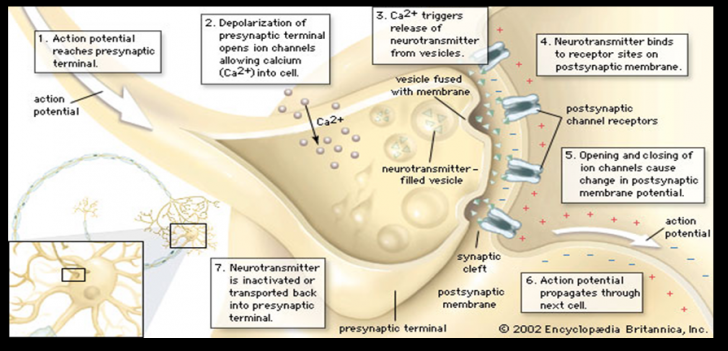
Impulsurile nervoase sunt transmise de la un neuron la altul prin jonctiuni morfo-functionale numite sinapse. Sinapsele sunt structuri de contact functional intre neuroni sau intre neuroni si efectori, specializate in transmiterea informatiei. Transmiterea sinaptica a informatiilor se face pe doua cai distincte: chimica si electrica (cu predominanta celei chimice).
In alcatuirea unei sinapse chimice intra suprafata de contact a terminalului axonal presinaptic denumita membrana presinaptica, suprafata receptoare a celulei adiacente (membrana postsinaptica) si spatiul dintre aceste doua suprafete, fanta sinaptica.
Axonul presinaptic se termina la locul de "contact" cu neuronul postsinaptic printr-o serie de fibre terminale presinaptice denumite butoni sinaptici sau terminali
Butonul presinaptic contine un numar insemnat de mitocondrii, enzime si vezicule sinaptice. Veziculele sinaptice contin mici cantitati de mediatori chimici. Existenta numeroaselor mitocondrii in butonul presinaptic este legata de necesitatile energetice pentru sinteza si eliberarea de mediatori chimici.
Fanta sinaptica este spatiul delimitat intre membranele pre- si postsinaptica.
Membrana postsinaptica contine ancorate molecule receptoare care se cupleaza specific cu mediatorul chimic. Moleculele receptoare alcatuiesc canale care sunt in mod normal inchise in perioadele dintre transmiterile sinaptice. Ca raspuns la cuplarea cu mediatorii chimici, canalele transmembranare se deschid permitand ionilor de sodiu, potasiu si calciu sa le traverseze.
In urma eliberarii din veziculele presinaptice sub actiunea influxului nervos, moleculele de mediator chimic se cupleaza cu receptorii postsinaptici determinand modificari ale permeabilitatii canalelor ionice transmembranare cu aparitia unui PPSE, in cazul sinapselor excitatoare, sau PPSI, in cazul sinapselor inhibitoare.
Cresterea sau scaderea valorii potentialului de membrana postsinaptic depinde de natura neurotransmitatorului chimic din veziculele presinaptice si de natura receptorului din membrana postsinaptica. Cand transmiterea sinaptica reduce potentialul membranei postsinaptice fata de valoarea de repaus, de exemplu de la -75mV la -65mV, schimbarea postsinaptica de potential este numita potential postsinaptic excitator (PPSE). Acest potential este denumit excitator, deoarece fiecare astfel de transmitere sinaptica mareste sansele aparitiei potentialului de actiune.
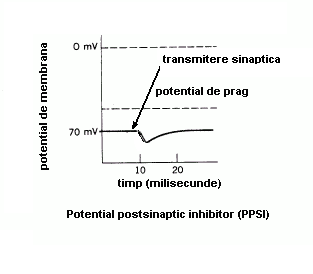
Cand amplitudinea potentialului de membrana este redusa in urma transmiterii sinaptice (de la -75mV la -65mV) de catre PPSE, membrana este depolarizata sau, mai precis hipopolarizata. Aceasta hipopolarizare a membranei postsinaptice rezulta din interactiunea neurotransmitatorului cu receptorul din membrana postsinaptica. Interactiunea neurotransmitator-receptor determina deschiderea canalelor de Na+, ceea ce permite ionilor de Na+ sa difuzeze in neuron, in directia gradientului lor chimic si a celui electric. Deoarece, mediatorul chimic presinaptic este descompus in scurt timp, potentialul postsinaptic dispare, durata lui fiind de numai cateva milisecunde. Amplitudinea potentialului postsinaptic este maxima doar in imediata apropiere a sinapsei. Desi potentialul postsinaptic se propaga pe suprafata membranei, amplitudinea sa scade pana la disparitie pe masura departarii de punctul in care a fost generat.

Cand in urma interactiunii mediatorului chimic cu receptorii postsinaptici rezulta deschiderea canalelor de K+, acesta difuzeaza prin canalele deschise in afara neuronului in cantitate mai mare decat obisnuit ducand la cresterea potentialului postsinaptic (hiperpolarizarea membranei).Aceasta hiperpolarizare a membranei postsinaptice este numita potential postsinaptic inhibitor (PPSI) deoarece scade posibilitatea aparitiei unui potential de actiune. Ca si PPSE, PPSI se propaga pe suprafata membranei postsinaptice, amplitudinea sa scazand pe masura propagarii, pana la disparitie.
Deoarece magnitudinea potentialelor
postsinaptice descreste pana la disparitie pe masura
departarii de punctul in care au fost generate, celula nervoasa
trebuie sa dispuna de un alt mijloc pentru transmiterea semnalului
electric de la sinapsa receptoare dendritica la extremitatea axonala.
Acest mijloc este potentialul de actiune neuronal denumit si
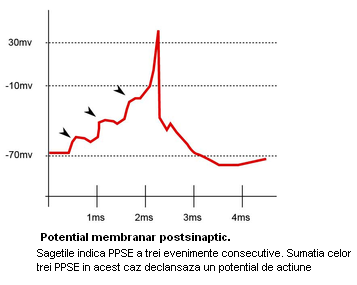
influx nervos, care se formeaza ca rezultat al sumei algebrice a
numeroaselor PPSE si PPSI si se propaga pana la
extremitatea axonala fara sa scada in amplitudine. La
extremitatea de origine a unui axon sosesc numeroase PPSE si PPSI ale
caror efecte simultane se insumeaza algebric. PPSE deschid canalele
de Na+ voltaj dependente, permitand Na+ sa patrunda in
celula, in timp ce PPSI deschid canalele de K+ voltaj dependente,
permitand K+ sa iasa din celula.
Mecanismul transmiterii informatiei prin sinapsele chimice
Mediatia colinergica
Acetilcolina asigura transmiterea chimica a informatiei in sinapsele preganglionare simpatice si parasimpatice, in fibrele postganglionare parasimpatice si in unele fibre postganglionare simpatice. Tot acetilcolina asigura transmiterea informatiei si in placa neuromusculara. In perioada dintre transmiteri, acetilcolina este stocata in butonul axonal presinaptic sub forma unor vezicule. Acetilcolina este sintetizata in corpul neuronal sau in terminatia axonala, din colina si acetil Coa sub controlul colinacetilazei. Veziculele presinaptice contin si ATP, cu rol de cotransmitator. Sosirea undei de depolarizare la extremitatea fibrei nervoase determina schimbari ale potentialului membranar, schimbari care permit Ca2+ sa curga in interiorul terminalului butonal. Trecerea Ca2+ se face prin canalele de calciu care normal sunt inchise, ele deschizandu-se ca raspuns la schimbarile de voltaj ale membranei. Concentratia Ca2+ in terminalul butonal axonal este extrem de rapida, acesta posedand mecanisme pentru sechestrarea rapida a Ca2+. Cresterea concentratiei Ca2+ determina apropierea veziculelor cu mediator de suprafata membranei presinaptice, fuzionarea membranei acestora cu membrana presinaptica si eliberarea transmitatorului (si eventual a cotransmitatorului in fanta sinaptica). Acetilcolina eliberata din vezicule difuzeaza prin fanta sinaptica. Datorita distantei mici de difuziune, acetilcolina ajunge in contact cu membrana postsinaptica intr-o fractiune de milisecunda (durata totusi mult mai lunga decat in cazul sinapselor cu transmitere electrica). Ajunsa in contact cu membrana postsinaptica, acetilcolina se cupleaza cu situsul activ al receptorilor de acetilcolina ancorati in aceasta (receptori muscarinici sau nicotinici). Cuplarea mediator-receptor determina deschiderea canalelor de sodiu ceea ce permite influxul acestor ioni. Aceste canale sunt numite chimic-dependente spre deosebire de canalele voltaj-dependente. Fiecare molecula canal necesita doua molecule de acetilcolina pentru a fi deschisa. Molecula canal ramane deschisa o perioada scurta de timp, perioada in care este traversata de circa 20000 ioni de Na2+. Ca urmare a transferului transmembranar de ioni, potentialul de membrana local se reduce pana aproape de zero (PPSE). Amplitudinea scaderii potentialului membranar depinde de numarul canalelor deschise si de durata de timp in care acestea raman deschise. Modificarile de permeabilitate ale membranei postsinaptice au ca efect aparitia pe suprafata acesteia a potentialului postsinaptic. In faza urmatoare, situsul esterazic al receptorului inactiveaza acetilcolina prin descompunere in colina si radical acetil, sub actiunea colinesterazei. Ca urmare, canalele de Na+ se inchid. Sinteza acetilcolinei poate fi blocata cu ajutorul hemicolinei, iar eliberarea acesteia cu ajutorul toxinei botulinice. Substantele anticolinesterazice de tipul ezerinei si prostigminei blocheaza activitatea colinesterazei ducand la acumularea de acetilcolina in spatiul sinaptic si la prelungirea efectelor acesteia.
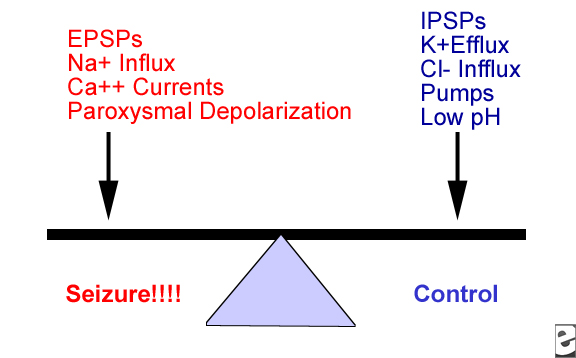
Doua tipuri de modificari pot determina proprietatile epileptogenice ale tesuturilor neuronale.
Este posibil ca excitabilitatea neuronala anormala sa fie rezultatul dezechilibrului dintre mecanismele de depolarizare si cele de repolarizare ale celulelor ("excitabilitatea tesutului neuronal"). Retelele neuronale aberante, ce produc o sincronizare anormala a unui grup de neuroni, se pot forma in timpul dezvoltarii si propagarii unei crize epileptice ("sincronizarea tesutului neuronal").
Hiperexcitabilitatea neuronala rezultata in urma unei descarcari celulare aleatorii, nu poate duce singura la propagarea unei crize epileptice. Intr-adevar, atat comportamentul normal cat si cel anormal, necesita un anumit grad de sincronizare al descarcarilor intr-o populatie de neuroni.
Astfel, crizele epileptice isi au originea intr-o cumulare de modificari atat ale excitabilitatii cat si ale sincronizarii neuronale.
|
|
Excitabilitatea neuronilor individuali este afectata de:
Proprietatile membranei celulare si micromediul neuronului
Procesele intracelulare
Caracteristicile structurale ale elementelor neuronale
Conexiunile interneuronale
Proprietatile membranei si micromediului
neuronilor, care
mentin diferentele de potential ale incarcaturii
electrice, sunt determinate de permeabilitatea
selectiva a ionilor si de pompele ionice. Neurotransmitatorii
excitatori actioneaza de regula prin deschiderea canalelor de Na+
sau Ca2+ , in timp ce neurotransmitatorii inhibitori
deschid canalele de K+ sau Cl- ( mecanismul de
actiune al unor anumite medicamente anticonvulsivante este blocarea
canalelor de Na+ sau Ca2+ ). Concentratiile ionice
extracelulare pot deasemenea contribui la excitabilitatea neuronala; de
exemplu, o crestere a concentratiei K+ extracelular
determina depolarizarea membranei.
Diferitele Procese intracelulare sunt controlate de informatiile genetice. Excitabilitatea neuronala poate fi preprogramata prin efectele controlate de ADN asupra structurii celulare, metabolismului energetic, functiilor receptorilor, eliberarii de neurotransmitatori si asupra canalelor ionice. Mecanismele care induc aceste schimbari, fie ele fazice sau pe termen lung, par sa fie legate de curentii ionici in special de influxul ionilor de Ca. Ca2+ intracelular mediaza schimbarile din proteinele membranare pentru a initia eliberarea de neurotransmitatori si deschiderea canalului ionic. Influxul ionilor de Ca influenteaza expresia informatiei genetice care produce diferite modificari temporare sau permanente ale excitabilitatii. Acest lucru se poate intampla prin inducerea selectiva a genelor pentru a sintetiza proteine specifice. Un exemplu in acest caz este inducerea genei c-fos pentru a produce proteina c-fos in neuronii implicati intr-o criza epileptica prin administrarea de pentilentetrazol. Efectele exacte ale acestui lant de reactii nu sunt pe deplin cunoscute, dar ofera un mijloc de studiu al consecintelor excitatiei neuronale pe culturi celulare ca model pentru epilepsie, invatare si memorie.
Privind Caracteristicile structurale ale elementelor neuronale in relatie cu epilepsia, cele doua regiuni primare ale creierului implicate in epilepsie sunt neocortexul cerebral si hipocampul.
In neocortex, sinapsele excitatorii sunt realizate in principal de ramurile dendritice. Eliberarea neurotransmitatorilor la acest nivel da nastere potentialelor excitatorii postsinaptice. Sinapsele inhibitorii sunt mai proeminente in regiunea somei sau a dendritelor proximale si dau nastere la potentialele inhibitorii postsinaptice. Locatia acestor sinapse previne ca fenomenele excitatorii distale sa ajunga la baza axonului. Alterarile morfologiei neuronale, fie spontane fie ca un raspuns la un traumatism, pot mari excitabilitatea fie printr-o crestere a numarului de sinapse excitatorii, fie printr-o scadere a numarului de sinapse inhibitorii. Asemenea alterari se pot exprima printr-un numar redus de ramuri dendritice cu sinapse excitatorii plasate mai aproape de baza axonului. Leziuni ale corpului neuronal sau ale cailor neuronale duc la degenerescenta terminatiilor axonice, si o noua terminatie axonala poate apare pentru a face contact cu membranele postsinaptice libere, fapt care poate duce la o crestere a potentialului excitator al neuronului. Curentii ionilor de Ca, care apar in special la nivelul dendritelor, produc o depolarizare prelungita de mare amplitudine care poate induce o descarcare exploziva de Na+, fiind urmata de o hiperpolarizare prelungita.
Neuronii sunt influentati de interconexiunile sinaptice si nonsinaptice. Transmisia neurochimica dintre neuroni implica o serie de etape ce pot fi modificate in mod selectiv pentru a schimba excitabilitatea neuronala. Aceste etape constau in eliberarea neurotransmitatorului in fanta sinaptica si membrana postsinaptica, rezultand potentiale postsinaptice excitatorii sau inhibitorii via Ca2+ si a altor mesageri secundari. Transmitatorii sunt dezactivati de catre enzime, fie prin recaptare in terminatiile axonice, fie prin captare de catre celula gliala. In sistemul nervos central neurotransmitatorii excitatori principali sunt aminoacizii glutamat si aspartat, iar cei inhibitori sunt reprezentati de GABA (acidul gamma-aminobutiric) si glicina. Neurotransmitatorii si neuromodulatorii isi exercita efectele actionand asupra receptorilor. Propietati specifice ale receptorilor au fost identificate pe baza efectelor unor anumiti agenti agonisti si antagonisti, dintre care unii sunt medicamente anticonvulsivante. Medicamentele ce actioneaza pe receptorii GABAA , ce activeaza Cl- , par sa fie mai eficiente ca anticonvulsivante, decat cele care actioneaza pe receptorii GABAB, care activeaza K+. Receptorul GABAA prezinta o importanta majora in crizele Petit mal datorita rolului sau in sincronizarea si desincronizarea cailor talamocorticale.
Descarcarile explozive ale acestor circuite sunt atribuite neuronilor din nucleul reticular al talamusului si duc la o sincronizare si desincronizare a electroencefalogramei (EEG). Alterarea acestui mecanism duce la aparitia crizelor Petit mal. Acidul Kainic si N-metil-D-aspartat (NMDA) sunt aminoacizi excitatori analogi folositi pentru a defini clasele de receptori ce raspund la glutamat si aspartat. Antagonistii NMDA sunt un potential mecanism pentru unele anticonvulsivante.
|
GABA site Barbiturate site Steroid site Picrotoxin site |
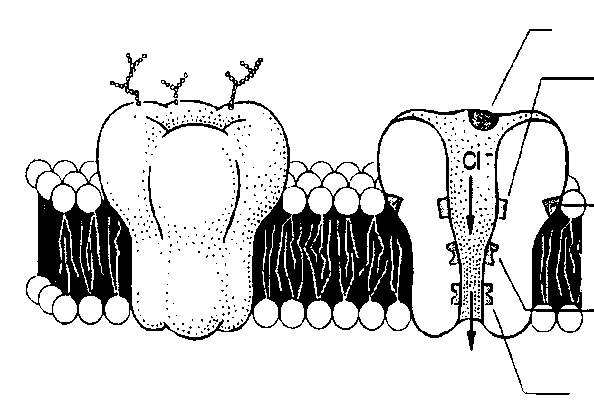
-Diagram of the GABAA receptor -

IV.1 ELECTROENCEFALOGRAMA (EEG)
Electroencefalografia este o metoda neinvaziva de explorare a fluctuatiilor de potential electric din creier inregistrat la nivelul scalpului.
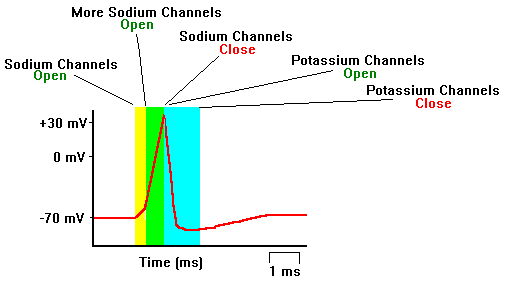
Diferenta de potential electric a unui neuron la nivelul membranei celulare este de 70 V, interiorul este negativ, la exterior pozitiv. Diferenta de potential electric indusa de stimularea sinaptica, depolarizeaza membrana neuronala, exteriorul neuronului devine negativ. In conditii normale neuronii corticali sunt continuu depolarizati si repolarizati asincron, iar curentii electrici sunt formati in spatiul extracelular.
Astfel in epilepsie o populatie larga de neuroni se descarca cu un sincronism anormal ; semnul EEG al acestei descarcari este o unda ascutita cu amplitudine mare (varf).
Scurt istoric:
In anul 1929, psihiatrul german Hans Berger a demonstrat ca este posibila inregistrarea undelor electrice generate in creier fara a deschide craniul si descrierea lor grafica pe hartie. Berger a numit aceasta noua forma de inregistrare, EEG
Prima inregistrare EEG. Hans Berger 1928
Tot el a demonstrat ca aceste unde se modifica in functie de statusul functional al creierului, cum ar fi in timpul somnului, anesteziei, precum si in unele boli ale sistemului nervos cum ar fi epilepsia. Acestea au fost intr-adevar descoperiri revolutionare si au stat la baza unei noi si foarte importante ramuri a medicinei numita neurofiziologia clinica.
Totusi electrozii utilizati de Berger erau prea mari pentru a realiza studii topografice detaliate ale EEG. Cativa ani mai tarziu acest dezavantaj a fost remediat. Astfel in anul 1936 W. Gray Walter a demonstrat ca este posibila identificarea activitatii electrice anormale a ariilor cerebrale in jurul unei tumori, prin utilizarea unui numar mare de electrozi de mici dimensiuni. Tot in cadrul activitatii sale, in anul 1957, inventeaza toposcopul. Acest aparat utiliza activitatea EEG pentru a crea o harta a suprafetei creierului si avea 22 de tuburi catodice care erau conectate la o pereche de electrozi situati pe cap. Electrozii erau aranjati in asa fel incat fiecare tub putea arata intensitatea activitatii in diferite zone ale creierului. Prin intermediul acestui aparat, Walter, a aratat ca undele cerebrale din starea de repaus sunt diferite de cele generate intr-o stare de concentrare. Cu toate acestea, costurile si complexitatea toposcopului nu au asigurat un succes comercial si o utilizare larga.
Considerata la un moment dat ca o metoda "clasica", cu posibilitati limitate, gratie mijloacelor moderne introduse in domeniu, EEG a devenit in prezent una dintre cele mai actuale si complexe tehnici de explorare a creierului.
In principiu un electroencefalograf este compus din urmatoarele sisteme:
de culegere a biocurentilor cerebrali;
de amplificare;
de afisare sau inscriere.
La acestea se adauga in functie de posibilitati un sistem de stimulare si unul de prelucrare a informatiilor obtinute.
Sistemul de culegere a biocurentilor cerebrali este compus din electrozi si conductori electrici care fac legatura cu sistemul de amplificare.
Amplasarea electrozilor sau distribuirea lor pe scalp se face in mod simetric, la distante egale dupa diverse scheme. In prezent este acceptat pe plan international sistemul 10-20 % - the ten-twenty system - recomandat de Ghidul Societatii Americane de Electroencefalografie (1991).
Figura 1- Schema procentuala Figura 2- Schema de montaj a electrozilor propusa de Soc. Am. de
EEG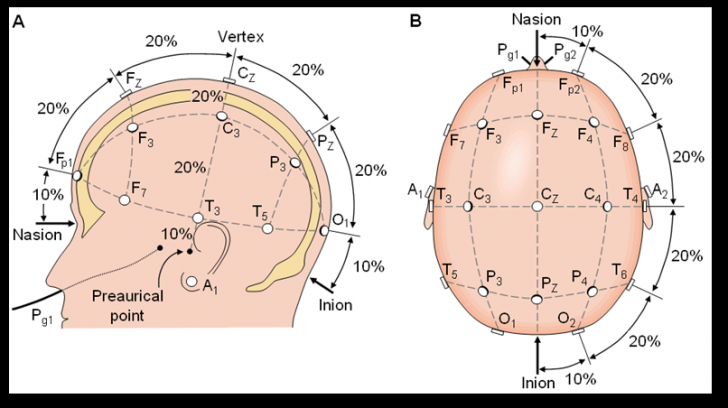
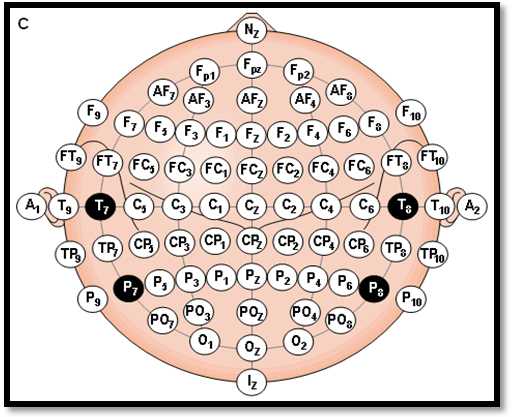
Sunt doua sisteme de culegere- monopolar si bipolar.
Sistemul monopolar foloseste un electrod comun inactiv sau indiferent "de referinta", care este plasat de obicei pe lobul urechii, dar poate fi asezat si in alte zone ca baza nasului, menton sau la nivelul vertebrei C7.
Sistemul bipolar culege diferenta de potential dintre doua arii elctrice de la care se inregistreaza suma algebrica a activitatii lor.
Montarea electrozilor se face in sistemul 10-20 pentru copiii cu varsta mai mare de 2 luni. La sugarii mai mici de 2 luni se folosesc 3 electrozi parasagitali de fiecare parte, 2 electrozi temporali, 2 electrozi de vertex si un electrod de impamantare.
In sistemul bipolar se disting 3 tipuri de montaje "exploratoare" sau de "orientare" : circulare, longitudinale si transversale. La copil se vor folosi montaje bipolare longitudinale si transversale si montaje referentiale, la fel ca la adult.
Ritmurile cerebrale
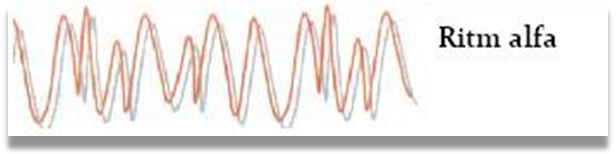
Ritmul alfa este format din unde sinusoidale
a caror ampiltudine creste si descreste periodic
imbracand imagini fusiforme, denumite curent "fusuri
alfa". Acest ritm constituie expresia activitatii
electrice de fond a creierului la un subiect normal aflat in stare de veghe
si repaus psihosenzorial. Frecventa ritmului alfa este cuprinsa
intre 8 si 13 c/s, cu o medie de 10 c/s. Obisnuit, ritmul alfa are o
frecventa de 10 c/s si o amplitudine medie de 50-60 V.
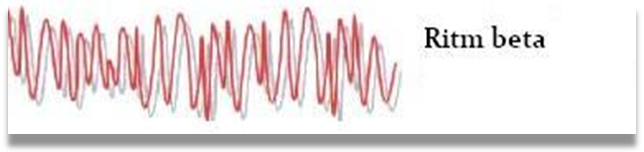
Ritmul beta este expresia electrica a
unui creier in stare de activitate. Are o frecventa rapida
cuprinsa intre 14 si 30 c/s, o amplitudine redusa de 5-30 µV
si o morfologie neregulata, discontinua, fusiforma sau
sinusoidala.
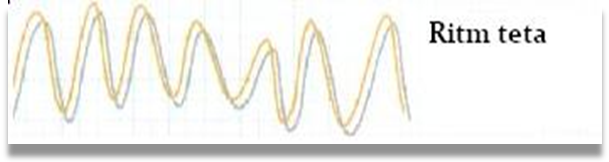
Ritmul teta are frecventa cuprinsa intre 4 si 7 c/s, amplitudine de 30-70 µV, in medie 50 µV, este monomorf sau polimorf si constituie ritmul de baza al copilului intre 2 si 7 ani.
Ritmul delta are o frecventa de 0,5-3 c/s si amplitudine medie pana la 100 µV, ajungand uneori la 200 µV. Prezenta sa la adult este totdeauna patologica, in mod normal fiind prezent doar la copilul pana la 2-3 ani si, indiferent de varsta, in somnul profund.

Artefactele in electroencefalografie
Pe langa activitatea electrica specifica creierului, pe un traseu EEG se inregistreaza si o serie de alte elemente grafice care nu sunt expresia potentialelor cerebrale si care poarta denumirea de artefacte. Se deosebesc artefacte biologice si artefacte fizice.
Artefactele biologice sunt cele mai frecvente si cel mai dificil de sesizat pe un traseu:
Miscarile oculare- se reflecta prin unde sinusoidale regulate bifazice.
Tremorul pleoapelor- imbraca aspect de unde monomorfe, grupate, ritmice localizate bilateral.
Electromiograma muschilor frontali- constituie cel mai frecvent artefact biologic intalnit pe un traseu EEG. Este expresia potentialelor musculare ale muschilor scalpului si fetei.

Figura 3 -Electromiograma muschilor frontali
Miscarile respiratorii- apar ca unde lente, ample, supraincarcate de ritmurile cerebrale normale sau patologice.
Miscarea de suctiune- induce grafoelemente lente sinusoidale si ascutite, ritmice si continue.

Miscarile de
masticatie si deglutitie- au aspecte caracteristice si durata actului motor efectuat.
Figura 4- Artefact determinat de deglutitie
Miscarea ritmica a barbiei- determina siruri lungi de grafoelemente lente si ascutite continue.
Artefacte fizice
Solutia salina cu care se umecteaza electrozii poate favoriza o scurtcircuitare, in cazul in care acestia sunt plasati apropiat, si sa rezulte de asemenea artefacte pe traseul EEG.
Artefacte
de retea electrica- se
prezinta sub forma unei tuse groase a liniei de baza, parazitand
una, mai multe sau toate derivatiile. Are frecventa retelei
(50Hz) si amplitudinea
Traseul electroencefalografic normal
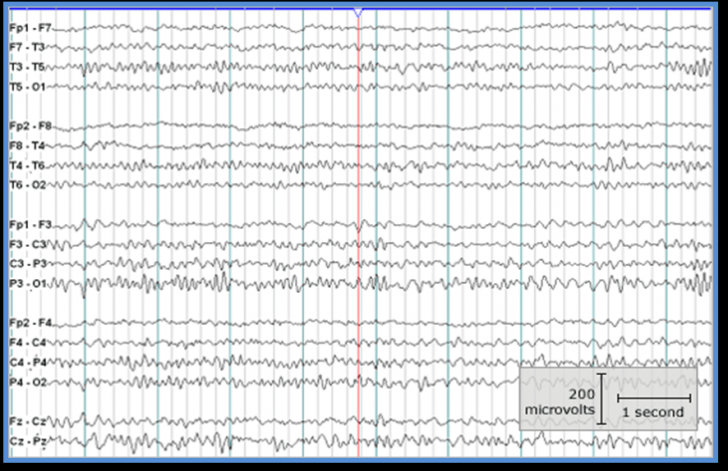
Traseul EEG in stare de veghe la
copil
Sugarul prezinta o activitate lenta de tip delta, 3 c/s, si amplitudinea de 30-40 µV, uniform fara diferente regionale si cu asimetrie interemisferica.
Dupa varsta de 5 luni activitatea bioelectrica cerebrala incepe sa se diferentieze pe regiuni si sa se organizeze in fusuri.
Intre varsta de 1 si 2 ani activitatea lenta creste in amplitudine. Incepe sa apara ritmul teta polimorf.
Intre varsta de 2 si 4 ani scade incidenta ritmului delta si creste cea a ritmului teta.
Intre varsta de 5 si 6 ani incepe sa apara ritmul alfa instabil intricat cu ritm lent, care este dominant. Dupa aceasta varsta ritmul teta incepe sa diminue ca incidenta, sa se retraga spre ariile temporale iar ritmul alfa ocupa ariile posterioare, intricat cu un procent mic de ritm delta, care se blocheaza la deschiderea ochilor.
Dupa varsta de 10 ani ritmul alfa devine stabil, modulat in fusuri in regiunile posterioare.
Dupa varsta de 12-14 ani traseele EEG sunt similare cu ale adultilor.
Electroencefalografie clinica
Epilepsia este afectiunea care beneficiaza in cea mai larga masura de aportul EEG- fiind utila atat pentru precizarea diagnosticului cat si pentru monitorizarea tratamentului.
Diagnosticul in epilepsie este in primul rand bazat pe elemente de ordin clinic, dar EEG isi pastreaza valoarea mai ales in cazul dificultatilor de diagnostic.
Pledeaza pentru diagnosticul de epilepsie, daca tabloul clinic il sustine, prezenta pe un traseu EEG de modificari sau anomalii epileptiforme (termen recomandat de Federatia Internationala de Neurologie Clinica in 2002).
Acestea constau in:
complexe varf-unda (CVU);
varfuri;
polivarfuri;
polivarf-unde;
unde ascutite (sharp-waves);
diferitele lor combinatii deja mentionate;
complexul poliunde lente;
complexul poliunde lente si ascutite.
Prezenta de anomalii epileptiforme pe un traseu EEG nu presupune obligatoriu si un diagnostic de epilepsie asa dupa cum, un traseu EEG normal nu poate nici sa-l exluda.
Exista rar sansa ca EEG sa fie efectuat in timpul unei crize epileptice; majoritatea sunt efectuate intercritic sau postcritic
Epilepsia generalizata tonico-clonica
Intercritic se pot gasi:
traseu normal;
traseu instabil cu alfa lent intrerupt de alte ritmuri;
traseu lent difuz sau localizat;
traseu de aspect intercritic cu descarcari bilaterale sau regionale, izolate sau grupate de varfuri, unde-lente, complexe varf-unda, compexe polivarf-unda, complexe varf-unda degradate.
EEG criza tonico-clonica 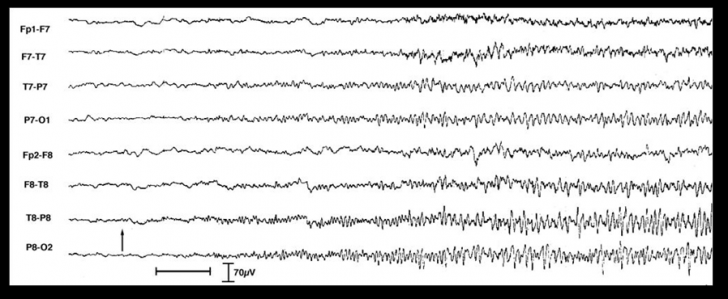
In timpul crizei tonico-clonice
generalizate anomaliile paroxistice apar bilateral, simetric si sincron
si difera ca aspect dupa fazele crizei.
Traseul EEG devine mai intai, ca un preaviz al furtunii electrocerebrale care va urma, iritabil, imbogatit cu varfuri, polivarfuri, sharp waves, difuze sau focalizate.
Debutul crizei se face prin aplatizare sau prin desincronizare ori prin sincronizare rapida, cu durata de 1-3 sec. ,urmata de scurte clonii ale muschilor fetei.
Desfasurarea crizei se petrece in 5 faze distincte:
faza tonica se caracterizeaza prin ritmul recrutant epileptic. Este format din varfuri cu frecventa de 10-12 c/s, amplitudine progresiv crescuta- 100-200-300 µV, sincrone, generalizate cu durata de 20-30 sec. (b)
faza clonica, in care ritmul recrutant este intercalat cu unde lente, la inceput cu frecventa de 8 c/s, apoi de 3-4 c/s, imbracand un aspect particular de unde lente crenelate de varfuri si de polivarfuri-unda. (c)
faza comatoasa sau stertoroasa reprezinta sfarsitul crizei. Este anuntata electric printr-o aplatizare generalizata a traseului (silentium electric) care dureaza 5-20 sec. Corespunde fazei de depresie postcritica, de epuizare corticala. (d)
faza postcritica se caracterizeaza prin activitate lenta de tip delta monomorf si polimorf, difuz, 1-3 c/s, amplitudine 50-70 µV. Este faza de suferinta corticala exprimata clinic prin stare confuzionala agitata sau linistita. (e)

faza
de somn postcritic
poate dura cateva minute sau ore.
Traseul EEG in criza grand-mal
Electroencefalografia computerizata
Dezvoltarea tehnologiei computerizate a influentat si modalitatea de inregistrare a electroencefalogramei. S-a trecut astfel de la inregistrarile pe hartie, la suportul electronic.
EEG computerizat corecteaza in mare parte neajunsurile metodei clasice:
foloseste suport electronic; EEG este stocata in calculator sau arhivata pe CD, discuri optice, DVD; informatia poate fi usor vehiculata intre computere, laboratoare, prin Internet; se poate "citi" electroencefalograma de la distanta.
dupa faza de
achizitie a semnalului, computerul permite vizualizarea unui grafoelement
in montajele si/sau derivatiile selectate de cel care citeste
EEG; prelucrarea computerizata permite si analizarea unor portiuni
mai scurte sau mai lungi ale traseului, in ceea ce priveste ponderea
anumitor ritmuri sau grafoelemente; aceasta estimare este imposibil de
cuantificat pe un traseu simplu;
Electroencefalografia computerizata
presupune deci pe de o parte, inregistrarea unui traseu EEG pe computer, iar pe
de alta parte, prelucrarea acestui traseu cu obtinerea unei EEG
cantitative, numite si "brain
mapping".
Trebuie insa subliniat ca la baza unei interpretari corecte sta traseul EEG conventional.
O tehnica, de acum in unele tari, prin posibilitatile tehnice de realizare, o constituie inregistrarea de lunga durata a EEG. Este necesara indeosebi cand EEG standard nu ofera datele necesare. Timpul de inregistrare se intinde pe o durata de ore incluzand si o noapte de somn.
Video-EEG este astazi larg utilizat in acest scop. Cand crizele de epilepsie par sa fie rezistente la tratament si se suspicioneaza in aceste cazuri o intricare cu crize psihogene, se impune o inregistrare video-EEG de lunga durata.
Mappingul magnetoencefalografic este in prezent o tehnica de cercetare ce urmareste decelarea campurilor magnetice foarte slabe induse de activitatea cerebrala, mai ales intercritica.
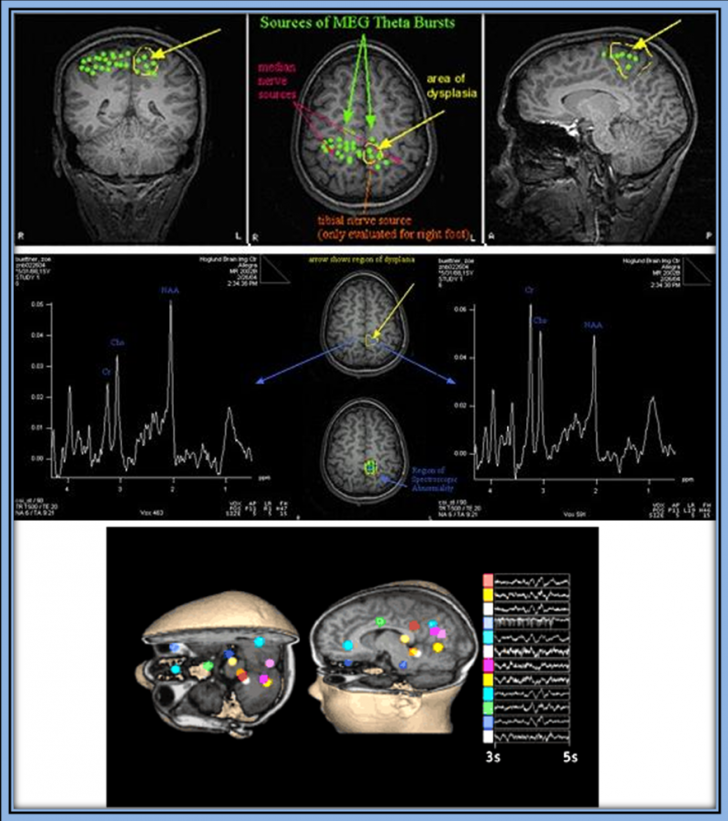
Figura 5- Mapping magnetoenecfalografic util in precizarea
ariilor functionale in vecinatatea focarelor
epileptogene
Monitorizarea de lunga durata este necesara in special in evaluarea cazurilor de epilepsie cu indicatie neurochirurgicala. In cazurile in care crizele nu pot fi bine localizate utilizand electrozi de suprafata sau atunci cand datele neuropsihologice nu sunt in concordanta cu inregistrarile EEG, se apeleaza la tehnicile invazive EEG.
Se vor utiliza electrozii sfenoidali (dispusi sub zygoma spre foramen ovale pentru a inregistra suprafata infero-meziala a lobului temporal) sau electrozi dispusi percutan in foramen ovale- fosa cerebrala medie pentru a inregistra activitatea portiunii posterioare a hipocampului si a girului parahipocampal. Electrozii corticali (electrocorticografia) , chiar si epidurali permit efectuarea de inregistrari acute sau cronice, realizand mappingul cortical.
Electrozii de profunzime sunt electrozi drepti inserati stereotactic, in parenchimul cerebral:
la baza lobului frontal prin orificii de trepan frontale,
spre structurile temporale meziale utilizand orificiile de trepan parietale,
multiplii electrozi dispusi paralel multicontact temporal hipocampic pentru a obtine o vedere spatiala a surselor epileptogene diferite si caile lor de transmitere,
printr-un electrod multicontact dipus printr-o gaura de trepan parietala in hipocamp de-a lungul axului sau bilateral.
IV.2 COMPUTER TOMOGRAFIA (CT)
Este o metoda neuroradiologica de investigatie, pusa la punct de G. Hounsfield in 1972, bazata pe radiatiile X generate de un tub radiogen de mare putere, care se deplaseaza cu 1-2 grade pe o orbita paralela cu craniul, absorbtia fascicului de raze X in structurile craniocerebrale fiind analizata de calculator, care produce prin reconstructie matematica in termeni de densitate, imagini matriciale de inalta rezolutie in plan axial, coronal, sagital sau tridimensional. Imaginile se pot stoca in memoria aparatului si pot fi fotografiate. Avantajele metodei sunt legate de calitatea informatiei, accesibilitate, rapiditate, cost.
Tomografia cu emisie de pozitroni (PET)
Ofera informatii in vivo referitoare la procesele patologice si a repercursiunilor acestora in parenchimul cerebral normal. Aceasta metoda de investigatie se foloseste atat in afectiunile neurologice (boala Parkinson, demente) cat si in neurochirurgie (tumori cerebrale, epilepsie).
Cel mai utilizat radiofarmaceutic in clinica epilepsiei este reprezentat de 18F-florodeoxyglucoza (18FDG). Scanarea intercritica demonstreaza la nivelul focarului un hipometabolism, pe cand scanarea obtinuta in timpul unei crize va evidentia un hipermetabolism. Cu toate acestea nu permite o delimitare neta a focarului epileptic in vederea gestului chirurgical, nu poate diferentia focarele epileptice neocorticale fata de cele limbice iar in cazul focarelor epileptice multiple in ambele emisfere metoda este mai putin sensibila.
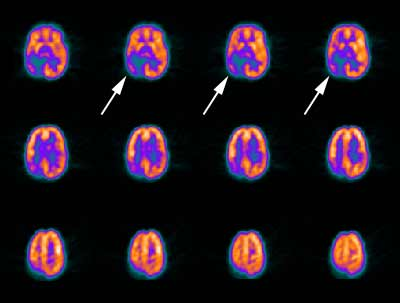
Figura 6- FDG-PET- sagetile indica o scadere a metabolismului glucozei la nivelul lobilor parietal si temporal
Tomografia computerizata cu emisie unica fotonica SPECT

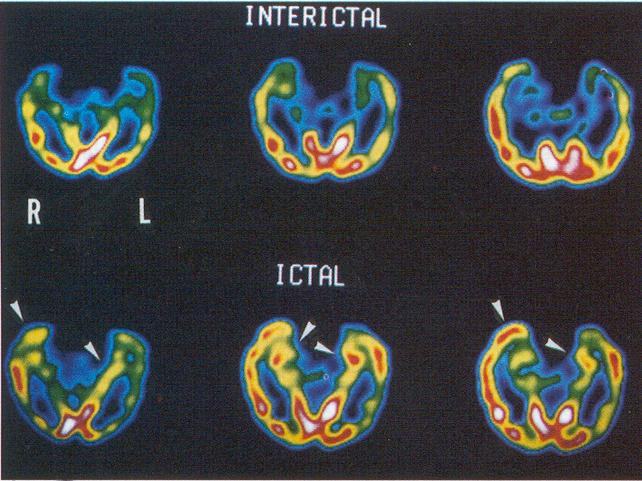
|
Figura 7- Scanarea intercritica arata o hipoprefuzie la nivelul lobului temporal stang . In timpul crizei- hiperperperfuzie bitemporala |
IV.3 REZONANTA MAGNETICA NUCLEARA (RMN)
Explorarea prin rezonanta magnetica se bazeaza pe imaginea indusa de comportarea variabila a protonilor de hidrogen din tesut cand acesta este expus unui camp magnetic puternic. Expusi campului magnetic al aparatului RMN, protonii trec de la un nivel energetic redus la un nivel energetic crescut, prin absorbtia unui cuantum energetic, respectiv revin la nivelul energetic initial, intr-un proces numit "rezonanta". Rezonanta este favorizata de pulsurile de radiofrecventa ale fotonilor direct in corp.
Fata de explorarea CT, explorarea prin RM ofera o serie de avantaje:
absenta radiatiilor ionizante, cu un mai bun contrast pentru tesutul moale, atat la examinarea nativa cat si cu substanta de contrast (Gadolinium),
posibilitatea de a scana structuri cerebrale, orbitare, spinale in diferite planuri fara a modifica pozitia pacientului,
permite diferentierea intre leziunile inflamatorii benigne si cele maligne,
detecteaza fluxul anormal in structurile vasculare.
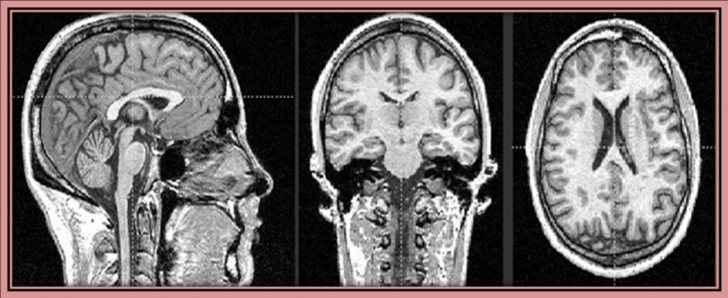
In epilepsie, RMN permite caracterizarea
procesului ce sta la baza majoritatii epilepsiilor temporale, a
sclerozei hipocampice si a anomaliilor de dezvoltare a sistemului nervos
central (migrare neuronala heterotipica, disgenezii), care au putut
fi corelate cu epilepsiile complexe, pana acum neetichetate.
IV.4 Radiografia craniana
Contributia radiografiei craniene in neuroimagistica epilepsiei este redusa.
Cu toate acestea este utila in depistarea fracturilor craniene atat post-criza convulsiva cat si ca evenimente declansatoare ale acestora prin contuzii sau dilacerari cerebrale (rar).
Deasemenea, in cazul sindromului de hipertensiune intracraniana, avand ca simptome principale cefalee, varsaturi, crize epileptice, radiografia craniana poate evidentia:
dehiscenta suturilor;
accentuarea amprentelor vasculare la nivelul boltii;
sporirea diametrelor orificiilor din baza craniului.
V. Modificari biochimice cerebrale
Convulsiile tonico-clonice prelungite determina tulburari metabolice severe: hipoxemie, hipercapnie, acidoza respiratorie, acidemie lactica.
Prin hipoventilatie scade eliminarea CO2 (hipercapnie), creste concentratia plasmatica a H2CO3 si apare acidoza respiratorie.
Organismul nu este adaptat la
cresterea rapida a presiunii partiale a CO2 in
sangele arterial, astfel intervin hematiile in interiorul carora acidul
carbonic disociat cedeaza hidrogenul care ulterior va fi preluat de
catre hemoglobina. Bicarbonatul difuzeaza in afara celulei in
schimbul acestuia patrunzand Cl. Insa, aceasta crestere a
bicarbonatului extracelular nu compenseaza suficient favorizand
aparitia conditiilor de anaerobioza cu formarea acidului lactic
(
Acidul lactic este produsul final al glicolizei anaerobe. El provine din transformarea anaeroba a acidului piruvic.
Transformarea acidului piruvic (AP) se realizeaza diferit in functie de conditiile de oxigenare:
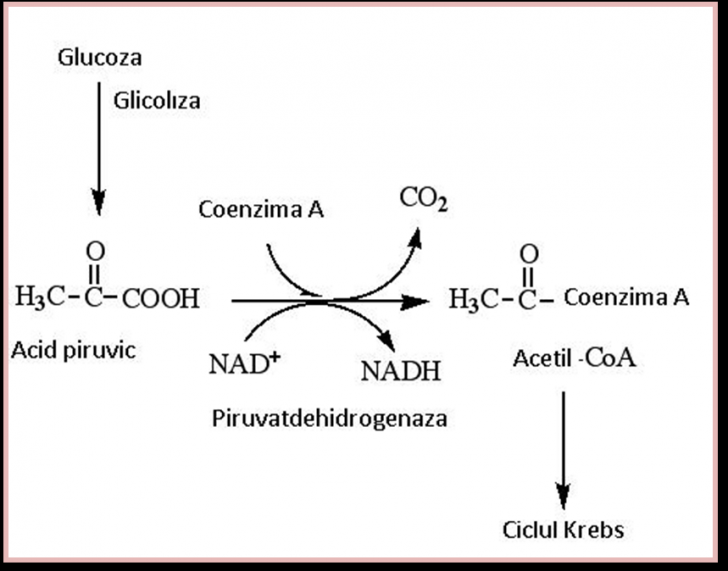
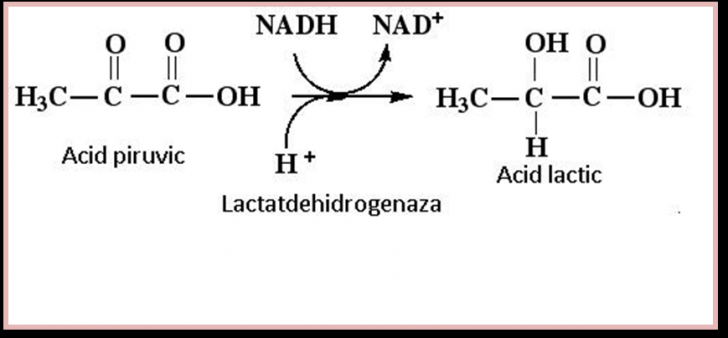
In concluzie, productia de
productia de AP (direct proportional);
concentratia de NADH (direct proportional);
concentratia de NAD (invers proportional).
Din aceasta relatie, rezulta 2 clase de acidoze lactice:
Acidoza lactica de tip A, cu raport NADH/NAD crescut (cu potential redox crescut);
Acidoza lactica de tip B, prin cresterea productiei de AP (raport NADH/NAD normal- oxigenare tisulara normala).
In acidoza lactica de tip A:
raportul NADH/NAD este crescut;
raportul AL/AP este mult crescut (peste 10:1);
intreaga
cantitate de AP este transformata in
Cauza acidozei lactice de tip A este hipoxia tisulara severa, care poate aparea in stari de soc, insuficienta respiratorie, insuficienta cardiaca, anemii severe.
VI. Manifestari clinice
Convulsiile generalizate de tip tonico-clonic sunt expresia suferintei creierului in totalitate, incluzand ambele emisfere cerebrale si adesea structurile subcorticale. Convulsiile pot fi generalizate de la inceput sau au debut focal cu generalizare secundara.
Crizele tonico-clonice consta initial intr-o crestere a tonusului anumitor muschi (faza tonica) urmata de contractii bilaterale simetrice ale extremitatilor (faza clonica).
Acest tip de convulsii este unul dintre cele mai severe, potential amenintator de viata. Atacul convulsiv poate debuta brusc, fiind precedat de tipat sau de aura
Aura -reprezinta un fenomen motor sau senzitiv ce marcheaza stadiul initial al unei crize. In mod normal apare cu cateva secunde/minute inainte de faza critica. Intensitatea sa, durata si tipul variaza de la pacient la pacient. Majoritatea pacientilor, insa, nu isi pot aminti acest eveniment.
Cu toate acestea, pot fi descrise mai multe tipuri de aura:
|
Afective |
frica, anxietate paranoia alte emotii |
|
Cognitive |
déjà vu- recunoasterea unor informatii care de fapt nu au fost niciodata percepute jamais vu- incapacitatea de a recunoaste informatii care au existat si care au fost anterir percepute amintiri |
|
Psihomotorii |
Automatisme (miscari repetate) : grimase, mestecat, inghitit; |
|
Senzitive |
Auditive Gustative: gust amar sau metalic Olfactive: perceperea de mirosuri neplacute Vizuale: ingustarea campului vizual, halucinatii vizuale Tactile: amorteala sau furnicaturi Vertij |
Bolnavul isi pierde cunostinta si cade.
Faza tonica (contractie musculara sustinuta)
De obicei faza tonica consta intr-o scurta perioada in flexie urmata de o perioada mai lunga in extensie.
Faza "de flexie" de regula porneste din regiunea fetei: ochii deschisi, globii oculari deviati in sus, gura rigida deschisa; gatul: rigid in semiflexie; trunchi: torace orientat inainte pe pelvis. Flexia se raspandeste apoi si la nivelul extremitatilor, implicand mai mult membrele superioare decat cele inferioare si mai mult musculatura proximala decat cea distala. Bratele sunt ridicate, adduse si rotate extern iar picioarele si coapsele sunt flectate, adduse si rotate extern.
Faza "de extensie" incepe la nivelul musculaturii axiale cu extensia spatelui si a gatului. Maxilarele sunt puternic stranse, adesea bolnavul muscandu-si limba sau buzele. Musculatura toracica si abdominala se contracta putand produce uneori un "tipat tonic" pe masura ce aerul este impins peste corzile vocale. Bratele sunt coborate si adduse. Antebratele pot ramane flectate sau pot fi extinse si pronate.
Degetele pot fi inclestate si articulatia radio-carpiana extinsa sau pot fi extinse cand articulatia radio-carpiana este felctata.
Membrele inferioare sunt extinse, in adductie si rotatie externa.
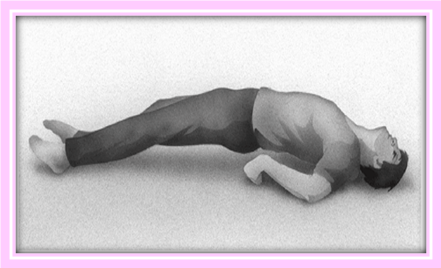

In timpul perioadei de tranzitie de la
faza tonica la cea clonica (contractii musculare intermitente),
tetanosul devine incomplet. Rigiditatea tonica este inlocuita de un
tremor fin, ce creste in amplitudine si scade in frecventa
de la 8 la 4 Hz. Tremorul este cauzat de scaderea intermitenta a
tonusului. Incepe la nivelul extremitatilor si se extinde proximal.
Faza clonica (contractii ritmice)

In timpul acestei faze, relaxarea musculaturii
intrerupe complet contractiile tonice. Revenirea intermitenta a tonusului
muscular produce aparitia contractiilor ritmice (lente pana la
violente), care scad in intensitate si frecventa pe
masura ce criza se apropie de final.
Fenomenele autonomice (vegetative)
Apar in faza preictala, sunt maxime la sfarsitul fazei tonice si scad brusc la inceputul fazei clonice. Sunt reprezentate de: hipertensiune, tahicardie, presiune crescuta la nivelul vezicii urinare, cresterea tonusului sfincterian, cianoza, piloerectie, transpiratie abundenta, hipersalivatie, hipersecretie bronhoalveolara.
La inceputul fazei tonice, printr-un expir violent, apare apneea ce se mentine pe toata durata fazelor tonica si clonica si deseori pana la inceputul perioadei postictale.
Apneea nu poate fi explicata doar pe baza contractiilor musculare, cel mai probabil un mecanism central fiind implicat in mentinerea ei.
Faza postictala (postcritica) imediata
Relaxarea musculara completa nu apare imediat in faza postcritica. La aproximativ 5 secunde dupa ultima contractie clonica, incepe o noua perioada de contractie tonica ce dureaza de la cateva secunde pana la 4 minute. Tonusul crescut predomina la nivelul muschilor cefalici; trunchiul si bratele pot fi extinse, dar nu atat de violent ca in faza tonica.
In perioada dintre ultima contractie clonica si faza tonica postictala imediata, muschii sfincterieni se relaxeaza, in acest moment putand aparea incontinenta.
Respiratia revine la normal postictal imediat (combinatia dintre maxilarele puternic inclestate si secretiile in exces are drept rezultat obstructia partiala a respiratiei). Aceasta este stertoroasa iar muschii accesori sunt activati.
Tensiunea revine si ea la normal dar tahicardia persista. Cianoza se transforma in paloare. Starea de inconstienta se mentine iar reflexele cutanate si pupilare sunt absente. Reflexele profunde de tendon sunt modificate.
Faza postictala tardiva
In acesta faza prdomina flascitatea, mai mult sau mai putin completa. Ritmul cardiac revine la normal. Reflexele tendinoase sunt de obicei diminuate si uneori raspunsul la reflexul plantar este extensia.
Pacinetul se poate trezi, trecand prin stadii succesive de coma, stari de confuzie si somnolenta sau poate cadea intr-un somn profund fara a se trezi.
Durata fazelor
Durata medie a fazelor ce compun o criza tonico-clonica, este dupa cum urmeaza:
faza tonica: 10-30 secunde
faza clonica: 30-50 secunde
faza postictala imediata: 1-5 minute
faza postictala tardiva: 2-10 minute
Total: 5-15 minute
VII. Complicatii
Posibilele complicatii ale crizelor tonico-clonice sunt reprezentate de:
Traumatisme la nivelul cavitatii bucale- se pot produce prin muscarea limbii, buzelor si partii interne a obrazului.
Traumatisme craniene- fracturi, contuzii si hematoame epidurale/subdurale provocate de cazaturi (la inceputul crizei) sau de activitatea clonica.
Pneumonia de aspiratie- aspirarea secretiilor sau a continutului stomacal regurgitat poate avea loc atunci cand reflexele, ce protejeaza in mod normal caile respiratorii, sunt inhibate postictal putand pune in pericol viata pacientului.
Edem pulmonar- edemul pulmonar postictal este o complicatie rara (imediata sau tardiva) ce se manifesta clinic prin dispnee, tuse, sputa sangvinolenta si radiografie pulmonara anormala. Aceasta complicatie, de obicei, necesita doar oxigenoterapie si trebuie diferentiata de pneumonia de aspiratie.
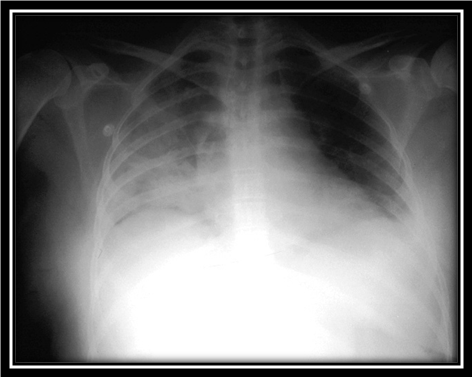
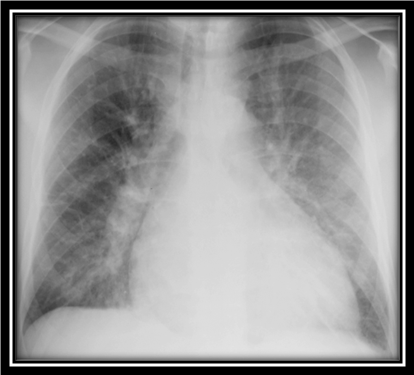
Pneumonia de aspiratie Edem pulmonar
Status epilepticus - consta in convulsii tonico-clonice care survin repetat, fara perioada de relaxare musculara si revenirea constientei. Durata crizei poate depasi cateva ore si se datoreaza unei activitati epileptice continue sau unor crize repetate de convulsii, aparute la interval scurt,care nu permit reluarea starii de constienta intre crize. Toate tipurile de crize (crizele convulsive partiale sau generalizate) pot progresa spre status epilepticus.
Convulsiile prelungite se asociaza cu hipoxie cerebrala, hipoglicemie, tahicardie, hipertensiune, acidoza respiratorie si lactica.
Aspectul clinic poate fi identic cu cel al tuturor formelor clinice de convulsii dar, de obicei, se suprapune peste cel al crizelor tonico-clonice generalizate.
Starea de rau epileptic reprezinta intotdeauna o mare urgenta medicala, deoarece, in lipsa tratamentului adecvat, poate avea sfarsit letal sau poate determina sechele neurologice permanente, datorita afectarii hipoxice a creierului.
Stabilizarea functiilor vitale este primul gest terapeutic. Asigurarea permeabilitatii cailor respiratorii superioare, aspirarea secretiilor, eventual administrarea oxigenului pe masca sunt primele gesturi medicale. Montarea unei linii de abord venos este obligatorie, precum si recoltarea catorva examene de laborator de urgenta: glicemie, ionograma, creatinina, nivel seric al medicatiei anticonvulsivante administrate anterior sau al toxicelor medicamentoase care ar fi putut precipita criza.
Medicatia anticonvulsivanta se va administra i.v. , de prima alegere la copil fiind benzodiazepinele. Diazepam se va administra i.v. in doza de 0,3-0,5 mg/kg, lent si nu mai mult de 3 doze succesive la interval de 20 minute, daca fenomenele convulsive nu cedeaza. O alternativa foarte eficienta se dovedeste a fi administrarea rectala a produsului Desitin.
Medicatia de a doua optiune, in cazul in care benzodiazepinele nu au avut rezultatul scontat, este reprezentata de Phenidal (fenitoin i.v.), in doza de 15-30 mg/kg doza totala, administrata fractionat in bolusuri de 10 mg/kg/doza.
Statusul epileptic nonresponsiv la variantele terapeutice anterior descrise evolueaza favorabil cu Midazolam, 0,20 mg/kg in bolus, urmat de perfuzie lenta cu o doza de intretinere de 1-5 µg/kg/minut.
(a) status epilepticus
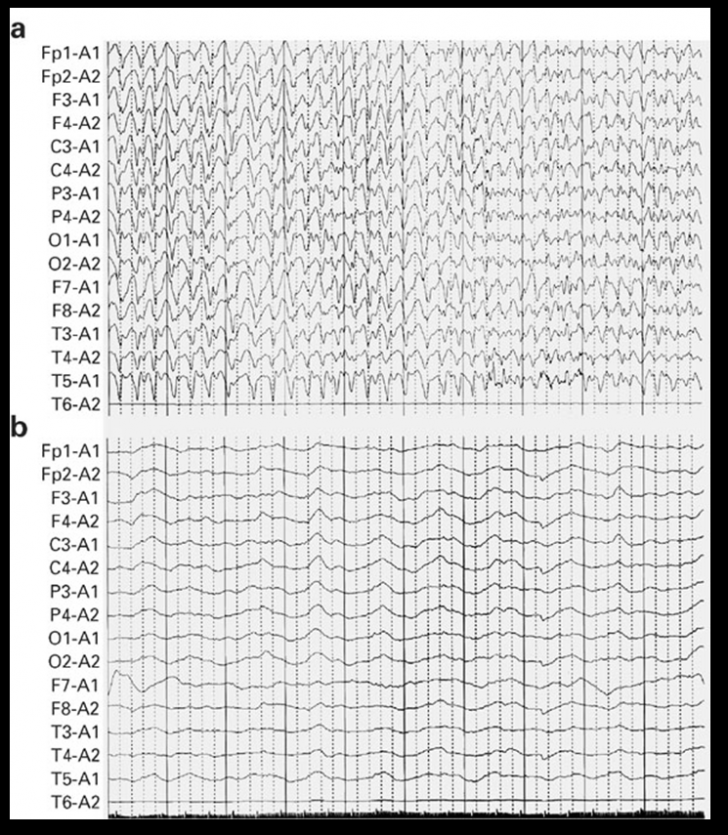
(b) descarcarile ritmice dispar consecutiv administrarii de Midazolam i.v.
VIII. Tratament
Tratamentul epilepsiei trebuie sa fie complex si individualizat. El va cuprinde:
-terapia medicamentoasa, in criza si de lunga durata;
-asistenta psiho-sociala;
-interventia chirurgicala, atunci cand este nevoie.
Tratamentul medicamentos are ca scop suprimarea crizelor si a recurentelor, folosind o medicatie antiepileptica care sa aiba cat mai putine efecte secundare, deci care sa afecteze cat mai putin posibil dezvoltarea fizica, psihica si comportamentala ulterioara.
Intelegerea mecanismelor de actiune si a farmacocineticii medicamentelor antiepileptice (MAE) este extrem de importanta pentru ca acestea sa fie utilizate intr-un mod cat mai eficient. Multe structuri si procese sunt implicate in dezvoltarea unei crize, incluzand neuroni, canale ionice, receptori si sinapse excitatoare si inhibitoare. Medicamentele antiepileptice modifica aceste procese in favoarea inhibitiei fata de excitatie cu scopul de a opri sau preveni crizele epileptice.
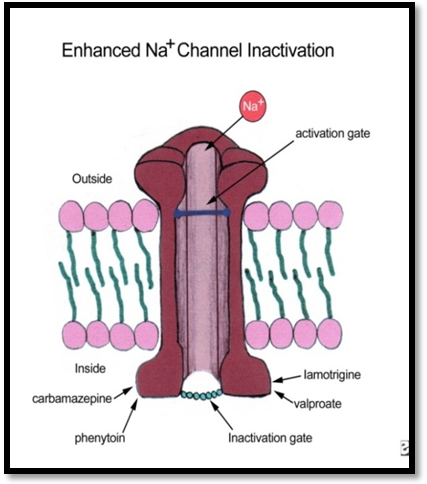
Canalele de sodiu
Producerea unui potential de actiune de catre un axon necesita trecerea Na+ in interior prin canalele de sodiu. Fiecare canal, din punct de vedere dinamic, exista in 3 forme, dupa cum urmeaza:
- O stare de repaus in timpul careia canalul permite trecerea sodiului in celula
- O stare activa in care canalul permite un influx crescut de sodiu in celula
- O stare inactiva in care canalul nu permite trecerea sodiului in interiorul celulei
In timpul unui potential de actiune aceste canale sunt activate permitand influxul ionilor de sodiu. Prin descarcari axonale repetate o multitudine de canale de Na+ devin inactive ducand axonul in imposibilitatea de a mai propaga potentialul de actiune. MAE care vizeaza aceste canale, le stabilizeaza in forma inactiva prevenind trecerea la forma activa; astfel este evitata descarcarea repetata a axonului.
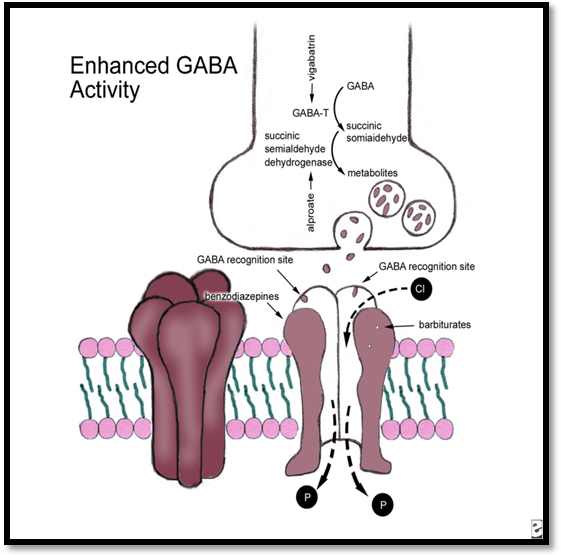
Receptorii GABA-A
Atasarea GABA la receptorii GABA-A faciliteaza trecerea ionilor de Cl- prin canalele de clor, in interiorul celulei. Influxul acestora va avea drept rezultat un potential de repaus mai negativ in celula ceea ce va ingreuna depolarizarea. Unele MAE sunt agoniste acestui tip de conducere GABA-mediata blocand recaptarea GABA sau inhiband metabolismul acestuia mediat de GABA-transaminaza, avand drept rezultat o acumulare crescuta a GABA la nivelul receptorilor postsinaptici.
Receptorul GABA-A mediaza influxul de Cl-, ducand la hiperpolarizarea celulei si inhibitie. MAE pot actiona ca potentatori ai influxului de clor sau ca inhibitori ai metabolismului GABA.
Receptorii pentru glutamat
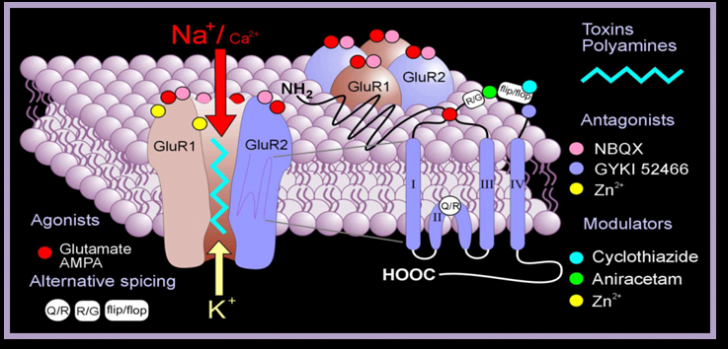
Receptorul pentru glutamat are 5
posibile situsuri de legare, raspunsul fiind in functie de situsul
stimulat sau blocat. Situsurile de legare sunt reprezentate de: AMPA, kainate,
NMDA, glicina si situsul metabotropic care are 7 subunitati
(GluR 1-7). MAE ce modifica acesti receptori sunt antagoniste ale
glutamatului.
VIII.1 PRINCIPII DE TRATAMENT ANTIEPILEPTIC
1. Nu se trateaza prima criza de convulsii, mai ales daca este suspectata o epilepsie idiopatiaca, deoarece aceasta ar putea fi unica. Criza izolata cu traseu EEG normal necesita numai supraveghere.
2. Tratamentul se va institui in cazurile de epilepsie in care diagnosticul este cert. "Potentialul convulsiv" inregistrat EEG, fara crize manifeste, nu are indicatie terapeutica.
3. Evaluarea rezultatelor tratamentului se face in primul rand pe criterii clinice si abia in al doilea rand pe criteriul normalizarii EEG. Normalizarea traseului EEG nu reprezinta un scop in sine al tratamentului anticonvulsivant.
4. Monoterapia este ferm recomandata si reprezinta tratamentul de prima intentie. In alegerea drogurilor antiepileptice, se va tine seama de:
-eficienta medicamentului respectiv asupra acelui tip de epilepsie;
-efecte secundare;
-particularitatile individuale ale pacientului.
5. Eficacitatea terapeutica depinde de tipul de criza si de tipul de epilepsie, cu conditia ca incadrarea sa fie facuta corect, ceea ce nu este totdeauna usor. Este posibil ca, la inceputul evaluarii, modificarile EEG sa nu fie suficient de sugestive sau conditiile de inregistrare sa nu fie perfecte.
6. Monoterapia presupune, la randul ei, droguri de prima, a doua sau a treia alegere si numai daca acestea se dovedesc a fi ineficiente se trece la politerapie antiepileptica.
7. Politerapia devine necesara numai daca bolnavul prezinta mai multe tipuri de crize care nu pot fi controlate cu un singur medicament.
8. Se obisnuieste ca medicatia antiepileptica sa fie administrata in doze progresiv crescande (posibil daca numarul crizelor nu este foarte mare) urmata de cresterea lenta a dozelor pana se ajunge la acumulare medicamentoasa si la un nivel seric optim. Se evita astfel principalele efecte adverse ale acestei medicatii.
9. Evaluarea eficacitatii terapeutice se face numai dupa o perioada de acumulare a drogurilor. Pentru a se obtine un nivel eficient, medicatia trebuie administrata zilnic, neintrerupt si, pentru majoritatea preparatelor, in doze fractionate. Dozarea nivelului seric este necesara numai in unele cazuri. Se va aprecia eficacitatea clinica si abia dupa aceea efectul favorabil asupra modificarilor traseului EEG.
10. Monitorizarea periodica (clinica, EEG si paraclinica) este obligatorie. Examenul minimal (hemoleucograma, teste de citoliza hepatica) este necesar in special in primele 6 luni de la inceputul tratamentului cand pot fi evidentiate principalele efecte toxice ale medicatiei antiepileptice.
12. Pacientul trebuie informat asupra principalelor efecte secundare ale medicatiei (si chiar asupra eventualelor riscuri pe care trebuie sa si le asume, alaturi de medic) precum si a unor conditii de viata care vor trebui respectate (evitarea expunerii intempestive la soare, evitarea unor alimente cum sunt cafeaua, ciocolata, interzicerea petrecerii unui timp prea indelungat la televizor sau in fata ecranelor computerelor). Practicarea sporturilor in care scurte pierderi de cunostinta ar putea provoca accidente grave este formal contraindicata.
13. Renuntarea la unul dintre medicamentele antiepileptice pentru ineficienta sau pentru ca s-a declarat brusc "vindecarea" se face lent, in trepte, niciodata brusc. Aceasta perioada de sevraj va fi lunga (1-3 luni, mergand pana la 12 luni in anumite cazuri). Sevrajul se poate propune dupa o perioada de 2 (5) ani de evolutie fara crize convulsive (criteriu clinic!).
VIII.2 TRATAMENTUL IN TIMPUL CRIZEI
sa se incerce protejarea
persoanei de lezari; sa se protejeze de cazaturi daca
este posibil; sa se mute mobila sau alte obiecte care ar putea rani
persoana in timpul crizei;
- sa nu se introduca nimic, inclusiv degetele, in gura pacientului;
introducerea unui material in gura bolnavului poate produce lezari
acestuia, ca de exemplu aschierea dintilor sau fractura mandibulei
(daca pacientul este suprins in timp util, se va preveni muscarea
limbii prin plasarea unui material textil moale intre arcadele dentare,
posterior;
- se va preveni asfixia prin plasarea pacientului in decubit lateral;
- sa nu se incerce mentinerea pacientului intins pe jos;
- se va preveni survenirea unei noi crize prin administrare intra-musculara sau intra-rectala de Diazepam 0,1-0,3 mg/kgc.
Se poate repeta administrarea de Diazepam dupa 20 minute (daca nu a cedat la prima administrare).
Dupa o criza convulsiva
-se examineaza persoana
daca a suferit leziuni ;
- daca bolnavul nu poate fi intors intr-o parte in timpul
convulsiilor, sa se realizeze aceasta dupa ce criza a luat
sfarsit si pacientul este mai relaxat ;
- daca bolnavul prezinta dispnee, sa se curete usor
cavitatea bucala de voma sau saliva ;
- sa se aleaga o zona sigura unde pacientul poate fi
asezat pentru a se odihni;
- sa nu se ofere nimic de mancare sau de baut, pana ce pacientul
nu este deplin constient si atent;
- o persoana care tocmai a prezentat o criza convulsiva
este deseori confuza pentru o scurta perioada de timp dupa
terminarea crizei; sa se supravegheze bolnavul pana ce acesta este
constient si familiar cu imprejurimile.
VIII.3 TRATAMENTUL DE LUNGA DURATA

ACIDUL VALPROIC (VPA) sau sarea sodica a acestuia (valproatul de sodiu)
Denumiri comerciale: Convulex, Depakine, Orfiril, Petilin.
Este singurul antiepileptic al carui spectru de actiune cuprinde toate tipurile de epilepsii, fie ca sunt forme generalizate (cu crize tonico-clonice, crize mioclonice, absente tipice, sindrom West, sindrom Lennox-Gastaut), fie forme locale (motorii, senzoriale, psihomotorii). Este medicamentul ideal pentru pacientii care prezinta crize majore alternand cu crize partiale.
Actiune: blocheaza canalele de sodiu voltaj-dependente, prelungindu-le starea inactiva. Timpul de injumatatire este de 14 ore. Nivelul terapeutic plasmatic este de 30-100 g/ml, dar relatia acestuia cu eficacitatea clinica este discutabila. Se utilizeaza sub forma de acid valproic sau valproat de sodiu, dar exista si preparate care contin un amestec al acestor doua substante (Depakine Chrono).
Doze: Doza initiala este de 10 mg/kg/zi, care se creste progresiv pana la 15-40 mg/kg/zi, cu o doza uzuala de 20-30 mg/kg/zi. Exista fluctuatii largi ale nivelului seric in decursul zilei, ceea ce ar putea avea ca efect reducerea actiunii antiepileptice. Preparatele foarte noi sunt concepute ca tablete enterosolubile sau comprimate filmate cu cedare controlata, minitablete retard sau capsule cu granule care permit o eliberare prelungita in intestin. Doza administrata va fi crescuta lent, astfel ca la doza optima se va ajunge in interval de o saptamana.
Efecte adverse. Acestea se vor "astepta" la inceputul tratamentului, in primele 6 luni de administrare, perioada in care monitorizarea tratamentului trebuie sa fie mai stricta. Cel mai frecvent efect advers consta in citoliza hepatica cu cresterea transaminazelor (foarte rar s-au semnalat accidente fatale, cu necroza hepatica acuta). Se mai semnaleaza tremor, leucopenie, trombocitopenie, anemie, pancreatita (uneori fatala!), aparitia brusca a unori stari de stupoare sau coma, fenomene cu caracter idiosincrazic, caderea parului, sindrom Steven-Johnson, eritem multiform. Cresterea nedorita in greutate ar putea fi un efect advers redutabil al tratamnetului cu acid valproic, mai ales la adolescente.

2.FENITOINA (difenilhidantiona) (DPH)
Face parte din calsa hidantoinelor, fiind inrudita chimic cu barbituricele. Indicatia majora este reprezntata de crizele tonico-clonice si crizele focale Jacksoniene. Nu are actiune asupra absentelor tipice si nu se administreaza nici in convulsiile febrile.
Actiune: blocheaza canalele de sodiu voltaj-dependente (efect direct proportional cu doza administrata) si inhiba neurotransmitatorii centrali. Exista o mare variatie indvidulala privind biodisponibilitatea. Nivelul terapeutic plasmatic este de 10-20 g/ml, iar peste 25 g/ml se inregistreaza fenomene de supradozaj.
Doza: medie este de 5-7 mg/kg/zi , tabletele avand 100 mg. Se incepe cu o doza progresiv crescanda, 2mg/kg/zi , se creste lent cu 1 mg/kg/zi pana se ajunge la doza terapeutica recomandata. Pentru copilul de 3-6 ani , doza calculata reprezinta de obicei 1-2 tb/zi (100-200 mg), iar peste 6 ani 1-3 tb/zi (100-300 mg).
Efecte adverse: ataxie, diplopie, vertij, nistagmus, miscari coreiforme, tremor de repaus, gingivita hipertrofica, descrisa mai ales la copii, acnee, hirsutism, eruptii cutanate, anemie megaloblastica. Administrata femeii gravide se transmite transplacentar si produce hemoragie la nou-nascut prin hipoprotrombinemia pe care o induce, dar care se poate corecta prin administrare de vitamina K. Nu se va administra daca exista bloc AV, bloc sino-atrial, fibrilatie, flutter, hipotensiune arteriala.
Marele avantaj al acestui antiepileptic este acela ca efectul anticonvulsivant nu este insotit de sedare
Produsul injectabil de fenitoina se numeste Phenidan si are indicatie speciala in statusul epileptic. Se gaseste sub forma de fiole (250 mg/5 ml) sau flacoane de solutie perfuzabila (15 mg/ml, respectiv 750 mg/50 ml). Se recomanda in crizele prelungite de convulsii, ca medicament de a doua alegere, i.v. , lent, cu atentie, deoarece administrarea paravenoasa accidentala poate produce necroza tisulara. Ritmul de administrare recomandat la copil este de 1 mg/kg/min, de preferat cu pompa de perfuzie. Se face precizarea ca solutia din fiola nu se poate dilua, astfel ca se va administra in ritm mai lent, de 0,5 mg/kg/min. Doza totala maxima este de 30 mg/kg/zi in prima zi, pentru ca in zilele urmatoare sa scada la 20 mg/kg/zi, respectiv la 10 mg/kg/zi in a treia zi.
Denumiri comerciale: Fenobarbital, Gardenal, Luminal.
Este un antiepileptic cu spectru larg de actiune, indicat in crizele majore tipice, epilepsiile focale, dar inactiv in absentele tipice. Pana recent a fost cel mai utilizat antiepileptic in pediatrie, in special la copilul sub 5 ani si in tara noastra exista o mare experienta in "manevrarea" acestui drog, bine tolerat la copil, cu putine efecte adverse. Recent a inceput sa fie inlocuit de produsele mai noi si pentru ca somnolenta (uneori agitatia) pe care o determina este considerata intolerabila. Este cel mai vechi antiepileptic cunoscut si utilizat ( de la inceputul secolului XX).
Actiune: se fixeaza pe receptorii GABA-ergici, folosind actiunea GABA de deschidere a canalelor de clor. Timpul de injumatatire este foarte lung (40-70 de ore), fapt foarte important in cazul intoxicatiilor cu fenobarbital. Concentratiile plasmatice cu efect terapeutic sunt de 10-20 g/ml.
Doza curenta pediatrica cu actiune antiepileptica preventiva este de 5-8 mg/kg/zi, de administrat in 2-3 prize zilnice. Este conditionat in tablete de 0,015 g si 0,10 g.
Efecte adverse: sedarea este unul din principalele efecte nedorite, pentru care in prezent este considerat un drog de a doua alegere.
Efectul inductor enzimatic il face recomandabil in tratamentul icterului neonatal cu bilirubina indirecta (chiar la aceasta varsta este foarte bine tolerat). Sedarea este mai putin evidenta dupa un timp de folosire. Ca si restul medicamentelor antiepileptice, produce obisnuinta si sevrajul se va face cu prudenta. Dintre efectele adverse se descriu osteomalacie, fracturi in os patologic, eruptii scarlatiniforme, rubeoliforme, anemii megaloblastice.
Produsul injectabil autohton se gaseste in fiole de 200 mg/2 ml (100 mg/ml) si nu poate fi administrat intravenos din cauza unui prezervant special. Produsul autohton nu poate fi administrat decat i.m. daca se doreste administrarea parenterala, in criza de convulsii de exemplu.
4.CARBAMAZEPINA (CBZ) (Derivat N carbamil al imiostilbenului, substanta inrudita chimic cu antidepresivele triciclice)
Denumiri comerciale: Timonil, Tegretol, Finlepsin.
Indicatia majora este reprezentata de crizele tipice grand-mal si crizele partiale. Poate agrava crizele mioclonice!
Actiune: blocheaza canalele de sodiu voltaj dependente si inhiba astfel descarcarile neuronale repetitive. Concentratia serica eficace este de 4-10 g/ml. Peste 10 g/ml apar efectele toxice.
Doze . Tabletele sunt de 200 mg, iar doza pediatrica curenta este de 10-25 mg/kg/zi. Se incepe cu 5 mg/kg/zi si se creste treptat doza pana la 10-25 mg/kg/zi. Pentru uz pediatric exista sirop 100 mg/5 ml (Timonil, Tegretol) sau produse retard, care permit administrarea unor doze unice. Acestea pot fi de 150 mg, 300 mg pentru a fi adaptate varstei si greutatii pacientului.
Efecte adverse. Carbamazepina nu are ca efect secundar sedarea dar poate scadea atentia (important pentru copilui scolar), poate produce diplopie si uscaciune a gurii datorita unor efecte anticholinergice. Are si ea actiune de inductor enzimatic, poate induce osteoporoza, anemie megaloblastica, trombocitopenie, agranulocitoza si anemie aplastica.
CLONAZEPAM (CZP)
Denumire comerciala: Rivotril.
Actiune anticonvulsivanta si miorelaxanta. Este eficace in toate formele de epilepsie, inclusiv in crizele minore.
Actiune: Inhibitie GABA-ergica prin fixare pe receptorii pentru GABA si facilitarea deschiderii canalelor de clor.
Doze. Se gaseste conditionat in tablete de 0,5 si 2 mg. Doza medie pediatrica este de 0,2 mg/kg/zi. Se incepe cu 0,5 mg/zi si se creste treptat pana la 1-4 mg/zi, in functie de varsta.
Efecte adverse: Sedare, somnolenta, mai ales la inceputul tratamentului. Se mai noteaza, in special la copii, agitatie, agresivitate, iritabilitate, cresterea salivatiei si a secretiilor bronhopulmonare. In timp, se dezvolta toleranta si chiar dependenta la medicament.
Este un produs cu importante proprietati anticonvulsivante, cu actiune care se instaleaza rapid, caracter esential care il recomanda ca produs de baza pentru sistarea crizelor de convulsii, in convulsiile ocazionale sau in starea de rau convulsiv. Deoarece durata de actiune este foarte scurta, administrarea lui se va asocia cu alt anticonvulsivant cu actiune de mai lunga durata, cum ar fi fenitoina.
Doza anticonvulsivanta este de 0,3-0,5 mg/kg/doza. Fiola contine 10 mg/2 ml , deci 1 ml din fiola contine 5 mg, adica o doza pentru un copil de 10 kg. Trebuie subliniat ca solutia din fiola nu se poate dilua si ea se va administra foarte lent, direct intravenos, cu multa precautie, deoarece poate produce depresie respiratorie, uneori stop respirator in timpul administrarii. Convulsiile cedeaza de obicei in timpul administrarii.
Absorbtia Diazepamului din regiunea rectala este semnificativ mai rapida comparativ cu celelalte cai de administrare (orala, i.m. , supozitoare), fiind depasita doar de calea de administrare i.v. Are avantajul ca poate fi administrat si la domiciliu de catre parinti, este total atraumatic si reduce stresul familiei care are un copil ce poate prezenta oricand o criza de convulsie. Este medicamentul ideal pentru copiii cu convulsii febrile recurente.
6.ANALOGI AI ACIDULUI GAMA-AMINO-BUTIRIC
VIGABRATIN (VGB)
Denumire comerciala: Sabril.
Este antiepilepticul formelor refractare de convulsii, mai ales in crizele partiale cu sau fara generalizare secundara. Este considerat in prezent antiepilepticul de electie in sindromul West. Efectul antiepileptic se datoreaza inhibarii ireversibile a GABA-transaminazei, cu impiedicarea catabolizarii acidului gamaaminobutiric, principalul neurotransmitator inhibitor de la nivelul creierului.
Doza este 40 mg/kg/zi initial, dar se poate ajunge la 80-100 mg/kg/zi.
Efecte adverse: somnolenta, cefalee, depresie, agitatie, diplopie.
Denumire comerciala: Neurotonin.
Se gaseste sub forma de capsule de 100, 300 si 400 mg de gabapentin. Este indicat in monoterapia unor cazuri de convulsii nou diagnosticate sau in tratamentul unor convulsii partiale simple sau complexe, singur sau in asociere.
Nu exista experienta privind tratamentul copiilor sub varsta de 2 ani. Pentru tratamentul asociat al copiilor intre 3 si 12 ani se incepe cu administrarea unor doze care se cresc progresiv, initial 10 mg/kg/zi, crescand treptat cu cate 10 mg/kg/zi pana la o doza medie de 30 mg/kg/zi gabapentin. Aceasta doza poate fi depasita la nevoie, pana la un maxim de 40-50 mg/kg/zi. Doza totala zilnica va fi administrata in 3 prize, inidferent de orarul meselor. Intervalul dintre administrari nu va depasi 12 ore iar la intreruperea tratamentului se recomanda sevrajul lent. Nu se va recomanda copiilor cu absenta.
Efecte adverse: somnolenta, oboseala, ameteli, cefalee, crestere in greutate, tremor, disartrie, amnezie, labilitate emotionala. Sub varsta de 12 ani s-au semnalat in mod special hiperkinezie si comportament agresiv. S-au semnalat uneori citoliza hepatica si fluctuatii ale glicemiei, ceea ce recomanda un control mai strict al glicemiei la diabetici.

LAMOTRIGIN (derivat feniltriazinic) (LMG)
Denumire comerciala: Lamictal (Glaxo).
Indicatia majora este reprezentata de crizele partiale cu sau fara generalizare secundara, desi este acceptat ca este un antiepileptic cu spectru larg, de ultima generatie, care, in afara de efectul favorabil demonstrat in crizele partiale, mai este eficient si in convulsiile tonico-clonice primar generalizate, in absentele tipice si atipice, in convulsii tonice si atonice, sindrom West.
Durata lenta de eliminare permite sa fie administrat de 2 ori pe zi . Doza de intretinere la copil este de 5-15mg/kg/zi iar in asocierile cu valproat este de 1-5 mg/kg/zi. Dozele se cresc foarte lent, de aceea trebuie asteptat pana apare raspunsul la tratament. Indexul terapeutic este foarte larg, astfel ca dozele se pot creste in limite largi, fara o crestere substantiala a riscului. Reactia adversa cel mai frecvent intalnita este rash-ul cutanat, iar cresterea in greutate nedorita remarcata dupa tratamentul indelungat cu acid valproic este mai putin severa dupa lamotrigin. Nici doza de LMG si nici nivelul seric nu sunt predictibile pentru eficacitate sau efecte adverse, de aceea fiecare pacient trebuie sa primeasca o doza strict individualizata de LMG. Studii recente sugereaza ca LMG ar putea fi eficient in controlul convulsiilor epilepsiei mioclonice juvenile in locul acidului valproic, considerat pana recent medicamentul de soc.

Denumire comerciala: Topamax.
Antiepileptic de ultima generatie, cu multiple potentiale mecanisme de actiune:
|
Locul de actiune |
Mecanism de actiune |
|
Canale de Na+ voltaj dependente |
Limitarea descarcarilor repetitive |
|
Receptorii GABA A |
Potenteaza inhibitia mediata GABA la nivelul receptorilor GABA A, nivel care nu este influentat de benzodiazepine sau barbiturice |
|
Receptorii glutamat AMPA/kainate |
Blocheaza neuroexcitotoxicitatea indusa prin glutamat influentand activitatea receptorilor non-NMDA |
|
Canalele de Ca2+ voltaj dependente |
Usoara reducere a curentului de calciu la nivelul canalelor voltaj dependente |
|
Anhidraza carbonica |
Inhiba izoenzimele II si IV ale anhidrazei carbonice |
Topiramatul este indicat ca terapie adjuvanta in crizele partiale, crizele tonico-clonice primar generalizate si in crizele asociate cu sindromul Lennox-Gastaut la copii peste 2 ani. In timp ce unele anticonvulsivante pot cauza o crestere semnificativa in greutate, topiramatul a fost asociat cu o scadere in greutate.
Doze: pentru pacientii intre 2-16 ani doza zilnica totala recomandata ca terapie adjuvanta este de 5-9 mg/kg/zi impartita in doua doze. Pentru a obtine un raspuns clinic optim, doza trebuie crescuta cu 1-3 mg/kg/zi in interval de 1-2 saptamani.
Efecte secundare: Cele mai frecvente efecte secundare ale topiramatului sunt relationate cu SNC.
Profilul efectelor secundare difera in contextul monoterapie versus politerapie. Astfel in cazul monoterapiei, ca efect secundar predomina parestezia, pe cand in terapia adjuvanta cel mai des sunt incriminate ameteala si oboseala. Alte efecte: cognitive- precum confuzie si lipsa concentrarii. Acestea apar de obicei in primele saptamani de tratament si pot disparea cu timpul.
Scaderea in greutate apare la majoritatea pacientilor. La copii aceasta pierdere de greutate este temporara si nu a fost asociata cu un efect advers asupra cresterii per ansamblu.
Denumiri comerciale: Liskantin, Milepsinum, Majsolin.
Mecanism de actiune asemanator topiramatului.
Indicat in terapia initiala sau adjuvanta a crizelor tonico-clonice, a miocloniilor si a epilepsiei partiale.
Doze: Se incepe cu 50 mg/zi in doua prize si se creste la 150 pana la 500 mg/zi divizat in trei prize egale.
Efecte secundare si toxicitate: Pacientii trebuie avertizati asupra eventualelor efecte secundare si o atentie deosebita trebuie acordata in special la inceputul tratamentului cu acest drog.
Printre efectele adverse frecvente se numara: ameteala, greata, sedare, ataxie, rash. Rar poate aparea leucopenie si trombocitiopenie, agranulocitoza si anemie aplastica, limfadenopatie si hepatita. Deasemenea este notabila agresivitatea si personalitatea schimbata similare efectului fenobarbitalului.
Medicamente de linia I (medicamente care administrate singure asigura prevenirea aparitiei unuia sau mai multor tipuri de crize epileptice).
Medicamente de linia II (medicamente care administrate numai cu cele din linia I asigura prevenirea aparitiei unuia sau mai multor tipuri de crize)
|
Tipul crizei |
MAE de prima alegere |
MAE de a doua alegere |
Alte MAE ce pot fi folosite |
MAE de evitat (pot agrava) |
|
Generalizate tonico-clonice |
VPA, CBZ, LTG, TPM |
OXC, LEV, CLB |
Acetazolamida, CZP, PB, PHT, PRM |
TGB, VGB |

CBZ= carbamazepina
CZP= clonazepam
CLB= clobazam
LTG= lamotrigina
LEV= levetiracetam
OXC= oxcarbazepina
PB= fenobarbital
PHT= fenitoin
PRM= primidona
TPM= topiramat
TGB= tiagabina
VGB= vigabratin
VPA= acid valproic
Toate medicamentele anticonvulsivante adecvate trebuie experimentate metodic pana se atinge controlul cel mai bun al convulsiilor. Nu exista nici o dovada, in prezent ca pacientii tratati cu mai multe anticonvulsivante au un raspuns mai bun decat cei cu unul sau doua anticonvulsivante. Din contra, pacientii cu o schema simpla au mai putine reactii adverse fata de cei cu scheme medicamentoase complexe si, de asemenea, fara exacerbarea frecventei convulsiilor.
IX. Evolutie

Pana la 95 % din pacientii cu convulsii tonico-clonice de cauza necunoscuta vor avea o perioada de 5 ani fara crize intr-un interval de 20 de ani de la debutul bolii. Dintre acestia 21 % pot avea recaderi in timpul perioadei de observatie de 20 de ani.
Frecventa convulsiilor tonico-clonice generalizate la momentul diagnosticului poate indica evolutia si remisiunea ulterioara. Esecul reducerii frecventei crizelor la 2 ani dupa diagnostic, scade sansele de remisiune in urmatoriii ani. Intreruperea tratamentului antiepileptic cronic este dominata de criteriile clinice. Factorii de risc la intreruperea tratamentului sunt: debutul crizelor sub varsta de 8 ani; crizele dificil de controlat; crizele partiale; prezenta anomaliilor neurologice sau psihice asociate.
Criteriul EEG - normalizarea traseului intercritic - este socotit, in prezent, de importanta secundara; cu exceptia epilepsiei-absenta, normalizarea EEG nu este neaparat necesara pentru decizia intreruperii tratamentului. Multi autori considera ca riscul recaderilor este mai mare la pacientii cu paroxisme EEG decat la acei cu trasee EEG normale, neexistand insa consens deplin in aceasta problema. Unii cercetatori au raportat remisiuni prelungite la pacientii cu anomalii marcate EEG, iar altii recomanda tratamentul anticonvulsivant pe toata durata persistentei paroxismelor EEG. Exista si opinia ca tratamentul trebuie continuat o perioada suplimentara de un an, dupa care administrarea anticonvulsivantului se va intrerupe, indiferent de aspectul traseului EEG.
In cele mai multe sindroame
epileptice, EEG normala nu este o conditie necesara pentru
intreruperea tratamentului. Intreruperea tratamentului se poate efectua in
epilepsia benigna rolandica, in situatia in care EEG se poate
normaliza, in medie, 2 ani de la ultima criza convulsiva. Nu
exista dovezi ca pubertatea are vreo importanta in luarea
deciziei de oprire a tratamentului. Intreruperea brusca a unui
anticonvulsivant poate sa determine instalarea unei stari de rau
epileptic si este contraindicata.

Majoritatea autorilor sunt de acord ca intreruperea tratamentului anticonvulsivant trebuie sa se faca progresiv, pe baza experientei clinice, cu observatia ca recaderile sunt frecvente, chiar dupa intreruperea lenta a tratamentului. Aicardi (1994) recomanda intreruperea lenta a tratamentului in decurs de 3-6 luni. Intreruperea unor anticonvulsivante ca fenobarbitalul si benzodiazepinele necesita precautii speciale deoarece aparitia convulsiilor "de sevraj" pare mai frecventa cu aceste medicamente.
Aparitia uneia sau, mai rar, a doua crize convulsive dupa oprirea tratamentului ridica o problema dificila. Multi epileptologi considera ca astfel de convulsii sunt, mai curand, "convulsii de sevraj" decat recaderi si, de aceea, nu reprezinta o indicatie de reluare a tratamentului. Este adevarat ca unii pacienti nu mai prezinta convulsii in absenta unui tratament dupa astfel de "convulsii de sevraj", dar incidenta acestora nu se cunoaste si chiar notiunea de "criza de sevraj" este empirica. Pe de alta parte, efectele psihologice ale unei convulsii aparute la intreruperea tratamentului sunt destul de severe. Aicardi (1994) considera ca este bine ca pacientul si familia sa fie avertizati de posibilitatea unui astfel de accident, sa li se spuna ca o convulsie aparuta poate ramane izolata si sa fie sfatuiti sa nu reia tratamentul daca apare o criza, lasand la alegerea lor o alta conduita daca sunt inspaimantati de o a doua convulsie eventuala. Alti autori reiau tratamentul pe o perioada de 6 luni. Crizele ce apar la peste 2-3 luni dupa "sevraj" trebuie considerate recaderi. In aceste cazuri, reluarea tratamentului este, in general, recomandata (Aicardi, 1994), uneori pe perioade lungi, chiar toata viata .
Cu toate progresele remarcabile ale ultimelor decenii in domeniul neurologiei si, implicit, in cel al epilepsiei, in ceea ce priveste clasificarea clinica, investigatiile si tratamentul, se constata ca aspectele psihice si psiho-sociale ale bolii ocupa un loc mai putin important in arsenalul terapeutic atat al epileptologiei, cat si al altor boli neurologice.

Reaparitia unei crize dupa o perioada de control duce la prabusirea sperantelor de "vindecare". Acelasi efect negativ il are si esecul unui medicament antiepileptic nou introdus care fusese investit pozitiv de medic si care fie nu ajuta, fie chiar agraveaza situatia clinica.

Cei mai expusi pacienti pentru a dezvolta complicatii
psihologice sunt in special cei cu intelect normal si cu epilepsii cu
prognostic bun, acestia trebuind sa fie abordati
multidisciplinar. Este esentiala informarea familiei si
pacientului in legatura cu toate aspectele discutate mai sus. Intotdeauna
trebuie lasata pacientului 'o
Copyright © 2026 - Toate drepturile rezervate