 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
NORME TEHNICE
DE PREPARARE SI CONTROL
ALE
VACCINULUI
DE PREPARARE A VACCINULUI VIU CONTRA CONTRA PSEUDOPESTEI AVIARE - "AVIPESTIVAC - Cl/90 "
1. CARACTERISTICILE PRODUSULUI
1.1. Vaccinul contra pseudopestei aviare este constituit din lichidul alantoamniotic, recoltat de la embrioni de gaina, inoculati cu virusul pseudopestei aviare Cl/90 (La Sota) continand minimum 106,0DIE50/doza vacinala si un coloid protector al virusului.
1.2. Vaccinul Cl/90 se prezinta sub forma liofilizata sau lichida, in fiole sau flacoane, care contin: 50, 100, 200, 250, 500 doze pentru administrare individuala si 500, 1000, 2500, 5000 doze pentru administrare in apa de baut sau aerosoli.
1.2.1. Vacinul liofilizat are aspectul unei pastile pufoase, de culoare alb-galbuie sau brun-rosiatica .
1.2.2. Vacinul sub forma lichida este galbui, transparent sau usor opalescent, uneori poate prezenta depozit de urati.
1.2.3. Vacinul pentru administrare individuala este livrat impreuna cu diluantul ambalat corespunzator numarului de doze specificat pe eticheta.
1.2.3.1. Diluantul este o solutie tampon fosfat, cu pH
1.2.3.2. Diluantul este steril, incolor, transparent si fara impuritati.
1.3. Denumirea comerciala a vaccinului contra pseudopestei aviare, preparat cu Cl/90 ( La Sota ) este AVIPESTIVAC-Cl/90.
2. COMPOZITIA PRODUSULUI
2.1. Vaccinul contra pseudopestei aviare
AVIPESTIVAC-Cl/90 este constituit din
lichidul alantoamniotic recoltat de la embrioni de gaina
inoculati cu virus
3. Materiale
Oua embrionate de gaina.
3.1.1.Ouale embrionate de gaina in varsta de 9-10 zile, utilizate la prepararea vaccinului AVIPESTIVAC - Cl/90, vor avea coaja alba si trebuie sa provina de la efective de pasari conventionale sau pasari libere de germeni patogeni specifici (SPF).
3.1.2. Conditiile de admisibilitate a oualelor conventionale folosite in productia vaccinului AVIPESTIVAC - Cl/90, sunt cuprinse in Tehnica 1.
3.2. Virusul Newcastle -tulpina La Sota- Cl/90.
3.2.1 Virusul Newcastle -tulpina La Sota- Cl/90 se utilizeaza pentru inocularea oualor embrionate.
3.2.2. Tulpina de lucru (TL) de virus Cl/90 de La Sota, se prepara, conserva si utilizeaza conform ,,Normelor tehnice de preparare si control" ale acesteia.
3.3. Substante protectoare
3.3.1. Diluantul protector utilizat pentru virusul pseudopestei aviare Cl/90 La Sota este hidrolizatul de colagen.
3.3.1.1. Hidrolizatul de colagen se prezinta ca o solutie galbui-bruna, clara cu pH = 7,2-7,5. La concentratii mari pot apare cristale proteice
3.3.1.2. Concentratia de substanta uscata pentru hidrolizatul de colagen intrebuintat la seriile de vaccin liofilizat este de 15-18 %, iar pentru seriile de vaccin lichid este de 7,5-9%.
3.3.2. Se pot folosi si alti diluanti protectori ca: peptona (2%) - lactoza (10%), carboximetil celuloza (CMC), triturat de embrioni inoculati cu virusul pseudopestei aviare, ser normal de cal-inactivat si cu 5% glucoza sau alte compozitii verificate din punct de vedere al calitatii protectoare, conform Tehnicii 13.
3.4. Antibiotice, chimioterapice.
3.4.1. Solutiile de antibiotice utilizate in diferite faze de productie sunt: solutia de penicilina-streptomicina, neomicina, gentamicina, doxysol sau alte antibiotice cu spectru larg.
3.4.1.1. Solutiile de antibiotice se prepara si se folosesc conform Tehnicii 2, asigurandu-se o concentratie finala in vaccin de 1/1 000-1/2 000 de antibiotice cu spectru larg si 400 000 UI/1 000 penicilina.
3.4.1.2. Folosirea altor antibiotice decat cele prevazute in Tehnica 2 se face dupa testarea prealabila a eficacitatii fata de flora contaminanta si a efectului acestora fata de virusul Newcastle, CL/90, tulpina La Sota.
3.5. Mertiolatul de sodiu
3.5.1. Solutia de mertiolat de sodiu se prepara si se intrebuinteaza conform Tehnicii 2, in dilutie finala de 1/10 000.
4. MODUL DE PREPARARE
4.1. Obtinerea suspensiei virale.
4.1.1. Ouale embrionate in varsta de 9 zile se controleaza pentru aprecierea viabilitatii, conform Tehnicii 1.
4.1.1.1. Marcarea pozitiei embrionilor se face prin miraj efectuat in ziua inocularii.
4.1.2. Suspensia de virus necesara inocularii embrionilor in varsta de 10 zile se prepara prin diluarea virusului - tulpina de lucru (Cl/90 - La Sota) in solutie de tampon fosfat salin (TFS), cu pH = 7-7,5 incit sa se obtina o concentratie finala de 105 -106 DIE50 /ml. Diluantul va contine 2 000 UI penicilina si 10 mg streptomicina /ml.
4.1.2.1. Suspensia de virus Cl/90-La Sota (TL), in dilutia de lucru, va fi conservata la +4/+80C pe toata perioada de utilizare.
4.1.3. Virusul Cl/90 - La Sota TL se inoculeaza steril in cavitatea alantoidiana a oualor embrionate de 10 zile. Fiecare ou se inoculeaza cu 0,1-0,2 ml suspensie de virus Cl/90-La Sota tulpina de lucru.
4.1.4. Embrionii conventionali inoculati, mentinuti la incubator la +37/+380C sunt controlati prin ovoscopie la 24 si 72 ore dupa inoculare, eliminandu-se cei morti.
4.1.4.1. Embrionii SPF se controleaza la 24 si 60 ore dupa inoculare, eliminandu-se, de asemeni, cei morti.
4.1.5. Embrionii vii SPF la 72 ore si embrionii conventionali vii la 86-88 ore dupa inoculare se sacrifica prin refrigerare la +40C, timp de 24-48 ore, dupa care se folosesc la obtinerea suspensiei virale.
4.1.6. Virusul contra pseudopestei aviare Cl/90- tulpina La Sota, reprezentat de lichidul alantoamniotic se recolteaza prin aspiratie, in conditii de asepsie, de la embrionii sacrificati conform pct. 4.1.5.
4.1.6.1 Recoltarea lichidului alantoamniotic se face in recipienti de sticla cu capacitate de 1 000 ml, individualizati, care se depoziteaza la +4/+80C pana la terminarea controlului de faza al sterilitatii conform pct. 8.1.
4.2. Prepararea vaccinului.
4.2.1. Suspensiile virale necontaminate cu bacterii sau fungi se comaseaza cu diluantul protector, solutia de antibiotice si mertiolat de sodiu.
4.2.1.1. Seriile de vaccin liofilizat contin 7% lichid alantoamniotic si 30% diluant protector (colagen-peptona-lactoza). Seriile de vaccin lichid contin 50% lichid alantoamniotic si 50% diluant protector (colagen).
4.2.2. Seria de productie este reprezentata de cantitatea de vaccin existenta intr-un recipient (20-40 l) in cazul vaccinului lichid sau de continutul de vaccin introdus intr-un aparat de liofilizare.
4.2.2.1. Fiecare serie de productie este controlata pentru sterilitate bacteriologica si micologica conform pct. 8.1.2.
4.2.2.2. Controlul pe flux tehnologic al concentratiei in virus a seriilor de vaccin se face prin sondaj, la 1-2 serii, obtinute din acelasi lot de embrioni conform Tehnicii 4.
5. MODUL DE CONDITIONARE
5.1. Seriile de vaccin lichid corespunzatoare conform pct. 4.2.2.1. si 4.2.2.2. se repartizeaza in flacoane de 50 ml si se conserva la +4/+80C, in vederea utilizarii sub forma lichida.
5.1.1. Seriile de vaccin lichid contin 1 000, 2 000, 2 500, 3 000, 5 000 doze /flacon.
5.2. Conditionarea prin liofilizare se va executa conform "Fisei tehnologice privind liofilizarea vaccinului viu contra pseudopestei aviare Cl/90-tulpina La Sota", Tehnica 14.
5.2.1. Seriile de vaccin liofilizat contin: 50, 100, 200, 250, 500 sau 1 000 doze /flacon (liola).
5.3. Vaccinul Cl/90-tulpina La Sota lichid sau liofilizat se conserva la +4/+80C pana la terminarea controlului final.
5.4. Etichetarea si ambalarea.
5.4.1. Dupa controlul final fiecare floacon/fiola va fi signat(a) sau va purta o eticheta care va avea inscris numele producatorului, denumirea comerciala a produsului, numarul seriei, valabilitatea, numarul de control.
5.4.1.1. Etichetele flacoanelor/fiolelor de vaccin preparat pe embrioni SPF vor purta la loc vizibil stampila "SPF".
5.4.2. Fiolele/flacoanele vor fi ambalate in cutii colective, pe care se va aplica o eticheta cu urmatoarele specificatii: numele producatorului, denumirea comerciala a produsului sau seriei, numarul de doze per fiola sau flacon, valabilitatea, viza laboratorului de control.
5.4.2.1. Pe eticheta cutiilor cu vaccin Cl/90-La Sota SPF va fi stampilat la vizibil "SPF".
5.4.2.2. Pe cutiile colective se va aplica o banderola de garantie pe care va fi inscrisa denumirea unitatii producatoare, precum si o eticheta avertizoare "FRAGIL".
5.4.3. In fiecare cutie colectiva se vor introduce 2-3 exemplare din instructiunile de folosire a produsului.
6. VALABILITATEA
6.1. Vaccinul livrat in stare lichida, care are ca protector hidrolizatul de colagen va putea fi folosit in timp de 4 luni de la data recoltarii virusului.
6.2. Produsul liofilizat va avea o valabilitate de 12 luni de la data liofilizarii.
6.3. Vaccinul va fi folosit in limitele termenului inscris pe eticheta.
7. CONDITII DE PASTRARE SI TRANSPORT
7.1. Vaccinul "AVIPESTIVAC Cl/90" lichid si liofilizat va fi conservat la producator si pana la utilizare la +4/+80C.
7.2. Diluantul va fi pastrat la temperatura camerei (+20/+240C).
7.3. Transportul vaccinului se va efectua numai in masini si lazi izoterme, la temperatura de +4/+80C.
8.CONTROALE PE FLUX TEHNOLOGIC
8.1. Determinari calitative.
8.1.1. Se executa din continutul fiecarui recipient cu lichid alantoamniotic recoltat conform pct. 4.1.6.1. Insamantarile vor fi efectuate in acceiasi zi cu recoltarea lichidului alantoamniotic dupa metodologia cuprinsa in Tehnica 3.
8.1.2. Controlul bacteriologic si micologic se executa, de asemeni, la fiecare serie de vaccin prelevanu-se proba dupa comasarea lichidului viral cu celelalte componente auxiliare (diluant protector, antibiotice) folosindu-se metodologia din Tehnica 3.
8.1.3. Suspensia virala din flacoanele initiale de recoltare si cea din recipientii ce contin o serie de vaccin contaminata cu bacterii, se elimina din productia vaccinului "AVIPESTIVAC Cl/90" sau se utilizeaza in procesul de preparare al vaccinului inactivat si cu adjuvant uleios, numai daca corespunde controlului cantitativ conform Tehnicii 4.
8.1.4. Solutia de colagen se controleaza din punct de vedere bacteriologic si fungic, inainte de introducerea sa in vaccin conform Tehnicii 3.
8.2. Determinari cantitative. Controlul concentratiei in virus.
8.2.1. Se executa conform prevederilor pct. 4.2.2.2. la anumite serii de vaccin, dupa comasare si adaugarea componentelor auxiliare (diluant protector, antibiotice) stabilindu-se titrul DIE50/ml dupa metodologia din Tehnica 4.
8.2.1.1. Titrul DIE50/ml trebuie sa fie de cel putin 109,6/ml pentru ca o serie de vaccin "AVIPESTIVAC Cl/90" sa fie admisa la conditionare.
8.2.2. Laboratorul de control produse biologice va preleva probe de lichid alantoamniotic de la fiecare serie de vaccin predata pentru conditionare, inainte de amestecul cu mediul protector, precum si dupa aceea.
8.2.2.1. Probele prelevate vor fi conservate prin congelare pana la terminarea controlului curent al seriei de vaccin.
8.2.2.2. In cazul in care titrul unei seri de vaccin liofilizat este cu 0,75 log10 mai mic decat titrul lotului de lichid alantoamniotic predat spre liofilizare, se face controlul concentratiei in virus pe baza probei prelevate conform pct. 8.2.2.
9. EVIDENTA DE PRODUCTIE SI CONTROL PE FLUX
9.1. Se tine in registre oficiale.
9.1.1. Registrul de productie va cuprinde toate datele tehnice referitoare la materialul biologic folosit in prepararea vaccinului.
9.1.2. Registrul de control pe faze de productie va cuprinde rezultatele controalelor bacteriologice, micologice, precum si a concentratiei in virus, efectuate de producator.
9.1.3. Registrul pentru evidenta prepararii, controalelor si consumului tulpinii de lucru (TL).
10. NORME DE PROTECTIA MUNCII
10.1. Orice acident de munca, indiferent de gravitatea lui, va fi anuntat imediat sefului de munca, iar in lipsa acestuia, persoanei care ii tine locul sau sefului de echipa.
10.2. Persoanele care vin la serviciu in stare de ebrietate sau consuma alcool in timpul serviciului nu vor fi admise la lucru. Acestea vor fi sanctionate conform regulamentului de ordine interioara.
10.3. Pentru lucrarile de laborator este obligatorie purtarea echipamentului de protectie.
10.4. Este interzisa folosirea echipamentului de protectie, in alte scopuri decat cele pentru care a fost destinat.
10.5. In boxele sterile se va folosi echipament tehnologic special (halate, bonete, baticuri, sorturi, pantofi de tenis/baschet) destinat strict operatiunilor din boxa.
10.6. Este interzisa folosirea boxelor sterile in alte scopuri decat cele prevazute de fluxul tehnologic (recoltari, inoculari, insamantari, titrari, comasari etc.).
10.7. In incaperi, camere - laborator, boxe sterile, se va face curat zilnic. Saptamanal fiecare loc de munca trebuie riguros dezinfectat, dupa executarea in prealabil a curateniei zilnice.
10.8. Dupa orice lucrare efectuata in boxa sterila se va efectua dezinfectia acesteia.
10.9. Dupa terminarea activitatii, personalul care a lucrat in boxa sterila se va spala pe maini la chiuveta, folosind sapun, peria de unghii si solutie dezinfectanta.
10.10. Se interzice accesul personalului cu lenjerie sau imbracaminte din fibre sintetice in laboratoarele in care se lucreaza cu flacara deschisa.
10.11. Se interzice purtarea halatelor din molton in timp ce se lucreaza cu flacara deschisa.
10.12. Este interzisa pastrarea hranei in frigiderele unde se gasesc tulpini de agenti infectiosi, bacterieni sau virali.
10.13. Pentru evitarea posibilitatilor de accidentare, se va folosi numai sticlarie intacta, fara zgarieturi sau bule de aer.
10.14. La lucrarile sub vid, baloanele vor fi puse in cos special de sarma pentru impiedicarea raspandirii cioburilor in caz de explozie (se interzice folosirea baloanelor din sticla cu zgarieturi, crapaturi sau bule de aer la lucrari sub vid).
10.15. Decongelarea produselor conservate in azot lichid, se va face prin introducerea flacoanelor sau fiolelor cu produs in vase cu apa mentinuta la temperatura camerei. Muncitorul care executa aceasta operatie va purta in mod obligatoriu echipament tehnologic care sa-i acopere corpul, inclusiv fata, precum si ochelari de protectie pentru a evita ranirile grave, prin explodarea recipientilor de sticla.
10.16. Transportul baloanelor (goale sau cu lichide), se va face in cosuri de nuiele, sau din plasa de sarma pe carucioare.
10.17. Manipularea baloanelor cu lichide, in boxe, in camere frigorifice si la fiolaj se va face cu atentie deosebita pentru evitarea spargerilor si accidentarilor.
10.18. La pregatirea pipetelor Pasteur, cand se taie teava de sticla se vor purta ochelari de protectie, iar mainile vor fi protejate de manusi textile. Dupa taierea cu pila a tevii de sticla, ruperea se face indreptand taietura spre partea opusa operatorului.
10.19. Tuburile de sticla (canulele) care se introduc in orificiile dopului de cauciuc sau alte tuburi de cauciuc, trebuie sa aiba marginile rotunjite la flacara. Tubul trebuie umectat cu apa, solutie de sapun sau glicerina si se tin cat mai aproape de capatul care se introduce. La aceasta operatie, mainile vor fi protejate prin manusi textile, prin invelire cu un prosop sau cu panza de tifon umed, pus in 4-5 straturi.
10.20. La topirea cerii de albine si parafinei, se pune mai intai apa in tava, (cat este necesar) si apoi se pun bucatile de ceara si parafina pentru topit.
10.21. Tava cu ceara si parafina topita se va da jos de pe trepied numai dupa ce s-a solidificat.
10.22. Este interzisa functionarea lampilor de ultraviolete in prezenta oamenilor.
10.23. Substantele toxice vor fi pastrate in dulapuri incuiate si se va tine o evidenta precisa a consumului acestor substante. La substantele toxice au acces numai persoanele autorizate.
10.24. Substantele toxice se vor elibera pentru consum numai in cantitatile necesare si cu aprobarea sefului de laborator sau de compartiment.
10.25. Manipularea substantelor corozive (soda caustica, sublimat coroziv) se face cu multa atentie, purtandu-se manusi de cauciuc si ochelari de protectie.
10.26. Paharele de alcool in care se tin pensele si foarfecile in timpul recoltarii, vor fi puse in placi Petri, pentru evitarea imprastierii alcoolului pe masa de lucru, in caz de spargere a paharelor.
10.27. Manipularea aparaturii de laborator, se va face numai de catre persoanele care cunosc instructiunile de folosire si care au fost instruite in acest scop.
10.28. Fiecare aparat va fi folosit conform normelor generale de exploatare.
10.29. Se vor lua toate masurile necesare, in privinta protectiei personalului din laboratorul de productie si control pentru prevenirea imbolnavirilor cu virusul pseudopestei aviare.
11. NORME SANITARE VETERINARE DE LUCRU PENTRU VACCINUL ,,AVIPESTISOTA-Cl/90"
11.1. Masuri de prevenirea difuzarii virusului "pseudopestei aviare" Cl/90, La Sota
11.1.1. Aria de productie a vacinului AVIPESTIVAC-Cl/90, va fi complet separata de zonele in care se manipuleaza alte tulpini virale.
11.1.2. Personalul angajat in productia de vaccin nu trebuie sa intre in contact cu personalul care se ocupa de ingrijirea pasarilor.
11.1.3. Spatiile tehnologice de lucru se vor dezinfecta periodic, la incheierea unui ciclu de fabricatie cu formaldehida, calculandu-se 5-10 ml la m3 .
11.1.4. Deseurile de oua embrionate provenite din procesul de productie a vacinului AVIPESTIVAC -Cl/90, se vor strange si depozita in saci de plastic, inchisi etans, introdusi apoi in containere metalice. Containerele metalice vor fi depozitate intr-un spatiu frigorific special amenajat, care sa impiedice difuzarea materialelor infectate.
11.1.5. Se va asigura permanent dezinfectia containerelor metalice si a camerei frigorifice, cu solutie de cloramina 5%, iar a spatiului din jurul lor, cu soda caustica 1-2%, sau solutie de cloramina 5%, decontaminol, Javel 70% s.a.
11.1.6. Transportul containerelor care contin deseuri de oua, se face cu mijloace auto etanse care sa impiedice difuzarea materialelor virulente. Dezinfectia mijloacelor de transport dupa efectuarea transportului se face cu solutie de NaOH 2%, decontaminol etc.
11.1.7. Recipientii de sticla care au continut virus contra pseudopestei La Sota, precum si instrumentarul folosit se vor dezinfecta cu formol 3-5%, alcool etilic 70-900, sublimat 0,5%, cloramina 0,5-1%, sau prin autoclavare.
11.2. masuri de prevenire a contaminarii vaccinului "avipestivac cl/90" cu bacterii sau fungi
11.2.1. Incaperile de lucru si suprafetele acestora se vor curata mecanic si dezinfecta cu solutie de detergenti 1%, decontaminol, javel 70%, solutie de fenol 3-4%, sau solutie de cloramina 1-3%, formaldehida, calculandu-se 5-10 ml/m3 .
11.2.2. Dezinfectia instrumentarului metalic se va efectua prin fierbere sau cu solutie de cloramina 5%.
11.2.3. Incubatoarele vor fi periodic curatate mecanic, peretii vor fi spalati cu solutie de detergenti 1% si apoi dezinfectate cu vapori de formol (5-10 ml/m3)
11.2.3.1. In tavile de evaporare ale incubatoarelor se va introduce solutie de cloramina 0,5-2%, Javel 70% s.a.
11.2.4. Dezinfectia cojii oulalor inainte de incubare si recoltare se face prin pensularea de minimum 4 ori, cu tinctura de iod, avand o concentratie de 55-70% alcool si 2-10% iod.
11.2.5. In timpul procesului de recoltare se vor utiliza tampoane de vata cu alcool si recipienti care contin alcool etilic pentru dezinfectia instrumentelor, in scopul mentinerii aspsiei acestora.
Dr. D. Trepcea Dr. P. Stiube
SEF DE LABORATOR
Dr. Mihai Ion
Dr. Danut Turcu
NORME TEHNICE
PRIVIND PREPARAREA SI CONTROLUL vaccinului PSEUDOPESTEI AVIARE Cl/90 (LA SOTA)
1. CARACTERISTICI principale
1.1. Virusul contra pseudopestei Cl/90 - La Sota este o tulpina lentogena, cu mare difuzibilitate, cu o buna capacitate antigenica, utilizata la prepararea vaccinului viu contra pseudopestei "AVIPESTIVAC - Cl/90".
2. simbol si provenienta
2.1. Tulpina Cl/90 de virus contra pseudopestei aviare, provine dintr-o mostra de virus Newcastle (virus stoc), primita de catre CCBPAM Voluntari in 1981 si a fost utilizata pentru obtinerea tulpinii matca (TM) La Sota - Cl/90.
Virusul contra pseudopestei aviare intrebuintat pentru prepararea vaccinului comercial este tulpina de lucru (TL) Cl/90 - La Sota, obtinuta in cadrul ROMVAC COMPANY S.A. prin multiplicare in culturi de celule si clonare.
3. CARACTERELE TULPINII VACCINALE La Sota
3.1. Cl/90 - La Sota dezvolta la cultivarea pe oua embrionate in varsta de 10-11 zile o concentratie virala de minimum 10 9DIE50 /ml lichid alantoamniotic.
3.2. Timpul mediu de mortalitate al tulpinii de virus Cl/90 - La Sota pentru embrionul de gaina in varsta de 10-11 zile, este de 104-122 ore
3.3. CL/90 - La Sota - este apatogena pentru puiul de gaina in varsta de 6-10 saptamani, inoculat intravenos sau intramuscular.
3.4. Indicele de patogenitate intracerebrala a Cl/90 - La Sota este de maximum 0,18.
3.5. Titrul hemaglutinat al tulpinii de virus Cl/90 - La Sota este de minimum 1/640.
4. obtinerea tulpinilor matca si de lucru
4.1. .Prepararea tulpinii matca (TM Cl/90 - La Sota).
4.1.1. Prepararea unei serii de virus Cl/90 - La Sota, tulpina matca se face o data la 5 ani.
4.1.1.1. In mod exceptional se face prepararea unei serii noi de virus Cl/90 - La Sota tulpina matca, la alte etape decat cele prevazute la pct. 4.1.1.
4.1.2. Seria de virus Cl/90 - La Sota, tulpina matca se prepara din virusul La Sota stoc, conservat la -1960C.
4.1.3. La prepararea virusului Cl/90 - La Sota - tulpina matca se folosesc oua embrionate SPF in varsta de 9-11 zile.
4.1.3.1. In vederea inocularii suspensia de virus Cl/90 - La Sota stoc se diluiaza in tampon fosfat salin cu pH=7,2 - 7,5. Diluantul nu va contine antibiotice. Inoculul se va pastra tot timpul utilizarii la +40C.
4.1.3.2. Virusul Cl/90 - La Sota stoc se inoculeaza steril in cavitatea alantoidiana a oualor embrionate SPF de 10 zile. Fiecare ou se inoculeaza cu 0,1-0,2 ml suspensie virala avand concentratie finala de 105 - 106DIE 50 /ml.
4.1.3.3. Ouale embrionate SPF, inoculate cu virus Cl/90 - La Sota stoc se incubeaza la +37/+380C timp de 72 ore.
4.1.3.4. Embrionii inoculatii, conform pct. 4.1.3.2. morti in primele 24 de ore sunt eliminati din procesul de preparare a virusului Cl/90 - La Sota - TM. Embrionii vii la 72 ore de inoculare, se sacrifica la temperatura de +40C, dupa care se folosesc pentru obtinerea suspensiei de virus La Sota-TM.
4.1.3.5. Lichidul alantoamniotic, care contine virus Cl/90 - La Sota - TM se recolteaza prin aspiratie, in conditii de asepsie, din ouale embrionate inoculate conform pct. 4.1.3.2.
4.1.3.6. Virusul Cl/90 - TM se recolteaza individual din fiecare ou embrionat in flacoane sterile.
4.1.3.7. Fiecare flacon cu lichid alantoamniotic obtinut conf. pct. 4.1.3.6. se controleaza in ziua recoltarii privind sterilitatea pentru bacterii si fungi, conform Tehnicii 3.
4.1.3.8. Flacoanele care au fost gasite corespunzatoare conform pct. 4.3.7. se comaseaza in sticle sterile.
4.1.3.9. Cantitatea de lichid alantoamniotic care reprezinta virusul Cl/90 - La Sota - TM (corespunzatoare din punct de vedere calitativ), trebuie sa fie de minim 100 ml.
4.2. PREPARAREA TULPInii DE LUCRU (TL) - LA SOTA.
4.2.1. Virusul Cl/90 - La Sota - TL se prepara din virusul La Sota - tulpina matca, pe oua SPF embrionate, in varsta de 10 zile.
4.2.2. Virusul Cl/90 - La Sota - TL - reprezinta primul pasaj din virusul Cl/90 - La Sota - TM.
4.2.3. Virusul La Sota - TL se prepara si se controleaza ca si tulpina matca.
4.2.3.1. Virusul Cl/90 La Sota - TL, reprezentat de lichidul alantoamniotic se recolteaza steril prin aspiratie din ouale embrionate inoculate conform pct. 4.1.3.2.
4.2.3.2. Intr-un flacon steril se recolteaza lichidul alantoamniotic din maximum 10 oua embrionate, inoculate cu virus La Sota.
4.2.3.3. Fiecare flacon cu lichid alantoamniotic se controeaza din punct de vedere calitativ privind sterilitatea pentru bacterii si fungi, conform Tehnicii 3.
4.2.3.4. Flacoanele care contin virus Cl/90 La Sota - TL, controlat conform pct. 4.2.3.3. se comaseaza.
4.2.4. Cantitatea de lichid alantoamniotic care reprezinta virusul Cl/90 La Sota - TL, trebuie sa asigure necesarul de tulpina de lucru pentru productia de vaccin, timp de 2 ani (minimum 300 ml).
5. modul de conditionare
Virusul Cl/90 La Sota - TM obtinut coform pct. 4.1.3.9. se repartizeaza cate 1 ml in fiole de sticla sau teflon.
5.2. Virusul Cl/90 La Sota - TM obtinut coform pct. 4.2.4. se conditioneaza prin lifilizare, conform fisei tehnice pentru liofilizarea vaccinului La Sota Tehnica 5 sau se repartizeaza cate 1 ml in fiole de sticla sau teflon mentinute in azot lichid la -1960C.
5.3. Pe fiecare fiola care contine virus Cl/90 La Sota - TM, se inscrie: denumirea, numarul pasajului virusului, data recoltarii.
5.4. Fiecare fiola/flacon cu virus Cl/90 La Sota - TL va avea inscris pe eticheta: TL-Cl/90-La Sota, numarul pasajului virusului, anul prepararii.
6. modul de conservare
6.1. Fiolele care contin virus TM si TL Cl/90 La Sota conditionate sub forma lichida se depoziteaza la -1960C, imediat dupa conditionare.
6.2. Fiolele sau flacoanele conditionate sub forma liofilizata se conserva la +40C.
7. valabilitatea
7.1. Virusul Cl/90 La Sota - TM, mentinut in azot lichid are valabilitatea de 5 ani de la data recoltarii.
7.2. Virusul Cl/90 La Sota - TL lichid, conservat la -1960C are valabilitatea de 3 ani de la data recoltarii, iar virusul Cl/90 - TL, conservat prin lifilizare are valabilitatea de 12 luni de la data recoltarii.
7.2.1. In cazul in care la sfarsitul valabilitatii se constata existenta unui numar de fiole sau flacoane care mai pot fi utilizate in procesul de productie al vaccinului "AVIPESTIVAC - Cl/90" se procedeaza la prelungirea valabilitatii.
7.2.1.1. Prelungirea valabilitatii TL-Cl/90 La Sota se face de catre specialistii Laboratorului de control produse biologice, la cererea laboratorului de productie, prin aprecierea concentratiei in virus a cel putin 3 fiole sau flacoane conform Tehnicii 4.
8. NORMELE TEHNICE DE CONTROL PENTRU Cl/90 LA SOTA
8.1. Controlul TM si TL Cl/90 - La Sota se executa la fiecare pasaj de catre Laboratorul de control produse biologice.
8.2. Prelevarea probelor destinate controlului TM si TL Cl/90 va fi executata de catre personalul laboratorului de control.
8.2.1. In vederea efectuarii tuturor controalelor calitative si cantitative ale virusului Cl/90 TM si TL, sunt necesare minimum 25 fiole sau flacoane conditionate lichid sau liofilizate.
8.3. Controlul sterilitatii bacteriologice si micologice a tulpinii La Sota.
8.3.1. Se executa la fiecare pasaj de TL si TM la cate 3 flacoane sau fiole.
8.3.2. Tehnica dupa care se executa controlul si interpretarea rezultatelor este cuprinsa in Tehnica 3.
8.3.3. Tulpina matca si de lucru Cl/90 La Sota trebuie sa fie sterila din punct de vedere bacteriologic si micologic.
8.4. Controlul puritatii virusologice a tulpinii Cl/90 La Sota.
8.4.1. Controlul puritatii virusologice si interpretarea rezultatelor sunt prevazute in Tehnica 6.
8.4.1.1. Controlul puiritatii virusologice se executa din minimum 6 fiole sau flacoane de virus Cl/90 - La Sota TM sau TL.
8.4.1.2. TM si TL Cl/90 - La Sota nu trebuie sa contina alte virusuri decat virusul pseudopestei aviare La Sota.
8.5. Controlul inocuitatii virusului Cl/90 - La Sota se executa pentru fiecare pasaj de tulpina matca si tulpina de lucru
8.5.1. Metodologia de lucru si interpretarea rezultatelor sunt cuprinse in Tehnica 7.
8.5.2. Puii de gaina pe care se efectueaza controlul inocuitatii nu trebuie sa moara sau sa prezinte semne de boala care pot fi atribuite inoculului.
8.6. Timpul mediu de letalitate al dozei minime letale embrionare trebuie sa fie de minimum 104 ore.
8.7. Patogenitatea intracerebrala pentru puii de gaina in varsta de o zi.
8.7.1. Se efectueaza conform Tehnicii 9 la fiecare pasaj de TM - TL -Cl/90 - La Sota.
8.7.2. Indicele de patogenitate intracerebrala nu trebuie sa fie mai mare de 0,3.
8.8. Controlul proprietatilor fizico-chimice al flacoanelor si fiolelor de tulpina matca si de tulpina de lucru Cl/90-La Sota, se executa conform Tehnicii 10, pentru fiecare pasaj de TM si TL.
8.9. Controlul cantitativ al virusului Newcastle.
8.9.1. Controlul concentratiei in virus Cl/90 La Sota se face la fiecare pasaj de TM si TL, la minimum 3 fiole/flacoane.
8.9.1.1. Concentratia in virus se stabileste conform Tehnicii 4.
8.9.1.2. Titrul virusului Newcastle din lichidul alantoamniotic Cl/90 - La Sota trebuie sa fie de minimum 109 DIE50/ml.
8.9.1.3. Anual se va determina de catre laboratorul de control produse biologice concentratia in virus a tulpinii de lucru La Sota (conservata sub forma lichida la -1960C sau in stare liofilizata la +40C), corelandu-se titrul DIE50 constatat cu dilutia de lucru, la inocularea embrionilor pentru productie de vaccinuri.
8.9.2. Controlul activitatii hemaglutinante a TM sau TL Cl/90 La Sota se executa conform Tehnicii 4.
8.9.2.1. Titrul hemaglutinant al TM sau TL - Cl/90 La Sota, trebuie sa fie de minimum 1/640.
8.10. Controlul efectului protector specific se face la fiecare pasaj de TM sau TL, conform Tehnicii 11.
8.10.1. Pasajul de TM sau TL Cl/90 se considera corespunzator cand 95-100% din puii vaccinati rezista la infectia de control.
9. EVIDENTA PRIVIND CONTROLUL SI FOLOSIREA IN PRODUCTIE A TULPINII MACA Cl/90 SI TULPINII DE LUCRU - LA SOTA
9.1. Evidenta prepararii si folosirii in productie a TM si TL se tine in registre oficiale de catre laboratorul de productie.
9.2. Evidenta controalelor efectuate asupra tulpinii matca si tulpinii de lucru se tine in registrele laboratorului de control.
10. NORME DE PROTECTIA MUNCII
10.1. Orice accident de munca, indiferent de gravitatea lui va fi anuntat imediat sefului locului de munca, iar in lipsa acestuia persoanei care ii tine locul sau sefului de echipa.
10.2. Persoanele care vin la serviciu in stare de ebrietate sau consuma alcool in timpul serviciului nu vor fi admise la lucru. Acestea vor fi sanctionate conform regulamentului de ordine interioara.
10.3. Pentru lucrarile de laborator este obligatorie purtarea echipamentului de protectie.
10.4. Este interzisa folosirea echipamentului de protectie, in alte scopuri decat cele pentru care a fost destinat.
10.5. In boxele sterile se va folosi echipament tehnologic special (halate, bonete, baticuri, sorturi, pantofi de tenis/baschet) destinat strict operatiunilor din boxa.
10.6. Este interzisa folosirea boxelor sterile in alte scopuri decat cele prevazute de fluxul tehnologic (recoltari, inoculari, insamantari, titrari, comasari etc.).
10.7. In incaperi, camere - laborator, boxe sterile, se va face curat zilnic. Saptamanal fiecare loc de munca trebuie riguros dezinfectat, dupa executarea in prealabil a curateniei mecanice.
10.8. Dupa orice lucrare efectuata in boxa sterila se va efectua dezinfectia acesteia.
10.9. Dupa terminarea activitatii, personalul care a lucrat in boxa sterila se va spala pe maini la chiuveta, folosind sapun, peria de unghii si solutie dezinfectanta.
10.10. Se interzice accesul personalului cu lenjerie sau imbracaminte din fibre sintetice in laboratoarele in care se lucreaza cu flacara deschisa.
10.11. Se interzice purtarea halatelor din molton in timp ce se lucreaza cu flacara deschisa.
10.12. Este interzisa pregatirea mancarii in laborator, precum si folosirea sticlariei sau a altor vase de laborator pentru baut apa.
10.13. Este interzisa pastrarea hranei in frigiderele unde se gasesc tulpini de agenti infectiosi, bacterieni sau virali.
10.14. Pentru evitarea posibilitatilor de accidentare, se va folosi numai sticlarie intacta, fara zgarieturi sau bule de aer.
10.15. La lucrarile sub vid, baloanele vor fi puse in cos special de sarma pentru impiedicarea raspandirii cioburilor in caz de explozie (se interzice folosirea baloanelor din sticla cu zgarieturi, crapaturi sau bule de aer la lucrari sub vid).
10.16. Decongelarea produselor biologice conservate in azot lichid, se va face prin introducerea flacoanelor sau fiolelor cu produs in vase cu apa mentinuta la temperatura camerei. Muncitorul care executa aceasta operatie va purta in mod obligatoriu echipament tehnologic care sa-i acopere corpul, inclusiv fata, precum si ochelari de protectie pentru a evita ranirile grave, prin explodarea recipientilor de sticla.
10.17. La pregatirea pipetelor Pasteur, cand se taie teava de sticla se vor purta ochelari de protectie, iar mainile vor fi protejate de manusi textile. Dupa taierea cu pila a tevii de sticla, ruperea se face indreptand taietura spre partea opusa operatorului.
10.18. Tuburile de sticla (canulele) care se introduc in orificiile dopului de cauciuc sau alte tuburi de cauciuc, trebuie sa aiba marginile rotunjite la flacara. Tubul trebuie umectat cu apa, solutie de sapun sau glicerina si se tine cat mai aproape de capatul care se introduce. La aceasta operatie, mainile vor fi protejate prin manusi textile, prin invelire cu un prosop sau cu panza de tifon umed, pus in 4-5 straturi.
10.19. La topirea cerii de albine si parafinei, se pune mai intai apa in tava, (cat este necesar) si apoi se pun bucatile de ceara si parafina pentru topit.
10.20. Tava cu ceara si parafina topita se va da jos de pe trepied numai dupa ce s-a solidificat.
10.21. Este interzisa functionarea lampilor de ultraviolete in prezenta oamenilor.
10.22. Substantele toxice vor fi pastrate in dulapuri incuiate si se va tine o evidenta precisa a consumului acestor substante . La substantele toxice au acces numai persoanele autorizate.
10.23. Substantele toxice se vor elibera pentru consum numai in cantitatile necesare si cu aprobarea sefului de laborator sau de compartiment.
10.24. Manipularea substantelor corozive (soda caustica, sublimat coroziv) se face cu multa atentie, purtandu-se manusi de cauciuc si ochelari de protectie.
10.25. Paharele de alcool in care se tin pensele si foarfecile in timpul recoltarii, vor fi puse in placi Petri, pentru evitarea imprastierii alcoolului pe masa de lucru, in caz de spargere a paharelor.
10.26. Manipularea aparaturii de laborator, se va face numai de catre persoanele care cunosc instructiunile de folosire si care au fost instruite in acest scop.
10.27. Se vor lua toate masurile necesare, in privinta protectiei personalului din laboratorul de productie si control pentru prevenirea imbolnavirilor cu virusul pseudopestei aviare.
11. norme sanitare veterinare de lucru pentru vaccinul avipestivac - cl/90
11.1. MASURI DE PREVENIREA DIFUZARII VIRUSULUI PSEUDOPESTEI AVIARE Cl/90 - LA SOTA
11.1.1. Aria de productie a vacinului AVIPESTIVAC-Cl/90, va fi complet separata de zonele in care se manipuleaza alte tulpini virale.
11.1.2. Personalul angajat in productia de vaccin nu trebuie sa intre in contact cu personalul care se ocupa de ingrijirea pasarilor.
11.1.3. Spatiile tehnologice de lucru se vor dezinfecta periodic, la incheierea unui ciclu de fabricatie, cu formaldehida, calculandu-se 5-10 ml la m3.
11.1.4. Deseurile de oua embrionate provenite din procesul de productie a TM si TL Cl/90, se vor strange si depozita in saci de plastic, inchisi etans, introdusi apoi in containere metalice. Containerele metalice vor fi depozitate intr-un spatiu frigorific special amenajat, care sa impiedice difuzarea materialelor infectate.
11.1.5. Se va asigura permanent dezinfectia containerelor metalice si a camerei frigorifice, cu solutie de cloramina 5%, iar a spatiului din jurul lor, cu soda caustica 1-2%, sau solutie de cloramina 5%, Decontaminol, Javel 70% s.a.
11.1.6. Transportul containerelor care contin deseuri de oua, se face cu mijloace auto etanse care sa impiedice difuzarea materialelor virulente. Dezinfectia mijloacelor de transport dupa efectuarea transportului se face cu solutie de NaOH 2%, Decontaminol, Javel 70% s.a.
11.1.7. Recipientii de sticla care au continut virus Cl/90 contra pseudopestei La Sota, precum si instrumentarul folosit se vor dezinfecta cu formol 3-5%, alcool etilic 70-900 sublimat 0,5%, cloramina 0,5-1%, sau prin autoclavare.
11.2. masuri de prevenire a contaminarii vaccinului "AVIPESTIVAC Cl/90" CU BACTERII SAU FUNGI
11.2.1. Incaperile de lucru si suprafetele acestora se vor curata mecanic si dezinfecta cu solutie de detergenti 1%, solutie de fenol 3-4%, sau solutie de cloramina 1-3%, formaldehida, calculandu-se 5-10 ml/m3 .
11.2.2. Dezinfectia instrumentarului metalic se va efectua prin fierbere sau cu solutie de cloramina 5%.
11.2.3. Incubatoarele vor fi periodic curatate mecanic, peretii vor fi spalati cu solutie de detergenti 1% si apoi dezinfectate cu vapori de formol (5-10 ml/m3).
11.2.3.1. In tavile de evaporare ale incubatoarelor se va introduce solutie de cloramina 0,5-2%, Javel 70% s.a..
11.2.4. Dezinfectia cojii oulalor inainte de incubare si recoltare se face prin pensularea de minimum 4 ori, cu tinctura de iod, avand o concentratie de 55-70% alcool si 2-10% iod.
11.2.5. In timpul procesului de recoltare se vor utiliza tampoane de vata cu alcool si recipienti care contin alcool etilic pentru dezinfectia instrumentelor.
Romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Sef laborator Sef control
produse Biologice
Dr. Ion Gugiu Dr. Silvia Purcarea
Sef departament control
dr. Venera Stanescu
Dr. Danut Turcu
NORME TEHNICE
de CONTROL al VACCINULUI CONTRA PSEUDOPESTEI AVIARE ,,avipestivac - Cl/90"
1. caracteristicile produsului
1.1. Vaccinul contra pseudopestei aviare, preparat cu Cl/90 - La Sota este o suspensie de virus Newcastle intr-un diluant protector (hidrolizatul de colagen, peptona-lactoza, etc). Vaccinul lichid este galbui, limpede sau usor opalescent, poate prezenta depozite de urati, care nu influenteaza calitatea produsului. Vaccinul liofilizat se prezinta sub forma unei pastile pufoase, de coloare alb-galbuie sau rosietica.
2. compozitie
2.1. Vaccinul viu contra pseudopestei aviare avipestivac - Cl/90 este constituit din lichidul alantoamniotic al embrionilor de gaina inoculati cu tulpina de lucru Cl/90 la care se adauga un diluant protector, solutia de antibiotice si mertiolat de sodiu, conform prevederilor din normele tehnice de preparare.
3. modul de recoltare a probelor pentru control
3.1. Controlul final se executa de catre Laboratorul de control produse biologice la fiecare serie de vaccin avipestivac- Cl/90, care corespunde conditiilor de admisibilitate.
3.2. Numarul de probe (fiole sau flacoane), care se preleveaza la fiecare serie de vaccin, este mentionat in tabelul 1.
Tabelul 1
|
Numarul total de flacoane (fiole) /serie |
Numar de flacoane (fiole) care se preleveaza pentru control si arhiva |
|
Pana la 500 De la 500-1 000 De la 1 000-3 000 Pentru fiecare 1 000 flacoane (fiole) in plus la seriile cu peste 3 000 flacoane |
3.2.1. Cand numarul de probe este insuficient se poate preleva un numar suplimentar de fiole (flacoane).
4. Controale calitative ale vaccinului viu contra pseudopestei aviare avipestivac- Cl/90.
4.1. Controlul sterilitatii bacteriologice si fungice.
4.1.1. Controlul sterilitatii bacteriene si fungice se executa la fiecare serie de vaccin dupa conditionare, conform metodologiei cuprinse in Tehnica 3.
4.1.2. Vaccinul avipestivac- Cl/90 nu trebuie sa fie contaminat cu bacterii sau fungi.
4.1.2.1. Se admite eliberarea seriilor de vaccin liofilizate, contaminate cu flora apatogena, in cazul in care contin maximum 1 germen pe doza vaccinala.
4.2. Controlul puritatii virusologice.
4.2.1. Se executa la prima serie de vaccin produsa dupa schimbarea tulpinii de lucru, conform Tehnicii 6.
4.2.2. Seria de vaccin controlata nu trebuie sa contina alte virusuri decat virusul Newcastle.
4.3 Controlul inocuitatii.
4.3.1. Controlul inocuitatii vaccinului avipestivac- Cl/90 se executa la fiecare serie de vaccin conform Tehnicii 7.
4.3.2. Vaccinul avipestivac- Cl/90 inoculat conform Tehnicii 7 nu trebuie sa produca reactii locale sau generale, care pot fi atribuite inoculului.
4.4. Controlul proprietatilor fizico-chimice si conditiile de admisibilitate sunt cele prevazute in Tehnica 10.
5. CONTROale cantitative
5.1. Controlul concentratiei de virus se efectueaza la fiecare serie de vaccin conditionata sub forma lichida sau liofilizata prin stabilirea titrului DIE50/ml, conform Tehnicii 4.
5.1.1. Fiecare doza de vaccin avipestivac- Cl/90 va contine minimum 106 DIE50 virus Cl/90 La Sota. Fiecare fiola sau flacon liofilizat contine 50, 100, 200, 250, 500 sau 1 000 doze. Vaccinul lichid contine: 1 000, 2 000, 2 500, 3 000, 5 000 doze la sfarsitul valabilitatii.
5.2. Efectul protector specific.
5.2.1. Se executa la prima serie de vaccin produsa dupa schimbarea TL-ului, conform Tehnicii 11.
5.2.2. Seria de vaccin este corespunzatoare cand minim 90% din puii vaccinati rezista la infectia de control.
LABORATORUL DE CONTROL POATE SA CONTROLEZE SI PRIN ALTE METODE ANUMITE SERII DE VACCIN DIN PUNCT DE VEDERE CALITATIV SI CANTITATIV
6. MODUL DE CONDITIONARE
6.1. Vaccinul viu contra pseudopestei aviare AVIPESTIVAC -Cl/90 poate fi conditionat sub forma lichida sau liofilizata.
7. CONDITIILE DE CONSERVARE SI TRANSPORT
7.1. Vaccin avipestivac-Cl/90 liofilizat si lichid se metine pe toata perioada controlului, transportului si depozitarii, pana la utilizare, la +40C, in depozite frigorifice sau mijloace de transport care asigura temperatura de +40C.
8. VALABILITATEA VACCINULUI AVIPESTIVAC-Cl/90
8.1. Vaccinul avipestivac-Cl/9 liofilizat are valabilitatea de 4 luni, de la data liofilizarii.
8.2. Vaccinul AVIPESTISOTA-Cl/90 lichid are valabilitatea de 4 luni de la data recoltarii.
9. EVIDENTA CONTROLULUI VACCINULUI AVIPESTIVAC-Cl/90
9.1 Evidenta controlului vaccinului AVIPESTIVAC-Cl/90 se tine in registre oficiale de control, fisa de control sau buletine de analiza cuprinzand toate lucrarile executate si rezultatele obtinute in controlul final al produsului.
10. NORME DE PROTECTIA MUNCII
10.1. Normele de protectia muncii sunt cele prevazute la pct. 10- din normele de preparare a vaccinului AVIPESTIVAC-Cl/90
11. NORME SANITARE VETERINARE DE LUCRU PENTRU VACCINUL AVIPESTIVAC-Cl/90
11.1 MASURI DE PREVENIREA DIFUZARII VIRUSULUI PSEUDOPESTEI AVIARE Cl/90
11.1.1. Normele sanitar-veterinare de lucru cu virusul Newcastle tulpina Cl-90 la executarea lucrarilor de control sunt cele prevazute la pct. 11 din Normele tehnice de preparare a vaccinului AVIPESTIVAC-Cl 90.
11.2. MASURI DE PREVENIRE A CONTAMINARII VACCINULUI "AVIPESTIVAC Cl/90" CU BACTERII SAU FUNGI
11.2.1. Incaperile de lucru si suprafetele acestora se vor curata mecanic si dezinfecta cu solutie de detergenti 1% decontaminol Javel 70% s.a , solutie de fenol 3-4%, sau solutie de cloramina 1-3% formaldehida calculandu-se 5-10 ml/m3 .
11.2.2. Dezinfectia instrumentarului metalic se va efectua prin fierbere sau cu solutie de cloramina 5%.
11.2.3. Incubatoarele vor fi periodic curatate mecanic, peretii vor fi spalatii cu solutie de detergenti 1%si apoi dezinfectate cu vapori de formol (5-10 ml /ml3 )
11.2.3.1. In tavile de evaporare ale incubatoarelor se va introduce, solutie de cloramina 0,5 -2%.
11.2.4. Dezinfectia cojii oualor inainte de inoculare si recoltare se face prin pensulare, de minimum 4 ori, cu tinctura de iod, avand o concentratie de 55-70% alcool si 2-10% iod.
11.2.5. In timpul procesului de recoltare, se vor utiliza tampoane de vata cu alcool si recipienti care contin alcool etilic pentru dezinfectia instrumentelor, in scopul mentinerii sepsiei acestora.
Romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Sef departament control
dr. Venera Stanescu
Dr. Danut Turcu
NORME TEHNICE
de preparare a diluantului pentru vaccinuri antivirale liofilizate - diluvac -
1. DEFINITIE
1.1. diluantul pentru vaccinuri antivirale este un tampon fosfat (izotonic, Sorensen) 6,67 mM, cu pH 7,2 + 0,3, care se foloseste la reconstituirea in forma lichida a vaccinurilor antivirale liofilizate (ex. contra pseudopestei aviare - AVIPESTIVAC- Cl/90).
1.2. Produsul se prezinta sub forma unui lichid incolor, limpede fara suspensie sau sediment.
2. METODA DE PREPARARE
2.1. Materiale necesare :
I. fosfat disodic ( Na2 HPO4 p.a) .0,576 g cf.F.R.ed.IX
fosfat monopotasic (KH 2 PO4) ..0,356 g
apa distilata ..ad. 1000 ml cf. F.R. ed. IX
SAU
ii. - fosfat disodic ( Na2 HPO4 x12 H2O ) 0,705 g cf.F.R.ed.IX
fosfat monosodic NaH 2 PO4 x H2O) 0,330 g cf.F.R.ed.IX
apa distilata ..ad. 1000 ml cf. F.R. ed. IX
2.2. Tehnologia de preparare:
2.2.1. Se iau 39,2 ml din solutia stoc de fosfat monopotasic 66,7 mM (anexa 1), 60,8 ml solutie stoc de fosfat disodic 66,7mM (anexa 2), se aduc la 900 ml cu apa deionizata.Se verifica si se corecteaza pH-ul daca este nevoie, se corecteaza cu solutie stoc (anexa 1 sau 2), apoi se completeaza volumul la 1000 ml cu apa distilata.
In cazul celei de-a doua varianta de preparare, se procedeaza la fel ca la pct.2.2.1. Separat se dizolva fosfatul disodic si monosodic in cate 100 ml apa distilata. Se obtine produsul finit (DILUVAC) pH
2.2.2. Produsul astfel obtinut se filtreaza prin filtru doc dublat cu matase, atasat la furtunul de transvazare si se repartizeaza in flacoane din sticla neutralizata, de 10, 20, 50, 100 ml
2.2.3. Diluantul (DILUVAC ), se sterilizeaza prin autoclavare la temperatura de 1210C, timp de 30 minute.
3. ETICHETAREA
3.1. Fiecare flacon va purta o eticheta cu :
denumirea unitatii producatoare
denumirea produsului
numarul seriei
cantitatea
valabilitatea
stampila controlului de calitate
4. AMBALAREA PRODUSULUI
4.1. Flacoanele se vor ambala in cutii colective pe care se va aplica o eticheta cu aceleasi specificatii de la pct. 3.1.
5. VALABILITATEA, DEPOZITAREA, TRANSPORT
5.1. Valabilitatea produsului este de doi ani de la data prepararii.
5.2. Produsul se depoziteaza la temperatura camerei, la loc ferit de lumina solara directa.
5.3. Pentru transportul produsului se utilizeaza mijloace de transport obisnuite.
La transportul produsului se anexeaza certificatul de calitate.
6. Evidenta productiei
6.1. Evidenta productiei se tine in registrul de productie, in care se mentioneaza :
data prepararii
seria
componentele cantitative
caracteristicile produsului
Romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
SEF DE LABORATOR
Dr. Ion Mihai
ANEXA nr. 1
PENTRU PREPARAREA SOLUTIEI STOC DE FOSFAT MONOPOTASIC 66,7 Mm
Se cantaresc cu precizie 9,08 g fosfat monopotasic KH2 PO4 uscat in prealabil la 110 0C, timp de 1-2 ore si se dizolva in cca. 500 ml apa deionizata la fierbere.
Se raceste solutia si se completeaza la 1000 ml cu apa deionizata. Rezulta o solutie de fosfat monopotasic de concentratie 66,7mM.
ANEXA nr. 2
PREPARAREA SOLUTIEI STOC DE FOSFAT DIPOTASIC 66,7 Mm
Se cantaresc cu precizie 9,479 g fosfat disodic Na2H PO4 uscat in prealabil la 1100C timp de 1-2 ore si se dizolva in cca in 500 ml apa deionizata, la fierbere.
Se raceste solutia si se completeaza la 1000 ml apa deionizata. Se obtine solutia de fosfat disodic de concentratie 66,7mM.
NORME TEHNICE
DE CONTROL ALE DILUANTULUI PENTRU VACCINURI ANTIVIRALE LIOFILIZATE - DILUVAC
1. DEFINITIE
1.1. Diluantul pentru vaccinuri antivirale liofilizate, este un tampon fosfat 6,67 (izotonic, sorensen ), cu pH 0,3 care se utilizeza pentru reconstituirea in forma lichida, a vaccinurilor liofilizate, ex. contra pseudopestei aviare - AVIPESTIVAC-Cl/90.
2. CONDITII TEHNICE
2.1. Caracteristici Conditii de admisibilitate
- aspect- solutie limpede, clara
-culoare..- incolora
-miros..-fara
-pH - 7,2
- identificare.- conf. pct. 3.3.
- variatia de volum pe ambalaj..- 10, 20, 50, 100 ml
- sterilitate microbiologica..- conf. pct. 3.4.
- inocuitate..- conf. pct. 3.5.
- valabilitate- 2 ani
3. CONTROLUL CALITATII DILUANTULUI
3.1. Aspectul, culoarea, mirosul si variatia de volum pe ambalaj se verifica conform F.R.ed. IX cap. Controlul organoleptic.
3.2. Determinarea pH.
Se executa electrometric. Valoarea pH- ului trebuie sa fie 7,2
3.3. Identificarea componentelor
3.3.1. Identificarea fosfatilor
3.3.1.1. Reactivi necesari :
acid azotic solutie 25%
molibdat de amoniu solutie 5%
3.3.1.2. Reactia de identificare : 2 ml diluant se amesteca cu 1 ml acid azotic solutie 25% si 2ml solutie molibdat de amoniu 5%.
Aparitia unui precipitat de culoare galbena confirma prezenta fosfatilor in diluant.
3.4. Controlul sterilitatii bacteriene si fungice.
4.4.1. Controlul sterilitatii se face la toate seriile de diluant.
4.4.2. Numarul de flacoane / fiole controlate, sunt prezentate in tabelul nr. 1.
TABELUL Nr. 1
|
Nr. flacoane / fiole pe serie |
Nr.minim de probe prelevate Pentru control |
|
pana la 1000 peste 3 000 |
cate 2 probe pentru fiecare 1000 flacoane / fiole in plus |
3.4.3. Tehnica de control.
a) Mediile de cultura :
mediul I cu tioglicolat de sodiu conf. F. R. ed. IX
mediu lI (Csapek) conf. F. R. ed. IX
Mediul I cu tioglicolat de sodiu, poate fi inlocuit cu medii uzuale : bulion simplu, geloza simpla si bulion cu ficat.
b) Metoda de insamantare :
- din continutul fiecarei probe de diluant se insamanteaza 3-4 picaturi in cate 2 tuburi cu mediu I si 2 tuburi cu mediu II. In cazul cand mediul I este inlocuit cu medii uzuale, insamantarea se va efectua in cate un tub cu bulion simplu, geloza simpla si bulion cu ficat. Mediile I sau uzuale insamantate, se incubeaza in termostate la 370C, 7 zile si 7 zile la temperatura camerei. Tuburile cu mediul II insamantate se tin 7 zile la 24 20C.
c) Interpretarea rezultatelor
Toate tuburile cu medii insamantate trebuie sa ramana nemodificate dupa terminarea perioadei de observatie. Daca apare o infectie bacteriana sau micotica, la 1 sau mai multe tuburi, iar tuburile neinsamantate raman sterile, controlul se repeta pe un numar dublu de probe.
Rezultatul controlului trebuie sa corespunda pct.c, in caz contrar, seria se respinge.
3.5. Controlul inocuitatii :
3.5.1. Controlul inocuitatii nespecifice se executa la fiecare serie de diluant, astfel: 3 soareci de 18-20 g sau cobai de 300-350 g se vor inocula parenteral cu cate 0,5 ml diluant si respectiv 2 ml.
3.5.2. Supravegherea animalelor inoculate, se face timp de 7 zile, timp in care trebuie sa supravietuiasca si sa nu prezinte reactii generale sau locale.
3.5.3. Daca unul din animalele inoculate moare in perioada de observatie, controlul se repeta la un numar dublu de animale si trebuie sa corespunda la pct. 3.5.2.
4. PROBE PENTRU ARHIVA
4.1. Din fiecare serie de diluant, se iau 3 flacoane care vor fi conservate la +80C, 2 luni de la expirarea valabilitatii.
5. EVIDENTA CONTROLULUI
5.1. Evidenta controlului se tine intr-un registru tehnic de control, care va cuprinde:
denumirea produsului
data prepararii
seria
rezultatele determinarilor de la pct. 2.1.
5.2. La fiecare serie de produs, se va elibera fisa tehnica de calitate, in care se vor trece rezultatele controlului
romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Sef departament Sef control
de control produse Biologice
Dr. Ion Gugiu Dr. Silvia Purcarea
Dr. Danut Turcu
Tehnica 1
OUA SI EMBRIONI PROVENITI DE LA PASARI CONVENTIONALE
(CONDITII DE ADMISIBILITATE )
1. MATCA DE PRODUCTIE, GAINI RASE USOARE CONVENTIONALE DE LA CARE PROVIN OUALE SI EMBRIONII PENTRU PREPARAREA SI CONTROLUL VACCINULUI AVIPESTISOTA Cl/90, trebuie sa indeplineasca urmatoarele conditii de admisibilitate :
1.1. Ouale fecundate trebuie sa provina de la pasari de reproductie, gaini rase usoare, crescute in conditii corespunzatoare de cazare si furajare.
1.2. Pasarile trebuie sa fie clinic sanatoase, serologic negative la testul de hemaglutinare si seroaglutinare pentru infectia cu salmonele imobile si fata de 9R.
1.3. Ouale trebuie sa provina de la pasari din efective in care nu a evoluat in ultimele 12 luni holera, tifopuloroza, pseudopesta, variola, micoplasmoza clinic evolutiva.
2. OUALE FECUNDE PROVENITE DE LA PASARI CONVENTIONALE
2.1. Ouale trebuie sa aiba coaja alba, nedeformata si o greutate de peste 55 g.
2.2. Ouale vor fi recoltate de mai multe ori pe zi (din cuibare special amenajate ), formolizate imediat dupa recoltare si inaintea incubarii si conservate la 8 - 120C, cel mult 7 zile. Data recoltarii oualor trebuie mentionata pe certificatul de calitate. Ouale recoltate direct de pe asternut nu sunt corespunzatoare pentru obtinerea de embrioni destinati productiei de biopreparate.
3. CONDITII IN CARE SE INCUBEAZA OUALE DESTINATE PRODUCTIEI SI CONTROLULUI VACCINULUI AVIPESTISOTA Cl/90
3.1. Ouale embrionate destinate productiei de vaccin se vor livra de catre statia de incubatie nominalizata, cu aprobarea ANSV din MAA, insotite de certificat sanitar veterinar eliberat de DSV-judetean
3.2. Incubatia oualor se face in aparate montate in spatii special amenajate si autorizate din punct de vedere sanitar-veterinar.
3.3. In spatiile de incubatie pentru ouale de gaina nu este permisa incubarea oualor provenite de la alte specii sau eclozionarea embrionilor.
3.4. Se va respecta tehnologia de incubatie pentru ouale provenite de la pasari de reproductie.
3.5. Ouale pot fi incubate si in spatiile de incubatie ale ROMVAC COMPANY SA, respectandu-se aceleasi conditii tehnologice ca si in statiile de incubatie din unitatile avicole de stat. Nu se vor incuba ouale conventionale in sectorul SPF.
3.6. Ouale embrionate se controleaza prin ovoscopie in ziua receptiei, indepartandu-se ouale limpezi, cu salazele rupte, cu coaja fisurata sau embrionii morti.
3.7. Se admit pentru productia de vaccin ouale embrionate in a 9-11-a zi de incubatie, cu coaja alba, fara crapaturi, curate, cu salazele intregi.
3.7.1. Controlul final al oualor embrionate se va face in ziua inocularii accestora pentru productia de vaccin.
4. CONDITII DE TRANSPORT A OUALOR SI EMBRIONILOR
4.1.Ouale destinate productiei de vaccin se vor ambala in cofraje noi, in cutii speciale de transport.
4.2. Se vor utiliza mijloace de transport speciale,care vor fi dezinfectate. Nu se admite transportul altor materiale sau produse in aceste mijloace de transport.
4.3. In timpul transportului va trebui sa se asigure conditiile necesare de temperatura si ventilatie, care sa permita mentinerea viabilitatii embrionilor.
romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Dr. Danut Turcu
TEHNICA 2
PREPARAREA SOLUTIILOR DE ANTIBIOTICE
SI MERTIOLAT DE SODIU
1. SCOPUL
1.1. Solutiile de mertiolat de sodiu si antibiotice sunt parti componente ale vaccinului AVIPESTIVAC- Cl/90, avand rol bacteriostatic si bactricid.
2. MATERIALE
2.1. Mertiolat de sodiu
2.2. Penicilina
2.3. Neomicina
2.4.Gentamicina
2.5. Doxysol C sau alte antibiotice cu spectru larg
2.6. Apa deionizata sau distilata
3. PREPARAREA SOLUTIEI DE MERTIOLAT DE SODIU SI FOLOSIREA EI
3.1.Mertiolatul de sodiu este o substanta cristalina de culoare alba, cu proprietati bactericide.
3.2. Solutia de mertiolat de sodiu se prepara prin dizolvarea a 2 grame de substanta in 100 ml apa deionizata. Solutia omogena rezultata se repartizeaza in flacoane cu dop etans si se sterilizeaza 15 minute la 1210 C.
3.3. Solutia de mertiolat de sodiu sterila (concentratie 2%) se adauga la suspensia vaccinala in cantitate care sa asigure o concentratie finala de 1/5 000-1/10 000.
4. PREPARAREA SOLUTIILOR DE ANTIBIOTICE SI FOLOSIREA LOR
4.1. Solutiile de antibiotice vor contine : penicilina, gentamicina, doxysol C sau alte antibiotice cu spectru larg.
4.1.1. Solutia de penicilina se prepara astfel :
1.000.000 UI penicilina se dizolva in 10 ml apa deionizata, sau distilata.
Solutia obtinuta se sterilizeza prin filtrare pe membrana de 0,22 si se stocheaza la -200 C. Din aceasta solutie se ia 1 ml si se adauga la 100 ml diluant, pentru inocul realizandu-se o concentratie finala de 1 000 UI/ml.
4.1.2. Solutia de neomicina se obtine prin dizolvarea a 4 grame de neomicina in 100 ml apa deionizata sau distilata. Solutia omogena se sterilizeaza prin filtrare pe membrana de 0,22 si se stcheaza la -200 C. Din aceasta solutie se adauga la suspensia vaccinala o cantitate corespunzatoare pentru a se realiza o concentratie de 1 : 2.000.
4.1.3. Solutia de gentamicina se obtine prin dizolvarea a 4 grame gentamicina in 100 ml apa deionizata sau distilata. Solutia omogena se sterilizeaza prin filtrare pe membrana de 0,22 si se stocheaza la -200 C. Din aceasta solutie se adauga la suspensia vaccinala o cantitate corespunzatoare pentru a se realiza o concentratie de 1 : 2.500.
4.1.4. Solutia de Doxysol C se obtine prin dizolvarea a 5 grame doxysol C in 100 ml apa deionizata sau distilata. Solutia omogena se sterilizeaza prin filtrare pe membrana de 0,22 si se stocheaza la -200 C. Din aceasta solutie se adauga la suspensia vaccinala o cantitate corespunzatoare pentru a se realiza o concentratie de 1 : 3.000.
4.1.5. In locul penicilinei, neomicinei, gentamicinei sau doxysolului C se pot folosi si alte antibiotice cu spectru larg: colimicina, kanamicina, bacitracina.
Folosirea altor antibiotice decat cele prevazute in tehnica 1 se face cu avizul L.C.S dupa testarea prealabila a eficacitatii fata de flora contaminanta si efectul acestora fata de virusul contra pseudopestei aviare.
ROMVAC COMPANY S.A.
Dr. D. Trepcea Dr. P. stiube
Dr. Danut Turcu
TEHNICA 3
CONTROLUL STERILITATII MICROBIOLOGICE
1. CONTROLUL STERILITATII BACTERIOLOGICE SI FUNGICE
1.1. Se executa la fiecare pasaj al tulpinii matca, de lucru si la fiecare serie de vaccin.
1.1.1. In scopul efectuatii controlului se insamanteaza cate 3 fiole (flacoane) din pasajul de tulpina matca sau de lucru si cate 3 flacoane din fiecare serie de vaccin.
1.1.2. In cazul recontrolului se preleveaza un numar suplimentar de probe.
2. MATERIALE
bulion Martin
mediu I, cu tioglicolat de sodiu
mediul II, tip Sabouraud
bulion simplu
geloza simpla
bulion cu ficat
mediu Csapek, Sabouraud solid
pipete Pasteur gradate
3. TEHNICA DE CONTROL
3.1. Pregatirea probei pentru control.
Probele de virus Cl/90 La Sota tulpina matca, tulpina de lucru sau vaccin AVIPESTIVAC-Cl/90, vor putea fi folosite pentru control dupa:
a) decongelarea completa a suspensiei virale conservata la -1960 C;
b) reconstituirea virusului (vaccinului) "AVIPESTIVAC Cl/90" liofilizat, la volumul initial, (se face cu bulion Martin).
c) direct din suspensia de vaccin "AVIPESTIVAC Cl/90" pentru seriile conditionate sub forma lichida.
3.2. Metoda de control :
Din continutul fiecarei probe de virus Cl/90- La Sota, se insamanteaza 0,5 ml in sticlute cu 50 ml mediul I si 0,5 ml in sticlute cu 40 ml mediul tip II, sau tuburi cu Sabouraud solid. In cazul in care mediul I este inlocuit cu medii uzuale, insamantarile se vor efectua in cate un tub cu bulion simplu, geloza simpla si bulion cu ficat.
Mediile cu tioglicolat de sodiu sau mediile uzuale inoculate si mediile martor neinoculate, se incubeaza la termostat la 370C, timp de 7 zile si 7 zile la temperatura de +20/+250C.
Tuburile cu mediul II insamantate si tuburile martor neinsamantate, se tin 14 zile la temperatura de +20/+250C.
3.2.1. La controlul bacteriologic, conform pct. 3.2. se vor folosi si medii martor neinsamantate.
4. INTERPRETAREA REZULTATELOR
4.1.Toate mediile insamantate cu probe de virus vaccin Cl/90- La Sota si mediile martor neinsamantate, trebuie sa ramana sterile dupa terminarea perioadei de control.
4.2. In mod exceptional, la seriile de vaccin "AVIPESTIVAC Cl/90"- liofilizat, se admite prezenta contaminarii cu bacterii apatogene, maximum 1 germen/doza vaccinala.
4.2.1. Patogenitatea florei bacteriene se va determina inoculand cultura integrala de 24-48 ore, din repicaje, la urmatoarele animale de experienta :
5 soareci inoculati cu cate 0,2 ml subcutan si
5 pui de 10-30 zile, inoculati intramuscular, sau
5 pui in varsta de 10-30 zile administrandu-li-se 0,2-0,5 ml pe cale oculo-conjunctivala.
Animalele se tin in observatie 10 zile, in care timp trebuie :
sa supravietuiasca
sa nu prezinte nici un simptom de boala, sau
sa nu prezinte nici o reactie locala (abcese, necroze ).
In cazul cand in timpul observatiei mor doi soareci sau doi pui, controlul se repeta pe un numar dublu de soareci sau pui, care dupa inoculare trebuie sa supravietuiasca pe toata durata observatiei. Vaccinul trebuie sa fie liber de germeni patogeni.
4.3. Daca mediile insamantate sunt infectate cu bacterii sau fungi si mediile neinsamantate - martor- sunt sterile, controlul se repeta pe un numar dublu de probe.
4.3.1. Daca mediile insamantate si mediile neinsamantate - martor - sunt infectate cu bacterii sau fungi, controlul se repeta pe acelasi numar, utilizand o alta serie de medii.
4.4. Rezultatul recontrolului trebuie sa fie corespunzator pct. 4.1. si 4.2.
4.5. Seria de vaccin eliberata conditionat nu trebuie sa contina Enterobacteriacee, fungi sau alta flora patogena.
5. CONTROLUL PENTRU GERMENI DIN GRUPUL ENTEROBACTERIACEE
5.1. Scopul
Se executa pentru seriile de vaccin care se elibereaza conditionat si care contin maximum un germen/doza vaccinala.
5.2. Materiale:
cultura bacteriana de 24-48 ore izolata din vaccin,
medii de cultura,
reactiv Ehrilich-Kovacs,
benzi impregnate cu acetat de plumb
zaharuri : manita, zaharoza, lactoza, glucoza, maltoza.
5.3. Tehnica de lucru
5.3.1. Cultura bacteriana de 24-48 ore, izolata din vaccin se insamanteaza pe unul din mediile selective (Mac-Conkey, Drigalski sau Cristensen).
5.3.2. Placile cu mediu selectiv insamantate sunt pastrate la 370 C timp de 24-48 ore.
5.3.3. In cazul inocularii unor germeni presupusi a apartine grupului Enterobacteriacee se executa controlul caracterelor culturale, morfologice, biochimice si serologice pentru identificare.
In acest caz, seria de vaccin se respinge.
6. CONTROLUL PENTRU GERMENI DIN GRUPUL MYCOPLASMA (PPLO)
6.1. Scopul
Se executa la fiecare serie de tulpina matca si de lucru si prima serie de vaccin preparata dupa schimbarea tulpinii de lucru.
6.2. Materiale :
-virus Cl/90-La Sota (TM, TL, vaccin) minimum 3 fiole/flacoane
-bulion PPLO
-agar PPLO
-tulpina de referinta Mycoplasma gallisepticum (S6)
6.3. Tehnica de lucru
6.3.1. Din continutul suspensiei de virus se insamanteaza 1 ml in 100 ml bulion PPLO.
6.3.2. Concomitent, se insamanteaza cate 2 tuburi bulion PPLO si o placa cu agar PPLO,cu aceleasi cantitati dintr-o cultura proaspata de Mycoplasma gallisepticum (S6) sau alta tulpina de M. gallisepticum de referinta.
Acestea vor constitui martori pentru verificarea calitatilor nutritive ale mediilor folosite.
6.3.3. Doua flacoane cu bulion PPLO si o placa cu agar PPLO neinoculate vor servi ca martor.
6.3.4. Mediile cu bulion PPLO se incubeaza la 370C, iar placile cu agar PPLO se incubeaza la 370C, intr-o atmosfera umeda imbogatita cu 10%CO2.
6.3.4.1. Dupa 5-6 zile de incubatie, din probele de bulion PPLO, se efectueaza un pasaj prin reinsamantarea a cate 2 ml in tuburi cu 5 ml bulion PPLO si o placa cu agar PPLO.
6.3.5. Se executa 3-4 pasaje succesive pe mediile de cultura specifice, la un interval de 5-6 zile (perioada de control 21-28 zile).
6.4. Interpretarea rezultatelor
6.4.1. Testul este negativ cand proba martor insamantata cu Mycoplasma gallisepticum (S6) a fost pozitiva in bulion si agar PPLO, mediile martor neinsamantate pe agar si bulion PPLO au fost sterile si cand proba de virus (vaccin) Cl/90-La Sota a fost negativa pe toata perioada controlului.
6.4.2. Tulpina matca si tulpina de lucru, precum si vaccinul AVIPESTIVAC-Cl/90 nu trebuie sa contina germeni din grupa PPLO.
Romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Dr. Danut Turcu
TEHNICA 4
CONTROLUL CANTITATIV AL VIRUSULUI (VACCINULUI) PSEUDOPESTEI AVIARE-Cl/90-LA SOTA
1. SCOPUL
1.1. Controlul cantitativ al virusului Cl/90 La Sota se executa la fiecare pasaj de tulpina matca, tulpina de lucru si serie de vaccin "AVIPESTIVAC Cl/90", prin stabilirea concentratiei de virus.
1.1.1. Controlul activitatii hemaglutinate se face la fiecare pasaj de tulpina matca si de lucru La Sota.
2. MATERIALE
virus Cl/90
oua embrionate SPF sau conventionale
ser fiziologic tampon steril
hematii de pasare 0,75%
3. METODA DE LUCRU PENTRU STABILIREA CONCENTRATIEI IN VIRUS
3.1. Concentratia de virus Cl/90 La Sota se determina la minimum 3 fiole din virusul Cl/90-TM, Cl/90-TL, 3 flacoane la fiecare serie de vaccin AVIPESTIVAC liofilizat.
3.2. Controlul concentratiei de virus Cl/90-La Sota se executa pe oua embrionate de gaina SPF sau conventionale in varsta de 9-11 zile.
3.3. Virusul Cl/90 La Sota (TM, TL, seria de vaccin ) se dilueaza in solutie tampon fosfat salin (TFS ) sau in diluantul corespunzator seriei de vaccin.
3.3.1. Dilutiile zecimale :10-7, 10-8 , 10-9 de virus Cl/90 - La Sota sunt inoculate la embrioni SPF sau conventionali, cate 0.1 ml in cavitatea alantoidiana.
3.3.2. Ouale embrionate dupa inoculare, sunt incubate 72 ore, la +370 - +38 0 C.
3.3.3. Embrionii morti in primele 24 ore dupa inoculare se elimina din control. Numarul acestora nu trebuie sa depaseasca 20%. Daca numarul embrionilor morti depaseste 20% controlul se repeta.
3.3.4. Embrionii sacrificati la 72 ore prin pastrare la 40 C, vor fi controlati individual pentru activitatea hemaglutinanta a lichidului alantoamniotic.
3.3.5. Concentratia de virus Cl/90 - La Sota exprimata in doze infectioase 50 (DIE50) se calculeaza prin metoda Reed si Muench, media replicatelor conf. pct. 3.1.
4. CONTROLUL ACTIVITATII HEMAGLUTINANTE
4.1. Se executa conform tehnicii curente de laboraror, folosind o suspensie de 0,75% eritrocite de gaina SPF, sau de la pasari receptive la pseudopesta aviara.
4.2. Citirea reactiei se face in momentul cand eritrocitele din tubul martor sunt complet depuse dupa 45 minute - o ora.
5. INTERPRETAREA REZULTATELOR
5.1. Titrul infectios al virusului contra pseudopestei Cl/90- La Sota, (din lichidul alantoamniotic) calculat dupa metoda Reed si Muench, trebuie sa fie de minimum 109 DIE50/ml.
5.1.1. Titrul virusului contra pseudopestei Cl/90- La Sota din seria de vaccin trebuie sa fie de minimum 106 DIE50 / doza vaccinala, pe toata perioada de valabilitate.
5.2. Titrul hemaglutinant al tulpinii matca si de lucru trebuie sa fie de cel putin 1/640.
Romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Dr. Danut Turcu
TEHNICA 5
FISA TEHNOLOGICA
PENTRU CONDITIONARE PRIN LIOFILIZARE A VACCINULUI VIU CONTRA PSEUDOPESTEI AVIARE ,,AVIPESTIVAC-Cl/90"
. Vaccinului viu contra pseudopestei aviare, AVIPESTIVAC-Cl/90, se prepara din lichidul alantoamniotic al embrionilor conventionali sau SPF, in amestec cu un suport protector de liofilizare.
Suportul protector de liofilizare este hidrolizatul de colagen cu 15-16 % substanta uscata, pH 7,0-7,4, steril din punct de vedere bacteriologic, peptona 12 %, lactoza 10%, sau alta substanta specifica: -ser de bou sau ser de cal, polivinil pirolidona (PVP), carboximetil celuloza (CMC), zaharuri etc. - testate si avizate in productie.
Raportul de amestec intre suport si lichid alantoamniotic este de 1/2 - 1/3 pentru tulpinile lentogene ale virusului pseudopestei aviare.
2. Proprietatile fizico-chimice ale amestecului
substanta uscata 6-7%
pH = 7,4-7,8
punct crioscopic..-5 -70C
zona de eutexie .. 40- 420C
zona de congelare totala .- 44 - 450C
3. Liofilizare
3.1. Congelarea se face cu 1 grad Celsius pe minut pana la -45: -460C.
Timpul de congelare - 4 ore.
3.2. Sublimarea se realizeaza in 14-16 ore, la temperatura de 6-90C (pe rafturi) la o presiune de maximum 8 x 10-1 torr.
Temperatura programata pentru condensator este de -780C.
Sublimarea se considera finisata cand temperaturile in produs ating valori pozitive.
3.3. Desorbtia se realizeaza in 4-6 ore, la temperatura de +29- +300C in produs (33-340C pe rafturi) si presiunea de 2-4 x10-2 torri.
3.4. Liofilizarea se considera terminata, cand temperatura condensatorului si presiunea in camera ating valori constante pentru cel putin o ora in timpul desorbtiei.
Tehnologia de liofilizare, conform pct. 3 - se aplica in cazul utilizarii flacoanelor tip I de 10 ml in care s-au repartizat cate 3 ml amestec si la care s-au atasat dopuri tip A. Pentru aceasta tehnologie, cantitatea maxima de vaccin introdusa in aparatul tip LIOMAX- 3 va fi de 17 litri.
5. In cazul modificarii unuia din parametrii de la pct. 4, tehnologia de liofilizare se modifica in consecinta
6. Pentru liofilizarea vccinurilor contra pseudopestei aviare in fiole fara dop, in care s-a repartizat cate 1 ml sau 1,5 ml/fiola, ori a flacoanelor de 13 ml cu dop tip B, in care s-au repartizat cate 3 ml/fiacon, se utilizeaza urmatoarea tehnologie
6.1. Congelarea se face cu 10C/min., pana la -45: - 46 0C.
Timpul de congelare este de 6 ore.
6.2. Sublimarea se realizeaza in 16-19 ore, la temperatura de 3-40C (pe rafturi), la o presiune de maximum 8 x 10-1 torri. Temperatura programata in condensator va fi de -750C.
Sublimarea se considera finisata cand temperaturile produsului ating valori pozitive.
6.3. Desorbtia se realizeaza in 14-16 ore, la temperatura de +29 +300C, in produs si presiunea de 2-4 x 10-2 torri.
Temperatura programata se considera finisata cand temperaturile produsului ating valori pozitive.
6.4. Liofilizarea se considera incheiata cand presiunea in camera si temperatura condensatorului ating valori constante pentru cel putin 8-10 ore in timpul desorbtiei.
6.5. In continuare, in incinta liofilizatorului se introduce argon sau alt gaz inert, dupa care se efectueaza operatia de stopering.
7. Dupa liofilizare, flacoanele sunt inchise cu ajutorul capsulelor de aluminiu, apoi sunt numarate, introduse in saci de plastici si sigilate, de catre Laboratorul de control. Fiecare sac va avea in interior o etcheta cu datele seriei respective.
8. Dupa sigilare, sacii cu flacoane sunt predati la depozitul frigorific, unde se pastreaza la +4 sau +80C pana la terminarea operatiunilor de control.
8.1. Parametrii urmariti de catre Laboratorul de control produse biologice sunt cei prevazuti in ,,Normele de preparare si control" specifice vaccinurilor contra pseudopestei aviare.
9. Dupa terminarea controlului si emiterea certificatelor de calitate, recipientii cu vaccinuri sunt etichetati sau stantati, ambalati in cutii de carton, sigilati si predati serviciului de livrari pe baza de nota de predare, insotita de certificatul de calitate
romvac company s.a.
Dr. D. Trepcea Dr. P. stiube
Dr. Danut Turcu
TEHNICA 6
CONTROLUL PURITATII VIRUSOLOGICE
1. SCOPUL
1.1. Se executa la fiecare serie de tulpina matca, tulpina de lucru si la prima serie de vaccin preparata dupa schimbarea tulpinii de lucru -Cl/90.
1.2. Controlul se efectueaza pe minimum 3 replicate, fiecare constituind comasatul a trei fiole (flacoane) de virus (vaccin) Cl/90 - La Sota.
2. CONTROLUL PURITATII VIRUSOLOGICE PE OUA EMBRIONATE SPF
2.1. Materiale:
virus Cl/90 La Sota in concentratie 107 DIE50/0,2 ml
virus Cl/90 La Sota in concentratie 107 DIE50/0,1 +0,1 ml
ser NDV monospecific inactivat 60 minute la 560C (amestec neutralizat)
50 embrioni SPF in varsta de 9 - 11 zile
200 embrioni SPF in varsta de 9 - 11 zile pentru pasaje
2.2. Mod de lucru
2.2.1. Se inoculeaza urmatoarele loturi de embrioni cu cate 0,2 ml astfel:
a) 10 embrioni in cavitatea alantoidiana cu virus Cl/90 La Sota
b) 10 embrioni in cavitatea alantoidiana cu amestec neutralizant, controlat in prealabil prin reactia de hemaglutinare (care trebuie sa fie negativa);
c) 10 embrioni pe membrana corioalantoidiana cu virus Cl/90 La Sota
d) 10 embrioni pe membrana corioalantoidiana cu amestec neutralizant
e) 10 embrioni martori neinoculati.
2.2.2. Embrionii se incubeaza 7 zile la temperatura de 37 - 380C
2.2.3. Embrionii morti in primele 24 ore se elimina. Procentul de embrioni morti la sfarsitul perioadei de observatie nu trebuie sa depaseasca 20% din lot.
2.2.4. Lichidele alantoamniotice de la embrionii morti din lotul b se comaseaza si se executa 1 - 2 pasaje din comasat, prin inoculare intraalantoidiana, pentru evidentierea altor virusuri.
2.2.4.1. Se procedeaza similar cu lichidele alantoamniotice recoltate de la embrionii ramasi in viata (lot b), la sfarsitul perioadei de observatie.
2.2.5. Membranele corioalantoidiene de la embrionii morti din lotul b se controleaza, comaseaza, tritureaza, se suspenda in ser fiziologic in proportie de 1/10 si se inoculeaza pe MCA pentru 1 - 2 pasaje.
2.2.5.1. cu membranele corioalantoidiene de la embrionii ramasi in viata din lotul d se procedeaza ca la pct. 2.2.5.
2.2.6. Lichidele alantoamniotice ale embrionilor morti si sacrificati de la loturile b si d, se vor controla in final prin hemaglutinare, care trebuie sa fie negativa.
2.3. Interpretarea rezultatelor
2.3.1. La embrionii inoculati intraalantoidian si pe membrana corioalantoidiana cu virus (vaccin) Cl/90 La Sota loturile a + c, la sfarsitul perioadei de observatie nu trebuie sa se constate prezenta altor virusuri. Letalitatea si leziunile trebuie sa fie specifice virusului Cl/90 La Sota.
2.3.2. La sfarsitul perioadei de observatie, dupa cele doua pasaje succesive trebuie sa supravietuiasca cel putin 80% din embrionii inoculati si din lotul de embrioni martor neinoculati. Acestia nu trebuie sa prezinte leziuni care ar putea fi atribuite altor virusuri si nici activitatea hemaglutinanta.
3.CONTROLUL PURITATII VIRUSOLOGICE PENTRU VIRUSUL EMIA
3.1. Scopul
Se executa pe minimum 3 replicate, fiecare constituind comasatul a 3 fiole/flacoane de virus Cl/90 La Sota - tulpina matca, tulpina de lucru si prima serie de vaccin obtinuta dupa schimbarea pasajului tulpinii de lucru.
3.2. Materiale:
virus (vaccin) Cl/90 La Sota in concentratie 107 DIE50/0,1 ml
virus EMIA tulpina patogena cu 103 DIE50/0,1 ml
ser pozitiv NDV (Newcastle disease virus) inactivat 60 minute la 560C
40 embrioni SPF in varsta de 6 - 7 zile
30 pui SPF susceptibili la EMIA, in varsta de o zi.
3.3. Mod de lucru
3.3.1. Controlul se va face pe oua embrionate SPF susceptibile la EMIA sau pe pui de o zi proveniti din pasari SPF susceptibile la virusul EMIA.
3.3.2. Tehnica de lucru pe oua embrionate:
Se inoculeaza intravitelin 0,2 ml/ou embrionat in varsta de 6 - 7 zile dupa cum urmeaza:
a) 10 embrioni cu 0,2 ml tulpina patogena EMIA in concentratie de 103 DIE50 ;
b) 10 embrioni cu 0,2 ml amestec de 0,1 ml ser pozitiv NDV cu 0,1 ml tulpina patogena EMIA in concentratie de 103 DIE50 /0,1 ml;
c) 10 embrioni cu 0,2 ml amestec virus Cl/90 La Sota 0,1 ml + ser monospecific NDV;
d) 10 embrioni martor neinoculati.
Embrionii se tin sub observatie pana la sfarsitul perioadei de incubatie.
3.3.3. Tehnica de lucru pe pui de o zi:
Se inoculeaza loturi de cate 10 pui astfel:
e) 10 pui de o zi SPF se inoculeaza in volum de 0,05 ml intracerebral cu o doza vaccinala de virus Cl/90 La Sota;
f) 10 pui de o zi se inoculeaza intracerebral cu 0,05 ml de amestec neutralizant (virus Cl/90 La Sota + ser monospecific NDV);
g) 10 pui martor neinoculati
Puii se tin in observatie timp de 21 zile in conditii de izolare.
3.3.4. Interpretarea rezultatelor
3.3.4.1. Embrionii din lotul a, precum si embrionii din lotul b trebuie sa prezinte leziuni specifice produse de virusul EMIA.
3.3.4.2. Embrionii din loturile c si d trebuie sa reziste in proportie de 80 % la sfarsitul perioadei de observatie. Dupa ecloziune puii rezultati se tin sub observatie 21 de zile si nu trebuie sa prezinte semne nervoase care pot fi atribuite virusului EMIA.
3.3.4.3. Puii morti din loturile e, f, g, dupa 24 ore de la inoculare vor fi examinati in vederea stabilirii cauzei mortii. Se admite o mortalitate (la loturile de pui) pe toata perioada de observatie de 20 %.
Puii care supravietuiesc (sau puii care se imbolnavesc) nu trebuie sa prezinte semne nervoase pe toata perioada de observatie.
ROMVAC COMPANY SA
DIRECTOR GENERAL DIRECTOR TEHNIC
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA 7
Controlul inocuitatii virusului (vaccinului) pseudopestei Cl/90 la sota
1. SCOPUL LUCRARII
Controlul inocuitatii se executa in mod obligatoriu pentru fiecare serie de virus Cl/90 La Sota - TM /TL si la toate seriile de vaccin "AVIPESTIVAC Cl/90".
2. MATERIALE
virus Cl/90 La Sota, serii de vaccin
pui de gaina SPF sau conventional in varsta de 10 zile sau 3 - 5 saptamani
pipete Pasteur
seringi
3. CONTROLUL INOCUITATII
Se executa pe pui de gaina in varsta de 10 zile ori 3 - 5 saptamani, sau pui conventionali receptivi la pseudopesta aviara.
3.1. Puii (loturi de cate 5 - 10) se inoculeaza conform tabelului nr. 1
Tabelul nr. 1. Contolul inocuitatii pe pui de gaina sau conventionali
|
Calea de administrare |
Numar pui |
Varsta |
Cantitatea de virus /pui (ml) |
Nr. minim doze vaccinale /pui |
|
intramuscular oculo - conjunctival lot martor |
3 -5 sapt 9- 12 sapt |
2 gtts |
3.2. Reconstituirea sau diluarea virusului Cl/90 La Sota - tulpina matca, tulpina de lucru si a vaccinului "AVIPESTIVAC Cl/90" se va face in solutie tampon sau diluantul corespunzator vaccinului.
3.3. Puii de gaina inoculati conform pct. 3.1. si puii martor se mentin sub observatie 14 zile pentru seriile curente de vaccin. Pentru tulpina matca si de lucru perioada de observatie a puilor este de 21 zile.
3.3.1. In peroiada de observatie, puii de gaina nu trebuie sa prezinte simptome de boala care pot fi atribuite inoculului si nu trebuie sa moara.
3.4. In cazul in care din loturile inoculate cu virusul Cl /90 LaSota sau lotul martor, moare cel putin un pui cu simptome care pot fi atribuite inoculului, controlul se repeta pe un numar dublu de probe-
3.5. Daca la repetarea experimentului se constata cazuri de boala sau mortalitate la pui, care pot fi atribuite inoculului seria de tulpina matca, tulpina de lucru, vaccinul se rebuteaza.
ROMVAC COMPANY SA
DIRECTOR GENERAL DIRECTOR TEHNIC
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA 8
Timpul mediu de letalitate al dozei
minime letale embrionare
(Mean Death Time of the Minimum Lethal Dose) - (MDT/MLD)
1. SCOPUL
1.1. Timpul mediu de letalitate se executa pentru fiecare serie de virus Cl/90 La Sota tulpina matca si de lucru.
2. MATERIALE
virus Cl/90 La Sota
embrioni SPF in varsta de 10 zile
solutie tampon fosfat
3. METODA DE LUCRU
3.1. Virusul Cl/90 - La Sota se dilueaza in solutie tampon fosfat salin (TFS) de la 10-1 - 10-10.
3.2. Zece embrioni sunt inoculati dimineata (orele 8) si zece embrioni dupa-amiaza (orele 18) cu virus La Sota 0,1 ml in camera alantoamniotica, din dilutia 10-1 si din ultimile 5 dilutii (10-6 - 10-10).
3.2.1. Ouale inoculate se examineaza zilnic, dimineata si dupa-amiaza (orele 8 si 16), prin ovoscopie, relizandu-se intervalele de timp 8-16 ore.
4. INTERPRETAREA REZULTATELOR
4.1. Timpul mediu de letalitate al dozei minime letale se calculeaza la 128 ore de la inoculare si se bazeaza pe dilutia cea mai mare la care mor toti embrionii de gaina si poseda capacitatea hemaglutinanta.
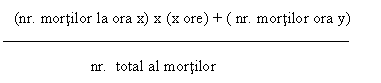
MDT =
Timpul mediu de letalitate embrionara al Cl/90 La Sota trebuie sa fie 104 - 122 ore.
ROMVAC COMPANY SA
DIRECTOR GENERAL DIRECTOR TEHNIC
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA
Patogenitatea intracerebrala pentru puii de gaina la varsta de o zi
scopul lucrarii
Se efectueaza la fiecare pasaj de tulpina matca si de lucru Cl/90 La Sota.
materiale
virus Cl/90 La Sota
pui de gaina de 24 - 40 ore
seringi
3. metoda de lucru
3.1. Zece pui de gaina de cel putin 24 ore, dar nu mai mari de 40 ore se inoculeaza intracerebral cu 0,05 ml virus Cl/90 diluat 1/10.
3.2. Zece pui de gaina proveniti din aceiasi sursa si din aceiasi ecloziune se vor inocula cu 0,05 ml PBS.
3.3. Zece pui de gaina proveniti din aceiasi sursa si din aceiasi ecloziune neinoculati, sunt crescuti ca lot martor.
3.4. Puii de gaina din fiecare lot vor fi individualizati.
3.4.1. Puii de gaina din loturile 3.1., 3.2. si 3.3. vor fi crescuti in acelasi izolator.
3.5. Puii de gaina mentionti la pct. 3.1.4.1 vor fi controlati zilnic si se va inregistra data la care s-au imbolnavit sau au murit. Observatia dureaza 8 zile.
4. INTERPRETAREA REZULTATELOR
4.1. Indicele de supravietuire se calculeaza pe baza timpului de mortalitate si pe baza scorului stabilit pentru fiecare zi, conform pct. 4.1.1.
4.1.1. Scorul pentru letalitate
0 = pui de gaina clinic normali (N)
1 = pui de gaina clinic bolnavi (B)
2 = pui de gaina morti (M)
4.1.1.1. Se inregistreaza zilnic puii normali, bolnavi sau morti, cumuland rezultatele dupa urmatorul exemplu:
|
Specificare |
Ziua 1 2 3 4 5 6 7 8 |
|
Normali (N) Bolnavi (B) Morti (M) |
10 9 9 6 6 6 6 6 0 1 0 3 0 0 0 0 4 0 0 1 1 4 4 4 4 = 18 80 |
IPIC se calculeaza dupa formula: (N x O) + (B x 1) + (M x 2) .
N + B + M
N = 58 x 0 = 0
B = 4 x 1 = 4
M = 18 x 2 = 36 4 + 36 = 40 = 0.5
80 40 80 80
Indicele de patogenitate intracerebrala trebuie sa fie maximum 0,18
ROMVAC COMPANY SA
DIRECTOR GENERAL DIRECTOR DE PRODUCTIE
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA 10
controlul proprietatilor fizico-chimice
1. scopul lucrarii
Controlul proprietatilor fizico-chimice se executa la toate seriile de tulpina matca, tulpina de lucru si de vaccin AVIPESTIVAC - Cl/90.
Proprietatile fizico-chimice ale seriilor de virus vaccin AVIPESTIVAC - Cl/90 trebuie mentinute pe toata durata valabilitatii.
2. aspect
2.1. Tulpina matca, de lucru si seriile de vaccin conditionate lichid trebuie sa fie de culoare galbui-transparenta sau opalescenta, fara impuritati.
2.2. Tulpina de lucru si seriile de vaccin conditionate prin liofilizare in fiole sau flacoane, trebuie sa aiba pastila compacta, pufoasa, de culoare uniforma, alb-galbuie sau rosiatica.
3. OMOGENITATE
Continutul flacoanelor sau fiolelor de tulpina matca, tulpina de lucru si seriilor de vaccin "AVIPESTIVAC Cl/90" este omogen.
3.2. Pastila liofilizata a seriilor de tulpina de lucru si vaccin "AVIPESTIVAC Cl/90" trebuie sa se dizolve in intregime in diluantul respectiv, in 2-4 minute.
4. depozite
4.1. Vaccinul conditionat sub forma lichida poate prezenta un depozit de urati.
5. etanseitate recipienti
5.1. Flacoanele din sticla capsulate trebuie sa fie inchise etans, incat capsula de aluminiu sa nu se roteasca.
6. controlul umiditatii reziduale
6.1. Cotrolul umiditatii reziduale se executa la fiecare seri de tulpina de lucru si vaccin "AVIPESTIVAC Cl/90" liofilizat.
6.1.1. Umiditatea reziduala se executa la minimum 3 flacoane sau fiole pentru fiecare serie de virus Cl/90 La Sota - tulpina de lucru sau seria de vaccin.
6.1.1.1. Umiditatea reziduala se calculeaza ca medie a minimum 3 replicate.
6.2. Umiditatea reziduala se determina in laboratorul de control intern, intr-o camera special amenajata, cu instalatia Karl-Fischer montata intr-o camera cu umiditate controlata.
6.3. Reactiv Karl-Fischer
Solutia care contine 125 g iod si 65 g dioxid de sulf in 1 000 ml amestec de metanol si piridina.
Stabilirea titrului
un g apa se amesteca cu metanol anhidru si se completeaza la 100 ml cu metanol anhidru.
5 ml din aceasta solutie se titreaza cu reactiv Karl-Fischer.
Sfarsitul titrarii poate fi stabilit vizual prin schimbarea culorii de la galben la galben brun.
In acelasi timp se face o proba titrand 5 ml metanol anhidru.
Titrul sau echivalentul in apa al reactivului Karl-Fischer se calculeaza dupa relatia:
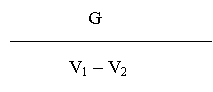
T =
In care :
G = cantitatea de apa in cei 5 ml de solutie
V1 = ml reactiv folosit la titrarea apei din solutia de metanol
V2 = ml reactiv folosit la titrarea metanolului.
La 1 ml reactiv proaspat preparat corespund aproximativ 0,005 g apa.
Titrarea cu reactivul Karl-Ficher
Intr-un flacon cu dop rodat se cantareste la balanta analitica o cantitate de 0,15 -0,18 produs liofilizat.
Se adauga 5 ml metanol, se agita un minut si se titreaza cu reactiv Karl-Ficher.
Sfarsitul titrarii poate fi stabilit vizual prin schimbarea culorii de la galben la galben-brun.
Continutul in apa se calculeaza dupa relatia:
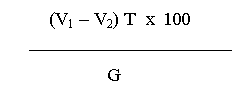
Apa =
In care :
V1 = ml reactiv Karl-Ficher folosit pentru titrarea probei de analizat
V2 = ml reactiv Karl-Ficher folosit pentru titrarea probei martor
G = cantitatea in g de substanta luata in lucru
T = titrul reactivului Karl-Ficher
OBSERVATII
Biureta cu reactiv Karl-Ficher trebuie sa fie protejata de umiditatea atmosferica prin adaptarea unui tub cu clorura de calciu anhidra sau gel de siliciu.
ROMVAC COMPANY SA
DIRECTOR GENERAL DIRECTOR DE PRODUCTIE
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA 11
CONTROLUL EFECTULUI PROTECTOR SPECIFIC (VALOAREA IMUNIZANTA) AL VIRUSULUI (VACCINULUI) CONTRA PSEUDOPESTEI "AVIPESTIVAC Cl/90"
1. SCOPUL LUCRARII
1.1. Controlul efectului protector specific se va executa la toate seriile de virus Cl/90 La Sota tulpina matca, tulpina de lucru si la prima serie de vaccin AVIPESTIVAC Cl/90 preparata dupa un nou pasaj al tulpinii de lucru.
2. materiale
virus tulpina patogena Craiova sau Hertz
virus tulpina Cl/90 La Sota (vaccin)
pasari SPF 3 - 5 saptamani
pasari conventionale receptive la pseudopesta
seringi
3. METODA DE LUCRU
3.1. Virusul Cl/90 La Sota - o doza vaccinala (106DIE50) se administreaza pe cale oculo-conjunctivala la 15 - 20 pui SPF (sau conventionali nevaccinati contra pseudopestei aviare si receptivi la aceasta boala) in varsta de 3 - 5 saptamani.
20 pui de gaina SPF (sau conventionali nevaccinati contra pseudopestei aviare) de aceiasi provenienta si acelasi lot de ecloziune, vor fi crescuti in izolatoare diferite, neinoculati, constituind lotul martor.
3.2. Puii de gaina vaccinati si martor, se mentin sub observatie 14 zile.
3.3. Infectia de control cu virusul pseudopestei aviare patogen (velogen)se executa la 14 zile dupa vaccinare.
3.3.1. Infectia de control se poate efectua administrand intramuscular, la puii vaccinati si nevaccinati martor, aproximativ 106DL50 virus velogen al bolii de Newcastle.
3.4. Dupa infectia de control prin inoculare, puii de gaina se tin sub observatie 15 zile.
3.5. Puii de gaina din lotul martor, nevaccinati, trebuie sa moara 100% cu simptome si leziuni de pseudopesta. Puii vaccinati cu virusul Cl/90 La Sota trebuie sa supravietuiasca infectiei in proportie de minimum 90%.
4. REZULTATE SI INTERPRETARE
4.1. Virusul Cl/90- La Sota - tulpina matca, tulpina de lucru, sau seria de vaccin este corespunzator cand 100% din puii nevaccinati mor sau reproduc pseudopesta aviara si minimum 90% din puii vaccinati rezista lainfectia de control conform pct. 3.5.
ROMVAC COMPANY S.A.
DIRECTOR GENERAL DIRECTOR DE PRODUCTIE
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA 12
FISA PENTRU TULPINA PATOGENA UTILIZATA LA CONTROLUL VALORII IMUNIZANTE A VACCINULUI ,, AVIPESTIVAC -Cl/90 "
1. DESCRIEREA TULPINII
Tulpina velogena ,,Craiova" de virus Newcastle a fost izolata dintr-un focar de pseudopesta aviara.
Virusul este intretinut si pasat in cadrul institutului pentru controlul produselor biologice si medicamentelor de uz veterinar.
2. CARACTERISTICILE TULPINII
- DIE50.- 10 8,5
- TML - 50 ore
- IPIC pui de o zi- 1,8
- DL50 pentru pui de 6 sapt. inoculati intravenos in dilutia 10 g ..-109
- stabilitate 560C H.A-120 minute
3. DOZA DE INFECTIE MINIMA 106 ELD50
4. INTRETINEREA TULPINII
4.1. Intretinerea tulpinii se face pe pui SPF inoculati pe cale intramusculara cu minimum 106 ELD50 de virus tulpina patogena ,,Craiova". De la puii morti de pseudopesta aviara, se preleveaza creierul care dupa triturare si aseptizare se inoculeaza in cavitatea alantoidiana a embrionilor SPF de 9-10 zile, asigurand 102,5 -103,0 EM/ou.
De la embrionii morti dupa 24 ore pana la 48 ore se recolteaza lichidul alantoamniotic. Se retin numai lichidele alantoamniotice necontaminate cu microorganisme.
Lichidele alantoamniotice recoltate si controlate prin hemaglutinare se comaseaza si se repartizeaza in fiole x 1 ml virus, care se mentin la temperatura de -18 sau -200 C.
Virusul obtinut trebuie sa corespunda caracteristicilor tulpinii (pct.2)
DLE50 va fi determinata la un interval de 3 luni.
1.4.2. Pasajul tulpinii se executa anual, la fiecare pasaj efectuandu-se controlul bacteriologic si micologic si controalele prevazute la pct.2.
1.4.2. Tulpina patogena ,, Craiova" de NDV se pastreaza si sub forma de creier congelat, efectuandu-se pasajele anuale.
ROMVAC COMPANY S.A.
DIRECTOR GENERAL DIRECTOR DE PRODUCTIE
Dr. D. Trepcea Dr. P. Stiube
Dr. Danut Turcu
TEHNICA 13
NORMA TEHNICA DE PREPARARE PENTRU HIDROLIZATUL DE COLAGEN (HCV)
1. TEHNOLOGIA DE PREPARARE
Intr-un vas de reactie se introduce intreaga cantitate de hidrolizat de colagen.
Sub agitare continua se adauga hidroxid de sodiu 50% pana la pH
Se repartizeaza in baloane de sticla de 10-15 l.
Se autoclaveaza 90 minute la 1210C.
A doua zi se verifica pH-ul.
Se sifoneaza in baloane de sticla de 10-15 litri, se pune dop de vata, folie de aluminiu si se leaga.
Se sterilizeaza 45 minute la 1210C.
CONDITII DE DEPOZITARE
Produsul se pastreaza in baloane din sticla, la frigider (+40C).
CONTROLUL STERILITATII BACTERIOLOGICE SI FUNGICE
Se executa si se interpreteaza rezultatele conform prevederilor din Tehnica 3.
NORMA TEHNICA DE PREPARARE A SOLUTIEI DE PEPTONA-LACTOZA
1. SCOPUL
Prepararea solutiei de peptona - lactoza ca suport pentru liofilizarea vaccinului viu AVIPESTIVAC Cl/90.
MATERIALE
- peptona 20 g
- lactoza ..100 g
- NH2 PO 4* 12 H2O .7,8 g
- KH2 PO 4 0,25 g
- glutamat de sodiu .0,50 g
- apa deionizata ad ..1000 ml
3. METODA
3.1. Lactoza se dizolva in apa deionizata incalzita la 50-600C.
3.2. Peptona se dizolva separat in apa deionizata.
3.3. Fosfatii se solubilizeaza, la cald, pe agitator cu plita.
3.4. Componentele de la punctele 3.1., 3.2., si 3.3. se comaseaza intr-un recipient si se aduce la volum cu apa deionizata.
3.5. Se sterilizeaza prin filtrare, prin membrana filtranta Millipore de 0,22mm si se repartizeaza la volume convenabile
3.6. Se controleaza din punct de vedere bacteriologic si fungic.
4. REZULTATE SI INTERPRETARE
Se utilizeaza solutiile de peptona - lactoza sterile din punct de vedere bacteriologic si fungic si care ofera protectie asupra virusului vaccinal BIA.
ROMVAC COMPANY S.A.
DIRECTOR GENERAL DIRECTOR DE PRODUCTIE
Dr. D. Trepcea Dr. P. Stiube
Copyright © 2026 - Toate drepturile rezervate