 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
1)Fortele Van der Waals :
a)forte de orientare(Keesom)intre molecule polare :UK=-Ck.1/(kB.T).r6
UK-potential Keesom;Ck –constanta;kB-constanta lui Boltzman;T-temperatura(K);r-distanta dintre molecule.
b)forta de polarizare(inductie)-forte Debye-se manifesta intre o molecula polara si una nepolara molecula polara=induce un moment de dipol temporar in molecula nepolara.
c)forte de dispersie(London)-forte cu caracter universal,se manifesta intre toate tipurile de molecule.Sunt singurele forte care se manifesta intre molecule nepolare.
UL=-CL . 1/r6
Uvw=UK+UD+UL ; Uvw-potential atractiv(negativ)
Fortele Van der Waals sunt slabe de cateva zeci de Kcal/mol si se manifesta la distante mici.
UT=UR+UA=UR+Uvw
UT=CR/R6:12 - Cvw/r6.
2)Modelul gazului ideal-s-a definit pe baza urmatoarelor ipoteze:
gazul este format din molecule considerate sferice,distribuite in mod dezordonat;
moleculele sunt considerate punctiforme(fara volum)
moleculele de dim.mult mai mici in raport cu distanta dintre ele de aceea se considera ca intre molecule nu se manifesta nici un tip de interactiune.
starea de gaz ideal corespunde la presiuni mici si foarte mici(tind catre 0)
Legi:a)Comportarea gazului in conditii izoterme:T=ct;p=f(v)t;v1p1=v2p2=ct.
b)Comportarea gazului in conditii izobare:p=ct;v=f(T)p ;V1/T1=v2/T2=ct
Volumul este o proprietate spatiala a materiei.Semasoara in m3 si subunitati;Se mai masoara in L.mL,etc.
c)comportarea gazului in conditii izocore:v=ct.
Presiunea este rezultatul exercitarii fortei pentru unitatea de suprafata;In cazul gazelor presiunea este expresia ciocnirii moleculelor pe suprafata peretelui vasului ; in SI,presiunea se masoara in Pa(Pascal).
Gazul ideal este o stare ipotetica ,un model de studiu al starii de agregare gazoase.Principala caracteristica a unui gaz ideal o reprezinta presiunea scazuta a gazului lipsa totala de interactiuni dintre moleculele gazului.
3)Gazele reale-sunt studiate in conditii de presiune medii ,mari si f mari.In aceste comditii moleculele sunt in continua agitare intre ele se exercita forte de interactiune (atractie sau repulsie).De asemenea pentru gazele reale moleculele au volume proprii diferite de 0.
Studiind compresivitatea gazelor reale Andrews a observat obtinerea unor izoterme diferite fata de cele ale gazului ideal.
Van der Waals a incercat sa explice izotermele Andrews ale gazului real tinand seama de 2 fenomene care au loc:
A)fiecare molecula are un volum propriu ceea ce inseamna ca ea nu se poate misca intr-un spatiu,decat intr-un minus volum propriu.
B)deoarece intre moleculele gazului real se manifesta forte de interactiune (atractive),intensitatea ciocnirilor,pe suprafata peretelui vasului este diferita fata de cea a gazului ideal.
4)Ecuatia Van der Waals-(P+a/Vm2)(Xm-b)=RT
PVm=RT + (b-a/RT); P 0(gaz ideal) ,b=a/RT=0;TB=Temperatura Boyle – temperatura la care un gaz real se comporta ca un gaz ideal.TB=a/Rb.
5)Starea lichida-substanta are forma nedeterminata si volum propriu ;
-intre particulele substantei se manifesta interactiuni mai puternice decat in gaze dar mai slabe decat la solide;
-moleculele se deplaseaza conferindu-i substantei proprietatea de curgere;
-substantele lichide sunt mai putin combustibil decat gazele;
-moleculele sunt aranjate ordonat decat la gaze ,avand o ordine locala pedistante mici.
6) Tensiunea la care sunt supuse moleculele din stratul 1 se numeste tensiune superficiala.
Tensiunea superficiala se poate defini in 2 moduri :
a)Consumul de lucru mecanic necesar maririi suprafetei interfazice cu o unitate ,asadar aceasta tensiune superficiala:ɣ=Dw/A variatia de lucru mecanic;A-aria suprafetei interfazice:[ɣ]si=J/m;
b)Reprezinta forta care se manifesta pe unitatea de lungime a unui perimetru interfazic:
ɣ =F/l;F forta;l-lungimea ;<N/m>;
ɣ-este influentata de urmatorii factori :
A)fortele intermoleculare (tensiunea superficiala creste cu cresterea intensitatii fortelor atractive dintre moleculele lichidului .
B)temperatura ɣ scade cu cresterea temperaturii datorita scaderii intensitatii fortelor intermoleculare.
7)Caracteristicile starii solide – substantele in stare solida au forma si volum propriu particulele au pozitie relativ fixa ;
-au numai miscare de vibratie;
-sunt f putin compresibile
-pot fi ordonate sau mai putin ordonate(din punct de vedere al ordinii particolelor unei substante in stare solida se impart in solide cristaline si solide amorfe).
8)Sistem termodinamic –o portiune din Univers limitata imaginar sau real in interiorul caruia se petrec diferite fenomene fizico-chimice.
Clasificare:1)dupa schimbul de energie si masa :a)deschise-are loc atat schimb de masa cat si schimb de energie;b)izolat-numai schimb de energie :DE diferit de 0,Dm=0;c)inchis-nu schimba nici masa nici energie;d)adiabate-nu schimba energie dar schimba masa .
2)Dupa compozitie:-monocompetente;dicompetente si policompetente.
3)Dupa numarul de faze:a)monofazice(omogene)o singura faza –monocompetente si policompetente;b)polifazice(heterogene)-2 sau mai multe faze in contact separate prin suprafete interfazice la nivelul carora marimile termodinamice inregistreaza salturi cantitative.
9)Proces termodinamic – reprezinta o transformare sau un ansamblu de transformari pe care le suporta sistemul in trecerea sa de la o stare initiala la o stare finala.
Clasificare:a)proc.reversibile –trecerea dintr-o stare initiala intr-o stare finala se poate face prin stari de echilibru ,fara modificarea substantiala a parametrilor si fara aportul mediului exterior;Procese ideale definite cu scopul fundamentarii teoretice a unor fenomene.
b)proc.ireversibile-procesele reale-trecerea din stare initiala in stare finala are loc spontan cu modificarea parametrilor de stare .Revenirea sistemului in stare initiala nu mai are loc spontan ci este nevoie de contributia mediului –consum de energie din mediu.
10)Variabile de stare independente:(parametri termodinamici de stare) acele variabile care se pot masura direct in diferite instrumente de masura(manometru,termometru,balanta).
Variabile de stare dependente(functii de stare)-variabilele care nu se pot masura direct dar se pot calcula cu ajutorul variabilelor independente pe baza unor relatii matematice numite ecuatii de stare.
pV=nRT; V,T,n-parametri de stare(variabile independente);p-variabila dependenta;p=nRt/V.
In functie de cantitatea de substanta care le influenteaza variabilele de stare pot fi:
a)extensive- a caror variatie depinde cantitatea de substanta (v,,entalpia)
b)intensive- a caror variatie nu depinde de cantitatea de substanta –marimile partiale.
11)Intre lucrul mecanic si caldura Joule stabileste un raport numit echivalentul mecanic al caloriei .Intr-un proces raportul dintre lucru mecanic produs si caldura consumata = const.
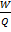 =J=4018 J/cal.La consumarea
unei cantitati de caldura egala cu o calorie se produce un lucru mecanic egal
cu 4.18 J.
=J=4018 J/cal.La consumarea
unei cantitati de caldura egala cu o calorie se produce un lucru mecanic egal
cu 4.18 J.
12)Energia interna-suma energiilor corespunzatoare tuturor tipurilor de miscare a particulelor din sistem;
-Marimea termodinamica de stare –variatia nu depinde de drumul parcurs. [U]si-energia interna ca marime extensiva=J(Kj).
13)Entalpie-variatia caldurii in conditii izobare.
-marime termodinamica de stare ,a carei variatie nu depinde de drumul parcurs.
H(entalpia)=U(energia interna)+pV(lucru mecanic).
dH=DU+Dpv+dvp,p=const.:dp=0.
dHp=Du+pdv
dhp(p=const)=δQ
DH(p=const)=Q
H=marime extensiva,se masoara in J(joule).
14)Capacitatea calorica –cantitatea de caldura necesara ridicarii temperaturii unui corp cu un grad;se poate exprima sub urmatoarele marimi intensive .
15)Caldura specifica-cantitatea de caldura necesara ridicarii temp.cu un grad a unui corp de 1 gram.
[c]si=<J/gram*grad>=<cal/g*grad> ;pentru apa c=1 cal/gram*grad
16)Caloria –cantitatea de caldura necesara ridicarii temp.cu 1 grad a unui gram de apa de la 14,5 la 15,5 in conditii de presiune constanta.
17)Caldura de reactie-se intelege caldura consumata sau eliberata la formarea unui mol de substanta.
18)Entropia-defineste starea de dezordine a unui sistem respectiv gradul de ireversibilitate al procesului.Un sistem cu entropie mare are si o stare de dezvolatare mare.Definirea entropiei ca marime termodinamica s a facut atat din punct de vedere experimental folosindu-se randamentul unui motor termic cat si teoretic folosindu-se teoriilestatistice privind probabilitatea de existenta a sist.in anumite stari.<S>=J/K-marime termodinamica de stare extensiva.proc.rev:dS=δQ/T;Dsrev=Q/T;(DS1)=-(DS2),variatia =0.
19)Procesele termodinamice ireversibile au loc cu producere de entropie si evolueaza spre stari de echilibru:dSirev-δQ/T>0
dSirev=δQ/T+SQ’/T-caldura necompensata(irev.)
TdS=δQ+δQ’
20)Entalpia libera Gibbs-este o marime care caracterizeaza spontaneitatea unei reactii chimice in conditii izoterme/izobare.
21)d/dT(DG/T)=-DH/T2 exprima influenta temperaturii asupra entalpiei libere GIBBS in functie de efectul termic al reactiei.
a)reactii endoterme(Dh>0)d/dT(DG/T)<0 react.endoterme sunt favorizate de cresterea temperaturii care determina scaderea entalpiei Gibbs.
b)reactii exoterme-(Dh<0)d/dt(DG/T)>0 react exoterme sunt favorizate de scaderea temperaturii deoarece aceast scadere determina o scadere a G.
c)reactii 0 termice –neinfluentate de temperatura.
22)Afinitatea chimica –derivata unui potential termodinamic cu gradul de avansare λ,cu semn neschimbat;
-este o marime care exprima gradul de spontanietate ,de reactivitate a componentilor.
23)Potential chimic-marime intensiva ,este entalpia
G.molara partiala:Gi=(δG/dT)p,n dt + (δG/δT)t,n dp +
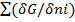 T,p,nj (diferit) idni; dGt,p=
T,p,nj (diferit) idni; dGt,p=
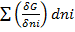
dGt,p=
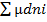 G=
G=
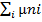 au expresii diferite in functie de starea de agregare si de puritate
pe un gaz pur in conditii de temperatura si presiune.
au expresii diferite in functie de starea de agregare si de puritate
pe un gaz pur in conditii de temperatura si presiune.
24)Prin transformare de faza intelegem trecerea sistemului dintr-o faza in alta la modificarea parametrilor externi.In sistemele monocompetente o faza este o stare de agregare C1,l,g,sau o stare alotropica (reprezinta 2 stari de cristalizare diferite ale celor 2 substante).
25)Relatia dintre numarul de faze in echilibru ,numarul de componenti si parametri macroscopici (p,T)se numeste legea fazelor sub forma ecuatiilor lui Gibbs.
V=c-f+2 v-variatia sistemului si exprima numarul de variabile care se poate modifica simultan fara ca sistemul sa suporte o transformare de faza;
c-numarul de componenti din sistem;f=numarul defaze in echilibru.
2-reprezinta cei doi parametri a caror variatie determina o transformare de faza.
32)Ebulioscobia
Molalitatea-reprezinta numarul de grame de substanta dizolvata de solvit existenta in 100 de grame de solvent.
33)Crioscopia-inseamna scaderea punctului de congelare a unei solutii in raport cu punctul de congelare al solventului .
34)Presiunea osmotica –prin osmoza se intelege trecerea selectiva a moleculelor solventului pntr-o membrana semipermiabila.
35)La cresterea concentratiei reactantilor echilibrul se deplaseaza in sensul obtinerii produsilor de reactie .
36)Temperatura influenteaza echilibrul chimic tinand
seama de influenta temperaturii asupra entalpiei libere Gibbs:
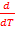 .(
.(
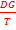 ) = - DH/T2 cresterea
temperaturii favorizeaza reactiile exoterme iar scaderea temperaturii
deplaseaza echilibrul in sensul reactiilor endoterme.
) = - DH/T2 cresterea
temperaturii favorizeaza reactiile exoterme iar scaderea temperaturii
deplaseaza echilibrul in sensul reactiilor endoterme.
37)Presiunea influenteaza reactiile chimice in faza gazoasa care au loc cu modificarea numarului de moli.Astfel cresterea presiunii deplaseaza echilibrul chimic in sensul micsorarii numarului de moli : Dɡ=c+d-(a+b) < 0 ;D=delta;ɡ-nyu
Dɡ=0
Copyright © 2024 - Toate drepturile rezervate