 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Fluidul intracelular al celulelor vii - citosolul - are o compozitie foarte diferita de a lichidului extracelular. De exemplu, concentratia potasiului si a fosfatului este mai mare in interiorul celulei decat in afara ei, in timp ce pentru sodiu, calciu si clor situatia este inversa. Aceste diferente sunt necesare functionarii normale a multor enzime intracelulare, bunaoara sintezele proteice de la nivelul ribozomilor necesita o concentratie relativ ridicata de potasiu.
Aceste diferente de concentratie sunt create si mentinute de membrana celulara sau plasmalema, prin stabilirea unei bariere de permeabilitate in jurul citosolului.
Membrana celulara are permeabilitate selectiva, care asigura pastrarea in celula a substantelor necesare, dintre care unele - in special proteinele - cu cost metabolic prea ridicat pentru a fi irosite, si previne patrunderea in interiorul celulei a substantelor ce nu-i sunt utile. De asemenea, poseda mecanisme (canale ionice, pompe ionice, proteine transportoare) care ajuta unele molecule sa strabata bariera membranara in vederea indeplinirii de catre celula a functiilor sale specifice.
Excitabilitatea este proprietatea fundamentala a oricarei celule vii de a reactiona la actiunea unui stimul prin modificarea permeabilitatii ionice a membranei sale plasmatice si generarea unui potential electric. La nivel de organ efector, reactia de raspuns se traduce prin indeplinirea unor functii specifice, ca secretia glandulara, contractia musculara etc.
Toate celulele vii sunt excitabile, dar gradul lor de excitabilitate este adaptat structurii lor functionale. Celula cea mai excitabila este neuronul, de rapiditatea sa de reactie chiar la stimuli cu intensitate mica depinzand capacitatea de integrare si coordonare a organismului. Urmeaza, in ordine, fibra musculara striata, muschii scheletici trebuind sa fie capabili de raspunsuri contractile rapide si precis gradate la comenzile emise de sistemul nervos central, apoi celulele musculare de tip cardiac si fibrele musculare netede. Structuri inalt excitabile sunt si celulele receptoare, ale analizatorilor, precum si alte celule cu rol de receptor grupate in zone strategice din interiorul organismului sau diseminate in muschi.
Celule mai putin excitabile - in care modificarile de permeabilitate membranara sunt de mai mica amploare si raspunsul specific al celulelor nu se bazeaza pe generarea unor potentiale de actiune - sunt hepatocitul si celulele tesutului conjunctiv, inclusiv celulele osoase.
Excitantul sau stimul poate fi orice agent din mediu capabil sa determine o reactie din partea unei structuri vii (in fapt, orice variatie a unei forme de energie din mediu, care la nivel celular capata valoare informationala).
Pentru a fi investita cu calitatea de stimul, variatia de energie trebuie sa indeplineasca o serie de conditii, adica sa se supuna legilor generale ale excitabilitatii:
1. Pentru a produce o reactie din partea celulei, excitantul trebuie sa aiba o anumita valoare minima: intensitate - prag sau liminara.
- 2. Stimulii subliminari produc doar reactii locale la nivel membranar, ce nu se pot transmite mai departe ca potential de actiune. Dar, daca stimulii subliminari actioneaza repetat si cu o frecventa care sa permita insumarea lor, ei pot genera o reactie din partea celulei sub forma unui potential de actiune.
- 3. La nivelul unei singure celule sau al unei unitati functionale (neuron, unitate motorie, sincitiu), un stimul liminar produce o reactie maximala, dar si un stimul superior ca intensitate va produce aceeasi reactie ca si excitantul liminar. Aceasta este legea "tot sau nimic". Respectiva lege nu mai este valabila in cazul agregatelor supracelulare (de ex. muschiul scheletic in ansamblul sau raspunde gradat).
Putem explica acest comportament al celulei excitabile potrivit legii "tot sau nimic" prin analogie cu modul cum se declanseaza o arma de foc: marimea exploziei si viteza cu care iese glontul de pe teava nu depinde de forta cu care se apasa tragaciul. Ori tragaciul este suficient apasat pentru ca arma sa ia foc, ori nu este, nu se poate trage cu arma "pe jumatate".
- 4. Pentru a evita adaptarea structurilor vii fata de variatia unei forme de energie, stimulul trebuie sa actioneze cu o anumita bruschete pentru a produce o reactie.
- 5. Excitarea repetata cu un stimul de aceeasi natura atrage dupa sine modificarea temporara a pragului de excitabilitate al celulei fata de acel stimul.
- 6. Reactia de raspuns la un stimul nu apare instantaneu, ci dupa un anumit interval de timp (in general foarte scurt) necesar desfasurarii proceselor fizico-chimice declansate de stimul.
Multe molecule prezinta sarcini electrice, datorita unor parti componente, ca gruparea carboxil (-COO-) sau amino (-NH2+). Majoritatea elementelor minerale sunt prezente in solutie (in citosol sau in lichidul extracelular) sub forma de particule incarcate electric sau ioni (Na+, K+, Cl- etc.).
Cu exceptia apei, componentele majore ale lichidului extracelular sunt ionii Na+ si Cl-, in timp ce fluidul intracelular contine concentratii mari de K+, anioni proteici si fosfati. Fenomenele ce rezulta din distributia acestor particule incarcate electric joaca un rol important in functionarea celulelor. Cand particule cu incarcatura electrica opusa se afla in acelasi mediu (loc), forta care le atrage una spre alta poate fi folosita pentru a efectua un travaliu. Dimpotriva, pentru a separa aceste particule, trebuie actionat cu o forta care sa invinga atractia dintre ele. Deci, sarcinile electrice de sens contrar au potentialul de a efectua un travaliu, daca se pot apropia una de alta. Acest potential poarta numele de potential electric sau, deoarece este determinat de diferenta de sarcina dintre doua puncte, de diferenta de potential - pe scurt, potential. Diferenta de potential se masoara in volti (V), dar in sistemele biologice ea este foarte mica, de aceea se foloseste ca unitate de masura milivoltul (mV). Miscarea sarcinilor electrice se numeste curent; daca sarcinile sunt de semn opus, curentul le apropie, daca sunt de acelasi semn, curentul le indeparteaza. Cantitatea de sarcini care se misca (curentul electric) depinde de diferenta de potential dintre sarcini si de natura mediului prin care ele se deplaseaza. Opozitia mediului fata de miscarea sarcinilor electrice este numita rezistenta. Relatia dintre intensitatea curentului (I), voltaj sau diferenta de potential (E) si rezistenta (R) este data de legea lui Ohm:
I = E/R
Materialele cu rezistenta electrica mare sunt izolatori electrici, in timp ce materialele cu rezistenta scazuta sunt conductori.
Apa este un slab conductor deoarece contine foarte putine particule incarcate electric. Daca in apa se adauga insa NaCl, ea dobandeste o conductibilitate relativ mare, deoarece ionii de Na+ si Cl- pot transporta curentul. Deoarece lipidele contin putine grupari incarcate electric, ele nu pot transporta curent si deci au o rezistenta electrica mare. Din aceasta cauza, straturile lipidice ale membranei celulare sunt regiuni cu rezistenta electrica mare care separa doua compartimente continand solutii apoase cu rezistenta electrica mica.
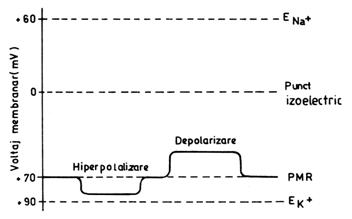
In conditii de repaus, toate celulele au o diferenta de potential intre fata externa si cea interna a membranei, cu fata externa incarcata pozitiv si au fata interna incarcata negativ. Acesta este potentialul membranar de repaus, al carui marime variaza intre -5 si -100 mV, in functie de tipul de celula (in neuron, este de ordinul a -40 pana la -75 mV). PMR al unor celule se poate modifica rapid, ca raspuns la o excitatie, aceasta proprietate fiind de esentiala importanta pentru functionarea lor.
PMR se caracterizeaza printr-un exces de ioni negativi in interiorul celulei si un exces de ioni pozitivi in exterior. Excesul de sarcini negative din celula, nefiind suficiente sarcini pozitive care sa le neutralizeze, sunt atrase electric spre excesul de sarcini pozitive de la exterior, si invers. Astfel, ionii in exces se aduna intr-un strat subtire la suprafata interna si la cea externa a membranei celulare, in timp ce majoritatea mediului extracelular, precum si cea mai mare parte a fluidului celular sunt practic neutre din punct de vedere electric (fig. nr. 1.). De precizat ca numarul de sarcini pozitive si negative care se aliniaza de o parte si de alta a membranei si genereaza diferenta de potential reprezinta o fractiune infinitezimala din numarul total de sarcini electrice dintr-o celula.
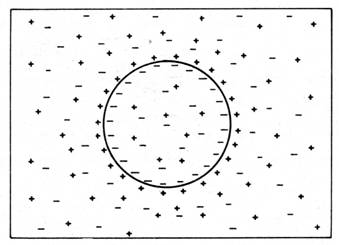
Fig. nr. 1. - Excesul de sarcini pozitive de la exteriorul celulei si excesul de sarcini negative din interior se aduna in apropierea membranei plasmatice. In realitate, aceste sarcini in exces reprezinta numai o mica parte din numarul total de ioni de la exteriorul si din interiorul celulei.
Marimea PMR este determinata in principal de doi factori: (1) diferenta in concentratiile ionilor de o parte si de alta a barierei membranare si (2) permeabilitatea diferita a membranei pentru diferite specii de ioni.
Diferitele mecanisme de
transport pasiv si activ sunt astfel coordonate intr-o celula vie
incat sa mentina ionii si alte substante intracelulare
la concentratii compatibile cu viata. Consecinta este faptul
ca interiorul celulei nu se echilibreaza cu lichidul extracelular, ci
exista intr-o stare
stationara diferita fata de acesta. De exemplu,
concentratia Na+ intracelular (10 mM intr-o celula
musculara) este mult mai scazuta decat a Na+
extracelular (140 mM), deci sodiul poate intra in celula prin transport
pasiv, difuziune in virtutea gradientului de concentratie. Dar, rata
intrarii sodiului este egalata de rata transportului activ al
sodiului spre exteriorul celulei via pompa
de Na-K. Astfel, concentratia intracelulara a sodiului este
mentinuta la un nivel scazut si constant, desi sodiul
intra si iese in permanenta din celula. Procesul este
invers pentru ionii de potasiu, care sunt mentinuti la o concentratie
ridicata in celula, comparativ cu exteriorul. Iesirea
pasiva a potasiului este contrabalansata de intrarea
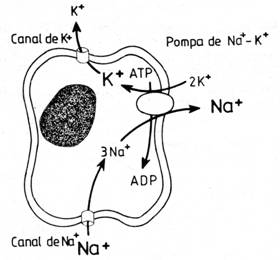
activa prin pompa de Na-K (fig. nr. 2.).
Fig. nr. 6.2. - Conceptul de stare stationara. Rata cu care Na+ intra in celula, deplasandu-se pasiv de-a lungul gradientului sau electrochimic, este egalata de rata transportului Na+ spre exterior prin activitatea Na+/K+-ATP-azei. Concentratia intracelulara a Na+ nu se modifica. In mod similar, rata efluxului pasiv de K+ este egalata cu rata transportului activ al K+ in celula, prin pompa. Concentratia intracelulara a K+ ramane mare si constanta la fiecare ciclu al ATP-azei. Doi K+ sunt schimbati pentru trei Na+ si o molecula de ATP este hidrolizata la ADP. Literele mari si cele mici reprezinta concentratiile ionice ridicate, respectiv scazute.
Atat in interiorul celulei, cat si in lichidul extracelular mai exista si alti ioni, ca Mg++, Ca++, H+, HCO3-, HPO4-2, SO42-, grupari amino- si carboxil ale aminoacizilor, anioni proteici mari, dar sodiul, potasiul si clorul sunt prezenti in cele mai mari concentratii si deci joaca rolul cel mai important in generarea PMR.
Concentratiile ionilor de Na+, K+ si Cl- in mediul extracelular si in citosolul unei celule nervoase sunt ilustrate in tabelul nr. 1.
Tabelul nr. 1. - Distributia celor mai importanti ioni de o parte si de alta a membranei plasmatice a unei celule nervoase
|
Ionul |
Concentratia, mmol/l |
|
|
Extracelular |
Intracelular |
|
|
| ||
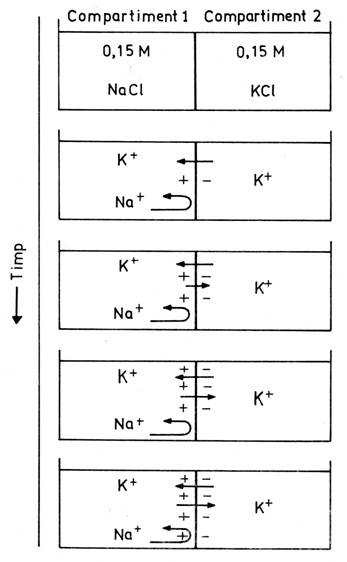 Pentru a intelege de ce
asemenea diferente de concentratie creeaza potentiale de
membrana, sa luam in considerare modelul teoretic din fig. nr. 3. Presupunem ca membrana care
separa cele doua compartimente prezinta canale deschise pentru K+,
dar nu si pentru Na+. Initial, nu va exista
diferenta de potential de o parte si de alta a membranei,
pentru ca cele doua solutii sunt neutre din punct de vedere
electric, adica ele contin acelasi numar de ioni pozitivi
si negativi (ionii pozitivi sunt diferiti ca specie in cele doua
compartimente, dar numarul lor este acelasi si fiecare este
neutralizat de un numar egal de ioni de clor). Datorita
existentei canalelor de K+ deschise, K+ va difuza
de-a lungul gradientului sau de concentratie, adica din
compartimentul 2 in compartimentul 1. Dupa ce cativa ioni de K+
au trecut in compartimentul 1, acesta va avea un exces de sarcini pozitive, iar
compartimentul 2 va avea un exces de sarcini negative, deci va exista o
diferenta de potential de o parte si de alta a membranei.
Pentru a intelege de ce
asemenea diferente de concentratie creeaza potentiale de
membrana, sa luam in considerare modelul teoretic din fig. nr. 3. Presupunem ca membrana care
separa cele doua compartimente prezinta canale deschise pentru K+,
dar nu si pentru Na+. Initial, nu va exista
diferenta de potential de o parte si de alta a membranei,
pentru ca cele doua solutii sunt neutre din punct de vedere
electric, adica ele contin acelasi numar de ioni pozitivi
si negativi (ionii pozitivi sunt diferiti ca specie in cele doua
compartimente, dar numarul lor este acelasi si fiecare este
neutralizat de un numar egal de ioni de clor). Datorita
existentei canalelor de K+ deschise, K+ va difuza
de-a lungul gradientului sau de concentratie, adica din
compartimentul 2 in compartimentul 1. Dupa ce cativa ioni de K+
au trecut in compartimentul 1, acesta va avea un exces de sarcini pozitive, iar
compartimentul 2 va avea un exces de sarcini negative, deci va exista o
diferenta de potential de o parte si de alta a membranei.
 Apare astfel un al treilea factor
care produce trecerea ionilor prin membrane: potentialul electric. Pe masura ce compartimentul 1
devine tot mai electropozitiv, iar compartimentul 2 din ce in ce mai
electronegativ, diferenta de potential de o parte si de alta a
membranei incepe sa influenteze deplasarea ionilor de potasiu. Ei
sunt atrasi de sarcinile negative ale compartimentului 2 si
respinsi de sarcinile pozitive ale compartimentului 1. Deci, forta
electrostatica actioneaza in sens contrar fortei gradientului
de concentratie. Atata timp cat forta datorata gradientului de
concentratie va fi mai mare decat forta gradientului electric, va
exista o deplasare a ionilor de potasiu din compartimentul 2 in compartimentul
1 si potentialul de membrana va creste. Ca urmare,
compartimentul 1 va deveni tot mai pozitiv, pana cand forta
electrica ce se opune intrarii potasiului va egala forta
gradientului de concentratie, care-i favorizeaza intrarea.
Apare astfel un al treilea factor
care produce trecerea ionilor prin membrane: potentialul electric. Pe masura ce compartimentul 1
devine tot mai electropozitiv, iar compartimentul 2 din ce in ce mai
electronegativ, diferenta de potential de o parte si de alta a
membranei incepe sa influenteze deplasarea ionilor de potasiu. Ei
sunt atrasi de sarcinile negative ale compartimentului 2 si
respinsi de sarcinile pozitive ale compartimentului 1. Deci, forta
electrostatica actioneaza in sens contrar fortei gradientului
de concentratie. Atata timp cat forta datorata gradientului de
concentratie va fi mai mare decat forta gradientului electric, va
exista o deplasare a ionilor de potasiu din compartimentul 2 in compartimentul
1 si potentialul de membrana va creste. Ca urmare,
compartimentul 1 va deveni tot mai pozitiv, pana cand forta
electrica ce se opune intrarii potasiului va egala forta
gradientului de concentratie, care-i favorizeaza intrarea.
Potentialul membranar la care forta electrica este egala si de sens contrar cu forta gradientului de concentratie pentru un anumit ion este numita potential de echilibru pentru acel ion. La potentialul de echilibru nu exista nici o deplasare a ionului respectiv prin membrana, deoarece cele doua forte contrare sunt egale si se anuleaza reciproc. Valoarea potentialului de echilibru pentru orice ion depinde de gradientul de concentratie al ionului de o parte si de alta a membranei. Daca concentratiile ionului in cele doua compartimente ar fi egale, nu ar exista gradient de concentratie, iar potentialul de echilibru ar fi si el zero. Cu cat este mai mare gradientul de concentratie, cu atat creste si potentialul de echilibru, deoarece este necesara o forta electrica mai mare pentru a contrabalansa forta gradientului de concentratie. Pentru neuroni, potentialul de echilibru al potasiului este de aprox. -90 mV, interiorul celulei fiind electronegativ comparativ cu exteriorul.

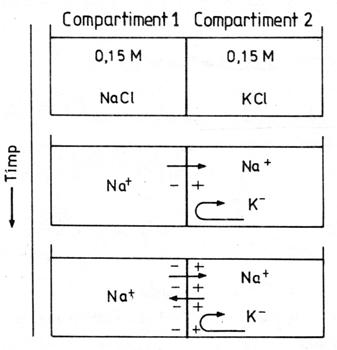 Daca utilizam, in
acelasi model teoretic, o membrana permeabila numai pentru sodiu
(fig. nr. 4.), apare o situatie
asemana-toare celei descrise mai sus pentru potasiu. Se va stabili un
potential de echilibru cand compartimentul 2 va deveni pozitiv
fata de compartimen-tul 1 si miscarea ionilor de sodiu prin
membrana va inceta. Pentru majoritatea neuronilor, potentialul de
echilibru pentru Na+ este de +60 mV, cu interiorul celulei
incarcat pozitiv (de remarcat ca o asemenea situatie nu se
produce in timpul cat celula se afla in repaus, ci doar in timpul
generarii potentialului de actiune).
Daca utilizam, in
acelasi model teoretic, o membrana permeabila numai pentru sodiu
(fig. nr. 4.), apare o situatie
asemana-toare celei descrise mai sus pentru potasiu. Se va stabili un
potential de echilibru cand compartimentul 2 va deveni pozitiv
fata de compartimen-tul 1 si miscarea ionilor de sodiu prin
membrana va inceta. Pentru majoritatea neuronilor, potentialul de
echilibru pentru Na+ este de +60 mV, cu interiorul celulei
incarcat pozitiv (de remarcat ca o asemenea situatie nu se
produce in timpul cat celula se afla in repaus, ci doar in timpul
generarii potentialului de actiune).
Deci, potentialul de echilibru este diferit pentru diferite specii de ioni, nu numai in valoare absoluta, ci si ca directie de actiune a fortei electrice, deoarece depinde de gradientul de concentratie al fiecarei specii de ioni.
Modelul nostru teoretic aproximeaza situatia dintr-o celula aflata in repaus, in care: (a) - concentratia K+ este mult mai mare in interiorul decat in exteriorul celulei, si (b) - membrana celulei este de 50-75 de ori mai permeabila pentru potasiu decat pentru sodiu.
Este generat un potential membranar (PMR), mai ales datorita deplasarii K+ in sensul gradientului sau de concentratie, prin canalele de K+ care sunt deschise, astfel incat interiorul celulei devine mai electronegativ decat exteriorul. Dar, PMR determinat experimental este mai mic decat potentialul de echilibru pentru potasiu, deoarece si in membrana celulei aflata in repaus exista un mic numar de canale pentru sodiu deschise, prin care Na+ difuzeaza continuu in celula, anuland efectul unui numar egal de ioni de potasiu care se deplaseaza spre exterior.
 In cazul unei membrane celulare care
permite difuziunea mai multor specii ionice, trebuie luate in considerare
gradientele de concentratie si potentialele de echilibru ale
tuturor acestor ioni, fiecare aducandu-si contributia la generarea
si mentinerea PMR. Pentru un gradient de concentratie dat, cu
cat permeabilitatea membranei pentru un anumit ion este mai mare, cu atat
contributia acelui ion la PMR va fi mai mare. Deoarece membrana
celulara in repaus este mult mai permeabila pentru potasiu decat
pentru sodiu, PMR are o valoare mai apropiata de potentialul de
echilibru al potasiului decat de al sodiului.
In cazul unei membrane celulare care
permite difuziunea mai multor specii ionice, trebuie luate in considerare
gradientele de concentratie si potentialele de echilibru ale
tuturor acestor ioni, fiecare aducandu-si contributia la generarea
si mentinerea PMR. Pentru un gradient de concentratie dat, cu
cat permeabilitatea membranei pentru un anumit ion este mai mare, cu atat
contributia acelui ion la PMR va fi mai mare. Deoarece membrana
celulara in repaus este mult mai permeabila pentru potasiu decat
pentru sodiu, PMR are o valoare mai apropiata de potentialul de
echilibru al potasiului decat de al sodiului.
 La
un PMR de -70 mV, o valoare caracteristica neuronului, nici sodiul si
nici potasiul nu se afla la potentialul lor de echilibru, deci
exista un continuu eflux de K+ si influx de Na+.
Cu toate acestea, concentratia sodiului
in interiorul celulei si a potasiului in lichidul extra-celular nu
creste, deoarece sodiul patruns in celula si potasiul
iesit la exterior sunt permanent trimisi inapoi in comparti-mentele
lor printr-un mecanism activ de transport
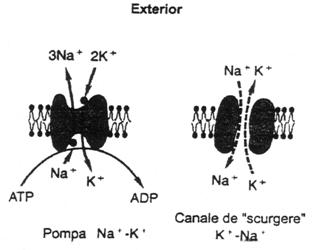
membranar - pompa de Na-K (care pompeaza continuu Na+ in
afara si K+ spre interiorul fibrei) (fig. nr. 5.).
La
un PMR de -70 mV, o valoare caracteristica neuronului, nici sodiul si
nici potasiul nu se afla la potentialul lor de echilibru, deci
exista un continuu eflux de K+ si influx de Na+.
Cu toate acestea, concentratia sodiului
in interiorul celulei si a potasiului in lichidul extra-celular nu
creste, deoarece sodiul patruns in celula si potasiul
iesit la exterior sunt permanent trimisi inapoi in comparti-mentele
lor printr-un mecanism activ de transport
membranar - pompa de Na-K (care pompeaza continuu Na+ in
afara si K+ spre interiorul fibrei) (fig. nr. 5.).
Acest mecanism isi poate aduce o dubla contributie la realizarea PMR:
1) indirecta, prin mentinerea concentratiilor ionilor de sodiu si de potasiu de o parte si de alta a membranei celulare;
2) directa, prin faptul ca numarul ionilor de sodiu si de potasiu transportati prin membrana nu este egal. Pompa de Na-K functioneaza ca o pompa electrogena, deoarece scoate din celula 3 Na+ pentru 2 K+ pe care-i introduce. Acest transport inegal contribuie la separarea sarcinilor de o parte si de alta a membranei si face ca valoarea PMR sa fie mai mare decat cea rezultata exclusiv in urma difuziunii ionilor in sensul gradientului de concentratie. In majoritatea celulelor contributia directa, electrogena a pompei de Na-K la realizarea PMR este mica.
Pe langa sodiu si potasiu, ionii de clor sunt prezenti in cantitate mare, mai ales in lichidul extracelular. Membrana plasmatica a majoritatii celulelor este permeabila pentru Cl-, dar nu prezinta pompe ionice. In acest caz, potentialul membranar stabilit de interactiunile ionice, descrise pana acum, va determina si deplasarea ionilor de clor. Electronegativitatea din interiorul celulei este forta care va determina deplasarea ionilor de clor spre exterior, pana la aparitia unui gradient de concentratie (concentratie mai mica de Cl- in interiorul celulei decat la exterior). Forta gradientului de concentratie va produce difuzarea ionilor de clor inapoi in celula, opunandu-se astfel fortei de gradient electric. Rezultatul este ca potentialul de echilibru pentru Cl- este egal cu PMR si clorul nu-si aduce contributia la valoarea potentialului de membrana.
In celulele cu un sistem de transport activ care scoate Cl- din celula (pompa de Cl-), valoarea PMR nu coincide cu potentialul de echilibru pentru clor si difuziunea ionului in celula contribuie la formarea PMR, participa la realizarea excesului de sarcini negative din celula si creste valoarea PMR
In neuroni, majoritatea sarcinilor negative din interiorul celulei nu se datoresc clorului, ci moleculelor organice, mai ales anionilor mari proteici, care, datorita dimensiunilor lor, nu pot strabate membrana celulara.
O alta modalitate de a ne referi la o membrana incarcata electric este sa spunem ca membrana este polarizata, adica are un potential diferit de zero. Daca PMR este punctul de referinta fata de care masuram modificarile de potential membranar, trecerea la o stare mai polarizata (cu interiorul membranei mai electronegativ si exteriorul mai electropozitiv) o numim hiperpolarizare, iar trecerea la o stare mai putin polarizata (mai aproape de 0 mV) o numim depolarizare (fig. nr. 6.).

Modificarile in
potentialul membranar al celulelor excitabile pot fi produse prin
alterarea temporara a permeabilitatii membranei pentru
anumiti ioni, sub influenta unui stimul.
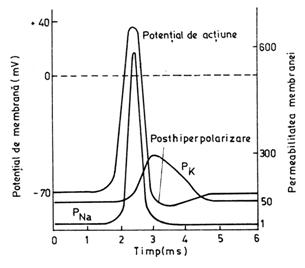
Potentialul de actiune este o modificare locala (apare la locul de actiune al unui stimul asupra membranei celulare) si rapida a potentialului membranar, putand dura chiar numai 1 ms, timp in care potentialul de membrana se poate modifica cu 100 mV si membrana se poate repolariza, refacand PMR.
Numai celulele nervoase, musculare si unele celule glandulare au membrane plasmatice capabile de a produce PA. Aceste membrane se numesc excitabile, iar proprietatea lor de a produce PA se numeste excitabilitate. In cadrul sistemului nervos, informatia poate circula in organism la distante mari, sub forma PA.
Bazele ionice ale generarii PA. Mecanismele modificarii de permeabilitate membranara. Am vazut ca marimea PMR depinde de (1) gradientele de concentratie pentru ionii de sodiu si potasiu si de (2) permeabilitatea selectiva a membranei celulare pentru ioni, in special de permeabilitatea diferita pentru Na+ si K+. Aceiasi factori sunt implicati si in cazul formarii PA: apare o modificare temporara a permeabilitatii membranei pentru ioni, in timp ce gradientul de concentratie ramane neschimbat si dirijeaza sensul de deplasare al ionilor. In stare de repaus, in membrana celulei sunt deschise mai ales canale de K+ si de Cl- si doar foarte putine canale de Na+. Din aceasta cauza, PMR este mai apropiat de potentialul de echilibru al potasiului decat de cel al sodiului.
In timpul generarii unui PA si apoi a revenirii la polaritatea de repaus a membranei, distingem doua evenimente majore - depolarizarea si repolarizarea - care se petrec in mai multe etape (fig. nr. ):
. Depolarizarea lenta. La locul de actiune a stimulului, in membrana celulei se deschid mai multe canale pentru Na+ si ionii de sodiu patrund in celula in numar mai mare decat in perioada de repaus. Rezultatul este o scadere a PMR de la -70 la -55 mV, membrana trecand intr-o stare mai putin polarizata;
2. Depolarizarea rapida. Inversarea polaritatii. Printr-un mecanism de feed-back pozitiv (fig. nr. 8.), patrunderea Na+ in celula determina deschiderea unui numar si mai mare de canale pentru Na+, permeabilitatea membranei pentru acest ion crescand de sute de ori. Ca urmare, polaritatea membranei scade vertiginos pana la atingerea punctului izoelectric (cand numarul sarcinilor pozitive si negative de o parte si de alta a membranei se neutralizeaza reciproc), iar cand importul de sarcini pozitive in celula excede exportul de sarcini pozitive datorat iesirii potasiului, polaritatea membranei se inverseaza, ea devenind electropozitiva pe fata interna si electronegativa pe fata externa. In aceasta faza, se dezvolta varful (spike-ul) PA, care ajunge, in celula nervoasa, la aproximativ +30 mV, aproape de valoarea potentialului de echilibru al sodiului. In celula nervoasa, PA dureaza aproximativ 1 ms, dar pot fi mult mai lung in anumite tipuri de celule musculare.
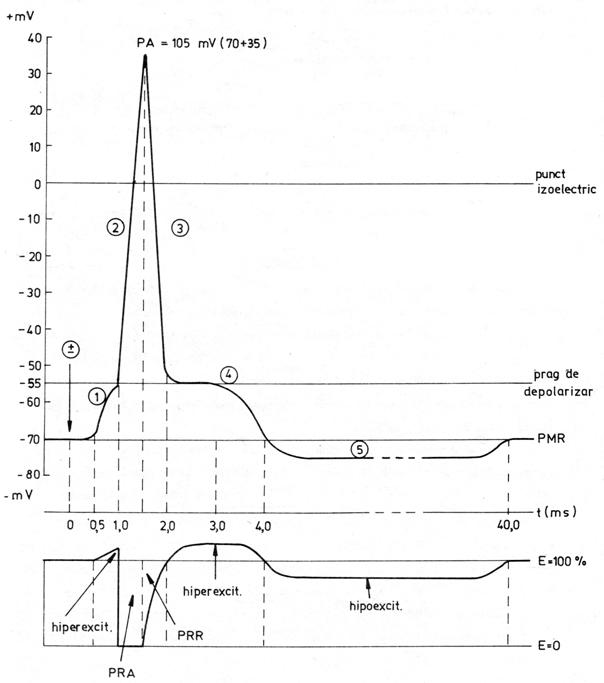
Fig. nr. - Potentialul de actiune al neuronului si modificarile de excitabilitate membranara care-l insotesc
3. Repolarizarea rapida. In timpul acestei etape, potentialul membranar revine rapid aproape de nivelul sau de repaus, datorita:
a) inchiderii canalelor pentru Na+, care au fost deschise in timpul depolarizarii rapide; astfel sodiul patruns in etapa precedenta ramane prizonier in celula.
b) deschiderii unui tip special de canale pentru K+, canalele voltaj-dependente. Ca urmare, difuzia potasiului din celula spre exterior intrece difuzia sodiului si reface rapid incarcatura electrica mai electropozitiva a fetei externe a membranei, comparativ cu cea interna;
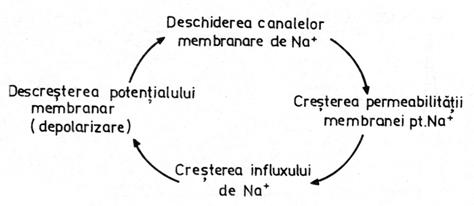
Fig.
nr. 8. - Relatia de
feed-back pozitiv dintre depolarizarea membranei si cresterea
permeabilitatii pentru sodiu
4. Repolarizarea lenta (postdepolarizarea sau postpotentialul negativ, dupa o denumire mai veche). Apare ca o intarziere a repolarizarii si se datoreaza excesului de sarcini pozitive ale ionilor de sodiu sechestrati in celula prin inchiderea canalelor pentru sodiu. Acesta nu poate fi compensat in totalitate prin iesirea K+, a carui conductanta a atins deja valoarea maxima si incepe sa scada. Aceasta etapa dureaza 2-3 ms;
5. Posthiperpolarizarea (postpotentialul pozitiv). Este o crestere a diferentei de potential transmembranar peste valoarea PMR, putand ajunge pana la -80 mV. In conditiile in care canalele pentru sodiu continua sa fie inchise, iar o parte a canalelor pentru potasiu deschise, reintra in functie pompa de Na-K, care scoate activ Na+ din celula. K+ difuzeaza prin canale la exterior si este reintrodus in celula de pompa, in timp ce Na+ nu poate patrunde in celula, este doar scos. In acest mod, in interiorul celulei, se creaza un deficit temporar de sarcini pozitive, ceea ce determina hiperpolarizarea membranei pentru o durata de cateva zeci de ms.
Ca urmare a implicarii, in aceasta etapa, a mecanismului de transport activ prin pompa ionica, se inregistreaza o crestere a consumului emergetic al celulei excitabile, insotita de eliberare de caldura.
Pe masura ce pompa ionica scoate Na+ si reintroduce K+ in celula, permeabi-litatea membranei revine la normal si la sfarsitul posthiperpolarizarii potentialul transmembranar se restaureaza la valoarea PMR (-70 mV, pentru celula nervoasa).
Putem observa ca, dupa generarea unui PA, ca urmare a actiunii unui stimul, revenirea membranei celulare la starea de polarizare caracteristica repausului (PMR) nu se face dintr-o data si nici in mod liniar. Daca, in celula nervoasa, dezvoltarea unui PA necesita doar 1 ms, restaurarea PMR la valoarea de -70 mV se atinge abia dupa 40-50 ms sau chiar mai mult, iar curba potentialului electric evolueaza, dupa faza de repolarizare rapida, in mod sinusoidal, apropiindu-se de valoarea PMR prin oscilatii deasupra si dedesubtul acestei valori. In fapt, aceasta modalitate de reactie este specifica majoritatii proceselor biofizice, biochimice si fiziologice (nu numai: la nivelul sistemelor supraindividuale, legile ecologice se manifesta in acelasi mod). Daca privim stimulul ca pe un factor perturbant al starii stationare de polarizare de repaus a membranei celulare (PMR), iar PA, ca fiind rezultatul acestei perturbari, revenirea sistemului (celulei) la starea stationara initiala se face incet, si poate fi reprezentata grafic sub forma unei sinusoide.
 S-ar putea crede ca pentru a
produce in potentialul membranar modificari de talia unui PA sunt
necesare deplasari transmembranare ale unui numar foarte mare de
ioni. De fapt, numai 1 din fiecare 100 000 de ioni de Na+ din
lichidul extracelular intra in celula pentru a participa la
declansarea PA si aproximativ aceeasi proportie de ioni de
K+ iese din celula pentru a restaura PMR. Aceasta
deplasare de ioni este atat de redusa incat produce doar modificari
infinitezimale ale concentratiei ionilor de o parte si de alta a
membranei celulare. Cu toate acestea, gradientele de concentratie ale
sodiului si potasiului ar disparea treptat daca pompa de Na-K nu
ar transporta mereu ionii inapoi in compartimentele lor de origine. Dar numarul
de ioni implicat in generarea unui singur PA este atat de mic incat pompa nu
este obligata "sa tina pasul" cu fiecare PA produs.
Daca aceasta este blocata experimental, se pot realiza inca sute
de PA, inainte de aparitia unor modificari sensibile in gradientele
de concentratie ale ionilor si respectiv in valoarea PMR. Asa se
explica faptul ca o celula excitabila poate raspunde
la un stimul puternic prin trenuri (serii) de PA, care au o frecventa
proportionala cu intensitatea stimulului, dar au toate aceeasi
amplitudine (se supun legii "tot sau nimic").
S-ar putea crede ca pentru a
produce in potentialul membranar modificari de talia unui PA sunt
necesare deplasari transmembranare ale unui numar foarte mare de
ioni. De fapt, numai 1 din fiecare 100 000 de ioni de Na+ din
lichidul extracelular intra in celula pentru a participa la
declansarea PA si aproximativ aceeasi proportie de ioni de
K+ iese din celula pentru a restaura PMR. Aceasta
deplasare de ioni este atat de redusa incat produce doar modificari
infinitezimale ale concentratiei ionilor de o parte si de alta a
membranei celulare. Cu toate acestea, gradientele de concentratie ale
sodiului si potasiului ar disparea treptat daca pompa de Na-K nu
ar transporta mereu ionii inapoi in compartimentele lor de origine. Dar numarul
de ioni implicat in generarea unui singur PA este atat de mic incat pompa nu
este obligata "sa tina pasul" cu fiecare PA produs.
Daca aceasta este blocata experimental, se pot realiza inca sute
de PA, inainte de aparitia unor modificari sensibile in gradientele
de concentratie ale ionilor si respectiv in valoarea PMR. Asa se
explica faptul ca o celula excitabila poate raspunde
la un stimul puternic prin trenuri (serii) de PA, care au o frecventa
proportionala cu intensitatea stimulului, dar au toate aceeasi
amplitudine (se supun legii "tot sau nimic").
Dupa cum am aratat mai inainte, faza de depolarizare rapida din generarea PA corespunde deschiderii in numar mare a canalelor intramembranare pentru sodiu, in timp ce repolarizarea rapida a membranei coincide cu deschiderea masiva a canalelor pentru potasiu. Putem spune, deci, ca aparitia PA se datoreste unui potential de sodiu, iar restaurarea PMR se realizeaza prin intermediul unui potential de potasiu (fig. nr. 9.).
 Canalele
ionice in producerea PA. Implicate in producerea PA, ele
poarta numele de canale
voltaj-dependente, deoarece devin operante cand se produc modificari
ale valorii potentialului membranar (modificari de voltaj). Desi
exista deosebiri intre proprietatile canalelor de sodiu si
de potasiu din membrana celulelor nervoase (spre exemplu, canalele de sodiu se
deschid mai rapid decat cele de potasiu si se inchid instantaneu dupa
un anumit interval de timp, independent de starea de polarizare a membranei, in
timp ce canalele de potasiu se deschid mai incet si nu se inactiveaza
spontan, ci continua sa ramana deschise cata vreme
membrana este depolarizata), ambele tipuri de canale sunt considerate canale voltaj-dependente rapide. Vom vedea, la studierea
excitabilitatii miocardului, ca exista in unele celule
si canale voltaj-dependente lente, a
caror actiune, combinata cu cea a canalelor rapide, duce la
prelungirea perioadei de depolarizare, ce ia forma unui platou, imediat
dupa atingerea varfului PA.
Canalele
ionice in producerea PA. Implicate in producerea PA, ele
poarta numele de canale
voltaj-dependente, deoarece devin operante cand se produc modificari
ale valorii potentialului membranar (modificari de voltaj). Desi
exista deosebiri intre proprietatile canalelor de sodiu si
de potasiu din membrana celulelor nervoase (spre exemplu, canalele de sodiu se
deschid mai rapid decat cele de potasiu si se inchid instantaneu dupa
un anumit interval de timp, independent de starea de polarizare a membranei, in
timp ce canalele de potasiu se deschid mai incet si nu se inactiveaza
spontan, ci continua sa ramana deschise cata vreme
membrana este depolarizata), ambele tipuri de canale sunt considerate canale voltaj-dependente rapide. Vom vedea, la studierea
excitabilitatii miocardului, ca exista in unele celule
si canale voltaj-dependente lente, a
caror actiune, combinata cu cea a canalelor rapide, duce la
prelungirea perioadei de depolarizare, ce ia forma unui platou, imediat
dupa atingerea varfului PA.
In stare de repaus, mentinerea PMR fara aparitia unor variatii de voltaj, se datoreste difuziunii pasive a ionilor printr-un alt tip de canale, numite canale ionice de scurgere ("leak" channels). Trecerea ionilor prin aceste canale este determinata de fortele descrise la subcapitolul privind PMR.
Unele membrane celulare poseda si un alt tip de canale proteice pentru ioni, ce se deschid in urma legarii unei alte molecule proteice (mediator chimic, hormon), numita ligand, la o molecula receptor atasata canalului, cu formarea unui complex ligand-receptor. Este cazul membranelor neuronale postsinaptice si al membranelor celulelor-tinta pentru diferite specii de hormoni. Asemenea canale poarta numele de canale ligand-dependente (ligand-gated) si poate cel mai tipic exemplu il reprezinta canalele acetilcolinice de la nivelul membranelor postsinaptice ale sinapselor avand ca mediator chimic acetilcolina (Ach). Legarea Ach la un receptor membranar determina deschiderea canalelor ligand-dependente, sub forma unui por cu diametrul de 0,65 nm, care permite ionilor pozitivi cu diametru mai mic decat al porului sa patrunda in celula.
♦ Canale ionice activate de intinderea membranei. Informatii noi privind natura si modul de functionare a canalelor ionice membranare au fost aduse prin punerea la punct a unei tehnici moderne de investigare, tehnica patch-clamping (engl. patch = petec, fragment; to clamp = a prinde, a fixa). Pentru realizarea acestei tehnici, fiziologii celulari E. Neher si B. Sakmann au fost distinsi, in anul 1991, cu Premiul Nobel pentru fiziologie. Ei au demonstrat ca varietatea tipurilor de canale ionice pe care le poseda membranele celulelor excitabile este mult mai mare decat s-a crezut anterior.
Tehnica patch-clamp utilizeaza pipete de sticla cu diametrul varfului de 1 mm. Varful pipetei este aplicat pe membrana celulei si se exercita o usoara suctiune; astfel, portiunea de membrana prinsa in lumenul pipetei este izolata electric de restul membranei. Daca in fragmentul de membrana a fost prins si un canal ionic, inchiderea si deschiderea sa pot fi evidentiate sub forma unor modificari masurabile de voltaj membranar.
Prin aceasta tehnica au fost puse in evidenta canale ionice activate pe intinderea membranei celulare, prezente in celulele receptoare, care sunt stimulate de distorsiuni ale membranei lor: firele de par, receptorii tactili, proprioceptorii, osmo- si baroreceptorii. O crestere locala a suprafetei membranei cu mai putin de 2 % duce la activarea maximala a acestor canale. Ionii vehiculati prin aceste canale sunt cationi, mai ales K+, Na+ si Ca++, in functie de tipul de celula receptoare. Mecanismul prin care intinderea membranei duce la deschiderea canalelor nu a fost inca in intregime elucidat, dar se pare ca sunt implicate structuri fibrilare ale citoscheletului care informeaza canalul ionic despre distorsiunea membranara. Asemenea canale sensibile la intindere au fost evidentiate in membranele bacteriilor si protozoarelor, ca si in multe tipuri de celule apartinand organismelor pluricelulare. In mod experimental, intinderea membranei are ca rezultat un flux ionic transmembranar si in cazul unor celule nespecializate pentru delectarea distorsiunilor, ceea ce a dus la concluzia ca acest tip de canal ionic reprezinta un mecanism primitiv de reactie la stimuli externi, din care au evoluat celelalte tipuri de canale ionice membranare.
Pragul de excitabilitate. Nu orice depolarizare declanseaza mecanismul de feedback pozitiv care duce la formarea unui PA. Dar un PA rezulta numai atunci cand, in etapa (1), membrana celulara este suficient de depolarizata, adica sunt deschise suficiente canale pentru sodiu, incat intrarea sodiului in celula sa exceada iesirea potasiului, deci sa apara un bilant net de deplasate a sarcinilor pozitive dinspre exterior spre interiorul celulei.
Potentialul membranar caracteristic acestui moment de inversare a fluxului net de sarcini pozitive se numeste potential-prag, iar stimulii care sunt exact atat de puternici cat sa depolarizeze membrana pana la acest nivel au fost denumiti stimuli-prag.
Pragul de excitabilitate (marimea depolarizarii initiale necesare pentru declansarea PA) este pentru majoritatea membranelor excitabile de 15 mV. Pentru o celula nervoasa cu PMR = -70 mV, potentialul-prag va fi: -70 +15 = -55 mV.
La depolarizari mai mici decat pragul, efluxul de sarcini pozitive (K+) continua sa depaseasca influxul (Na+) si mecanismul de feedback pozitiv care guverneaza etapa (2) de depolarizare rapida nu se poate declansa. In acest caz, nu se genereaza PA si potentialul membranar revine la valoarea de repaus de indata ce stimulul este indepartat. Aceste depolarizari slabe sunt numite potentiale subliminare. Ele sunt rezultatul actiunii unor stimuli subliminari. La stimuli supraliminari, membranele excitabile raspund prin serii de PA, a caror frecventa depinde de intensitatea stimulului.
Modificari de excitabilitate membranara in timpul generarii PA. In perioada de repaus, cand nici un stimul nu actioneaza asupra membranei, aceasta prezinta o diferenta de potential transmembranar de -70 mV si o excitabilitate de 100 % (normala). Orice stimul liminar sau supraliminar va modifica permeabilitatea membranei pentru ioni, va deschide canalele voltaj-dependente pentru sodiu si va depolariza membrana, generand un PA. La un nou stimul, venit in timpul producerii acestui PA, membrana se va comporta in mod diferit, in functie de etapa in care se afla PA si de intensitatea noului stimul (fig. nr. 6.).
In faza (1) de depolarizare lenta, excitabilitatea membranara creste usor peste normal (hiperexcitabilitate), fenomen datorat, in unele cazuri, sumatiei mai multor stimuli subliminari, iar in alte cazuri unui singur stimul de valoare prag sau peste prag. Despre stimulii subliminari, ca sursa de potentiale locale, vom discuta in subcapitolul urmator.
In etapa (2) de depolarizare rapida, excitabilitatea membranei scade brusc la zero; acum sunt deschise canalele voltaj-dependente pentru sodiu si exista un influx masiv de Na+, astfel incat membrana nu mai are resurse pentru a raspunde la un nou stimul care ar actiona in aceasta perioada. Aceasta este perioada refractara absoluta (PRA). Importanta PRA consta in aceea ca ea determina numarul de PA care pot fi generate in unitatea de timp intr-o membrana excitabila (labilitatea). Cu cat PRA este mai scurta, labilitatea neuronului creste. Majoritatea celulelor nervoase pot produce pana la 100 PA/s, iar unele pot lucra, pentru perioade scurte de timp, chiar la frecvente mai mari.
In faza (3) de repolarizare rapida, excitabilitatea membranei creste treptat, pe masura ce repolarizarea avanseaza. Canalele pentru Na+ s-au inchis in totalitate in momentul de varf al PA, au stat inchise un foarte scurt interval si acum sunt disponibile pentru a genera un nou PA. Este perioada refractara relativa (PRR), in care un stimul prag nu poate produce un PA, dar un stimul supraliminar are aceasta posibilitate. PRR corespunde cu permeabilitatea maxima a membranei pentru K+ (eflux masiv al acestui ion); un stimul supraliminar poate deschide mai multe canale pentru Na+, astfel incat influxul de sodiu sa intreaca efluxul de potasiu si sa permita intrarea in functie a mecanismului de feed-back pozitiv, descris anterior.
Faza (4) de depolarizare lenta (postdepolarizarea) este contemporana cu o usoara crestere a excitabilitatii peste valoarea normala (hiperexcitabilitate). Acum, in celula, exista un exces de sarcini pozitive (ioni de sodiu), ramase aici in urma inchiderii canalelor pentru sodiu, astfel incat chiar un stimul aflat cu putin sub pragul de excitabilitate poate produce un PA.
In timpul posthiperpolarizarii (5) care urmeaza, excitabilitatea membranei scade usor sub valoarea normala (hipoexcitabililate) din cauza deficitului de sarcini pozitive de pe fata interna a membranei, produs de reintrarea in functie a pompei de Na-K.
Odata cu refacerea PMR si excitabilitatea membranei revine la normal.
Modificarea
concentratiei Ca++ extracelular poate afecta excitabilitatea
membranara prin alterarea pragului de depolarizare necesar initierii
PA (fig. nr. 10.). In mod normal, ionii de calciu exercita un efect stabilizator asupra membranei,
prin interactiunea lor cu sarcinile negative ale capetelor polare ale
fosfolipidelor 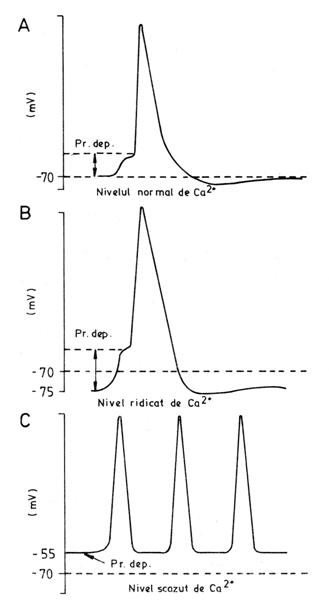 membranare
si cu sarcinile negative ale portiunilor proteice ce ies in afara
membranei. Existenta acestor sarcini negative legate de exteriorul
mem-branei produce o usoara depolarizare care scade valoarea PMR.
Daca o mare parte a lor este neutralizata de Ca++ extracelular,
efectul lor depolarizant este mai mic. Rezulta ca potentialul membranar este foarte
sensibil la concentratia calciului extracelular.
membranare
si cu sarcinile negative ale portiunilor proteice ce ies in afara
membranei. Existenta acestor sarcini negative legate de exteriorul
mem-branei produce o usoara depolarizare care scade valoarea PMR.
Daca o mare parte a lor este neutralizata de Ca++ extracelular,
efectul lor depolarizant este mai mic. Rezulta ca potentialul membranar este foarte
sensibil la concentratia calciului extracelular.
 Afectarea homeostaziei calciului produce
fluctuatii in functionarea muschiului cardiac (in unele cazuri
putand fi o cauza a hipertensiunii arteriale), dar si in
functionarea ner-vilor si a muschilor striati scheletici. Cand
concentratia calciului in sange este crescuta (hipercalcemie),
valoarea PMR este mai mare si pragul de depolarizare ce poate genera un PA
este mai greu de atins (fig. nr. 10.B).
Este necesar un stimul mai puternic pentru a produce depolarizarea. In consecinta,
membranele excitabile din structura nervilor si muschilor devin
relativ refractare la stimulare. In conditii de hipocalcemie, mai
putine sarcini negative de la exteriorul membranei sunt compensate de Ca++,
valoarea PMR scade si pragul de depolarizare este mai usor de atins
(fig. nr. 10.C). Membranele
celulelor musculare si nervoase devin hiperexcitabile si pot chiar
descarca PA in mod continuu, ca si cand ar fi fost stimulate.
Motoneuronii si fibrele musculare care se comporta astfel pot produce
spasme musculare (tetanie
hipocalcemica). Prezenta Ca++ extracelular in
concentratie constanta este considerata a avea un rol stabilizator asupra
potentialului membranar, prevenind fluctuatiile de excitabilitate.
Afectarea homeostaziei calciului produce
fluctuatii in functionarea muschiului cardiac (in unele cazuri
putand fi o cauza a hipertensiunii arteriale), dar si in
functionarea ner-vilor si a muschilor striati scheletici. Cand
concentratia calciului in sange este crescuta (hipercalcemie),
valoarea PMR este mai mare si pragul de depolarizare ce poate genera un PA
este mai greu de atins (fig. nr. 10.B).
Este necesar un stimul mai puternic pentru a produce depolarizarea. In consecinta,
membranele excitabile din structura nervilor si muschilor devin
relativ refractare la stimulare. In conditii de hipocalcemie, mai
putine sarcini negative de la exteriorul membranei sunt compensate de Ca++,
valoarea PMR scade si pragul de depolarizare este mai usor de atins
(fig. nr. 10.C). Membranele
celulelor musculare si nervoase devin hiperexcitabile si pot chiar
descarca PA in mod continuu, ca si cand ar fi fost stimulate.
Motoneuronii si fibrele musculare care se comporta astfel pot produce
spasme musculare (tetanie
hipocalcemica). Prezenta Ca++ extracelular in
concentratie constanta este considerata a avea un rol stabilizator asupra
potentialului membranar, prevenind fluctuatiile de excitabilitate.
In experimente efectuate cu curent galvanic (continuu), Pfluger a demonstrat ca intr-o celula nervoasa traversata de un curent subliminar se produc modificari de excitabilitate.
Sa consideram doi electrozi, unul negativ (catod) si altul pozitiv (anod), alimentati de la o sursa de curent continuu si plasati pe suprafata unei celule excitabile, de exemplu pe axolema unui neuron (fig. nr. 11.a). Trebuie reamintit ca simpla trecere a curentului electric prin electrozi nu produce nici o reactie din partea membranei celulare, ea fiind sensibila doar la variatii ale energiei electrice. Deci, o eventuala stimulare se poate produce numai la inchiderea sau la deschiderea circuitului.
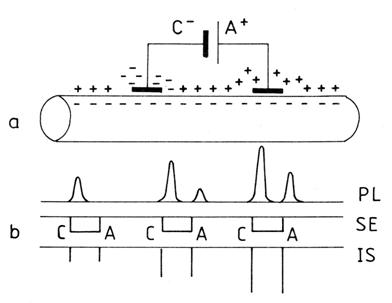
Fig. nr. 11. - Punerea in evidenta a potentialelor electrotonice (a) si relatia dintre amplitudinea potentialului si intensitatea stimulului (IS) la catod (C) si anod (A), in cazul stimularii cu stimuli subliminari (b); SE = inregistrarea semnalului electric (inchiderea, respectiv deschiderea circuitului).
La trecerea prin circuit a unui curent electric slab, cu valoare de stimul subliminar, nu este initiat un PA, dar excitabilitatea membranei se modifica in dreptul celor doi electrozi. La catod are loc o acumulare de sarcini negative la suprafata membranei, ceea ce duce la scaderea valorii PMR si deci a pragului de depolarizare. Fenomenul poarta numele de catelectrotonus si determina o hiperexcitabilitate locala. La anod are loc o acumulare de sarcini pozitive la suprafata membranei, ceea ce accentueaza polarizarea ei si duce la cresterea pragului de depolarizare. Acest anelectrotonus determina o hipoexcitabilitate locala.
Potentialele electrotonice, fiind produse de stimuli electrici subliminari, au toate caracteristicile unor potentiale locale, despre care vom vorbi in continuare. Ele nu initiaza PA, dar "pregatesc" membrana celulara pentru actiunea unui stimul liminar, modificandu-i, intr-un sens sau altul, capacitatea de a reactiona. Asa se explica de ce la actiunea unor stimuli cu intensitate crescanda PA apare mai repede la catod, in zona devenita hiperexcitabila si mai tarziu (doar la stimuli mai puternici) la anod, in zona de hipoexcitabilitate (fig. nr. 11.b.).
Potentialele locale sunt modificari ale potentialului membranar care privesc doar o mica regiune a membranei si mor la 1-2 mm distanta de locul lor de origine. Ele pot aparea fie sub forma unei depolarizari, fie sub forma unei hiperpolarizari si sunt produse de stimuli subliminari. Se mai numesc si "potentiale gradate" pentru ca au amplitudine variabila, proportionala cu intensitatea stimulului. Curentul local "curge", asa cum curge apa de-a lungul unui furtun fisurat. Se pierd sarcini de-a lungul membranei pentru ca membrana este in continuare permeabila pentru ioni, asa cum s-ar pierde apa de-a lungul furtunului fisurat, iar rezultatul este descresterea curentului cu distanta. Altfel spus, propagarea PL se face decremental, adica cu pierderi.
La aparitia unui PL, va exista un schimb de sarcini electrice intre locul sau de origine si regiunile adiacente ale membranei, aflate in stare de repaus. Astfel, PL creaza curent electric in lichidul extracelular si in fluidul intracelular, curenti care sunt proportionali cu amplitudinea potentialului. Prin conventie, directia de deplasare a sarcinilor pozitive este considerata directia de deplasare a curentului. Pe fata interna a membranei, sarcinile pozitive se vor departa de locul excitarii, spre zone mai negative, caracteristice PMR. Pe fata externa a membranei, sarcinile pozitive se vor indrepta dinspre regiunile mai pozitive adiacente spre locul de excitare, mai electronegativ. Acest curent local scade gradul de separare a sarcinilor (depolarizare) in regiunile din jurul zonei usor depolarizate prin excitarea cu stimulul subliminar. Curentul local este purtat de ioni ca K+, Na+, Cl- si HCO3-.
Dar, intrucat PL nu prezinta prag de depolarizare (depolarizarile locale pot fi produse de stimuli mult mai mici decat un stimul liminar) si nici perioada refractara (frecventa de actiune a stimulilor poate fi foarte mare, deoarece modificarile in incarcatura membranara sunt mici si nu necesita mecanisme speciale pentru restaurarea starii de repaus), ele se pot insuma si pot atinge astfel pragul de depolarizare necesar pentru generarea unui PA (fig. nr. 12.).
Sumatia poate fi temporala, daca in aceeasi regiune a membranei se aplica succesiv, cu frecventa mare, stimuli subliminari, sau spatiala, daca se aplica simultan stimuli subliminali in puncte foarte apropiate ale membranei.
Proprietatile PL si PA sunt prezentate comparativ in tabelul 2.
Tabelul nr. 2. - Proprietatile potentialelor locale si ale potentialelor de actiune
|
Potentiale locale |
Potentiale de actiune |
|
1. Amplitudinea este independenta de intensitatea stimulului, maxima odata ce a fost atins pragul de depolarizare. Se supune legii "tot sau nimic". |
|
|
3. Au perioada refractara. |
|
|
4. Nu se pot insuma. |
|
|
5. Sunt conduse nedecremental, amplitudinea ramane constanta. |
|
|
6. Durata este constanta si specifica pentru fiecare tip de celula. |
|
|
Sunt depolarizari. |
|
|
8. Sunt initiate de depolarizarea membranei. |
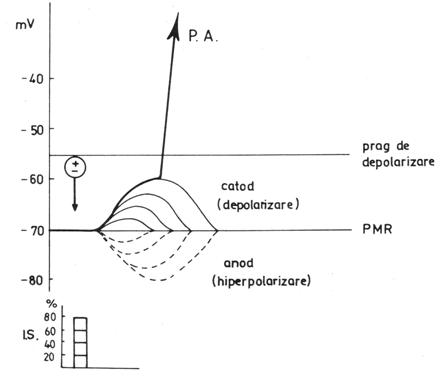
Fig.
nr. 12. - Generarea PA prin
insumarea PL la catod si starea de hiperpolarizare obtinuta prin
insumarea PL anodice; la catod se poate genera un PA prin insumarea unor
stimuli subliminari care nu depasesc prag. 80 % din intensitatea
stimulului prag IS = intensitatea stimulului, ca procent din intensitatea
stimulului prag.
Dupa localizare sau dupa functia pe care o indeplinesc, distingem mai multe tipuri de PL.
potentiale de receptor, care se nasc, sub influenta stimulilor specifici, in celulele receptoare ale analizatorilor (PR);
potentiale electrotonice (catelectrotonus si anelectrotonus);
potentiale postsinaptice, care apar in membrana postsinaptica si pot fi excitatoare (PPSE) sau inhibitoare (PPSI), dupa cum se produc prin depolarizarea, respectiv prin hiperpolarizarea membranei (fig. nr. 12.);
potentialele produse in mod spontan, in absenta unui excitant extern, de celulele pace-maker generatoare de automatism din tesutul nodal excito-conductor al inimii, din unele celule musculare ale intestinului subtire sau din centrii inspiratori bulbari.
Importanta fiziologica a PL este deosebita, deoarece reprezinta, la nivelul sinapselor, unica modalitate de comunicare intre celulele excitabile si creeaza, prin sumatie, conditiile necesare initierii PA.
Copyright © 2025 - Toate drepturile rezervate