 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Teoria mecanicii cuantice asupra legaturii covalente. Emeplificare pe molecula de H.
Teoria electronica clasica nu putea explica de ce la punerea in comun de perechi de electroni se formeaza legaturi atat de trainice ca in molecula de azot sau de diamant. Raspunsul cel mai corect l-a dat teoria mecanicii cuantice asupra structurii atomului, extinsa de W. Heitler si F. London (1927) la molecula de hidrogen, justificand riguros teoria semiempirica a lui Lewis si aratand sensul fizic precis al liniutei de valenta.
Mecanismul formarii legaturii covalente dupa mecanica cuantica este urmatorul: ori de cate ori doi atomi se apropie unul de altul in spatiu pentru a forma o molecula, norii lor electronici (orbitalii atomici) se suprapun (se intrepatrund) tot mai mult, interactiunile mutuale sporesc, electronii apartin in masura tot mai mare ambilor atomi, consolidand treptat legatura prin aparitia unor forte de atractie care tind sa aduca protonii pana la distanta de echilibru stabil r0 pentru care, energia potentiala a sistemului este minima.
Astfel, molecula ia nastere prin intrepatrunderea orbitalilor atomici, cu formare de orbitali moleculari comuni ambilor atomi, ceea ce constituie legatura covalenta.
Calculele efectuate de Heitler si London privind energia moleculei de H2 in functie de distanta dintre nuclee a aratat ca trecerea electronilor de la un atom la altul implica o variatie de energie. Calculele concorda perfect cu rezultatele experimentale si ele arata ca peste 90 % din energia de legatura dintre cei doi atomi provine din schimbul electronilor de la un nucleu la altul, pentru a nu spune „din punerea in comun a electronilor``.
Aceasta energie se numeste energie de schimb si se deosebeste de energia rezultata din atractia electrostatica, prezenta si ea dar in masura mult mai mica.
Principiile de la care au plecat Heitler si London pentru formarea orbitalilor moleculari in molecula de hidrogen sunt si principiile generale ale tuturor legaturilor covalente. Distributia electronilor in miscarea lor in molecula respecta ecuatia lui Schrödinger in care E reprezinta energia totala a moleculei, adica suma energiei cinetice si potentiale a fiecarei microparticule (electroni si nuclee).
Ecuatia nu are solutii decat pentru o serie discontinua de valori proprii ale energiei totale, valori ce corespund nivelelor de energie ale moleculei, respectiv ale orbitalilor moleculari.
Molecula exista ca formatie stabila atata timp cat corespunde unei micsorari a energiei in raport cu suma constituentilor sai luati separat, adica energia orbitalului molecular format este mai mica decat suma energiilor orbitalilor atomici care se intrepatrund.
Rezolvarea ecuatiei lui Schr dinger pentru molecule formate din atomi polielectronici intampina mari dificultati pentru care se fac multe aproximari ce duc la rezultate putin diferite de rezultatele experimentale.
In cazul hidrogenului, la care calculele corespund rezultatelor experimentale, formarea orbitalului molecular poate fi inteleasa daca se considera o molecula de H2 caracterizata de functia de unda care satisface ecuatia lui Schr dinger, pentru cei 2 protoni si 2 electroni constituenti. Cand cei doi atomi sunt departati ei pot fi caracterizati de functiile proprii A(1) pentru primul atom si B(2) pentru al doilea atom de hidrogen, in care A si B sunt nucleele iar 1 si 2 electronii, functii care exprima probabilitatea ca electronul (1) sa se gaseasca in jurul nucleului A, iar electronul (2) sa se gaseasca in jurul nucleului B. Aceste functii corespund starii fundamentale a atomilor.
Pentru a descrie formarea moleculei este nevoie de o functie de unda care sa exprime probabilitatea de a gasi simultan electronul (1) in jurul lui A si (2) in jurul lui B. Aceasta probabilitate simultana exprimata prin I este data de produsul celor doua probabilitati individuale: I = A(1)·B(2) si care constituie o solutie a ecuatiei pentru molecula H2 cand atomii nu sunt prea apropiati unul de altul (molecula instabila).
Daca se presupune ca se apropie cei doi atomi pana la pozitia de echilibru (molecula stabila), iar apoi se departeaza din nou, este imposibil de cunoscut daca electronul care graviteaza in jurul nucleului A este (1) sau (2). De aceea este posibila o noua functie II: II =A(2)· B(1)
Deoarece ecuatia lui Schrödinger este o ecuatie diferentiala de ordinul doi cu coeficienti constanti, apare ca o proprietate a acesteia cand I si II sunt doua solutii particulare ale ecuatiei iar C1 si C2 doi coeficienti variationali, ca solutia generala a ecuatiei pentru molecula de H2 sa rezulte din combinarea liniara a celor doua solutii particulare: H2 = C1I + C2II
Coeficientii C1
si C2 trebuie astfel alesi, incat energia E a moleculei
sa fie minima, de unde: 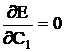 si
si 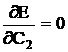
Legatura covalenta este determinata de doi electroni cu spini opusi a caror probabilitate de existenta este relativ mare intre cei doi atomi pe directia ce leaga cele doua nuclee.
Exista o analogie
perfecta intre intrepatrunderea orbitalilor atomici si
interferenta a doua unde (electronice stationare). Atunci cand
cele doua unde care interfera au ampltudini identice (bucle egale) ca
marime si sens (de exemplu +) cele doua unde se insumeaza,
iar in caz contrar ele se anuleaza. De aceea si in cazul suprapunerii
(intrepatrunderii) orbitalilor atomici rezulta orbitali moleculari a
caror functii de unda ![]() sunt date de suma, respectiv diferenta,
functiilor I si II:
sunt date de suma, respectiv diferenta,
functiilor I si II: ![]() si
si ![]() unde
unde ![]() corespunde orbitalului de legatura,
corespunde orbitalului de legatura,
![]() - orbitalului de antilegatura,
iar factorul 1/
- orbitalului de antilegatura,
iar factorul 1/![]() numit factor de normare, provine din
conditia impusa ca probabilitatea de a gasi electronul in intreg
spatiul respectiv sa fie egala cu 1. Semnul + si -
defineste functii simetrice (+), respectiv antisimetrice (-).
numit factor de normare, provine din
conditia impusa ca probabilitatea de a gasi electronul in intreg
spatiul respectiv sa fie egala cu 1. Semnul + si -
defineste functii simetrice (+), respectiv antisimetrice (-).
Orbitali moleculari si . In timp ce momentul cinetic al orbitalilor atomici se caracterizeaza prin numerele cuantice n si l, orbitalii moleculari se caracterizeaza prin numerele cuantice n si ultimul corespunzand componentilor momentului cinetic de-a lungul dreptei ce leaga cele doua nuclee. Deci, numarul inlocuieste numarul cuantic l. La valoarea l = 0 corespund orbitali atomici in timp ce la = 0 corespund orbitali moleculari б, (sigma); la l = 1 corespund orbitali atomici p, in timp ce la = 1 corespund orbitali moleculari ; la l = 2 corespund orbitali atomici d, in timp ce la = 2 corespund orbitali moleculari etc. Deci, prin contopirea a doi orbitali atomici pot rezulta in realitate doi orbitali moleculari: a) unul de energie joasa si stabil numit orbital de legatura () care corespunde functiilor simetrice si moleculelor stabile in care perechea de electroni de legatura au spin opus (); b) un orbital de energie mai ridicata, instabil, numit orbital de antilegatura (*,*) care corespunde functiilor antisimetrice si moleculelor excitate, in care perechea de electroni de legatura au spini paraleli ().
Legaturi se mai pot forma dintr-un orbital s cu unul p sau din doi orbitali px .
Norul electronic ce constituie legatura are o configuratie de elipsoid alungit, simetric de-a lungul axei ce leaga cele doua nuclee si prezinta densitate maxima in spatiul dintre cei doi atomi care formeaza legatura covalenta.
Orbitalii moleculari (legatura sau pp) rezulta din doi orbitali atomici p orientati paralel in spatiu si anume din doi orbitali py sau din doi orbitali pz.
Legaturile apar, intre atomii legati deja prin legaturi (HF, H2O).
Din figura 3 rezulta ca molecula de HF prezinta o legatura covalenta polara ca toti hidracizii halogenilor, din figura 4 reiese ca molecula apei are o structura unghiulara (intre cele doua legaturi exista un unghi de 104o30’).
Orbitali moleculari hibridizati. Formarea legaturii covalente in compusii organici ca si in combinatiile covalente a numeroase elemente ca beriliul, borul, carbonul etc., nu a putut fi explicata cu ajutorul teoriei dupa care se interpreteaza formarea legaturii in molecula de hidrogen.
Carbonul de exemplu are in starea sa fundamentala structura He, 2s2, 2px 2py. Deoarece numai electronii necuplati participa la legaturi covalente, prin existenta numai a 2 electroni necuplati, carbonul ar trebui sa se comporte bicovalent in compusii organici fapt ce nu se confirma. Practic, in toti compusii organic carbonul este tetracovalent. Aceeasi neconcordanta intre numarul de electroni necuplati (Be – 0, B – 1, C – 2) si numarul de covalente formate (Be – 2, B – 3, C – 4) se observa si la alte elemente:
Se considera insa ca, in stare activata (in conditii de reactie) se produce excitarea atomului cand, un electron din orbitalul 2s trece intr-un orbital 2p astfel incat, in cazul carbonului, rezulta o configuratie cu 4 electroni necuplati in stratul de valenta:
![]()
![]()
![]() 2s2 2px 2py
2s2 2px 2py
2s1 2px 2py 2pz
In noua stare, cei trei electroni existenti in orbitalii 2px, 2py, 2pz sunt echivalenti intre ei si orientati de-a lungul celor trei axe de coordonate dreptunghiulare. Cel de-al patrulea electron situat in 2s se deosebeste de acestia prin forma distributiei densitatii de sarcina (sferica), energie mai joasa si orientare in spatiu nedefinita. Aceasta neechivalenta a celor patru orbitali ai carbonului este in contradictie cu realitatea si anume cu echivalenta chimica a covalentelor carbonului si cu orientarea tetraedrica in spatiu a acestora.
Copyright © 2024 - Toate drepturile rezervate