 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Cinetica chimica. Determinarea ordinului partial de reactie si a constantei de viteza
Scopul lucrarii: se determina ordinul partial de reactie in raport cu Na2S2O3 pentru reactia dintre Na2S2O3 si H2SO4.
Principiul lucrarii:
Pentru o reactie chimica scrisa in forma generala:
![]() (1)
(1)
in care A1,A2, Ai sunt reactanti; A1', A'2, A'i sunt produsi de reactie iar, i, i sunt coeficientii stoechiometrici ai reactantilor, respectiv ai produsilor de reactie;
viteza de reactie (vR) se defineste prin variatia in timp (dt) a concentratiei unui reactant (dci) sau a unui produs de reacție (dc'i), ținand cont și de coeficienții stoechiometrici corespunzatori (i și i
![]() (2)
(2)
Semnul (-) se refera la scaderea concentratiei reactantilor care se consuma in timp, iar semnul (+) la cresterea concentratiei produsilor de reactie in timp, concentratia reactantilor fiind primul si cel mai important factor care influenteaza viteza oricarei reactii chimice.
Viteza de reactie pentru oricare proces chimic depinde de concentratia reactantilor si de temperatura:
v = f (ci, T) (3)
Forma concreta a functiei f (ci, T) depinde de natura reactiei. Pentru un mare numar de reactii, functia f(ci, T) este factorizabila, adica poate fi redata sub forma unui produs de doua functii:
F (ci, T) = f1(T) x f2(ci)
Functia f1(T) notata cu k este o constanta cinetica numita constanta de viteza. Functia f2(c2) este de forma:
![]()
unde exponentii ai se numesc ordine partiale de reactie in raport cu reactantii Ai.
Constanta de viteza k are o semnificatie fizica precisa, ea este viteza reactiei pentru care concentratia reactantilor este unitara.
Pentru o reactie chimica elementara
(izolata), exponentii ai
sunt numeric egali cu coeficientii stoechiometrici: ai =![]()
Suma ordinelor partiale de reactie reprezinta ordinul total de reactie:
a = ![]() (6)
(6)
Ordinul de reactie este o marime formala, care se determina experimental din masuratori de viteza de reactie. El poate fi zero, un numar intreg sau un numar fractionar.
Pentru determinarea ordinului partial de reactie in raport cu un reactant (se lucreaza la temperatura constanta) se variaza concentratia reactantului respectiv mentinand constanta concentratiile celorlalti reactanti.
In lucrarea de fata se va studia reactia chimica complexa dintre tiosulfatul de sodiu (Na2S2O3) si acidul sulfuric (H2SO4) care este usor de urmarit, deoarece unul din produsii de reactie, sulful, se separa sub forma de particule coloidale, care produc opalescenta solutiei, conform urmatoarelor reactii:
lenta
![]() Na2S2O3
+ H2SO4 Na2SO4 + H2S2O3
Na2S2O3
+ H2SO4 Na2SO4 + H2S2O3
(tiosulfat de sodiu) (acid tiosulfuric)
rapida
![]()
![]() H2S2O3 H2O + SO2 + S
H2S2O3 H2O + SO2 + S
![]()
Σ: ![]()
Viteza de reactie in raport cu sulful format este:
![]() (8)
(8)
Viteza de reactie in raport cu concentratiile reactantilor este:
vR = ![]() (9)
(9)
Aparatura si substante:
Aparatura: biurete, eprubete, cronometru
Substante: solutii de tiosulfat de sodiu (Na2S2O3) si de acid sulfuric (H2SO4)
Modul de lucru:
in patru eprubete numerotate de la 1 la 4 se introduc pe rand cate 5, 4, 3 si 2 mL solutie Na2S2O3, masurati cu biureta gradata in mL si zecimi de mL (1 cm3=1 mL), completand apoi continutul eprubetelor cu apa distilata pana la un volum total de 5 mL;
in alte 4 eprubete numerotate de la 5 la 8 se introduc cate 5 mL solutie H2SO4 masurati cu biureta;
peste
continutul eprubetei 1 se adauga solutia H2SO4
din eprubeta 5 si se agita; se masoara variatia de
timp (![]() t) din momentul
amestecarii solutiilor pana la aparitia opalescentei
(tulburarea solutiei care corespunde aparitiei primelor particule de
sulf coloidal);
t) din momentul
amestecarii solutiilor pana la aparitia opalescentei
(tulburarea solutiei care corespunde aparitiei primelor particule de
sulf coloidal);
se
procedeaza la fel si cu perechile de eprubete 2-6, 3-7, 4-8
notandu-se valorile ![]() t.
t.
Se spala imediat toate eprubetele
|
Nr. eprubete |
Volumul (mL) |
|
|
(secunde) |
-lg |
||
|
Solutie |
Apa c |
||||||
|
Na2S2O3 a |
H2SO4 b |
||||||
Calcule si rezultate:
Deoarece concentratia sulfului coloidal format in reactie poate fi considerata constanta, se poate scrie:
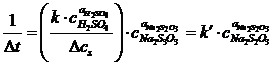 (10)
(10)
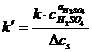 este constanta aparenta a vitezei
de reactie. (11)
este constanta aparenta a vitezei
de reactie. (11)
Relatia 10 se liniarizeaza prin logaritmare obtinandu-se ecuatia unei drepte de forma:
y = n + m ∙ x , adica:
![]() (12)
(12)
pentru care: y = - lg t x = lg cNa2S2O3;
m (panta dreptei din geometria analitica) = a Na2S2O3 (ordinul partial de reactie care
trebuie determinat);
n (ordonata la origine in geometria analitica) = lg k' (k' - marime proportionala cu
constanta de viteza a reactiei chimice din
cinetica chimica)
Se poate folosi si logaritmi naturali.
Se completeaza tabelul de mai sus calculand
![]()
![]() si -lg
si -lg![]() t.
t.
Cu valorile din tabel pentru ![]() si -lg
si -lg![]() t se reprezinta grafic dependenta -lg
t se reprezinta grafic dependenta -lg![]() t = f(
t = f(![]()
Se traseaza dreapta printre punctele reprezentate pe grafic si se calculeaza panta dreptei (m= a Na2S2O3), alegand doua puncte oarecare pe dreapta, si ordonata la origine (n= lg k'), iar prin antilogaritmare se determina constanta aparenta de viteza (k').
Se va aprecia in functie de
valoarea lui a, daca reactia este simpla sau complexa,
iar functie de valoarea lui ![]() t se va
aprecia daca reactia este sau nu rapida.
t se va
aprecia daca reactia este sau nu rapida.
Exercitii:
Pentru reactia 2A +B C, viteza de formare a compusului C este 0,5 mol/L h. Care este viteza de reactie raportata la reactanti?
Se considera reactia trimoleculara: 2 NO + O2 2NO2. Stiind ca reactia este o reactie simpla sa se calculeze constanta de viteza pentru formarea NO2 la 0oC, cunoscand ca prin reactia a 0,16 moli O2 si 0,04 moli NO intr-un vas de 0,5 L, viteza initiala de formare a NO2 este 8,19 10-9 mol/L s
Intr-un vas de 1 litru, aflat la temperatura de 427oC se produce reactia bimoleculara: H2 + I2 2HI. Se cere:
a) sa se calculeze viteza initiala de formare a HI la aceasta temperatura daca in vas se afla 0,08 g H2 si 1,27 g I2, iar constanta de viteza k = 0,42 L /mol s;
b) ce valoare are viteza initiala de reactie, daca masa de hidrogen ramane constanta si se dubleaza masa de iod;
c) ce valoare are viteza initiala, daca se dubleaza atat masa hidrogenului, cat si cea a iodului (temperatura si volumul raman aceleasi). Se cunosc AI = 127 atom/g, AH = 1 atom/g.
. Viteza reactiei A Produsi, la t =250C, are valoarea 9 10-4 mol/L s cand concentratia lui A este 6 10-4 mol/cm3 si are valoarea 7,5 10-4 mol/L s cand concentratia lui A este 5 10-4 mol/cm3. Sa se calculeze:
a) ordinul de reactie;
b) valoarea constantei de viteza, la temperatura de 250C;
c) ce concentratie trebuie sa aiba A pentru ca viteza de reactie initiala sa creasca de 4 ori.
Intr-o reactie monomoleculara A Produsi, la t =250C, timpul in care concentratia initiala scade la 25% este t =52 min. Se cere:
a) calculul constantei de viteza;
b) in cat timp concentratia initiala scade cu 75%;
c) calculul vitezei initiale de reactie, daca concentratia initiala a reactantului este 2,5 mol/L s
Copyright © 2024 - Toate drepturile rezervate