 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Legaturi chimice. Relatii in structura si proprietatile substantelor chimice.
1.Ioni.Legatura ionica (electrovalenta)
Atomii tind sa realizeze configuratii stabile, in marea majoritate a cazurilor de gaz rar (dublet dau octet). Gazele rare sunt singurele specii care se gasesc sub forma de atomi liberi (molecule monoatomice in conditii obisnuite.
Ionii sunt specii de atomi cu sarcina. Ionii negativi sunt specii care rezulta din
atomi prin acceptare de electroni: .![]()
Fenomenul este exoterm, energia eliberata se numeste afinitate de electroni si depinde de raza atomica si de numarul de electroni de pe ultimul strat. Cu cat raza este mai mare cu atat afinitatea de electoni este mai mica (scade puterea de atractie a nucleului). Deci afinitatea de electroni creste intr-o grupa principala a sistemului periodic de jos in sus.
Afinitatea de electroni scade atunci cand un atom accepta mai multi electroni,deoarece se consuma o parte din energia initiala pentru invingerea fortelor electrostatice de respingere dintre electroni. Deci intr-o perioada, afinitatea de electroni, electronegativitatea , creste de la stanga la dreapta. Cea mai mare afinitate de electroni este cea a fluorului (F).
Electronegativitatea unor elemente
H
2,1
LiCN OF
1,0 2,5 3,0 3,5 4,0 valori
masurate in eV.
Na Mg AlP S Cl
0,9 1,2 1,5 2,1 2,5 3,0
1eV/=23,06 kcal/mol( particula)
K Ca Br
0,8 1,02,8
Rb I
0,8 2,5
Cs
0,7
Se observa din studiul valorilor, ca metalele au afinitate foarte mica de electroni, nemetalele au afinitate mare. Ionii pozitivi sunt specii care rezulta din atomi prin cedare de electroni
![]()
Cedarea de electroni se face cu schimb de energie (fenomen endoterm) , care poarta denumirea de energie de ionizare, care depinde de raza si numar de electroni de pe ultimul strat. Energia de ionizare scade cu cresterea razei si creste cu numarul de electroni care trebuie cedati. Deci, in sistemul periodic, energia de ionizare in grupe creste de jos in sus, in perioada creste de la stanga la dreapta. Caracterul metalic (electropozitivitatea) creste in grupe de sus in jos si in perioade de la dreapta la stanga. Elementul cu caracterul metalic cel mai pronuntat (cel mai electropozitiv) este Cs(cesiu).
Energia de ionizare a primului electron (in unele cazuri al celui de-al doilea) pentru unii atomi din grupele principale.
(in kcal/mol)
H He
314565
Li Be B C N O FNe
124214 191 265 334311 403 495
420
Na Mg Al Cl
118175141297
346
KCaBr
99 141 272
274
In teoria electronica elaborata de W.Kossel 1916 si G.N.Lewis 1916, legatura ionica se realizeaza intre elemente cu caracter chimic diferit (metale si nemetale), prin transfer de electroni de la metal la nemetal, intre ionii formati se exercita forte electrostatice de atractie. Rezulta combinatii ionice foarte stabile, substante solide alcatuite dintr-un numar imens de ioni pozitivi si negativi. Numarul total de sarcini negative este egal cu numarul total de sarcini pozitive.
Fiecare ion exercita asupra unor ioni de semn contrar o atractie electrostatica uniform repartizata in toate directiile din spatiu, astfel ia nastere o constructie geometrica , care se numeste retea cristalina.
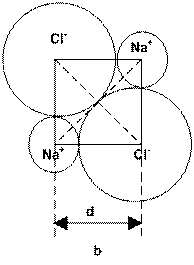
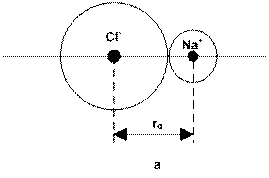
Clorura de sodiu cristalizeaza in retea cubica
compacta care corespunde unei aranjari de sfere inegale (ioni
monoatomici de forma sferica cu raze diferite). Tipul retelei
este determinat de raportul dintre raza cationului si raza anionului. In reteaua
NaCl ![]() . Ambii
ioni au numarul de coordinatie 6, fiecare ion de sodiu este inconjurat de
un octaedru de ioni de clor si fiecare ion de clor de un octaedru de sodiu.
Ionii Cl , cu volum mare, se ating
formand o retea cubica compacta, iar
ionii de Na+
ocupa golurile din aceasta retea.
. Ambii
ioni au numarul de coordinatie 6, fiecare ion de sodiu este inconjurat de
un octaedru de ioni de clor si fiecare ion de clor de un octaedru de sodiu.
Ionii Cl , cu volum mare, se ating
formand o retea cubica compacta, iar
ionii de Na+
ocupa golurile din aceasta retea.

Formarea NaCl din elemente
Na(s) + ½ Cl2(g) → Na+Cl- (s) ΔHg= 98 kcal/mol
Reactia decurge cu o degajare mare de energie (energia de formare) si poate fi considerata ca suma a cinci reactii simple (procese elementare).
Na(s) → Na(g) ΔHsublimeare= 23kcal/mol
Na(g) → Na+(g) +e- INa= 118kcal/mol (energie de ionizare)
½ Cl2(g) → Cl(g) ½ ΔHdisociere= 29 kcal/mol
Cl(g) + e-→ Cl-(g)ACl- = - 83 kcal/mol (afinitate de e-)
Na+(g) + Cl-(g) → Na+Cl - Ur = - 185 kcal/ mol (energie de retea)
Na(s) + ½ Cl2(g) → NaCl(s)ΔHf = - 98 kcal/mol
Transformari care pot fi redate prin ciclul Haber-Born
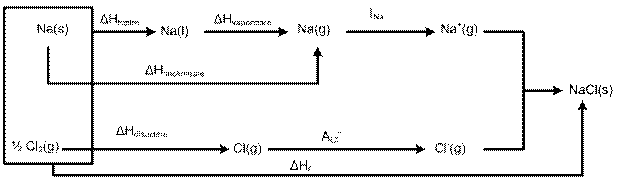
Ciclul Haber-Born a fost utilizat pentru calculul afinitatii de e- a unor atomi cunoscandu-se celelalte energii implicate in ciclu.
Propietatile substantelor ionice:
Substante solide cu stabilitate mare, cu puncte de topire ridicate.
Solubile in solventi polari (H2O), insolubile in solventi nepolari.
Nu conduc curentul electric in stare solida, conduc in solutie sau topitura se pot supune electrolizei).
Cristalele ionice sunt casante.
Categorii de substante ionice
Substante anorganice
-saruri NaCl, K2SO4, Mg(NO3) 2,NH4Cl, Ba3(PO4) 2.
-hidroxizi NaOH, Ca(OH) 2,Al(OH) 3, Fe(OH) 2,Fe(OH) 3.
-oxizi bazici K2O, CaO, AL2O3,Cu2O,CuO.
Substante organice
-sarurile acizilor carboxilici CH3 COONa, (C6H5COO) 2Mg
-alcoxizi, fenoxizi, aceturi CH3 O Na, C6H5OK, NaC ≡CNa
Din exemplele de mai sus rezulta ionii pot fi:
- ioni monoatomici Na+, Ca2+, Cl-,O2- etc;
- ioni poliatomici NH4+, SO42-, CO32-, NO3-etc.
In structura ionilor poliatomici se intalnesc legaturi covalente si uneori legaturi coordinative intre atomii participanti
Copyright © 2024 - Toate drepturile rezervate