 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Factorul esential in cataliza eterogena, il constituie natura suprafetei catalizatorului. Pentru explicarea mecanismului reactiilor acid catalizate, se tine cont de existenta centrelor acide de pe suprafata catalizatorului. Conform principiilor de baza ale catalizei, interactia catalizator - reactant se realizeaza prin intermediul centrelor active si conduce la formarea unor specii intermediare instabile, bogate in energie si foarte reactive. Zeolitii sintetici, considerati acizi anorganici solizi, fac parte din categoria catalizatorilor acido - bazici caracterizati prin existenta pe suprafata lor a centrelor active catalitic, cu caracter acid sau bazic, de tip Brönsted sau Lewis.
Zeolitii sunt materiale unice care, spre deosebire de alti catalizatori, poseda pe suprafata lor intercristalina centre active definite cristalografic. In cazul zeolitilor cu raport Si /Al > 5, centrele active sunt stabile la temperaturi inalte si adesea sufera mici modificari, la interactia cu reactantii sau produsele de reactie.
Acizii Brönsted fiind specii capabile sa cedeze protoni, se mai numesc si acizi protonici si pot fi: molecule neutre, ioni pozitivi sau ioni negativi, iar interactia acid - baza se poate scrie:
![]()
![]() acid A baza B + H +
acid A baza B + H +
Tinand cont de acestea, moleculele bazice adsorbite pe suprafata unui catalizator care poseda astfel de centre, vor fi transformate printr-un mecanism de transfer de protoni, de la catalizatorul solid (centrul Brönsted) la molecula adsorbita.
Acizii Lewis sunt specii capabile sa accepte o pereche de electroni, deci trebuie sa aiba un orbital vacant sau sa si-l faca disponibil la apropierea bazei. Pot fi: cationi metalici, ionul carboniu, Al 3+ etc. Transformarea moleculei adsorbite in acest caz are loc prin transferul unei perechi de electroni de la molecula de reactant catre suprafata catalizatorului (centru acid Lewis). Mecanismul carbocationic poate fi explicat daca se considera ca intermediarii de reactie apar ca urmare a interactiunii dintre moleculele reactante si centrele acide de pe suprafata zeolitului.
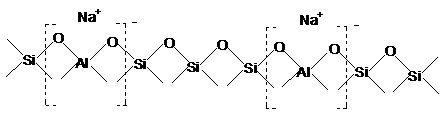 In forma Na+, asa cum rezulta in mod
obisnuit din sinteza, zeolitii nu prezinta centre acide,
reteaua zeolitica putand fi reprezentata astfel:
In forma Na+, asa cum rezulta in mod
obisnuit din sinteza, zeolitii nu prezinta centre acide,
reteaua zeolitica putand fi reprezentata astfel:
Prin inlocuirea ionilor Na+ cu ioni H+ sau cu alti ioni, in general cu mai multe valente, zeolitii se transforma in catalizatori care prezinta centre active cu caracter acid.
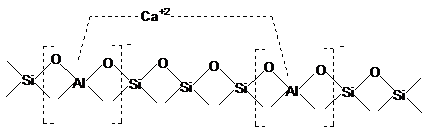 Pe baza datelor experimentale, se considera ca
inlocuirea ionilor Na+ din reteaua zeolitica cu ioni
polivalenti confera acesteia activitate catalitica de tip ion
carboniu care creste odata cu raportul SiO2/Al2O3.
In cazul zeolitilor cu acest raport mic, sarcina negativa
excedentara a fiecarui tetraedru [AlO4]- este
neutralizata de cationii de Na+ asociati, dand o
structura electric neutra. Prin inlocuirea cationilor de Na+
cu cationi di - sau polivalenti, de exemplu Ca2+ acesta se
leaga prin doua valente la distante inegale, fapt care
conduce la o repartitie neuniforma de sarcini, unul din tetraedre
fiind complet neutralizat, iar celalalt cu o sarcina partial
negativa. Astfel suprafata caracterizata prin sarcini
distribuite neomogen, poate favoriza reactii de tip ion carboniu prin
polarizarea legaturilor din moleculele reactante.
Pe baza datelor experimentale, se considera ca
inlocuirea ionilor Na+ din reteaua zeolitica cu ioni
polivalenti confera acesteia activitate catalitica de tip ion
carboniu care creste odata cu raportul SiO2/Al2O3.
In cazul zeolitilor cu acest raport mic, sarcina negativa
excedentara a fiecarui tetraedru [AlO4]- este
neutralizata de cationii de Na+ asociati, dand o
structura electric neutra. Prin inlocuirea cationilor de Na+
cu cationi di - sau polivalenti, de exemplu Ca2+ acesta se
leaga prin doua valente la distante inegale, fapt care
conduce la o repartitie neuniforma de sarcini, unul din tetraedre
fiind complet neutralizat, iar celalalt cu o sarcina partial
negativa. Astfel suprafata caracterizata prin sarcini
distribuite neomogen, poate favoriza reactii de tip ion carboniu prin
polarizarea legaturilor din moleculele reactante.
Calcule detailate au aratat ca intensitatea campului electrostatic al cationului in locuri accesibile reactantului are o astfel de valoare incat poate induce schimbari esentiale in pozitia perechii de electroni participanti din moleculele de reactant adsorbite. Cationul atrage perechea de electroni ce formeaza legatura C - H, inducand sarcini partiale localizate la cele doua elemente participante la legatura. Ca urmare a polarizarii legaturii C - H, atomul de C devine deficitar in electroni servind ca centru activ pentru reactiile de tip ion carboniu iar atomul de hidrogen se comporta ca un ion de hidrura.
Cationii metalici prezenti in structura zeolitilor transforma hidrogenul unei grupe OH, existente la un atom adiacent al retelei sau a moleculei de apa de hidratare a insusi cationului respectiv, in proton disponibil pentru diverse reactii chimice. Polarizarea grupelor OH structurale ca urmare a campului electrostatic al cationilor poate fi reprezentata astfel:

In zeolitii decationizati, natura centrelor active este diferita prin aceea ca nu sunt prezenti cationi metalici care sa polarizeze grupele structurale si moleculele de apa.
Zeolitii sunt folositi drept catalizatori in multe reactii chimice in care indeplinesc rol de catalizator acid Brönsted, catalizator bazic sau catalizator redox. Catalizatorii zeolitici pot fi monofunctionali (acizi solizi Brönsted HZ) sau bifunctionali (acizi solizi Brönsted + metal cu actiune specifica, de ex. hidrogenant /dehidrogenanta, HMZ).
Zeolitii si zeotipii care prezinta capacitate de schimb ionic pot fi transformati in acizi solizi Brönsted prin schimbul ionic total sau partial al cationilor compensatori de sarcina cu protoni. Activitatea de formare a carbocationilor ca intermediari de reactie se datoreaza transferului protonilor din centrele acide Brönsted catre moleculele reactante.
 In cazul
procesarii alcanilor, alchenelor si a cicloalcanilor pe catalizatorii
zeolitici se formeaza ca intermediari ionii de alchilcarbeniu (ce contin atomul de C
tricoordinat incarcat pozitiv in care cei trei substituenti sunt
grupe alchil sau H) sau ionii de alchilcarboniu
(ce contin atomul de C pentacoordinat incarcat pozitiv in care cel
putin un substituent este atomul de H).
In cazul
procesarii alcanilor, alchenelor si a cicloalcanilor pe catalizatorii
zeolitici se formeaza ca intermediari ionii de alchilcarbeniu (ce contin atomul de C
tricoordinat incarcat pozitiv in care cei trei substituenti sunt
grupe alchil sau H) sau ionii de alchilcarboniu
(ce contin atomul de C pentacoordinat incarcat pozitiv in care cel
putin un substituent este atomul de H).
Formarea carbocationilor pe un catalizator zeolitic monofunctional depinde de aciditatea zeolitului si de natura reactantilor:
mecanismul : prin aditia protonului zeolitic la o alchena:
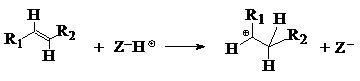
 mecanismul :
aditia protonului zeolitic la un alcan:
mecanismul :
aditia protonului zeolitic la un alcan:
ion alchilcarbeniu
Mecanismele 1 si 2 au loc pe centrele acide Brönsted ale zeolitilor iar mecanismul 1 se realizeaza mult mai rapid decat 2 si la temperaturi joase.
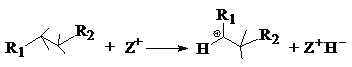 mecanismul
3: extragerea unui ion hidrura (H
mecanismul
3: extragerea unui ion hidrura (H![]() ) dintr-o molecula neutra (ex. alcan):
) dintr-o molecula neutra (ex. alcan):
(mecanismul 3 are loc pe centrele acide Lewis)
 sau de catre un ion carbeniu
R+ adsorbit in porii zeolitului prin transfer bimolecular de ion
hidrura:
sau de catre un ion carbeniu
R+ adsorbit in porii zeolitului prin transfer bimolecular de ion
hidrura:
Catalizatorii zeolitici bifunctionali contin un zeolit in forma hidrogen cu functie acida si un metal cu functie dehidrogenant /hidrogenanta. Componentele cu actiune dehidrogenant /hidrogenanta sunt:
metalele nobile: Pt, Pd, .
unele metale tranzitionale: Ni, Co, . sau post - tranzitionale: Ga, Zn, .
unii oxizi metalici: ZnO, Ga2O3, CuO, NiO, .
unele sulfuri metalice: NiS, Co/MoS, .
unii complecsi metalici.
In cazul procesarii alcanilor daca este prezent si hidrogenul se mareste durata
de lucru a catalizatorului (intre regenerari) cat si activitatea
catalitica. Prezenta H2 reduce ionii Me+n
la Me0 mult mai activ catalitic si previne formarea cocsului.
Metalul cu actiune dehidrogenanta favorizeaza trecerea alcanilor
in alchene iar alchenele prin protonare pe centrele acide Brönsted
formeaza cationii alchilcarbeniu; ionii alchilcarbeniu sufera
rearanjari prin izomerizari si reactii de scindare (in pozitia b) dupa care se desorb sub forma de alchene (n+i).
In prezenta metalului, alchenele sunt hidrogenate astfel
ca final vom avea noi alcani (iso). In procesul de aromatizare a
GPL si in cel de izomerizare a n-alcanilor,
metalul initiaza dehidrogenarea alcanilor la alchenele
corespunzatoare, alchene care apoi trec in arene (
Aciditatea zeolitilor este datorata in principal prezentei centrelor acide Brönsted dar si centrelor acide Lewis care se formeaza in urma unor tratamente termice la temperatura ridicata.
Un centru acid Brönsted este capabil sa transfere un proton (H+) de la zeolit la molecula adsorbita iar un centru acid Lewis este capabil sa transfere o pereche de electroni de la molecula adsorbita la suprafata zeolitului. Centrele acide Lewis se formeaza din centrele acide Brönsted prin eliminarea de apa la temperatura de circa 500 0C :
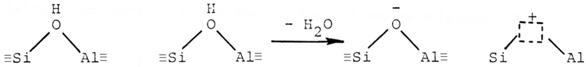
centre acide Brönsted centru acid Lewis
Pentru a descrie aciditatea zeolitilor trebuie sa facem distinctie intre:
natura centrelor acide (centre Brönsted, centre Lewis);
densitatea sau concentratia acestor centre;
taria lor sau distributia centrelor acide dupa taria lor;
locul lor in structura zeolitului.
Aciditatea Brönsted a zeolitilor este datorata grupelor OH ale suprafetei (sSiOHAls) care sunt capabile sa transfere protoni (H+) moleculelor adsorbite. Pentru aceasta trebuie ca grupele OH sa contina protoni mobili.
Grupele OH ale suprafetei zeolitice se pot forma in 4 moduri:
1. schimb ionic direct Na-zeolit cu un acid mineral diluat - HCl, HNO3, CH3COOH. Acest lucru este posibil numai in cazul zeolitilor cu raport Si /Al ridicat (cazul ZSM-5, MOR):
![]()
![]() Na+Z
Na+Z![]() -hidratat + (H+ + Cl
-hidratat + (H+ + Cl![]() )sol H+Z
)sol H+Z![]() -hidratat + (Na+ + Cl
-hidratat + (Na+ + Cl![]() )sol
)sol
2. schimb ionic indirect, mai intai in forma NH![]() sau AlK4N+ si apoi calcinare cu eliminare de NH3.
sau AlK4N+ si apoi calcinare cu eliminare de NH3.
![]()
![]()
![]() Na+Z
Na+Z![]() -hidratat + (NH
-hidratat + (NH![]() + Cl
+ Cl![]() )sol NH
)sol NH![]() Z
Z![]() -hidratat + (Na+ + Cl
-hidratat + (Na+ + Cl![]() )sol
)sol
NH![]() Z
Z![]() -hidratat H+Z
-hidratat H+Z![]() -calcinat + NH3 g
-calcinat + NH3 g
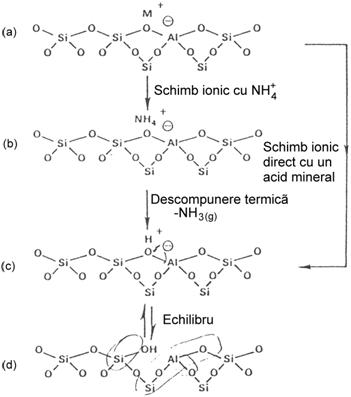 Formarea grupelor OH prin schimb ionic direct (cu acid) sau
indirect (prin intermediar NH
Formarea grupelor OH prin schimb ionic direct (cu acid) sau
indirect (prin intermediar NH![]() ) poate fi reprezentata astfel:
) poate fi reprezentata astfel:
3. prin disocierea apei in campul electrostatic puternic al cationilor di sau trivalenti:
![]() [Me+3(3Z
[Me+3(3Z![]() )(H2O)n]-hidratat [(2Z
)(H2O)n]-hidratat [(2Z![]() )Me+2(OH)]-partial +
(H+Z
)Me+2(OH)]-partial +
(H+Z![]() )-partial
)-partial
![]() deshidratat deshidratat
deshidratat deshidratat
![]()
![]() ex.:[La(H2O)n]+3
+ 3Na+Z
ex.:[La(H2O)n]+3
+ 3Na+Z![]() [La(H2O)n]+3(Z
[La(H2O)n]+3(Z![]() [(LaOH)H2O)]+2H+(Z
[(LaOH)H2O)]+2H+(Z![]()
![]() [La(OH)2] H+)2(Z
[La(OH)2] H+)2(Z![]()
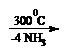
![]()
![]() 4. prin reducerea cu hidrogen
gazos a zeolitilor ce contin cationi ai metalelor tranzitionale
si nobile:
4. prin reducerea cu hidrogen
gazos a zeolitilor ce contin cationi ai metalelor tranzitionale
si nobile:
[Pd(NH3)4]+2
+ 2Na+Z![]() [Pd(NH3)4]+2(Z
[Pd(NH3)4]+2(Z![]() Pd+2(Z
Pd+2(Z![]() Pd0(H+Z
Pd0(H+Z![]()
![]() [Ni+2(Z
[Ni+2(Z![]() ]-deshidratat + H2(g) Ni0(H+Z
]-deshidratat + H2(g) Ni0(H+Z![]() )2-deshidratat
)2-deshidratat
![]() Aciditatea Lewis a
zeolitilor este pe de o parte datorata cationilor metalici (M+n)
care au abilitatea de a extrage o pereche de electroni de la o molecula de
reactant dupa ce in prealabil au fost calcinati la o temperatura
de peste 500 0C:
Aciditatea Lewis a
zeolitilor este pe de o parte datorata cationilor metalici (M+n)
care au abilitatea de a extrage o pereche de electroni de la o molecula de
reactant dupa ce in prealabil au fost calcinati la o temperatura
de peste 500 0C:
[M+2(Z![]() (H2O)n]-hidratat [M+2(Z
(H2O)n]-hidratat [M+2(Z![]() ]-complet deshidratat
]-complet deshidratat
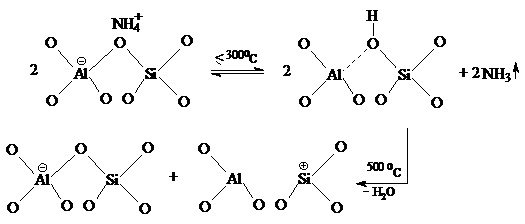 fie prin conversia a cate
doua centre acide Brönsted prin eliminare de apa (dehidroxilare) la
cca. 500
fie prin conversia a cate
doua centre acide Brönsted prin eliminare de apa (dehidroxilare) la
cca. 500
In acest fel apar 2 centre
acide Lewis - un centru pe speciile de Al tricoordinat si unul pe speciile
+Sis si un centru Lewis bazic pe
speciile Al![]() tetraedrice. In conditii normale, o parte din ionii Al
tetraedrice. In conditii normale, o parte din ionii Al![]() ies din retea in extraretea sub forma AlO+ si
compenseaza sarcinile negative ale ionilor Al
ies din retea in extraretea sub forma AlO+ si
compenseaza sarcinile negative ale ionilor Al![]() adiacenti. Se crede ca tocmai speciile extraretea AlO+
sunt centrele acide Lewis.
adiacenti. Se crede ca tocmai speciile extraretea AlO+
sunt centrele acide Lewis.

Prin adsorbtia piridinei,
spectroscopia IR distinge aciditatea Brönsted datorata ionului piridiniu
care vibreaza la 1545 cm![]() de cea Lewis datorata piridinei asociate care vibreaza la 1450 cm
de cea Lewis datorata piridinei asociate care vibreaza la 1450 cm![]()
Grupele OH formeaza 2
benzi de absorbtie: una la cca. ![]() , caracteristica grupelor silanolice terminale sSi-OH si una in regiunea
3600-
, caracteristica grupelor silanolice terminale sSi-OH si una in regiunea
3600-![]() caracteristica aciditatii Brönsted data de grupele sSi-OH-Als
caracteristica aciditatii Brönsted data de grupele sSi-OH-Als
Determinarea numarului si a tariei centrelor acide se realizeaza prin aplicarea mai multor metode si anume:
metode titrimetrice: determinarea aciditatii Hammett (Ho) a zeolitilor folosind ca indicatori o serie de aniline bazice care isi schimba culoarea la o anumita tarie acida; metoda nu poate distinge aciditatea Brönsted de aciditatea Lewis si indica numai aciditatea exterioara a zeolitului intrucat moleculele mari ale indicatorilor Hammett nu pot patrunde in porii zeolitului.
metode bazate pe adsorbtia si desorbtia unor baze: prin masuratori calorimetrice ale caldurii de neutralizare din reactia acid-baza (H-zeolit + NH3), metoda de adsorbtie care necesita mult timp pentru atingerea echilibrului de adsorbtie si prin metoda de desorbtie a unei baze (de ex. NH3) prin desorbtie termoprogramata (TPD).
Desorbtia amoniacului preadsorbit pe
suprafata zeolitica la temperatura programata
furnizeaza date despre concentratia centrelor acide cat si
despre taria acestor centre. Analiza cantitativa a amoniacului
desorbit poate fi realizata prin titrare, cu ajutorul spectrometriei de
masa, prin spectroscopie IR sau prin inregistrare cromatografica cu o
celula de termoconductibilitate. Metoda titrarii
amoniacului, data de catre Kerr, este cea mai sigura. Proba de
zeolit dupa activare termica si purjare cu azot este adusa
in contact cu amoniac gazos care se retine prin adsorbtie fizica
si chimica. Pentru aprecierea centrelor acide si a tariei
lor se ia in consideratie numai amoniacul adsorbit chimic (NH![]() ). Taria centrelor
acide se apreciaza pe baza pierderii de amoniac odata cu
cresterea temperaturii. Temperatura la care se elimina cea mai mare
cantitate de amoniac (TM) este corelata cu taria
acida. Maximul picului de desorbtie (TM) este corelat cu
viteza de incalzire (B) a probei prin relatia:
). Taria centrelor
acide se apreciaza pe baza pierderii de amoniac odata cu
cresterea temperaturii. Temperatura la care se elimina cea mai mare
cantitate de amoniac (TM) este corelata cu taria
acida. Maximul picului de desorbtie (TM) este corelat cu
viteza de incalzire (B) a probei prin relatia:
![]()
in care:
am - cantitatea adsorbita la saturatie
K0 - factorul exponential al vitezei de desorbtie
Ed - energia de activare a desorbtiei
Prin reprezentarea Vdes./timp vs temperatura se obtine curba desorbtiei amoniacului care prezinta unul, doua sau mai multe picuri de desorbtie. In fig. III.1 este prezentat spectrul de desorbtie termoprogramata a amoniacului de pe zeolitul H-ZSM-5 in care raportul Si /Al = 30.
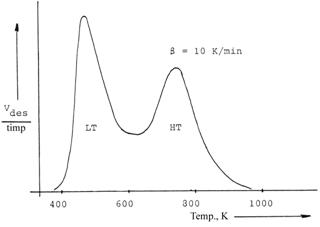
Fig. III.1. Curba desorbtiei termoprogramate a NH3 pe H-ZSM-5 (Si/Al=30) .[11, 15]
Picul de joasa temperatura (LT)
corespunde NH3 desorbit de pe centrele acide slabe (80-
Drept molecula bazica pentru studiul aciditatii prin metoda TPD este utilizata si piridina.
metoda spectroscopiei IR:
a) determinarea grupelor hidroxilice (OH) (aciditatea Brönsted) si corelarea aciditatii cu frecventa de intindere a grupelor OH; cu cat legatura O-H este mai slaba cu atat frecventa de intindere este mai joasa si cu atat taria acida este mai puternica. Pentru zeolitul ZSM-5 cu raportul Si/Al = 30 picul specific grupelor OH mai acide se gaseste la ~ 3605 cm-1; b) determinarea aciditatii prin adsorbtia unei baze, cel mai adesea piridina, cand, in prezenta centrelor acide Brönsted se formeaza ionul piridiniu iar in prezenta centrelor acide Lewis molecula de piridina este legata coordinativ, fiecare legatura avand benzi de absorbtie IR caracteristice in domeniul vibratiilor de deformare : ~ 1545 cm-1 pentru ionul piridiniu chemosorbit si ~ 1465 cm-1 pentru piridina legata pe centrele acide Lewis.
- metoda spectroscopiei RMN : spectrul 1H
Suprafata zeolitica, in special cea interna, are o energie ridicata si chiar la temperatura camerei se inregistreaza un proces lent de "relaxare" prin deplasarea ionilor de oxigen in structura cristalina datorita prezentei vacantelor anionice.
Ca urmare a deplasarii ionilor de oxigen in structura cristalina, centrele acide Brönsted si Lewis capata un caracter dinamic, proprietate specifica numai structurii zeolitice. Centrele acide dinamice de pe suprafata zeolitica accelereaza diverse reactii chimice mult mai eficient decat centrele acide de aceeasi natura si tarie de pe suprafata catalizatorilor amorfi.
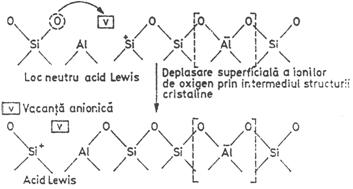
Aciditatea suprafetei zeolitice este puternic dependenta de temperatura. Cresterea temperaturii are ca rezultat scaderea aciditatii protonice si cresterea aciditatii neprotonice.
Desi marea majoritate a rezultatelor experimentale dovedesc ca reactiile accelerate de zeoliti se desfasoara pe centrele active cu caracter acid, totusi sunt mentionate si reactii, cum ar fi cea de rearanjare a tetrahidrofuranului in prezenta de H2S, la tetrahidrotiofen care este accelerata de formele alcaline ale zeolitilor: NaY, LiY, CaY. Piridina, care este otrava pentru catalizatorii cu centre acide, in cazul formelor alcaline favorizeaza unele reactii. Pe baza studiilor prin spectroscopie IR s-a constatat ca centrele acide protonice, responsabile pentru activitatea catalitica in numeroase reactii sunt situate in general in locuri accesibile moleculelor reactante. Independent de natura si localizarea lor, centrele acide sunt influentate de o serie de factori, cum sunt: gradul de schimb al ionilor Na + cu H + sau cu cationi polivalenti, natura cationului de schimb, temperatura si "istoricul" probei. Inlocuirea ionilor de Na + cu H + sau cationi polivalenti duce la cresterea aciditatii suprafetei zeolitului. Taria centrelor acide Brönsted este modificata ca urmare a actiunii polarizante exercitata de campul electrostatic atasat cationului, asupra grupelor hidroxilice.
Aciditatea suprafetei zeolitice este puternic dependenta de temperatura. Cresterea temperaturii are ca rezultat scaderea aciditatii protonice si cresterea aciditatii neprotonice.
Influenta exercitata de temperatura asupra aciditatii la tipuri structurale diferite caracterizate prin rapoarte molare SiO2 /Al2O3 variabile, este mai accentuata fata de tipul structural (H-ZSM-5 < H - MOR < HY) decat de valoarea raportului molar propriu aceluiasi tip structural.
Influenta diferitilor factori asupra tipului si tariei centrelor zeolitice acide este redata in figura III.2.

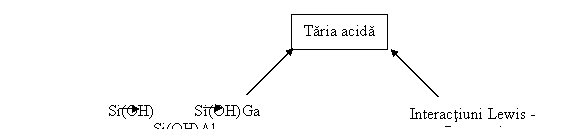
Fig. III 2. Factorii care influenteaza taria centrelor zeolitice acid.
Exista o relatie de
legatura intre unghiul legaturilor T - O -T si protonii
asociati din zeoliti, cresterea valorii unghiului determinand cresterea
aciditatii zeolitilor. Astfel,
centrele protonice din HMOR (unghiul T - O - T = 143 -180 0) si
din zeolitii HMFI (unghiul T - O - T = 133 - 177 0) sunt mai
puternice decat cele din zeolitii HFAU (unghiul T - O - T = 138 - 147 0).
Acest lucru poate
explica de ce zeolitii HMOR la 200 - 250
Un pas hotarator in designul tariei acide a
catalizatorilor zeolitici a constituit-o sinteza metalosilicatilor care
contin in structura alte elemente trivalente (B, Ga, Ge, In) decat
Al. Studiile FTIR si TPD-NH3 efectuate pe metalosilicati
cu structura
B(OH)Si < In(OH)Si << Fe(OH)Si < Ga(OH)Si < Al(OH)Si
Taria centrelor protonice depinde de gradul de
schimb ionic al cationilor Na+ (cu H+ dar nu numai) din
retelele zeolitice, aciditatea creste cu gradul de schimb ionic
(schimbul ionic avansat putand determina o crestere a tariei
centrelor acide deja prezente in structura zeolitilor). Studiile teoretice
si experimentale efectuate asupra influentei raportului Si /Al asupra
aciditatii zeolitilor au condus la concluzia ca taria
centrelor protonice este influentata de natura atomilor vecini.
Fiecare atom de Al din retea este inconjurat de 4 atomi de Si (regula lui
Lowenstein) (atomi nereast neighbors -NN), iar in prima vecinatate de 9-12
atomi de Si sau Al in functie de topologia retelei (next nereast
neighbors-
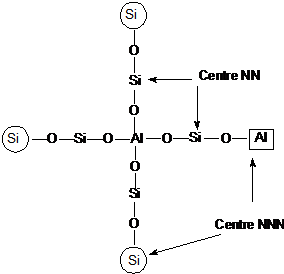
Utilizand
metoda calculelor statistice Wetcher a constatat ca valoarea raportului Si
/Al in care atomii de Al sunt izolati a fost de 7 (pentru zeolitii
avand 9 sau 12 atomi de atomi de Si sau Al in pozitiile
Speciile de Al extraretea rezultate in urma tratamentelor "blande" cu abur, au ca efect cresterea activitatii catalitice a zeolitilor. Cresterea activitatii este atribuita centrelor care prezinta o aciditate marita ca urmare a interactiunilor dintre grupele OH (centrele acide Brönsted) si speciile de Al extraretea (centre acide Lewis).
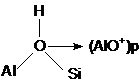
In sprijinul acestei ipoteze vine faptul ca indepartarea speciilor de Al extraretea prin tratamente acide sau cu hexafluorosilicat de amoniu are ca efect scaderea drastica a aciditatii zeolitilor.
Cresterea aciditatii in urma tratamentelor moderate cu abur este rezultatul interactiunilor dintre centrele protonice si speciile de Al extraretea, fapt confirmat in cazul zeolitilor FAU prin aparitia in spectrele IR a doua benzi aditionale la 3600 si 3525 cm-1. Acestea rezulta din deplasarea batocromica a benzilor de inalta si joasa frecventa (caracteristice gruparilor OH localizate in supercavitati si in prismele hexagonale). Aceasta deplasare batocromica este in concordanta cu extragerea unui electron de la gruparile hidroxil legate de speciile extraretea, fapt care conduce la slabirea legaturilor O - H si implicit la cresterea aciditatii.
Un alt factor important pentru activitatea catalizatorilor zeolitici il constituie accesibilitatea centrelor protonice. In mod evident ca, accesibilitatea centrelor acide depinde de localizarea acestora si dimensiunile moleculelor reactante. Astfel, in cazul zeolitilor cu structura tip FAU, centrele protonice situate in supercavitati sunt accesibile pentru majoritatea substantelor organice, comparativ cu centrele situate in prismele hexagonale care nu sunt accesibile moleculelor organice mari. In cazul zeolitilor cu structura tip MOR centrele protonice situate in canalele mai mari vor fi accesibile mai multor molecule organice comparativ cu centrele situate in interiorul "buzunarelor". In cazul zeolitilor HMFI, majoritatea centrelor protonice fiind situate la intersectiile canalelor vor fi egal accesibile sau inaccesibile moleculelor organice in functie de dimensiunile acestora. Acelasi lucru este valabil si in cazul zeolitilor HERI unde desi majoritatea centrelor acide sunt situate in interiorul cavitatilor mari datorita dimensiunilor ferestrelor de acces aceste vor fi disponibile doar moleculelor organice mici.
Molecule situate in interiorul nanocavitatilor zeolitice vor avea proprietatile electronice modificate. Astfel, dipol momentul acetonitrilului creste semnificativ in cazul adsorbtiei acestuia in "buzunarele" mordenitului comparativ cu adsorbtia acestuia in canalele liniare ale aceluiasi zeolit. Moleculele adsorbite in interiorul porilor /cavitatilor zeolitice capata caracter bazic fiind usor de protonat. Se poate spune ca zeolitii actioneaza ca solventi solizi, iar retelele lor anionice actioneaza ca baze conjugate ale protonilor stabilizand intermediarii de reactie pe parcursul mecanismelor concertate de reactie.
Din punct de vedere al catalizei eterogene, o reactie
parcurge mai multe etape, astfel ca reactantii, in urma accesului in
structura, trebuie sa difuzeze pana in
spatiile cu proprietati catalitice si sa se
adsoarba. In aceasta situatie, se formeaza un intermediar activat care apoi reactioneaza spre
produsii finali, care se desorb si trebuie sa poata difuza
prin
Accesul moleculelor reactante
si probabilitatea formarii moleculelor de produs sunt determinate in
principal de dimensiunile dar si de configuratia moleculelor
(selectivitate de forma). Termenul de selectivitate de forma a fost
introdus de catre Weisz si Frillete pentru a descrie comportarea
neasteptata a zeolitului LTA schimbat ionic cu Ca2+ ( CaA); la 260
In tabelul III.1 este prezentat un scurt istoric al catalizei selective de forma. Se pot distinge mai multe tipuri de selectivitate de forma, depinzand fie de dimensiunea limita a ferestrei de acces in pori a moleculei de reactant, fie de posibilitatea eliminarii din pori a produsului de reactie, fie de posibilitatea aparitiei anumitor stari de tranzitie.
Tabelul III.1. Scurt istoric al catalizei selective de forma.
|
1925 - primul efect de sita moleculara (adsorbtia pe chabazit; 1932 - sita moleculara - material poros care actioneaza ca sita la scara moleculara; 1960 - cataliza selectiva de forma pe site moleculare; 1966 - termenul de cataliza selectiva de forma apare in Enciclopedia of Chemistry; 1968 - primul proces comercial selectiv de forma Selectoforming pe erionit natural; 1967 - sinteza zeolitului ZSM-5
la firma Mobil Oil face posibila punerea in practica a mai multor
procese selective de forma ( 1968 - selectivitatea de stare de tranzitie; 1970 - efectul concentratie reactantilor in porii catalizatorilor zeolitici, 1984 - efectul "cuibar" - efectul "capcana"; 1991 - cataliza la gura porilor; 1995 - mecanism de tip "cheie - broasca" |
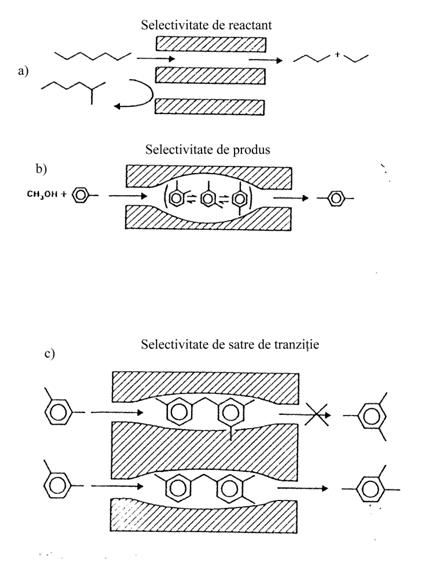
Selectivitatea reactantului apare atunci cand numai o parte din moleculele reactante sunt suficient de mici pentru a putea difuza in porii catalizatorului (fig. III.3.a).
Selectivitatea
la eliminarea produsului apare atunci
cand o parte din produsii formati in
Selectivitatea restrictiva a starii de tranzitie apare cand anumite reactii sunt impiedicate deoarece starile de tranzitie corespunzatoare ar avea nevoie de mai mult spatiu decat cel disponibil in cavitati (fig. III.3.c).
Controlul traficului molecular apare in zeolitii cu mai mult de un sistem de canale. In acesti zeoliti, reactantul este admis preferential in pori printr-un sistem de canale iar produsii sunt eliminati prin alt sistem de canale. Contra - difuzia este astfel minima (fig.III.3.d).
Conceptul de selectivitate de stare de tranzitie fost propus de catre Csicsery pentru a explica de ce nu se formeaza trialchilbenzeni simetrici in cazul disproportionarii dialchilbenzenilor pe H-MOR, desi difuzia acestora prin porii catalizatorului poate avea loc. Odata cu descoperirea zeolitilor cu pori medii si in special a zeolitului ZSM-5 cercetarile in domeniul catalizei selective de forma pur si simplu au "explodat", aplicatiile catalizei pe zeoliti cunoscand o expansiune extraordinara.
Majoritatea reactiilor catalizate de zeoliti au loc in interiorul porilor si /sau cavitatilor zeolitice intracristaline ale acestora. Cu alte cuvinte catalizatorii zeolitici pot fi considerati ca fiind o succesiune de reactoare nano si /sau moleculare, activitatea, selectivitatea si stabilitatea acestora depinzand intr-o masura mai mare sau mai mica de deschiderile (diametrele) porilor si cavitatilor, selectivitatea de forma fiind o caracteristica generala a acestora.
d)
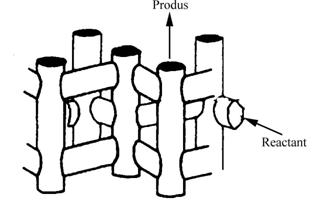
Controlul traficului molecular
Fig. III.3. Cataliza selectiva de forma: a) selectivitate de reactant; b) selectivitate la eliminarea produsului; c) selectivitate restrictiva a starii de tranzitie; d) trafic molecular.
Trebuie subliniat faptul ca, centrele active situate pe suprafata externa a cristalitelor zeolitice, desi sunt prezente intr-un numar mic comparativ cu centrele situate in porii sau cavitatile zeolitice (sub 1 % pentru cristalele de 1 m lungime) sunt implicate in reactiile catalitice, in general prezenta acestora avand ca efect scaderea selectivitatii de forma. Insa, studii recente au pus in evidenta faptul ca reactiile care au loc pe suprafata externa a catalizatorilor zeolitici si /sau la gura porilor sunt foarte selective, sugerandu-se existenta unei "selectivitati de forma" in functie de natura substratului.
In separarea moleculelor dupa dimensiuni in cazul catalizei pe zeoliti un rol hotarator il are natura acestora, respectiv arhitectura porilor. Intr-o forma simplista cataliza selectiva de forma se poate defini ca imposibilitatea unor molecule din amestecul de reactanti de a accede in interiorul porilor (selectivitate de reactant) sau a unor molecule de produsi de reactie de a parasi porii (selectivitatea de produs). In practica insa, selectivitatea de reactanti sau produsi nu se manifesta doar in cazul in care moleculele au dimensiuni mai mari decat diametrul porilor (excludere dupa dimensiuni) ci si atunci cand vitezele de difuzie ale acestora sunt mai mici decat ale altor molecule (pentru valori concludente diferentele de selectivitate dintre molecule participante la reactie trebuie sa fie de cel putin doua ordine de marime). Diferentele dintre vitezele relative de reactie si difuzie sunt datorate interactiunilor de natura fizica si chimica dintre speciile participante la transformarea chimica.
In cazul in care dimensiunile moleculelor participante la reactie sunt apropiate de diametrul porilor zeolitici se realizeaza un nou tip de difuzie (diferita de difuzia Knudsen sau difuzia moleculara), denumita difuzie configurationala care poate aduce modificari importante ale difuzivitatii. Astfel, pe zeolitul CaA, difuzivitatea trans - 2 - butenei este de 200 de ori mai mare comparativ cu cea a cis - 2 - butenei, desi diferenta dintre dimensiunile celor doi izomeri este de doar 0,2 Ǻ.
Natura suprafetelor intracristaline ale zeolitilor difera foarte mult de la puternic hidrofila (in cazul zeolitilor cu raport Si /Al mic) la slab hidrofila (hidrofoba) (pentru zeolitii cu raport Si /Al mare), fapt care influenteaza in mod semnificativ adsorbtia moleculelor polare si nepolare.
Selectivitatea de reactant a stat la baza punerii in practica a procesului Selectoforming. n-Alcanii din benzina usoara (n-C5 si n-C6) pot patrunde in interiorul porilor erionitului fiind transformate in propan si butan, iar moleculele izo-alcanilor corespunzatori nu vor suferi nici o transformare.
Selectivitatea de produs joaca un rol hotarator intr-o serie de procese tehnologice de obtinere a p - dialchilbenzenilor cum ar fi: disproportionarea selectiva a toluenului (SDTP), alchilarea toluenului cu etena /etanol. In toate aceste procese pe langa p-xilen, care este produsul majoritar, se formeaza si o- si m-xilenul, dar datorita dimensiunilor acestia nu pot difuza prin porii catalizatorilor zeolitici (ZSM-5) spre suprafata externa a cristalitelor zeolitice.
Pe zeolitul ZSM-5 modificat, in cazul reactiei de disproportionare a toluenului, care are loc la temperaturi ridicate, coeficientul de difuzie al p-xilenului este de cateva ori mai mare comparativ cu cei ai o - si m - xilenului. Cu alte cuvinte in cazul sintezei di-alchilbenzenilor izomerii orto si meta mai voluminosi vor suferi rapid reactii de izomerizare, transformandu-se in izomeri para eliminandu-se in felul acesta din porii catalizatorului.
In alte cazuri moleculele voluminoase se transforma cu viteze foarte mici in molecule cu diametre cinetice care sa nu le permita difuzia prin porii catalizatorilor zeolitici, iar prin acumularea acestora se formeaza cocsul, care produce dezactivarea acestora. In cazul cocsarii zeolitilor de tip MOR a fost propus asa - numitul mecanism al selectivitatii inverse: moleculele ramificate formate in supercavitati (care au diametrul de 1,3 nm) nu pot difuza prin porii de acces care au diametrul de 0,7 nm, in felul acesta se formeaza cocsul care limiteaza /blocheaza accesul moleculelor reactante spre centrele active.
Selectivitatea datorata efectului de sita moleculara, depinde de: vitezele relative de difuzie si de reactie, de dimensiunile moleculelor implicate in reactiile respective precum si de caracteristicile centrelor active (concentratia, numarul si taria acestora). In mod evident viteza de difuzie depinde de dimensiunea cristalitelor zeolitice, respectiv de dimensiunea "drumului de difuzie". Imbunatatirea selectivitatii catalizatorilor zeolitici se poate realiza prin alegerea unor conditii de lucru adecvate (temperatura are un rol hotarator asupra vitezei de reactie) si /sau prin ajustarea caracteristicilor acestora. De exemplu, in cazul disproportionarii toluenului, selectivitatea catalizatorului HZSM-5 fata de p - xilen este marita prin depunerea pe suprafata exterioara a cristalitelor zeolitice de Si, Mg, cocs, etc., care limiteaza desorbtia izomerilor meta si orto; acest efect este datorat partial si dezactivarii selective a centrelor acide situate pe suprafata externa a cristalitelor.
Selectivitatea de stare de tranzitie (spatioselectivitatea) apare atunci cand formarea intermediarilor de reactie sau a starilor de tranzitie, este limitata de spatiul disponibil din jurul centrelor active in general si de spatiul din porii zeolitici in particular. Cu alte cuvinte, spatioselectivitatea depinde de dimensiunile si forma: porilor, de dimensiunile intersectiilor acestora si a cavitatilor zeolitice. Selectivitatea de stare de tranzitie a fost propusa pentru prima data de catre Csicsery pentru a explica absenta 1 - trialchilbenzenilor in produsii de disproportionare a dialchilbenzenilor pe H-MOR, desi dimensiunile acestora le permit sa difuzeze prin porii zeolitici. Spatiul disponibil din canalele zeolitului H-MOR nu este suficient de mare pentru a gazdui intermediarii de tip difenilmetan, implicati in formarea 1 - trialchilbenzenilor, care sunt mai voluminosi decat cei implicati in formarea 1,2,3 - si 1,2,4 - trialchilbenzenilor.
Spre deosebire de selectivitatea datorata efectului de sita moleculara, spatioselectivitatea nu depinde de viteza de reactie si /sau difuzie. Acest lucru este evidentiat de faptul ca modificarea dimensiunilor cristalitelor zeolitice nu afecteaza spatioselectivitatea, dar influenteaza in mod hotarator selectivitatea datorata proprietatilor de sita moleculara. Cele doua tipuri de selectivitate pot actiona simultan ca in cazul izopropilarii naftalinei pe H-MOR.
Avand in vedere ca marea majoritate a compusilor sufera simultan transformari monomoleculare (intramoleculare) si /sau bimoleculare (intermoleculare), atunci este usor de inteles faptul ca forma si dimensiunile spatiului in care se afla situate centrele active influenteaza in mod hotarator selectivitatea acestor transformari. Starile de tranzitie (intermediare) corespunzatoare reactiilor bimoleculare sunt mai voluminoase decat cele corespunzatoare reactiilor monomoleculare si in consecinta primele reactii sunt mai sensibile la constrangerilor sterice exercitate de catre peretii porilor zeolitici asupra intermediarilor de reactie. Acest fapt explica rolul cheie jucat de structura porilor zeolitici asupra selectivitatii in foarte multe transformari chimice. Un exemplu in acest sens il constituie izomerizarea selectiva a xilenilor pe zeolitii HZSM-5, cand intermediarii de reactie voluminosi rezultati din reactiile secundare nu se pot forma la intersectiile porilor. In cazul in care o reactie poate avea loc atat printr-un mecanism monomolecular cat si bimolecular, importanta celui de al doilea scade cu dimensiunea spatiului din jurul centrelor active. Spatioselectivitatea joaca un rol important in formarea produsilor cu masa moleculara mare, implicati in formarea cocsului, deoarece mecanismul de formare al acestuia presupune mai multe etape bimoleculare (condensare, transfer de hidrogen, etc.) foarte sensibile la constrangerile sterice exercitate de peretii porilor si /sau cavitatilor. Cu alte cuvinte formarea cocsului este influentata pe de o parte de dimensiunea si forma porilor si /sau cavitatilor iar pe alta parte de selectivitatea de forma inversa.
Selectivitatea de forma si concentratia moleculelor din porii catalizatorilor zeolitici. Interactiunile dintre moleculele organice si peretii porilor sunt foarte puternice (fiind caracterizate de izoterme de tip I, Langmuir) astfel incat, zeolitii pot fi considerati ca fiind solventi solizi. Concentratia reactantilor in microporii zeolitici este considerabil mai mare decat in faza gazoasa, fapt care are o influenta pozitiva asupra vitezei de reactie, efect care este mai pronuntat odata cu cresterea ordinului de reactie, fiind favorizate reactiile bimoleculare comparativ cu cele monomoleculare.
Concentratia moleculelor reactante din porii zeolitici este responsabila in mare parte si de faptul ca zeolitii sunt mai activi comparativ cu ceilalti catalizatori conventionali. Un astfel de exemplu il constituie catalizatorul de cracare catalitica REHY utilizat in procesul FCC (cracare catalitica in strat fluidizat), care in functie de natura hidrocarburilor din materia prima este de 10 -10.000 ori mai activ decat catalizatorii amorfi de alumino - silice; selectivitatile obtinute sunt de asemenea total diferite, benzina obtinuta pe catalizatorii zeolitici fiind bogata in hidrocarburi aromatice si alcani fata de cea obtinuta pe Al2O3 . SiO2 care este bogata in naftene si alchene. Aceasta modificare drastica a selectivitatii este datorata raportului diferit dintre vitezele reactiilor de transfer de hidrogen (bimoleculare) si cea reactiilor de cracare, care este mult mai mare pe zeoliti decat pe alumosilice. Randamentele mai mari in benzina obtinute pe catalizatorii zeolitici se datoreaza in primul rand faptului ca hidrocarburile aromatice si alcanii sunt mai refractare fata de reactiile de cracare secundare.
In unele cazuri concentratiile mari ale unuia dintre reactanti in porii catalizatorilor zeolitici pot determina aparitia unor reactii nedorite. Un astfel de exemplu este cel al alchilarii i-butanului cu butene, reactie in care zeolitii s-au dovedit foarte eficienti, insa datorita faptului ca alchenele sunt mai puternic adsorbite in porii zeolitici comparativ cu alcanii, paralel cu reactiile de alchilare au loc si reactiile de cocsare si oligomerizare. Pe langa tipurile de selectivitate mai sus mentionate au fost propuse si alte tipuri.
Efectul de cavitate sau efectul ferestrei a fost propus de catre Gorring pentru a explica efectul de "neliniaritate" al catenei in cazul hidrocracarii n-alcanilor pe zeolitii T, chabazit si erionit. Astfel, in cazul cracarii n-C22 pe erionit se observa doua maxime in distributia moleculelor produsilor de reactie in functie de numarul atomilor de C la 4 si respectiv 11 si un minim la C 8, iar valorile difuzivitatilor se modifica in mod corespunzator (cu cel putin doua ordine de marime) de la minim la C 8 la maxim la C 4 si C11. Cu alte cuvinte pentru a se obtine selectivitati cat mai mari trebuie avute in vedere si dimensiunile si structurile moleculelor reactante si produsilor de reactie.
Conceptul de control al traficului molecular a fost propus de catre Derouane
si Gabelica pentru a explica absenta efectelor contradifuziei in
cazul conversiei metanolului pe zeoliti
Fraenkel si colab. au fost primii care au sugerat implicarea suprafetei
externe a catalizatorilor zeolitici in cataliza selectiva de forma.
Astfel, centrele acide localizate pe semicavitatile de pe
suprafata externa a zeolitilor HMFI, sunt responsabile pentru
formarea 2,6 - si 2,7 - dimetilnaftalinei in cazul reactiei de
metilare a naftalinei (efect "cuibar" - nest efect). Aceasta idee a fost
respinsa pe baza rezultatelor de adsorbtie, insa efectul de
cuibar a fost propus recent din nou pentru a se explica selectivitatea de
forma a sitei moleculare
Posibilitatea desfasurarii reactiilor chimice pe suprafata externa a catalizatorilor zeolitici, mai exact la "gura porilor" a fost avansata pentru prima data de catre Martens si colab. pentru a explica selectivitatea neobisnuita manifestata de unii zeoliti cu pori medii (ZSM-22 - TON) in reactia de izomerizare a n-alcanilor cu catene lungi. Pe Pt-HZSM-22 reactia decurge cu selectivitate mare fata de izomerii monoramificati desi, acestia nu se pot desorbi din canalele monodimensionale inguste ale zeolitului.
Cataliza la "gura porilor" poate fi de asemenea responsabila de izomerizarea selectiva a n-butenei la i-butena pe HFER. In acest caz, compusii hidrocarbonati captati in porii din vecinatatea suprafetei externe au fost considerati ca fiind speciile active.
Ulterior, s-a constatat ca reactiile secundare de ramificare a n-alcanilor pe Pt-HTON au loc in pozitii determinate de deschiderile porilor de pe suprafata externa a cristalitelor zeolitice. Acest tip de selectivitate a fost denumita selectivitate de tip "cheie - broasca /yala) fiind asemanatoare cu cataliza enzimatica. Acest concept a fost utilizat de catre Derouane si Vanderveken pentru a explica aromatizarea selectiva a n-C6 pe Pt-LTL, "efectele de captivitate" a intermediarilor de reactie in interiorul porilor cu structura specifica zeolitului LTL fiind considerate responsabile pentru conversia selectiva a n-hexanului in benzen.
Zeolitii, sunt total deosebiti de alte tipuri de catalizatori prin aceea ca centrele lor acide, se gasesc situate pe suprafata intracristalina (in cavitati si canale) si sunt asociati cu atomii de Al coordinati tetraedric din reteaua cristalina.
Aciditatea zeolitilor cu
pori medii si raport SiO2 /Al2O3 mare,
pare la prima vedere o problema mult mai usor de elucidat, mai
putin complicata. Astfel, chiar din 1980, Olson, a gasit, pentru probe de zeolit
HZSM-5 cu raport molar SiO2/Al2O3 cuprins
intre 35-60.000 (![]() 15 ppm Al), ca intre activitatea catalitica si numarul
de centre acide (protonice) se stabileste o variatie liniara
(fig.III.4.). La acest rezultat s-a ajuns
folosind asa numitul test
15 ppm Al), ca intre activitatea catalitica si numarul
de centre acide (protonice) se stabileste o variatie liniara
(fig.III.4.). La acest rezultat s-a ajuns
folosind asa numitul test ![]() .
.


![]()
![]()
![]() 200 2,0
200 2,0
![]()
![]()
![]()
![]() 150
150
![]()
![]()
![]() 1,0
1,0
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Semnal RMN-27Al 100 x[Al/(Al+Si)], RMN
![]()
![]() Fig. III.4 Relatia intre
activitatea catalitica, analiza elementara si semnalul Al
Fig. III.4 Relatia intre
activitatea catalitica, analiza elementara si semnalul Al ![]() ) functie de semnalul relativ Al
) functie de semnalul relativ Al
Relatii
asemanatoare au fost gasite pentru alte reactii acid
catalizate de acesti zeoliti, si anume: disproportionarea
toluenului, conversia metanolului la hidrocarburi, dezalchilarea
etilbenzenului, izomerizarea ciclopropanului, izomerizarea, xilenului, cracarea
cumenului.Rezultatele obtinute prin analiza elementara, spectroscopie
IR, TPD, Al
Informatii asupra sistemului de pori al zeolitilor au fost obtinute prin folosirea unor molecule reactante model si calcularea valorii indicilor respectivi.
Indicele de constrangere (CI): tine seama de selectivitatea pentru reactant .
Reactia test consta in cracarea amestecului 1 : 1 de n-hexan si 3-metilpentan in faza gazoasa.
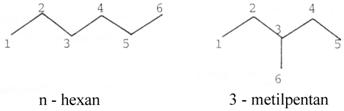
In functie de marimea porilor , viteza relativa de cracare a n-hexanului va fi diferita de viteza relativa de cracare a 3-metilpentanului.
Indicele de constrangere se
defineste astfel:![]()
CI = ![]()
si presupunand pentru cele doua reactii de cracare o cinetica de ordin 1, relatia devine :
CI = ![]()
Testul este sensibil pentru zeolitii cu pori medii ( de ex. ZSM-5) si insensibil pentru zeolitii cu pori largi.
Valorile CI pentru cele trei
clase de zeoliti in functie de marimea porilor sunt: CI < 1 - zeoliti cu pori largi (inele de ![]()
![]()
![]() si
si ![]() - atomi T)
- atomi T)
1 < CI < 12 - zeoliti cu pori
intermediari (medii) (inele de ![]() atomi T)
atomi T)
CI > 12 - zeoliti cu pori
mici (inele de ![]()
![]() si
si ![]() atomi T).
atomi T).
Valorile CI calculate la o anumita temperatura pentru un numar de zeoliti sunt prezentate in Tabelul III.2.
|
Zeolitul |
CI |
Inel, Ĺ |
Temp. |
ZSM-5ZSM-12 ZSM-22 ZSM-23 ZSM-48 Beta Erionit |
10T12T 10T 10T 12T 12T 12T 12T 8T |
Indicele de constrangere rafinat (
Reactia test consta in conversia n-decanului pe un catalizator zeolitic bifunctional in forma hidrogen cu 1 % Pt.
Indicele de constrangere rafinat se defineste ca raportul intre concentratia 2-metilnonanului si a 5-metilnonanului rezultati la izomerizarea a 5% din n-decan :
![]()
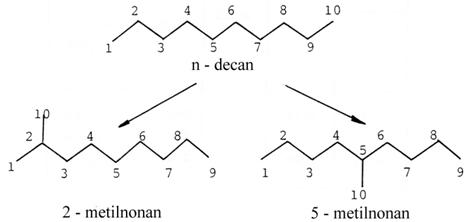
Testul este eficient pentru
caracterizarea zeolitilor cu pori medii (cu inel de 10 atomi T).
Spatiul necesar pentru formarea 5-metilnonanului este mai mare decat in
cazul 2-metilnonanului astfel ca valoarea ![]() T) si cu pori medii (
T) si cu pori medii (![]() T) sunt prezentate in Tabelul III.3 .
T) sunt prezentate in Tabelul III.3 .
Tabelul
III.3. Valorile
|
Zeoliti cu inele 12 T |
Zeoliti cu inele 10 T |
||||||
|
Zeolitul |
|
Zeolitul |
|
Zeolitul |
|
Zeolitul |
|
|
L Omega UsyY ZSM-3 CSZ-1 |
SAPO-37SAPO-5Beta Phi Mor OFF |
ZSM-25 ZSM-12ZSM-11ZSM-48 ZSM-5 |
ZSM-35FER ZSM-23 ZSM-22 SAPO-11 | ||||
Corespondenta dintre
valorile

Fig. III.5.
Corespondenta dintre valorile
Indicele de spatialitate (SI): tine seama de selectivitatea starii de tranzitie.
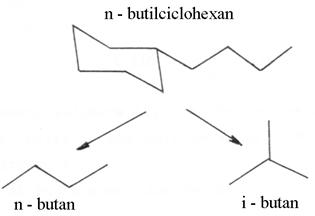 Reactia test consta in
hidrocracarea pe un catalizator zeolitic bifunctional a n-butilciclohexanului cu
formarea n-butanului si a izo-butanului; starea de tranzitie pentru
formarea izo-butanului este mai voluminoasa (necesita mai mult
spatiu) decat cea a n-butanului.
Reactia test consta in
hidrocracarea pe un catalizator zeolitic bifunctional a n-butilciclohexanului cu
formarea n-butanului si a izo-butanului; starea de tranzitie pentru
formarea izo-butanului este mai voluminoasa (necesita mai mult
spatiu) decat cea a n-butanului.
Disponibilitatea spatiului din sistemul de pori al zeolitului pentru o reactie catalitica sau alta este definita prin raportul dintre cantitatile de i-butan si n-butan formate, respectiv prin indicele de spatialitate:
Testul este eficient pentru caracterizarea zeolitilor cu pori largi cu inel de 12 atomi T; SI creste cu cresterea latimii porului si este sensibil la modificarea geometriei volumului liber intracristalin al zeolitului.
Valorile SI pentru unii zeoliti cu pori largi si cu pori medii sunt prezentate in figura III.6.

Fig. III.6 Valori ale indicelui de spatialitate (SI) pentru unele structuri zeolitice.
Zeolitul ZSM-5 este caracterizat si de un nou tip de selectivitate de forma numita "selectivitate spatiospecifica" sau selectivitatea starii de tranzitie, pentru a o deosebi de stereospecificitate. Aceasta apare cand intermediarii de reactie sunt mai voluminosi decat reactantii si produsii de reactie suficient de mici pentru a difuza din pori. Este independenta de marimea cristalului si de aciditate, dar depinde de diametrul porilor si structura zeolitului. Joaca un rol major in cracarea selectiva a parafinelor pe ZSM-5 precum si in alte procese din industria petrochimica.
Selectivitatea - para este un tip unic de selectivitate de forma intalnita la zeolitul HZSM-5 si se manifesta in reactiile de substitutie electrofila, cum ar fi alchilarea si disproportionarea alchil - aromatelor.
Pentru a obtine o buna selectivitate - para este necesar sa se indeplineasca conditia:
1/k « R2D (III.1)
unde: k -
R - raza cristalului;
D - difuzivitatea speciei cu cea mai lenta viteza de difuzie.
Caracteristicile de difuzie ale unui catalizator pot fi modificate printr-un numar mare de tehnici, fara alterarea activitatii si marimii cristalelor. Haag si colab. au propus un model de determinare cantitativa a selectivitatii - para pentru o mare varietate de catalizatori zeolitici de tip ZSM-5 modificati si nemodificati.
Modificarea zeolitilor sintetizati prin diverse tehnici permite controlul asupra aciditatii si /sau selectivitatii de forma a unei anumite structuri zeolitice.
Se deosebesc patru feluri de modificari:
- modificari structurale in care se schimba raportul SiO2/M2O3 (M = Al sau Fe, B, Ga, etc.) ceea ce duce la modificarea aciditatii; se realizeaza prin tratament cu vapori de apa;
- modificari ale suprafetei cristaline - marimii porilor - prin adaugarea unor specii mari organometalice care nu pot intra in sistemul de pori;
- modificari interne ale porilor care pot bloca sau modifica centrele acide si /sau modifica diametrul intern al porilor;
- prin adsorbtia unor hidruri metalice mici urmata de descompunere.
Modificarea activitatii si marimii porilor zeolitilor se poate realiza prin:
activitatea dimensiunea porilor
- prin schimb ionic da da
- tratament cu acizi minerali da uneori
- tratament cu vapori de apa da se formeaza mezopori
- extractie cu EDTA da se formeaza mezopori
- silizare cu Si Cl4 da se formeaza mezopori
- tratament cu (NH4)2SiF6 da se formeaza mezopori
- tratament cu HF da se formeaza mezopori
adsorbtie de molecule organice da da
- formare de cocs da da
- tratament cu organometalice uneori da
- realuminare (da) ?
Metode de preparare a zeolitilor cu Al excedentar.
Dealuminarea zeolitilor FAU-Y;
tratament hidrotermal asupra NH4Y cu formarea zeolitului ultra stabil: USY;
tratamente chimice:
- cu agenti chelatizanti [EDTA, ACAC (acetilacetona etc.)];
- reactie cu CrCl3 in solutie;
- reactie cu (NH4)2SiF6 in solutie;
- reactie cu SiCl4 in stare de vapori;
- reactie cu F2 (gaz);
tratament hidrotermal si chimic asupra USY:
- cu acizi (HCl, HNO3,etc.);
- cu baze (NaOH);
- cu saruri (KF,etc);
- cu agenti chelatizanti (EDTA, ACAC (acetilacetona etc.).
Dealuminizarea MOR si a altor zeoliti inalt siliciosi
tratamente chimice:
- reactie cu acizi (HF, HCl, etc.);
- reactie cu SiCl4 in stare de vapori;
- reactie cu (NH4)2SiF6 in solutie;
- reactie cu F2 (gaz);
tratamente hidrotermale si chimice:
- spalarea acida si cu tratamente cu vapori;
- spalari repetate acide si tratamente cu vapori.
Modificarea structurii retelei zeolitice in vederea cresterii stabilitatii termice, in paralel cu cresterea continutului de Al din retea, a condus la cresterea activitatii catalitice a zeolitilor respectivi. Acest lucru a fost observat de catre Kerr si colab. pentru zeolitul FAU-Y, de catre Mirandatos si Bathomeuf pentru mordenit, de catre Lago si colab., Haag si Lago pentru zeolitul ZSM-5. Multitudinea tehnicilor de modificare, pe de o parte, si efectele diferite ale acestora, pe de alta parte, fac dificila alegerea celei mai potrivite cai de dealuminare a zeolitilor. In tabelul III.5 sunt redate sumar efectele diferitelor tratamente asupra compozitiei suprafetei unor zeoliti.
Tabelul III.5. Compozitia suprafetei si adancimea de dealuminare a unor zeoliti.
|
Tratament |
Profilul /adancime de dealuminare |
|
Cu vapori de apa Acid (MOR si ZSM-5) Vapori de apa + acid (MOR si ZSM-5) Vapori de apa + acid (Y) EDTA SiCl4 (NH4)2F6 |
Suprafata bogata in Al Suprafata deficienta in Al Suprafata deficienta in Al Distributie aproape uniforma Suprafata deficienta in Al Suprafata bogata in Al Distributie aproape uniforma |
In cazul zeolitilor HZSM-5 activitatea catalitica
creste numai daca tratamentul cu vapori de apa se face la
presiuni scazute (sub
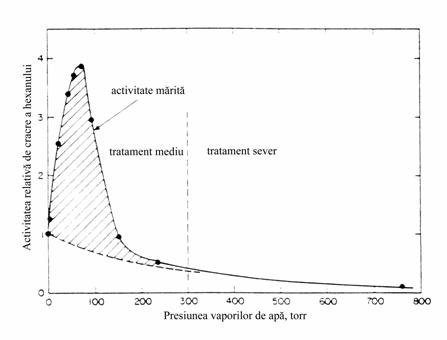
Fig. III.7 Efectul presiunii vaporilor de apa asupra activitatii de cracare a n-hexanului pentru zeolitul HZSM-5 cu SiO2/Al2O3 = 70.
Cataliza eterogena, aplicata azi in cele mai variate reactii chimice, foloseste o mare varietate de catalizatori, dintre care, o categorie deosebit de importanta o constituie catalizatorii zeolitici. Sub denumirea de zeoliti se intelege una din cele mai variate si mai intinse familii de minerale din clasa tectosilicatilor, formata din retele tridimensionale, continue de tetraedre [SiO4] si [AlO4]-, ce alcatuiesc un schelet rigid, deschis, incluzand in general cationii care neutralizeaza sarcina negativa excedentara a tetraedrelor de Al si molecule de apa.
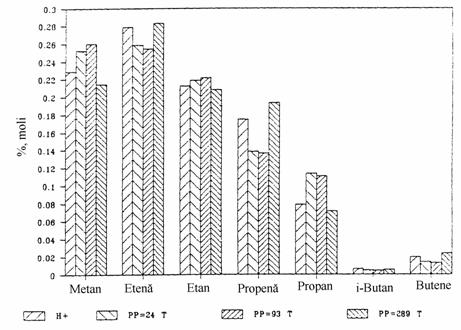
Fig. III.8. Comparatie intre produsii de reactie la cracarea n-butanului pe HZSM-5 tratat cu vapori de apa sub mai multe presiuni partiale: 24, 93 si 289 torr.
Smith defineste zeolitii ca fiind "aluminosilicati cu structura reticulara in care sunt incluse cavitati ocupate de ioni si molecule de apa, care dispun de o considerabila libertate de miscare, permitand schimbul ionic si deshidratarea treptata si ireversibila". In urma proceselor de deshidratare, zeolitii capata proprietati de sorbtie deosebite, putand permite intrarea in porii si cavitatile lor a unor atomi sau molecule cu dimensiuni critice mai mici decat ale acestor cavitati, fapt care le-a dat denumirea de "site moleculare zeolitice". In acest mod ei devin adsorbanti cristalini cu buna selectivitate si eficacitate. Ca urmare a capacitatii de schimb ionic, ei pot accepta in structura lor cationi ai metalelor divalente si tranzitionale, fapt care permite utilizarea lor ca suporturi active la obtinerea catalizatorilor. In plus, proprietatile acide ale carcasei zeolitice, pe de o parte si cationii de schimb pe de alta parte, le confera caracter de catalizatori bi- sau polifunctionali. Acesti catalizatori au o serie de caracteristici structurale specifice si ca urmare manifesta o selectivitate si o activitate catalitica superioara celei realizate de catalizatorii chimici conventionali. Aria catalizei pe zeoliti s-a extins rapid, numeroasele studii aparute, demonstrand interesul constant pentru studiul catalizatorilor zeolitici si aplicatiile acestora. Eforturile diverselor colective de cercetare au fost indreptate in urmatoarele directii:
- prepararea catalizatorilor zeolitici si a celor cu continut de zeolit;
- determinarea factorilor care influenteaza activitatea, selectivitatea si stabilitatea catalizatorilor zeolitici in reactii chimice;
- elucidarea naturii centrelor active si a mecanismului de activare;
elaborarea unor noi catalizatori polifunctionali pentru procesele petrochimice
utilizarea industriala si exploatarea catalizatorilor zeolitici intr-o serie de procese chimice;
Principalele tipuri de catalizatori zeolitici utilizati in cataliza eterogena sunt:
1.Catalizatori zeolitici monofunctionali. Catalizatorii zeolitici monofunctionali, actioneaza prin aciditatea acestora sau prin componenta metalica, zeolitul fiind considerat suport inactiv, desi starea componentei metalice catalitic activa este puternic dependenta de compozitia si structura cristalelor zeolitice. Acesti catalizatori accelereaza numeroase reactii chimice, unele dintre ele fiind aplicate industrial cu performante foarte bune:
- reactii de izomerizare ale: n-butenelor, pentenelor, xilenilor;
- reactii de deshidratare;
- reactii de cracare;
- reactii de alchilare;
- reactii de disproportionare si transalchilare;
- reactii de hidrogenare;
- reactii de aromatizare, etc.
2. Sisteme catalitice polifunctionale pe baza de zeoliti sintetici. Catalizatorii industriali sunt in majoritatea cazurilor sisteme policomponente complexe, obtinute prin amestecarea mecanica a doua sau mai multe componente catalitic active sau prin aplicarea componentelor active pe un suport activ sau inert. Descoperirea si introducerea in procesele industriale a catalizatorilor polifunctionali, prezinta o importanta deosebita, mai ales in contextul crizei de materii prime. De exemplu, prelucrarea petrolului care cuprinde mai multe reactii catalitice se realizeaza prin efectuarea acestora in mod succesiv; dar calea cea mai avantajoasa o constituie efectuarea lor intr-un singur stadiu tehnologic. Aceasta este posibila prin utilizarea catalizatorilor polifunctionali, care accelereaza mai multe reactii care au loc concomitent, de exemplu: reactii de cracare, izomerizare, deshidratare, oxidare si hidrogenare.
3. Catalizatori polizeolitici. Asemenea sisteme contin in acelasi catalizator, doua sau mai multe tipuri de zeoliti, fiecare avand o anumita actiune catalitica. Singurul proces studiat mai detailat pe astfel de catalizatori este cracarea catalitica. S-au studiat compozitii zeolitice cu continut de metale rare sau pe baza de faujasit ultrastabil Y, mordenit, erionit ferrierit sau zeoliti de tip ZSM.
4.Catalizatori zeolitici cu complecsi ai metalelor tranzitionale. Obtinerea acestor catalizatori se face prin fixarea complecsilor metalelor tranzitionale sau a clusterilor metalici pe polimeri organici sau minerali, ori pe suporturi minerale cum ar fi: SiO2, argile, zeoliti. Ultimii pot fi utilizati drept matrice pentru complecsii metalelor tranzitionale, dar si drept componenti ai catalizatorilor eterogeni cu complecsi ai metalelor tranzitionale.
5. Catalizatori zeolitici modificati. O serie de studii facute asupra comportarii zeolitilor au evidentiat unele limitari referitoare la activitatea catalitica, selectivitatea si in special la stabilitatea acestora.
In prezent, se cerceteaza
reglarea activitatii catalitice, directionarea si
modificarea selectivitatii in scopul imbunatatirii
acesteia. Cea mai simpla, precum si cea mai utilizata metoda
este modificarea compozitiei chimice a zeolitului si a conditiilor
de preparare a catalizatorului. Folosirea zeolitilor in cataliza
eterogena a fost publicata prima oara in 1960 de catre J.
A. Rabo si P.B. Weisz. Aceste prime lucrari se refereau la
reactii de izomerizare si cracare a parafinelor ce apar in
cavitatile zeolitilor de tip X si Y si au fost urmate
in 1962 de referiri la selectivitatea de forma a sitelor moleculare CaA . J. A. Rabo si P. B. Weisz au devenit pionierii
catalizei pe zeoliti care s-a dezvoltat si extins uimitor de repede,
in principal, datorita aplicatiilor potentiale ce au stimulat
si justificat cercetari atat pentru descoperirea de noi structuri
zeolitice cat si pentru cercetari experimentale ale reactiilor
catalitice. Primul proces catalizat de zeoliti aplicat industrial in 1962
de firma Mobil Oil a fost cracarea petrolului care a cunoscut o rapida
comercializare, existand pe plan mondial capacitati de prelucrare de
peste 40 milioane barili /zi. Acest proces precum si procesul SHELL
HYSOMER de izomerizare a parafinelor utilizeaza drept catalizatori
zeolitii cu pori largi a caror deschidere este data de inelul de
12 membri (X si Y cu metale rare; REX,
Descoperirea zeolitilor
inalt siliciosi caracterizati de pori cu marime medie, a deschis
drumul spre nenumarate noi posibilitati in sinteza,
caracterizare si cataliza. Cel mai remarcabil reprezentant al acestei
familii este zeolitul ZSM-5 (
Tabel III.6 Procese industriale catalizate de zeoliti ZSM-5 .
|
Titei Rafinare (purificare) Cracare catalitica Deparafinare distilate Deparafinare |
|
Chimicale Disproportionare toluen Sinteza de etil benzen si p-etiltoluen Disproportionarea para selectiva a toluenului Parafine usoare la aromate Izomerizarea xilenilor |
|
Combustibili sintetici si chimicale Metanol la benzina ( Olefine la benzina si distilate Aromatizarea hidrocarburilor inferioare (CYCLAR, AROFORMING, M-2FORMING) |
Trebuie remarcat faptul ca, fiind o
stiinta interdisciplinara, cataliza pe zeoliti a
beneficiat enorm de progresele inregistrate in sinteza, caracterizare,
sorbtie, difuzie si modelare teoretica. Astfel, cercetarile din domeniul sintezei au condus la descoperirea a 50 noi
structuri de aluminosilicati cristalini cu retele diferite si a
substitutiei izomorfe cu Fe, B, Ga, V, Be. Sinteza titanosilicatilor
cu structura ![]() a condus la extinderea aplicarii zeolitilor de la cataliza
acido-bazica la reactii de oxidare.
a condus la extinderea aplicarii zeolitilor de la cataliza
acido-bazica la reactii de oxidare.
Incepand cu 1982 S.T.Wilson si colab au comunicat prima sinteza a unor aluminofosfati cu structura de sita moleculara), ulterior fiind descoperite noi familii de site moleculare aluminofosfatice cu importante posibilitati de aplicare in cataliza, cum sunt: ALPO, SAPO, MeAPO, MeAPSO, ElAPO si ElAPSO. Pana in prezent au fost sintetizate circa 27 de structuri si circa 13 elemente au fost incorporate in retea alaturi de Al si P.
Designul /proiectarea unui catalizator pentru o reactie specifica este un proces dificil care necesita un volum foarte mare de munca si utilizarea unor cunostinte din domenii foarte diverse: chimie (organica, anorganica), chimie - fizica, cinetica, fizica corpului solid, mecanica, etc.
In cazul catalizatorilor zeolitici trebuie avute in vedere si o serie de concepte specifice cum ar fi de ex. selectivitate de forma, relatia de legatura dintre compozitia zeolitului si proprietatile centrelor catalitic active, etc. Pentru modificarea /ajustarea arhitecturii porilor si /sau centrelor zeolitice active in majoritatea cazurilor se folosesc tehnici clasice: schimb ionic, dealuminarea, grefarea sau depunerea de elemente pe suprafata externa a cristalelor etc. Exista destul de multe exemple de catalizatori zeolitici obtinute prin aproximari "abinitio":
- catalizatorul pe baza de erionit utilizat in procesul Selectoforming, care are la baza conceptul de selectivitate de reactant;
- catalizatorii
- catalizatorul Pt - mordenit, utilizat in procesul de izomerizare a alcanilor n-C5 - n-C8 a carui aciditate a fost ajustata prin formarea unor centre puternic acide rezultate in urma interactiunilor grupelor hidroxilice (din retea) cu speciile de Al extraretea;
Usurinta cu care isi modifica majoritatea zeolitilor proprietatile, poate explica partial de ce doar o mica parte dintre acestia (aproximativ o duzina dintre cele 130 de structuri cunoscute) sunt utilizati in procese comerciale, desi o serie de concepte noi legate de selectivitatea de forma a acestora cum ar fi: efectul "cuibar", cataliza "la gura porilor" etc., au fost utilizate cu succes in proiectarea catalizatorilor zeolitici utilizati in procese industriale cum ar fi izo-deparafinarea, sinteza selectiva a cumenului, etc.
Punerea in practica a unor noi metode pentru marirea suprafetei externe cum ar fi: sinteza nanocristalelor, dealuminarea, obtinerea zeolitilor /sitelor moleculare mezoporosi (oase), deschid noi perspective in ceea ce priveste utilizarea catalizatorilor zeolitici in practica industriala.
In viitor, modelarea moleculara precum si chimia computationala vor juca un rol important, deoarece zeolitii datorita structurii lor unice au fost printre primele substante testate in proiectarea virtuala a unor catalizatori pentru reactii chimice specifice.
Daca zeolitii au adus un aport hotarator in punerea in practica a unor procese /tehnologii ecologice in industria petrochimica si rafinarea petrolului, utilizarile acestora in domeniul sintezei de chimicale fine (la scara industriala) sunt relativ putine.
Insa, rezultatele obtinute in cercetarea fundamentala si aplicativa au evidentiat faptul ca zeolitii ca si catalizatori solizi acizi /bazici sau ca site moleculare mezoporoase prezinta activitati si selectivitati remarcabile in sinteza unor compusi organici, constituind potentiali inlocuitori ai catalizatorilor acizi clasici: AlCl3, H2SO4, H3PO4, BF3, etc., care prezinta un grad mare de poluare si coroziune a instalatiilor industriale. Unul din factorii care limiteaza utilizarea imediata a catalizatorilor zeolitici in aceste procese este legat de dificultatea inlocuirii proceselor necatalitice sau catalitice omogene cu procese catalitice eterogene, proiectarea de noi instalatii, volumul relativ mic al chimicalelor fine pe piata si nu in ultimul rand costurile relativ ridicate ale implementarii noilor tehnologii. Un alt factor care limiteaza utilizarea catalizatorilor zeolitici in sinteza industriala de chimicale fine il constituie dezactivarea relativ rapida a acestora datorita eterogenitatii /aciditatii suprafetelor acestora, limitarii difuzionale ale reactantilor si produsilor de reactie voluminosi si /sau polari. Cu alte cuvinte alegerea unor conditii de reactie optime, alegerea unui anumit tip de reactor functie de caracteristicile catalizatorilor zeolitici (dimensiunile cristalelor, porosi sau mezoporosi, etc.) sunt hotaratoare pentru succesul utilizarii zeolitilor in practica industriala.
Copyright © 2024 - Toate drepturile rezervate