 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
EXPRIMAREA CONCENTRATIILOR
CONCENTRATIA PROCENTUALA reprezinta numarul de grame de substanta dizolvate in 100g solutie.
msolutie = msubstanta dizolvata + msolvent g solutie ....msubstanta dizolvata g substanta
100 g solutie ..................c
![]()
obs. Se poate discuta si despre concentratii procentuale molare si volumetrice
concentratia molarA reprezinta numarul de moli de substanta (cu masa moleculara M) dizolvati in 1 litru de solutie.
V l solutie .............. ![]() moli substanta
moli substanta
1 l solutie ...............cM
![]() (mol/l)
(mol/l)
CONCENTRATIA NORMALA (valara) reprezinta numarul de echivalenti de substanta dizolvati in 1 litru solutie.
V l solutie .............. ![]() echivalenti substanta
echivalenti substanta
1 l solutie ...............cN
![]() (echivalenti/l)
(echivalenti/l)
obs. Calcularea valorii unui echivalent se realizeaza in mod diferit, in functie de substanta luata in discutie:
Element sau ion (metal sau nemetal)
![]()
![]()
![]()
![]()
![]()
Baza (hidroxid)
![]()
![]()
![]()
Acid
![]()
![]()
![]()
Sare
![]()
![]()
In cazul in care substanta participa la un proces redox
![]()
In titrari, la punctul de echivalenta, este valabila relatia:
![]()
In calculele stoechiometrice se poate aplica relatia:
![]()
CONCENTRATIA MOLALA reprezinta numarul de moli de substanta dizolvati in 1000 g solvent.
msolvent g solvent ......substanta dizolvata moli substanta
1000 g solvent ................cmolala
![]()
TITRUL reprezinta numarul de grame de substanta din 1 mililitru de solutie
V ml solutie .............. msubstantag substanta
1 ml solutie ...............T
![]() (g substanta /ml solutie)
(g substanta /ml solutie)
FRACTIA MOLARA reprezinta numarul de moli ai unui compus raportat la numarul total de moli din amestec.
Pentru un
amestec de N componenti, fractia molara a componentului i" este: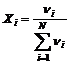
Suma
fractiilor molare ale tuturor componentilor este unitara: ![]()
Modalitati de calculare a masei moleculare a unei substante:
Utilizand densitatea in raport cu alta substanta
![]()
![]()
![]()
Utilizand ecuatia generala a gazelor perfecte:
![]() ,
,
unde p - presiunea gazului
V - volumul incintei
T - temperatura absoluta; T=273+ t(oC) (K)
R - constanta generala a gazelor
![]()
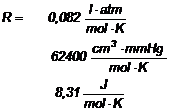
Utilizand legea lui Avogadro
22,4 l substanta gazoasa in conditii normale .. M g substanta
a l substanta .................. b g substanta
![]()
obs. Conditii normale: p0 =1 atm; t0 = 0oC;
Conditii standard: p = 1 atm; t = 25oC
M g substanta .. 1 mol substanta .. 6,023·1023 particule
m g substanta .. mol substanta .. N particule
![]()
Pentru un amestec de N componenti cu fractiile molare Xi
![]()
Pentru un amestec de N componenti aflati in amestec in proportiile ai%
![]()
Marimea fizica |
Unitatea de masura |
||
|
Lungimea |
l |
Metrul |
m |
|
Masa |
m |
Kilogramul |
kg |
|
Timpul |
t |
secunda |
s |
|
Temperatura |
T |
Kelvin |
K |
|
Intensitatea electrica |
I |
Ampère |
A |
|
Numar de moli |
n |
mol |
mol |
|
Intensitatea luminii |
I |
candela |
cd |
Multiplii si submultiplii zecimali ai unitatilor de masura
|
Prefix |
Notatie |
Factor de multiplicare |
|
Hexa |
E |
1018·unitate |
|
Penta |
P |
1015·unitate |
|
Tera |
T |
1012·unitate |
|
Giga |
G |
109·unitate |
|
Mega |
M |
106·unitate |
|
Kilo |
k |
103·unitate |
|
Hecto |
h |
102·unitate |
|
Deca |
da |
101·unitate |
|
Unitatea de baza |
unitate |
unitate |
|
Deci |
d |
10-1·unitate |
|
Centi |
c |
10-2·unitate |
|
Mili |
m |
10-3·unitate |
|
Micro |
10-6·unitate |
|
|
Nano |
n |
10-9·unitate |
|
Pico |
p |
1012·unitate |
|
Femto |
f |
10-15·unitate |
|
Ato |
a |
10-18·unitate |
Alte unitati de masura utilizate in chimie:
Å - Angström - 1 Å =10-10 m (unitate de masura utilizata in caracterizarea distantelor interatomice)
atm - atmosfera - 1atm = 760 torr = 105N/m2 (unitate de masura a presiunii unui sistem)
oC - grad Celsius - 1K = 273,5oC (unitate de masura a temperaturii unui sistem)
l, ml - litru, mililtru - 1l = 1000ml = 1dm3 (unitate de masura a volumelor)
ppm - parti pe milion - 1ppm =1g/g sau 1l/l sau 1g/ml
ppb - parti pe bilion - 1ppb = 1ng/g sau pentru solutii apoase 1ng/ml
ppt - parti pe trilion - 1ppt = 1pg/g sau pentru solutii apoase 1pg/ml
D - dalton - 1D = 1 mol/l
cal - calorie - 1cal = 4,18 J
Cate grame de fructoza si cate de apa sunt necesare pentru a obtine 50g de solutie cu concentratia de 20%?
Ce volum de solutie de acid arahidonic de concentratie 0,75M si ce volum de apa sunt necesare pentru a prepara 50 ml solutie acid arahidonic 0,3N?
Determinati, folosind regula dreptunghiului, cantitatea de solutie acid acetic 10% necesara pentru diluarea unei cantitati de 300g solutie acid acetic 90% pana la o concentratie de 60%. Ce cantitate de solutie cu concentratia 60% se poate prepara?
Folosind regula dreptunghiului sa se calculeze concentratia solutiei obtinute prin amestecarea a 200g solutie acid glucuronic 20% cu 700g solutie acid glucuronic 35%.
Se obtine o solutie 50% manoza prin diluarea unei solutii 90% manoza cu o solutie 40% manoza. Calculati cantitatea de solutie de concentratie 40% necesara diluarii unei cantitati de 500g solutie 90%.
In ce raport trebuie sa se amestece solutia de acid glucozaharic 0,5M cu solutia de acid glucozaharic 0,2M pentru a obtine o solutie 0,3M?
In arsurile provocate de iod sau brom zonele respective se tamponeaza cu o solutie de tiosulfat de sodiu 2%. Care este cantitatea de apa necesara pentru a prepara 1l de solutie tiosulfat 2% daca se porneste de la o solutie de tiosulfat de concentratie 0,5N? ( =1g/cm3).
Se da o solutie de acid succinic 5M cu 1,2g/cm3. Sa se calculeze concentratia procentuala de masa si titrul.
Se da o solutie de acid maleic 6M cu 1,2g/cm3. Sa se calculeze concentratia molala si fractiile molare ale componentilor solutiei.
Sa se calculeze titrul unei solutii apoase de permanganat de potasiu 0,5N. Ce volum de solutie este necesar pentru oxidarea a 2 moli acid oleic?
Cat acid oxalic (H2C2O4 ·2H2O) trebuie cantarit pentru a prepara 200 ml solutie 0,01M? Care este concentratia procentuala a solutiei preparate? 1g/cm3)
Prin amestecarea unor volume egale din cinci solutii ale aceleiasi substante, avand concentratiile molare in raportul 1:2:3:4:5, se obtine o solutie de concentratie 6M. Care au fost cele cinci concentratii?
Cate molecule de glucoza contine o celula bacteriana daca acest metabolit are o concentratie interna de 1M? Se presupune ca celula bacteriana este de forma cilindrica, avand diametrul 0,5m si inaltimea 2m.
Utilizand datele din problema anterioara, indicati cantitatea de glucoza prezenta in celula bacteriana.
La o persoana care are aciditate gastrica marita, concentratia de HCl este 0,7%. Considerand un volum de suc gastric de 250ml, sa se calculeze:
a. Ce cantitate de bicarbonat de sodiu solid trebuie administrata pentru restabilirea concentratiei normale de HCl (0,3%)?
b. Ce cantitate de solutie de NaHCO3 de concentratie 0,1M poate fi folosita in locul produsului solid pentru a aduce de asemenea concentratia la valoarea 0,3%?
Densitatile solutiilor sunt practic =1g/cm3, iar apa formata in reactii poate fi neglijata.
Cunoscand importanta deosebita a vitaminei C in alimentatie, iata continutul acesteia in unele produse vegetale :
|
Produs |
Continut (mg/100g produs) |
|
Ananas | |
|
Ardei verde | |
|
Ceapa | |
|
Conopida | |
|
Fragi | |
|
Grapefruit | |
|
Lamai (zeama) | |
|
Mandarine | |
|
Morcov | |
|
Nuci verzi (coji) | |
|
Portocale | |
|
Spanac | |
|
Urzici |
Ce cantitate de morcovi este necesara pentru a obtine 0,5l suc care sa contina acid ascorbic intr-o concentratie 2mM?
Se dau 250cm3 solutie CH3COOH cu concentratia 75% si cu un continut de 900g acid /l. Se adauga ulterior 100ml apa. Sa se indice:
a. Densitatea solutiei initiale
b. Concentratia procentuala a solutiei finale
c. Densitatea solutiei finale
Sa se calculeze cati cm3 dintr-o solutie de D-riboza 40% cu =1,25g/cm3 sunt necesari pentru a prepara 25 g solutie D-riboza 10%.
Sa se calculeze cati cm3 dintr-o solutie de D-gliceraldehida 45% cu 1,6g/cm3 sunt necesari pentru a prepara 1,5 l solutie D-gliceraldehida 0,1M.
Se oxideaza alcoolul etilic cu o solutie de K2Cr2O7 2N. Calculati volumul de solutie de bicromat de potasiu necesar obtinerii a 2,2g aldehida acetica.
Se oxideaza 4,6g etanol cu KMnO4, in vederea obtinerii acidului acetic. Calculati volumul solutiei 0,1N KMnO4 necesar oxidarii.
Calculati cantitatea de alcool etilic obtinuta din 400g glucoza care contine 10% impuritati.
20 cm3 solutie 60% alcool etilic cu 0,9g/cm3 se trateaza cu Na metalic. Ce volum de gaz se degaja?
Determinati cantitatea de solutie 50% acid acetic obtinuta la oxidarea aldehidei acetice cu 2000ml solutie 0,1N KMnO4.
Se fabrica 6,75kg formol 40% din alcool metilic cu un randament de 80%. Determinati cantitatea de metanol 90% necesara in procesul de fabricare.
Aerul uscat, inspirat de om la nivelul marii (760mmHg) contine: 78,55%N2; 20,92%O2; 0,04%CO2 si 0,48% vapori de apa. Calculati presiunile partiale ale acestor gaze in aerul inspirat.
Aerul alveolar saturat contine azot, oxigen, dioxid de carbon si vapori de apa. Presiunile partiale ale acestor gaze sunt respectiv: 573mmHg, 100mmHg, 40mmHg, 47mmHg. Calculati continutul procentual al fiecarui gaz din aerul alveolar. Comentati rezultatele obtinute.
Analiza sangelui unui adult aflat in coma alcoolica a indicat concentratia 0,069M alcool etilic. Determinati cantitatea de alcool prezenta in sangele pacientului daca acesta are 6 l sange.
Hidroxidul de magneziu se utilizeaza frecvent pentru diminuarea aciditatii stomacale, daca sucul gastric are in digestie concentratia 0,1M HCl, ce volum din acesta este neutralizat de o tableta de 500mg hidroxid de magneziu?
Solutiile saline fiziologice au osmolaritatea de 0,3 osmol. Cate grame de NaCl sunt necesare pentru prepararea a 10 l solutie fiziologica?
Care este osmolaritatea solutiilor:
a. 0,35M KBr
b. 0,15 M glucoza
Solutia pentru rehidratare uitlizata pentru copii contine urmatoarele componente: Na+, K+, Cl-, glucoza, respectiv in concentratiile: 90mM, 20mM, 110mM, 2%. Care este osmolaritatea acesteia?
Care este osmolaritatea solutiei 5% de glucoza, utilizata intravenos?
Ce cantitate de fluorura de sodiu se gaseste in 100kg apa potabila, daca aceasta contine 1,6ppm NaF.
Determinati numarul de mol, mmol, mol din urmatoarele cantitati:
a. 4,6g alcool etilic
b. 64g alcool metilic
c. 1,8g glucoza
d. 20g calciu.
In conditii normale, continutul plasmatic al glucozei este cuprins intre 80-120 mg 100 ml proba. Exprimati intervalul de normalitate in mmo l si respectiv mo l.
In urma analizei serului unui pacient s-a gasit o cantitate de glucoza de 180mg 100ml proba. Exprimati valoarea parametrului in mo l; mmo l; mo l.
Transformati in mol; mmol; mol urmatoarele cantitati:
a. 1,8 g glucoza
b. 36 g fructoza
c. 342 mg zaharoza
Exprimati concentratia de glucoza 0,02M in mmol/l, mol/l si mg/100ml.
Transformati in mg/100 ml urmatoarele solutii:
a. 0,005M glucoza
b. 0,004M galactoza
c. 3mM glucoza
d. 2000 M zaharoza.
Calculati cantitatea in grame a urmatorilor aminoacizi
a. 0,1 mol lisina
b. 200 ml solutie 1M serina
c. 500 ml solutie 2% glicina 1,1kg/l
d. 10-2 mol glutamina.
Transformati in mEq urmatoarele cantitati:
a. 230 mg Na+/100ml proba
b. 780 mg K+/100ml proba
c. 60 g Fe2+/100ml proba
d. 2,4 mg Na+/100ml proba
e. 10 mg Ca2+/100ml proba.
Transformati in mg /100ml proba urmatoarele cantitati:
a. 150 mEq Na+
b. 10 mol Fe2+
c. 1,2 mmol Mg2+
d. 4,5 mEq Ca2+
Determinati numarul de echivalenti, mEq, Eq din urmatoarele cantitati:
a. 64mg sodiu
b. 3,9 mg potasiu
c. 4,8mg magneziu
d. 2g calciu
Sa se transforme in mEq, mol, g / l urmatoarele concentratii:
a. 460mg Na+/100 ml proba
b. 60mg Mg2+/100 ml proba
c. 84 mg Fe2+/100 ml proba
d. 210 mg Fe3+/100 ml proba
Calculati concentratia micronormala a unei probe ce contine 72mg Fe2+/ 100ml proba (AFe=56).
Exprimati concentratia de Mg2+ 0,5 milinormala in g / 100ml (AMg=24).
Calculati procentul de azot din molecula guaninei dintr-o solutie 10 M.
Stiind ca intr-o proba de 100ml se afla 252ng timina, sa se indice concentratia milimolara a acesteia.
Concentratia dipeptidei Ala-Gly este 0,02M. Exprimati concentratia in mg / 100ml.
Calculati concentratia molara a unei probe ce contine 2,7g adenina / ml.
Cunoscandu-se concentratia 2,02M acid cis-oleic, sa se indice cate mg de acid sunt in 20ml proba.
Cate mg de acid linolenic sunt in 100 ml solutie cu o concentratie 0,04M.
Sa se indice concentratia normala a unei probe de 100 ml care contine 14g acid linoleic.
Transformati 3,2 mol lisina / 50ml proba in mg Lys / 1000dm3 .
Transformati in g / 100ml o solutie cu concentratia 0,03M treonina.
Sa se calculeze concentratia procentuala a solutiei de asparagina care are concentratia molara 3,7M (=1,2g/cm3).
Care este concentratia molara a unei solutii (=1,3g/cm3) care contine 2,1mg serina/100g solutie?
Stiind ca o solutie contine 4,6mg arginina in 100ml proba, care este concentratia molara?
Sa se indice concentratia micromolara a triptofanului, daca solutia contine 6,12g Trp / 100ml solutie.
Se da un amestec racemic al prolinei cu concentratia 0,1mM. Sa se indice cate grame din fiecare izomer exista intr-un litru de solutie.
Pentru o solutie ce contine 7,8g leucina/100ml solutie, sa se calculeze concentratia milimolara.
Sa se indice concentratia micromolara a unei probe de lactoza ce contine 684mg lactoza in 100ml solutie.
Care este concentratia procentuala a solutiei cu concentratia 0,02M galactoza, stiind ca =1,1g/cm3.
Calculati concentratia procentuala a solutiei de sucroza 3nM cu =1,2g/cm3.
Bibliografie
O. Arama, Aplicatii ale matematicii in farmacie si medicina, Ed. Dacia, Cluj Napoca, 1987
G. Barbulescu, Teste de chimie, Ed. Teora, Bucuresti, 1994
P. Budrugeac, Probleme de chimie, Ed. Academiei RSR, Bucuresti, 1986
P. Budrugeac, M. Niculescu, Exercitii si probleme de chimie, Ed. de Vest, Timisoara, 1994
C. G. Constantinescu, M. Negoiu, C. Constantinescu, Chimie anorganica, Ed. Didactica si Pedagogica, Bucuresti, 1986
J. E. Davis, W. K. MacNab, E.L. Haenisch, A. L. McClellan, P. R. O'Conner, Chimie: experiente si principii, Ed. Stiintifica si Enciclopedica, Bucuresti, 1983
V. Dinu, V. Atanasiu, I, Mihailescu, V. Bageacu, E. Trutia, Teste de biochimie medicala, Ed. Tehnica, Bucuresti, 1996
C. Gheorghiu, L. Antonescu, F. Zalaru, Chimie, Ed. Didactica si Pedagogica, Bucuresti, 1982
T. Hodisan, I. Haiduc, H. Nascu, C. Cimpoiu, Chimie analitica. Aplicatii, I, Ed. Quo Vadis, Cluj Napoca, 1997
T. Hodisan, Chimie analitica. Aplicatii. Analiza cantitativa, Ed. Quo Vadis, Cluj Napoca, 1998
I. Ionescu, S. Ilie, L.Cojocaru, T. Nedelea, Aplicatii si probleme de chimie, Ed. Didactica si Pedagogica, Bucuresti, 1983
S. Patachia, Ghid pentru realizarea si prezentarea unui raport stiintific in chimie, Ed. Lux Libris, Brasov, 1999
L. Roman, R. Sandulescu, Chimie analitica, I, II, Ed. Didactica si Pedagogica, Bucuresti, 1999
I. Schiketanz, F. Badea, Chimie organica prin probleme Ed. Stiintifica si Enciclopedica, Bucuresti, 1989
R. Tica, C. Draghici, A. Duta Capra, L, Isac, E. Tudor, L, Stezar, L. Dumitrescu, D. Perniu, Gh. Roman, D. Nanu, G. Savin, Invatam chimie prin probleme, Ed,. Ecran Magazin, Brasov, 1999
Copyright © 2024 - Toate drepturile rezervate