 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Manifestarile clinice ale cancerului colorectal sunt rezultatul a numeroase interactiuni la mai multe niveluri intre factorii ereditari, influentele din mediu si factori ce tin de organismul gazda (fig. 3.1). În prezent se incearca intelegerea bazelor moleculare care determina susceptibilitatea la cancer colorectal, pentru a identifica factorii care initiaza dezvoltarea tumorii, ii intretin progresia si determina raspunsul sau rezistenta la agentii antitumorali.
Studii exhaustive centrate pe modificarile genetice in cancerul colonic au facut ca acesta sa capete si sa-si mentina, timp de decenii, statutul de model pentru ilustrarea bazelor genetice ale cancerogenezei. În 2010, neoplazia colonica este descrisa in egala masura ca un prototip pentru exemplificarea rolului modificarilor epigenetice in tumorigeneza.
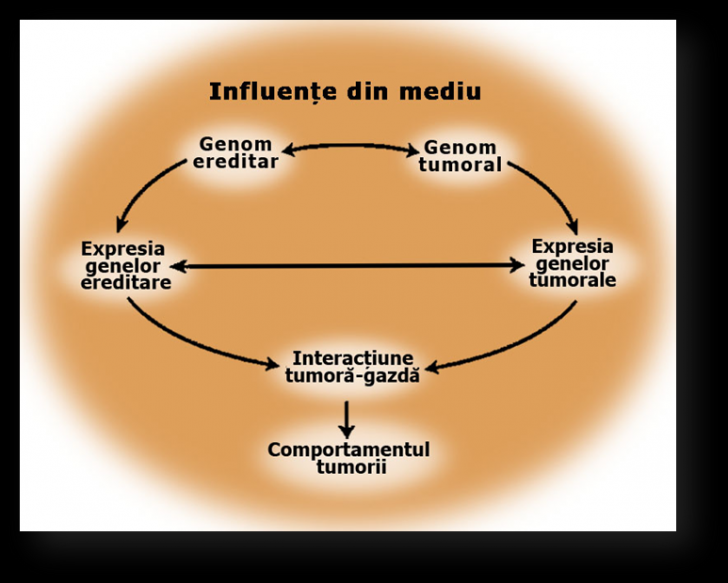
Figura 3.1. Carcinogeneza colorectala multifactoriala Interactiuni intre factorii genetici ai gazdei si factorii de mediu care conduc la aparitia tumorilor. Imagine adaptata din articolul cu titlul: Molecular Basis of Colorectal Cancer (Sanford et al, 2009).
Progresele tehnologiei secventierii ADN au facut posibila secventierea intregului genom codificant dintr-o formatiune canceroasa. Cancerul colorectal a fost primul exemplu al capacitatii acestei tehnologii, prin secventierea a 18.000 membri ai bazei de date de secvente de referinta (RefSeq) apartinand Centrului National pentru Informatica Biotehnologica din SUA (Sjöblom, Jones et al, 2006; Wood, Parsons et al, 2007). Au fost identificate mutatii somatice asociate cancerului in 848 gene, dintre care au fost selectate 140 gene candidate care au putut contribui la fenotipul canceros deoarece prezentau mutatii in cel putin doua cazuri de cancer colorectal. Prin corectia dupa dimensiunile genelor s-a aratat ca exista mai multe mutatii decat ar apare doar datorita intamplarii. În medie, genomul cancerului colorectal in stadiul IV poseda 15 mutatii ale genelor candidate si 61 mutatii ale genelor pasagere (evenimente mutationale cu frecventa foarte mica). Predominanta mutatiilor cu frecventa mica ale genelor candidate implica o eterogenitate enorma a cancerelor colorectale, care reflecta eterogenitatea aspectelor clinice.
Acest grad mare de eterogenitate genetica face dificila determinarea consecintelor clinice ale mutatiilor individuale. În plus, probabil ca aceste rezultate initiale se vor conserva, deoarece s-a dovedit ca unele mutatii considerate ca fiind rare in cancerul colorectal sunt de fapt destul de frecvente si ar putea fi implicate si in patogeneza altor tipuri de cancer (de exemplu mutatia DH1 observata initial in cancerul colorectal si ulterior in multe tipuri de glioame) (Parsons, Jones et al, 2008).
Prin secventierea genomului cancerelor colorectale au fost identificate noi tinte genice care sunt afectate frecvent de mutatii. Printre acestea se numara receptorii pentru efrine EPHA3 si EPHB6 (receptori pentru tirozin kinaze), care sunt responsabile pentru 20% din cancerele colorectale si FBXW7 cu rol intr-o cale de degradare a proteinelor care regleaza nivelele ciclinei E si care este mutanta in 14% din cancerele colorectale (Sjöblom, Jones et al, 2006; Wood, Parsons et al, 2007; Rajagopalan, Jallepalli et al, 2004).
În viitor, va constitui o provocare pentru cercetatori reducerea numarului celor 140 de gene candidate prin identificarea cailor biologice sau proceselor care sunt tinte comune ale acestor evenimente mutationale.
Pierderea stabilitatii genomice conduce la progresia cancerului colorectal prin facilitarea achizitiei de mutatii asociate fenotipului tumoral. În cancerul colorectal instabilitatea genomica are cateva forme, fiecare cu o cauza diferita (tabelul 3.1) (Lengauer, Kinzler et al, 1997).
Tabelul 3.1. Modele ale instabilitatii genomice in cancerul colorectal. Tabel preluat din articolul cu titlul: Molecular Basis of Colorectal Cancer (Sanford et al, 2009).
|
TIPUL DE INSTABILITATE / SINDROMUL |
TIPUL DEFECTULUI |
GENE IMPLICATE |
FENOTIP |
|
INSTABILITATE CROMOZOMIALA |
|||
|
Pierderea heterozigotiei in loci multipli |
Somatic |
Pierderea heterozigotiei APC, TP53, SMAD47'8 |
Defect caracteristic pentru 80-85% dintre cancerelele colorectale, in functie de stadiu |
|
DEFECTE ALE GENELOR DE REPARARE A NEPOTRIVIRILOR BAZELOR ADN |
|||
|
Cancer colorectal ereditar non-polipozic |
Ereditar |
Mutatii ereditare ale genelor MLH1, MSH2, MSH6 |
Cancere primare multiple, accelerarea progresiei tumorale, cresterea riscului de tumori endometriale, gastrice si de uroteliu |
|
Cancer colorectal sporadic cu deficienta a repararii nepotrivirilor ADN |
Somatic |
Metilarea somatica a MLH1 |
Cancer colorectal cu risc crescut de diferentiere slaba, localizat mai frecvent pe colonul drept, clinic mai putin agresiv decat tumorile cu deficiente ale genelor de reparare a nepotrivirilor bazelor ADN |
|
Fenotip metilant al insulelor CpG Metilarea locilor tinta |
Somatic |
Loci tinta: MLH1, MINT1, MINT2, MINT3 |
Defect caracteristic al 15% dintre cancerele colorectale, majoritatea cu deficiente ale repararii nepotrivirilor bazelor ADN datorate pierderii expresiei MLH1 |
|
Defect de reparare a exciziei bazelor Polipoza asociata MYH |
Ereditar |
MYH |
Dezvoltarea a 15 sau mai multe adenoame colorectale cu risc crescut de cancerizare |
Cea mai frecventa forma de instabilitate genomica in cancerul colorectal este instabilitatea cromozomiala, care conduce la numeroase modificari ale numarului si structurii comozomilor (Grady, Carethers et al, 2008). Instabilitatea cromozomiala este un mecanism eficient prin care se pierde alela "salbatica" a unor gene tumorosupresoare cum ar fi APC, P53 si SMAD4, care in mod normal previn aparitia fenotipului malign (Kinzler si Vogelstein, 2002; Grady si Markowitz, 2002; Fearon si Bommer, 2008). În cancerul colorectal exista numeroase mutatii inactivante ale genelor care mentin stabilitatea cromozomiala in timpul replicarii, prin acumulare acestea fiind responsabile pentru instabilitatea cromozomiala (Barber, McManus et al, 2008). În cancerul colorectal au loc rar rearanjari genice sau amplificari ale numarului de copii (Leary, Lin et al, 2008).
Evenimentele moleculare care stau la baza initierii, promovarii si progresiei cancerului colorectal au loc la mai multe nivele interdependente. Acest proces dinamic implica interactiuni intre factorii de mediu, factorii ereditari si mutatiile somatice acumulate din celulele epiteliului colorectal (fig. 3.2).
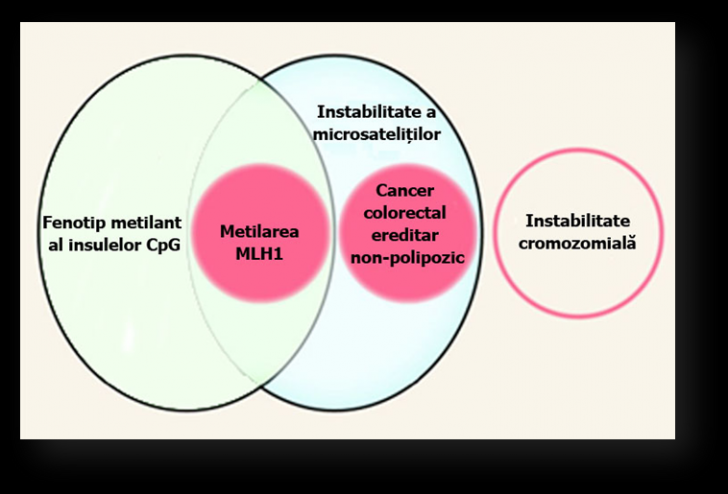
Figura 3.2. Cai de instabilitate genetica care contribuie la progresia neoplaziilor colorectale. Se prezinta interrelatiile ce definesc caile majore de instabilitate genomica in cancerul colorectal: instabilitatea cromozomiala si instabilitatea microsatelitilor produsa de mutatii genetice care pot fi transmise pe cale ereditara (ca in cancerul ereditar non-polipozic) sau achizitionate somatic prin metilare aberanta si inactivare epigenetica a MLH1 si fenotipul metilant al insulelor CpG. Imagine adaptata din articolul cu titlul: Molecular Basis of Colorectal Cancer (Sanford, Markowitz et al, 2009).
La unii pacienti cu cancer colorectal, s-a observat inactivarea genelor necesare pentru repararea erorilor de imperechere ale bazelor din ADN, denumite global gene de reparare a nepotrivirilor ADN (mismatch repair = MMR) (fig. 3.2). Aceste inactivari pot fi mostenite, ca in cazul cancerului ereditar non-polipozic (HNPCC) sau dobandite, asa cum se intampla la tumorile la care se inactiveaza prin metilare una dintre genele implicate.
Sistemul MMR joaca un rol important in reducerea mutatiilor si mentinerea stabilitatii genomice, prin corectarea nepotrivirilor de baze aparute prin erori de replicare semiconservativa a ADN si recombinare omologa. Principala cale MMR la bacterii este sistemul MutHLS. În acest sistem nepotrivirea este detectata de MutL, apoi dupa interactiunea cu MutL, endonucleaza MutH este activata si indeparteaza o portiune de 1-2 kb din catena ADN ce contine mutatia. În continuare zona excizata este resintetizata.
La eucariote complexul MMR cuprinde omologii proteinei MutS bacteriene: MSH2, MSH3 si MSH6. Omologul MutL bacterian are trei forme: MutLα, MutLβ and MutLγ. Complexul MutLα cuprinde subunitatile MLH1 si PMS2, heterodimerul MutLβ este format din MLH1 si PMS1, iar MutLγ din MLH1 si MLH3. MutH nu are omolog la eucariote, rolul sau fiind indeplinit probabil de activitatea exonucleazica a omologilor MutL. Initierea MMR la eucariote se face prin combinarea MSH2, MSH3 si MSH6. Pentru repararea mutatilor punctiforme este necesara combinarea MSH2 cu MSH6, iar complexul dintre MSH2 si MSH3 serveste la repararea unor mutatii de 2-4 baze.
Într-o etapa ulterioara este recrutat heterodimerul MLH1-PMS2 (MutLα) care coordoneaza evenimentele din repararea nepotrivirilor de baze. Recent s-a aratat ca acesta este o endonucleaza care introduce intreruperi in catena ADN, dupa activarea de catre omologii MutS si antigenul nuclear de proliferare (PCNA). Aceste intreruperi servesc ca puncte de pornire pentru activitatea exonucleazica ce indeparteaza catena de ADN care contine mutatia. Sunt putin cunoscute rolurile MutLβ si MutLγ. În final portiunea de ADN excizata este resintetizata de ADN polimeraze si inclusa in catena de ligaze (fig. 3.3).
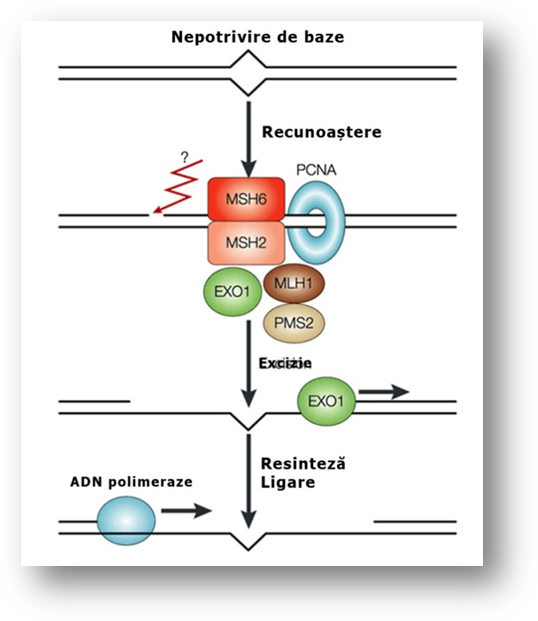
Figura 3.3. Mecanismul de reparare a nepotrivirilor bazelor ADN. Proteinele MMR se leaga de defectul de nepotrivire a bazelor in prezenta ATP (MSH2, MSH6, MLH1, PMS2, PCNA) si produc excizia catenei ADN afectate (EXO1). ADN polimerazele si ligazele resintetizeaza apoi catena, complementar celei neafectate. Imagine preluata din articolul cu titlul: AID and mismatch repair in antibody diversification (Martin si Scharff, 2002).
La pacientii cu HNPCC, defectele ereditare ale acestor gene (in principal MLH1 si MSH2) confera un risc de 80% sanse de a dezvolta cancer pe tot parcursul vietii, in medie in jurul varstei de 45 ani (Lynch HT, Lynch JF et al, 2008). Pierderea functiei de reparare a nepotrivirilor dintre bazele ADN se datoreaza nu numai alelelor mutante mostenite ereditar, dar si inactivarii somatice a alelei "salbatice" (Boland, Koi et al, 2008). La pacientii cu HNPCC, instabilitatea genetica rezultata este datorata acestor deficiente genetice care accelereaza dramatic ritmul de progresie a tumorilor, inregistrandu-se cazuri de cancere complet dezvoltate la 36 luni dupa o colonoscopie negativa (Järvinen, Aarnio et al, 2000). Din acest motiv, se recomanda efectuarea in fiecare an a unei colonoscopii la purtatorii unei gene HNPCC (Attard, Lynch et al, 2008; Järvinen, Aarnio et al, 2000), iar la cei la care apar leziuni displazice trebuie avuta in vedere colectomia profilactica. S-a constatat ca predispozitia la cancer colorectal familial este mai scazuta la purtatorii de mutatii ereditare a MSH6 (Kastrinos, Syngal et al, 2007). La circa 15 % din pacientii cu cancer colorectal non-familial se produce inactivarea somatica a acestor gene. Studiile au aratat ca la acesti pacienti se produce inactivarea ambelor alele ale genei MLH1 prin metilarea regiunii promotoare, dezactivandu-se repararea ADN (Pistorius, Gorgens et al, 2007).
Pierderea functiei de reparare a nepotrivirilor ADN este usor de recunoscut datorita asocierii cu epifenomenul de instabilitate a microsatelitilor. Incapacitatea de a repara alunecarea catenelor ADN din zonele moleculei cu secvente repetitive de unul sau doua nucleotide (microsateliti), modifica dimensiunea acestor secvente, care sunt imprastiate prin tot genomul. Deficienta de reparare a nepotrivirilor ADN poate fi detectata si prin analiza imunohistochimica, prin identificarea lipsei expresiei uneia din proteinele implicate (Hampel, Frankel et al, 2005; Ewald, Rodrigue et al, 2007). Majoritatea cancerelor caracterizate prin deficienta acestor gene apar in colonul proximal si in mod sporadic, fiind asociate cu varsta inaintata si sexul feminin. În acest tip de afectare a functiilor de reparare ADN, pot fi inactivate gene tumorosupresoare care poseda regiuni functionale ce contin secvente repetitive de unul sau doua nucleotide, cum sunt cele ce codifica factorul de crestere transformant β (TGF-β), receptorul acestuia de tip II (TGFBR2) si proteina X asociata cu BCL2 (BAX) (Lynch HT, Lynch JF et al, 2008; Fearon, Bommer et al, 2008).
O alta cale de progresie a celulelor epiteliale normale spre cancer colorectal este inactivarea unei gene implicate in repararea ADN prin excizarea bazelor, omologul mut Y murin (MUTYH sau MYH). Proteina MYH excizeaza din ADN 8-oxoguanina produsa prin lezarea oxidativa a guaninei (Jones, Emmerson et al, 2002; Al-Tassan, Chmiel et al, 2002). La indivizii cu doua alele MYH inactive apare un fenotip polipozic cu risc de cancer colorectal de aproape 100% pana la varsta de 60 de ani. Polipoza asociata cu mutatiile MYH este din ce in ce mai frecventa fiind prezenta la o treime din persoanele la care apar peste 15 adenoame colorectale. Diagnosticul acestei afectiuni se face prin testarea prezentei a doua mutatii, Y165C si G382D, care impreuna sunt responsabile pentru 85% din cazuri (Kastrinos si Syngal, 2007). Pana in prezent, in cancerul colorectal nu a fost detectata inactivarea somatica a genei MYH (Halford, Rowan et al, 2003).
Un alt mecanism de inactivare genica la pacientii cu cancer colorectal este inactivarea epigenetica, mediata in majoritatea cazurilor prin metilarea aberanta a ADN (Liu, Shen et al, 2009). Forma metilata a citozinei (5-metilcitozina) constituie o a cincea baza ADN, introdusa de metilazele ADN care modifica citozina din dinucleotidele CpG. În genomul normal metilarea citozinei are loc in secventele repetitive din afara exonilor, in general nu este prezenta in "insulele CpG" bogate in CpG existente in regiunile promotoare a jumatate din genele umane. În cancerul colorectal se intalneste o scadere a metilarii citozinei si o metilare aberanta considerabila in insulele CpG asociate cu unii promotori, (care induce inactivarea expresiei genice (Issa, 2004). În cancerul colorectal sporadic cu instabilitatea microsatelitilor, inactivarea epigenetica somatica blocheaza expresia MLH1. Dintre locii in care apare metilare aberanta in cancerul colorectal, exista cativa care sunt metilati in grup, fenomen numit fenotip metilant al insulelor CpG (CIMP sau CIMP-high) (Kim, Shin et al, 2009). Mecanismul molecular al CIMP ramane necunoscut, dar fenomenul a fost observat in mod repetat la circa 15% din pacientii cu cancer colorectal si este prezent in aproape toate tumorile cu metilare aberanta a MLH1 (Weisenberger, Siegmund et al, 2006; Nosho, Irahara et al, 2008) (fig. 3.2 si 3.3). Desi consecintele patogenice ale inactivarii MLH1 sunt bine stabilite, contributia altor fenomene de inactivare prin metilare la carcinogeneza colorectala ramane necunoscuta, cercetarile fiind in plina desfasurare (Kim, Lee et al, 2010). Un nivel intermediar de metilare aberanta in CIMP ar putea defini un subtip (CIMP2 sau CIMP-low) care se presupune ca este responsabil de 30% din cazurile de CIMP (Shen, Toyota et al, 2007; Barault, Charon-Barra et al, 2008). Un al treilea model de metilare este intalnit in exonul 1 al genei ce codifica vimentina. Desi acest locus nu este exprimat de catre mucoasa colonica normala sau in cancerul colorectal, el este metilat in 53-83% din cazurile de cancer colorectal intr-un model independent de CIMP (Chen, Han et al, 2005; Zou, Harrington et al, 2007).
p16INK4a este inactivat transcriptional prin hipermetilarea insulelor CpG la pacientii cu colita ulcerativa, ceea ce stimuleaza proliferarea celulara, fiind prezenta si la multe cazuri de cancer colorectal (Jie, Zhixiang et al, 2007). Pentru a clarifica mecanismul carcinogenezei, Zhang și Lang (2006) au izolat fragmente de ADNc corespunzatoare ARNm exprimate in tesutul canceros prin metoda cipurilor ADN (microarrays). A fost identificata o expresie crescuta a familiei de gene inductibile prin interferon 1-8U, gena exprimata puternic de asemenea in mucoasa cu inflamatie severa din colita ulcerativa non-maligna (Hisamatsu, Watanabe et al, 1999). Proteina 1-8U este asociata cu raspunsul antiproliferativ la interferon α (Brem, Oraszlan-Szovik et al, 2003).
Cancerele colorectale sunt unul dintre cele mai bune exemple ale tumorogenezei tumorale in etape. Progresia tumorala este un proces evolutiv, determinat de doi factori principali: generarea eterogenitatii si selectia variantelor cu cea mai buna supravietuire, crestere si invazie. Desi majoritatea datelor achizitionate pana in prezent sustin acest model, mecanismele care stau la baza lui raman in majoritate necunoscute.
În formularea initiala, secventa transformarii adenomului in carcinom (Kinzler si Vogelstein, 2002; Fearon, Bommer et al, 2008) era un model de dezvoltare a cancerului colorectal in care sunt achizitionate progresiv mutatii ce promoveaza fenotipul tumoral. Aceste mutatii intereseaza gene ce codifica proteine cu roluri cheie in diferentierea si proliferarea celulara (fig. 3.4). În final se selecteaza si se inmultesc clone celulare cu modificari genetice avantajoase. Mutatiile tumorale dicteaza caracteristici specifice, cum ar fi prezenta metastazelor locale sau la distanta.
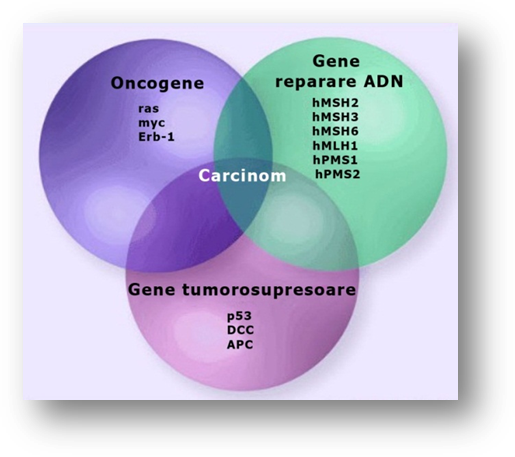
Figura 3.4. Mutatii care contribuie la progresia celulelor normale spre celule neoplazice. Acumularea acestor mutatii creste riscul de aparitie al adenomului si apoi al carcinomului. Imagine preluata din articolul cu titlul: Recent Advances in the Molecular Diagnosis and Prognosis of Colorectal Cancer (Sergio Huerta, 2008).
În mod surprinzator, nu au fost identificate mutatii noi la nivelul metastazelor tumorale prin secventierea la acelasi pacient a intregului genom de la nivelul tumorii primare si metastazelor la distanta, rezultand ca celulele care se desprind de la nivelul tumorii primare si metastazeaza la distanta nu necesita alte mutatii noi, in afara celor deja cunoscute. Deoarece "valul" de mutatii care apar simultan serveste ca "ceas molecular", faptul ca toate mutatiile din metastaze se regasesc de asemenea in tumora primara determina o metastazarea rapida, ce are loc in mai putin de 24 luni de la aparitia mutatiei finale in tumora primara (Jones, Chen et al, 2008).
Au fost izolate cateva cai de semnalizare cu un rol cheie clar in carcinogeneza colorectala (tabelul 3.2 si figura 3.5) (Goss si Groden, 2000; Copeland, Jenkins et al, 2009).
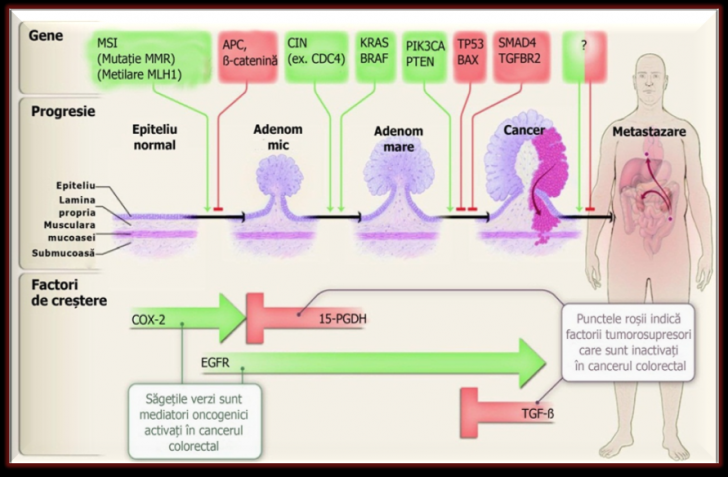
Figura 3.5. Cai genetice si ale factorilor de crestere care conduc progresia cancerului colorectal. În partea superioara se prezinta tintele alterarilor genetice, corelate cu progresia cancerului colorectal. Semnul de intrebare semnifica modificari genetice sau epigenetice care nu au fost inca identificate. În partea inferioara a figurii sunt prezentate principalele cai ale factorilor de crestere alterate in neoplazia colorectala. Imagine adaptata din articolul cu titlul: Molecular Basis of Colorectal Cancer (Sanford, Markowitz et al, 2009).
Tabelul 3.2. Oncogene si gene tumorosupresoare asociate frecvent cu cancerul colorectal. Tabel preluat din articolul cu titlul: Molecular Basis of Colorectal Cancer (Sanford, Markowitz et al, 2009).
|
GENA AFECTATA |
FRECVENTA % |
NATURA DEFECTULUI |
COMENTARII |
|
APC |
Activarea semnalizarii Wnt datorita incapacitatii de degradare a oncoproteinei 3-catenina |
Mutatie ereditara in polipoza colonica familiala; inactivarea somatica a fost detectata in 85% dintre cancerele colorectale |
|
|
MLH1, MSH2, MSH6 |
Defectul de reparare a nepotrivirilor bazelor ADN permite acumularea de mutatii oncogenice si pierderea genelor tumorosupresoare |
Mutatii ereditare in HNPCC; inactivarea epigenetica produce pierderea expresiei proteinei MLH1 |
|
|
TP53 |
|
Codifica o proteina responsabila de reglarea ciclului celular; inactivata prin mutatii fara sens si pierderea heterozigozitatii la 17p |
Mutatii ereditare in sindromul Li-Fraumeni |
|
TGFBR2 |
Receptor implicat in cai de semnalizare ce mediaza oprirea cresterii si apoptoza; este inactivat printr-o mutatie de alunecare in secventa repetitiva polyA din secventa codificatoare a TGFBR2 la pacienti cu deficiente in repararea nepotrivirilor bazelor ADN sau prin mutatii inactivante ale domeniului cu rol de kinaza |
Mutatii prezente in peste 90% din tumorile cu instabilitate a microsatelitilor si 15 % din cancerele colorectale cu microsateliti stabili |
|
|
SMAD4 |
Component esential ale caii de semnalizare prin TGF- β, impreuna cu SMAD2 si SMAD3, proteine inrudite; SMAD4 si SMAD2 sunt situate pe cromozomul 18q, locus frecvent afectat de pierderea heterozigozitatii in cancerele colorectale; inactivat prin deletie homozigota sau mutatie |
Mutatii ereditare in polipoza juvenila familiala, cu risk de cancer colorectal de 60% pana la varsta de 30-40 ani |
|
|
KRAS |
Codifica proteina G KRAS, a carei activare constitutiva are ca rezultat activarea cailor de semnalizare P13K-PDK1-PKB si RAF-MEK-ERK1/2, suprimand apoptoza |
Mutatii ereditare in sindromul cardiofaciocutanat |
|
|
BRAF V600E |
Mutatie activatoare in serin treonin kinaza BRAF, mediator din aval al caii de semnalizare RAF-MEK-ERK1/2, mimeaza consecintele biologice ale mutatiilor KRAS |
Asociata cu polipoza hiperplastica, cu incidenta crescuta in adenoamele serate; mutatia ereditara, ca si KRAS, in sindromul cardio-facio-cutanat |
|
|
PTEN |
Pierderea functionalitatii datorita mutatiilor inactivante conduce la activarea caii de semnalizare P13K, avand ca rezultat supravietuirea celulei si suprimarea apoptozei |
Mutatie ereditara in sindromul Cowden, asociat cu risc crescut de cancer de san, riscul de cancer colorectal este de 10%; rol posibil in mentinerea stabilitatii cromozomiale |
ERK - kinaza reglata de semnale extracelulare, MAPK - protein kinaza activata de mitogeni, PDK1 piruvat dehidrogenazo kinaza 1, PI3 fosfatidilinozitol kinaza 3, PKB - protein kinaza B.
Activarea caii de Wnt este considerata evenimentul initiatic al cancerului colorectal (Kinzler si Vogelstein, 2002). Semnalizarea Wnt este initiata de β-catenina care se leaga de parteneri nucleari (membri ai familiei de factori de activare a limfocitelor T), formand un factor de transcriptie care regleaza genele implicate in activarea celulara. Complexul de degradare a β-cateninei controleaza nivelul acesteia prin proteoliza.
Gena APC, componenta a acestui complex, in afara de contributia la degradarea β-cateninei inhiba de asemenea localizarea sa in nucleu (fig. 3.6) (Fearon, Bommer et al, 2008). Mutatia genei APC este cea mai frecventa mutatie in cancerul colorectal. În absenta APC, care actioneaza ca o frana pentru β-catenina, semnalizarea Wnt este activata constitutiv in mod neadecvat. Mutatiile ereditare ale APC stau la baza polipozei familiale si sunt cauza dezvoltarii polipilor adenomatosi (Lynch HT, Lynch JF et al, 2008). În majoritatea adenoamelor si cancerelor sporadice sunt prezente mutatii somatice si deletii care inactiveaza ambele copii ale APC. Într-o categorie de tumori cu APC de tip "salbatic", semnalizarea Wnt este activata prin mutatii ale β-cateninei, aceasta devenind rezistenta la complexul de degradare (Hlubek, Brabletz et al, 2007).
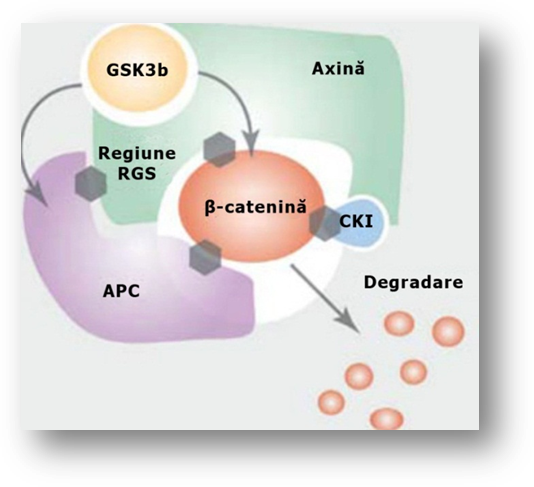
Figura 3.6. Rolul APC in degradarea β-cateninei. Imagine preluata din articolul cu titlul: The role of the Wnt signaling pathway in osteoblast commitment and differentiation (Yavropoulou et al, 2007).
Inactivarea caii p53 prin mutatia TP53 este al doilea moment genetic cheie in carcinogeneza colorectala. În majoritatea tumorilor, ambele alele TP53 sunt inactivate, de regula printr-o combinatie intre o mutatie fara sens, care inactiveaza activitatea transcriptionala a p53 si o deletie cromozomiala 17p care elimina a doua alela TP53 (Risio, Casorzo et al, 2003). Varianta "salbatica" a p53 mediaza oprirea ciclului celular si constituie un punct de control pentru declansarea mortii celulare (apoptozei), care poate fi activat de mai multe tipuri de stres celular (Vazquez, Bond et al, 2008). Inactivarea TP53 coincide adesea cu transformarea adenoamelor mari in carcinoame invazive (Goranova, Ohue et al, 2009). În multe tumori colorectale cu defecte ale repararii nepotrivirilor bazelor ADN, TP53 ramane de tip "salbatic", desi probabil ca in aceste tumori activitatea p53 este probabil atenuata de mutatii ale BAX, inductor al apoptozei (Soreide, Janssen et al, 2006).
Inactivarea mutationala a semnalizarii prin TGF-β este a treia etapa in progresia spre cancer colorectal. În circa o treime din cancerele colorectale exista mutatii somatice care inactiveaza TGFBR2 (Sjöblom, Jones et al, 2006; Wood, Parsons et al, 2007). În tumorile cu defecte in repararea nepotrivirilor intre bazele ADN, TGFBR2 este inactivat prin mutatii de alunecare intr-o secventa repetitiva de poliadenina din secventa ce codifica TGFBR2 (Chung, Young et al, 2008). În cel putin jumatate din cancerele colorectale cu astfel de defecte de reparare a ADN, semnalizarea prin TGF-β este abolita prin mutatii fara sens care afecteaza un domeniu al TGFBR2 kinazei sau, mai frecvent, mutatii sau deletii care afecteaza componenta din aval SMAD4 sau partenerii sai, factorii de transcriptie SMAD2 si SMAD3 (fig. 3.7) (Leary, Lin et al, 2008 Grady si Markowitz, 2008).
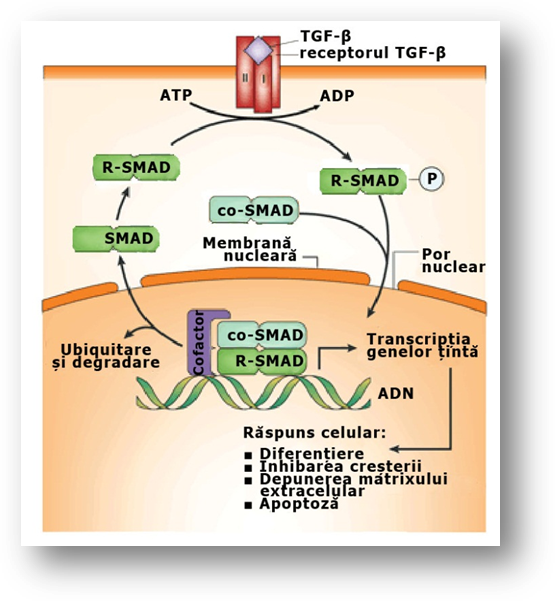
Figura 3.7. Calea de semnalizare prin TGF- β. Factorul de crestere transformant β se leaga de un receptor heterodimeric, care este o serin-treonin kinaza activata de ligand, care are drept substrat proteinele SMAD. Legarea TGF-β declanseaza activitatea kinazica a subunitatii I, care fosforileaza SMAD-urile cu specificitate pentru receptor (R-SMAD), cum este SMAD2. Acestea sunt translocate in nucleu de catre co-SMAD-uri (SMAD4). Complexul SMAD impreuna cu alte proteine care se leaga de ADN activeaza sau reprima transcriptia genelor tinta. Imagine preluata din articolul cu titlul: Signal transduction and genetic instability in colorectal cancer (Fodde et al, 2001).
Cateva oncogene joaca un rol cheie in oncogeneza colorectala (fig. 3.4, tabelul 3.2). Mutatiile oncogenelor RAS si BRAF, care activeaza calea de semnalizare prin protein kinaze activate de mitogeni (MAPK) se intalnesc in 37% si respectiv 13% din cancerele colorectale (Nosho, Irahara et al, 2008). Mutatiile RAS, in principal KRAS, activeaza GTP-aze care semnalizeaza direct spre RAF. Mutatiile BRAF semnalizeaza serin- treonin kinazei BRAF, care activeaza in continuare cascada MAPK (Siena, Sartore- Bianchi et al, 2009). Mutatiile BRAF pot fi detectate chiar si in polipi mici, iar comparativ cu mutatiile RAS sunt mai frecvente in polipii hiperplastici, adenoamele serate si cancerele de colon proximal, in special in cele cu fenotipul CIMP (fig. 3.5). Sindromul polipozei hiperplastice se caracterizeaza prin prezenta a numeroase leziuni hiperplastice, pacientii avand un risc inalt de cancer colorectal (Shen, Toyota et al, 2007). În aceste cazuri boala progreseaza printr-o leziune intermediara care histologic prezinta o margine dintata (adenom serat) (Weisenberger, Siegmund et al, 2006; O'Brien, 2007).
O treime din cancerele colorectale prezinta mutatii activatoare in P13KCA, care codifica subunitatea catalitica a fosfatidilinozitol 3-kinazei (P13K) (Samuels, Wang et al, 2004). Dintre alterarile genetice care pot afecta aceasta cale se pot aminti pierderea PTEN, un inhibitor al semnalizarii P13K, amplificarea substratului receptorului de insulina 2 (IRS2), activator din amonte al semnalizarii P13K, si coamplificarea AKT si PAK4, mediatori in aval ai semnalizarii P13K (Parsons, Wang et al, 2005).
Activarea cailor de actiune a factorilor de crestere este frecventa in cancerul colorectal (fig. 3.4). Una din etapele precoce si esentiale in dezvoltarea adenoamelor este activarea semnalizarii prin prostaglandine (Markowitz, 2007). Acest raspuns anormal poate fi indus de activarea asociata cu inflamatia sau cu factori mitogeni a COX-2, o enzima inductibila care mediaza sinteza prostaglandinei E2, agent puternic asociat cu cancerul colorectal (Cha si DuBois, 2007). Activitatea prostaglandinei E2 poate fi marita si prin scaderea 15-prostaglandin dehidrogenazei (15-PGDH), enzima limitatoare care catalizeaza degradarea prostaglandinelor (Backlund, Mann et al, 2005; Myung, Rerko et al, 2006). În aproximativ doua treimi din cancerele colorectale au fost observate nivele crescute ale COX-2 (Chan, Ogino et al, 2007) iar in 80% din adenoamele si cancerele colorectale 15-PGDH este absenta (Yan, Rerko et al, 2004). Testele clinice au aratat ca inhibitia COX-2 de catre antiinflamatoarele nesteroidiene previne dezvoltarea unor adenoame noi (Arber, Eagle et al, 2006; Bertagnolli, Eagle et al, 2006) si mediaza regresia adenoamelor existente la pacientii cu supraexpresia COX-2 (Hawk, Patterson et al, 2010).
Factorul de crestere epidermal (EGF) este o proteina solubila cu efecte trofice asupra celulelor intestinale. Studiile clinice au demonstrat un efect important al semnalizarii prin receptorul EGF (EGFR) intr-o categorie de cancere colorectale (Saif, 2010). EGFR mediaza semnalizarea prin activarea cascadelor de semnalizare MAPK si PI3K. Date clinice recente au aratat ca acele cancere colorectale avansate cu mutatii pro-tumorale ale acestor cai, cum ar fi mutatii activatoare ale KRAS (Amado, Wolf et al, 2008; Lièvre, Bachet et al, 2008; Karapetis, Khambata et al, 2008), BRAF (Di Nicolantonio, Martini et al, 2008; Wong si Cunningham, 2009) si subunitatii p110 a PI3K (Jhawer, Goel et al, 2008), nu raspund la terapia anti-EGFR.
Factorul de crestere endotelial (VEGF) care este produs in mod normal in leziuni sau in cursul cresterii, produce aparitia de noi vase stromale (angiogeneza). Studiile clinice au sugerat un rol al cailor angiogenetice in dezvoltarea si potentialul letal al cancerului colorectal. S-a aratat ca tratamentul cu anticorpi anti-VEGF (bevacizumab) a crescut cu 4,7 luni rata de supravietuire a pacientilor cu cancer colorectal, care era de 15,6 luni cu terapie standard (Hurwitz, Fehrenbacher et al, 2004). Ramane de efectuat identificarea unor tipuri moleculare de cancere care raspund la acest tip de tratament (Saltz, 2008).
Celulele stem joaca un rol special in cancerul colorectal (Boman, Huang et al, 2008). Celule stem izolate din masa canceroasa colorectala pot migra intr-un situs permisiv, cum este ficatul, producand o metastaza. Pana in prezent nu s-a reusit izolarea celulelor stem, desi exista markeri promitatori, cum sunt unele proteine de suprafata (CD133, CD44, CD166 si aldehid dehidrogenaza) (Lugli, Iezzi et al, 2010). Celulele stem normale din criptele colonice isi mentin diviziunea si diferentierea prin interactiuni stromalo-epiteliale solubile si de adeziune. O arie de investigatie promitatoare in cancerul colorectal este reprezentata de alterarile mecanismelor reglatoare ale celulelor stem, deoarece, teoretic, agentii care controleaza multiplicarea celulelor stem canceroase ar putea fi folositi in preventia si terapia cancerului colorectal (Pasqua, Scalera et al, 2010). Recent se investigheaza posibilitatea efectuarii transplantului alogenic de celule stem hematopoetice datorita efectului grefa versus tumora al limfocitelor donoare asupra celulelor neoplazice (Demirer, Barkholt et al, 2008).
O transpunere importanta in practica medicala a datelor despre genetica cancerului colorectal este dezvoltarea diagnosticului molecular pentru detectia cancerelor in faze incipiente. Au fost puse la punct tehnici de detectie a mutatiilor specifice cancerului colorectal si metilarii ADN aberante in ADN-ul extras din fecale provenite de la pacienti cu cancer colorectal sau adenoame avansate care au o sensibilitate de detectie a cancerului in faza incipienta de 46-77%, ( 72% in stadiile I/II, 43,7% in stadiile III/IV), superioara testelor pentru sangerari oculte in fecale, desi nu a fost demonstrata superioritatea lor in imbunatatirea mortalitatii (Itzkowitz, Jandorf et al, 2007; Itzkowitz, Brand et al, 2008; Ahlquist, Sargent et al, 2008 ). Testarea ADN fecal a fost adaugata la ghidul de screening anti-tumoral al Societatii Americane de Cancer (Levin, Lieberman et al, 2008) si pare a fi sensibila si pentru detectarea adenoamelor avansate (Li, Chen et al, 2009). De regula se folosesc paneluri multitinta, care detecteaza mutatii ale genelor APC, p53, K-ras, BAT-26 (marker de instabilitate a microsatelitilor) si un marker de apoptoza anormala.
Desi inca in dezvoltare, tehnicile pentru detectia ADN plasmatic liber ar putea avea utilitate clinica (Lefebure, Charbonnier et al, 2010). Se investigheaza tehnici de detectie a proteinelor plasmatice specifice tumorilor sau a profilelor ARN (Fong, Zhang et al, 2009). Printre intrebarile inca fara raspuns se numara intervalul optim dintre testele seriate si performanta sau eficienta din punct de vedere al costurilor a testarii ADN din fecale fata de testele imunochimice ale sangerarilor fecale oculte (Hundt, Haug et al, 2009).
Unul dintre scopurile cercetarilor asupra cancerului colorectal este traducerea bogatiei de cunostinte privind modificarile genetice in teste predictive sau de prognostic cu aplicabilitate clinica (tabelul 3.3) (Nibbe, Chance et al, 2009). Relatia dintre mutatiile componentelor semnalizarii prin EGFR, si terapia anti-EGFR este deocamdata singura aplicație terapeutica a geneticii cancerului colorectal (Wong, Cunningham et al, 2009).
Tabelul 3.3. Markeri ADN predictivi și de prognostic in cancerul colorectal Tabel preluat din articolul cu titlul: Molecular basis of colorectal cancer (Sanford, Markowitz et al, 2009).
|
MARKER ADN |
COMENTARII. PROGNOSTIC |
||
|
VALOARE PROGNOSTICA |
|||
|
APC |
Mutatia ereditara este definitorie pentru polipoza familiala colonica, sindrom predispozant pentru cancer colorectal, cu risc de 80% de a dezvolta cancer colorectal pe tot parcursul vietii. Pacientii cu mutatii ereditare APC. Pacientilor cu mutatii ereditare ale APC li se recomanda colectomie sau proctocolectomie profilactica. |
||
|
MLH1, MSH2, MSH6 |
Mutatia ereditara a acestor gene si a altora implicate in repararea nepotrivirilor intre bazele ADN este definitorie pentru cancerul colorectal ereditar non-polipozic, caracterizat de un risc de 40-80% de a dezvolta pe parcursul vietii cancer colorectal si un risc crescut de cancer endometrial. La acesti pacienti se recomanda supraveghere colonoscopica si se ia in considerare colectomia si histerectomia profilactica. |
||
|
Inactivarea prin metilare a MLH1 |
Inactivarea somatica a MLH1 in cancerele colorectale primare este evidentiata fie prin detectarea instabilitatii microsatelitilor in ADN, fie prin pierderea expresiei proteinei MLH1 evidentiata imunohistochimic. Aceasta inactivare este mai frecventa in primele stadii ale cancerului colorectal si poate fi un marker a unui cancer mai putin agresiv sau a unui prognostic mai bun in lipsa chimioterapiei adjuvante. |
||
|
VALOARE PREDICTIVA |
|||
|
Pierderea heterozigozitatii la locusul 18q |
Pierderea somatica a heterozigozitatii la locusul cromozomial 18q, care contine unele gene asociate cu cancerul colorectal (ex. SMAD2 si SMAD4) a fost asociata cu un prognostic mai slab la pacientii cu cancer colonic in stadiile II si III. |
||
|
KRAS |
Mutatia somatica, prin pierderea restrictionarii, stimuleaza semnalizarea prin cascadele MAPK si PI3K. Pacientii cu cancer colorectal in stadiul IV si mutatii activatoare ale KRAS nu raspund la terapia de inhibitie a EGFR. |
||
|
BRAF V600E |
Mutatia somatica ce activeaza aceasta kinaza stimuleaza semnalizarea prin calea MAPK. Pacientii cu cancer colorectal in stadiul IV si mutatii activatoare ale BRAF V600E nu raspund la terapia de inhibitie a EGFR. |
||
|
MLH1 inactivare prin metilare |
Pierderea functiei de reparare a nepotrivirilor ADN conduce la pierderea altor gene tumorosupresoare (de ex. TGFBR2 si BAX). Pacientii pot sa nu raspunda la fluorouracil si pot raspunde mai bine la irinotecan. |
||
Mutatiile ereditare ale genelor tumorosupresoare ca APC, MLH1 si MSH2 indica un risc foarte crescut de cancer colorectal, constituind indicatie pentru supraveghere si recomandare pentru chirurgie profilactica (Wilson, Ladner et al, 2007; Koopman, Venderbosch et al, 2009). Alti markeri somatici au o valoare prognostica modesta sau neconfirmata, nefiind utilizati in clinica (Walther, Johnstone et al, 2009). Cancerele colorectale sporadice cu mutatii ale genelor de reparare ADN au in general un prognostic favorabil (Ogino, Nosho et al, 2009).
Ratele mici de supravietuire in stadiile II si III au fost asociate cu pierderea p27 (reglator preapoptotic al ciclului celular) (Bertagnolli, Warren et al, 2009) sau pierderea heterozigotiei la locusul cromozomial 18q (Watanabe, Kobunai et al, 2010).
Studiile de epidemiologie genetica si cele pe gemeni monozigoti au aratat ca 35-100% dintre adenoamele si cancerele colorectale se dezvolta la indivizi cu o susceptibilitate mostenita (Cnattingius, Lundberg et al, 2009; Pasche si Yi, 2010). În plus, in unele familii exista un sindrom asemanator cu HNPCC dar fara dovezi ale mutatiei genelor de reparare a nepotrivirilor de baze ADN (Papaemmanuil, Carvajal-Carmona et al, 2008). Au fost identificati cativa loci genomici care ar putea gazdui gene de susceptibilitate cu penetranta inalta (Zanke, Greenwood et al, 2007; Neklason, Kerber et al, 2008; Neklason, Tuohy et al, 2010). Studii de asociere la nivel genomic au identificat variante ereditare de ADN puternic asociate cu susceptibilitatea la cancer colorectal, dar utilitatea clinica este limitata deoarece riscul relativ asociat cu aceste variante este scazut (Le Marchand, 2009; Olschwang, Vernerey et al, 2009; von Holst, Picelli et al, 2010).
Progresele recente ale tehnicilor moleculare pentru detectia precoce a cancerului colorectal arata ca depistarea genelor si a cailor care controleaza primele etape ale bolii, precum si susceptibilitatea individuala ar putea contribui in viitorul apropiat la imbunatatirea managementului clinic.
Studiile care contribuie la intelegerea cancerului colorectal la nivel molecular au furnizat date folosite pentru testele genetice a formelor familiale, definirea de markeri predictivi pentru selectarea pacientilor susceptibili la anumite forme de terapie si realizarea de teste de diagnostic molecular pentru detectia non-invaziva a cancerelor incipiente.
Au fost identificate noi cai biologice care ar putea conduce la descoperirea de agenti terapeutici noi. Desi unele mutatii cu frecventa inalta sunt tinte atractive pentru dezvoltarea de noi medicamente, acestea ar putea viza tinte aflate in aval pe cai de semnalizare comune.
Întelegerea semnalelor care dicteaza fenotipul metastastazant va furniza informatii necesare dezvoltarii de noi medicamente pentru prevenirea si controlul progresiei bolii.
Progresele considerabile inregistrate recent ne permit sa credem ca imbunatatirea cunostiintelor referitoare la bazele moleculare ale cancerului colorectal va continua sa conduca la progrese in diagnosticul si managementul acestei boli.
Copyright © 2024 - Toate drepturile rezervate