 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
TEST DE REPRODUCERE PENTRU DAPHNIA MAGNA
METODA
Prezenta metoda de testare a toxicitatii pentru reproducere reproduce Linia directoare 211 a OCDE (1998).
INTRODUCERE
Obiectivul principal al testului este evaluarea efectului produselor chimice asupra randamentului de reproducere al Daphnia magna.
DEFINITII SI UNITATI
Animale parinti: sunt acele femele de dafnia prezente la inceputul testului si al caror randament de reproducere constituie obiectul studiului.
Progenitura: exemplarele tinere de dafnia produse de animalele parinti in cursul testului.
Concentratia la care se observa cele mai mici efecte (CMEO): este concentratia cea mai mica experimentata la care se observa un efect important al substantei din punct de vedere statistic asupra reproducerii si mortalitatii parintilor (la p < 0,05) in comparatie cu martorul, intr-un timp de expunere stabilit. Cu toate acestea, toate concentratiile experimentate mai mari decat CMEO trebuie sa aiba un efect nociv egal cu sau mai mare decat cele observate la CMEO. Cand cele doua conditii mentionate nu pot fi satisfacute, trebuie sa se prezinte o explicatie completa a modului de alegere a CMEO (si, prin urmare, CFEO).
Concentratia la care nu se observa nici un efect (CFEO): este concentratia experimentata imediat sub CMEO, care, in comparatie cu martorul, nu are un efect important din punct de vedere statistic (p < 0,05), intr-un timp de expunere stabilit.
ECx: este concentratia substantei testate dizolvate in apa care genereaza o reducere de x % a reproducerii la Daphnia magna intr-un timp de expunere stabilit.
Rata intrinseca de inmultire: este o masura a cresterii populatiei care cuprinde capacitatea de reproducere si mortalitatea specifica varstei (20) (21) (22). La populatiile in stare stabila, aceasta va fi egala cu zero. La populatiile in crestere, aceasta va fi pozitiva si la populatiile in scadere, va fi negativa. Este clar ca aceasta din urma nu este de sustinut si in final va duce la disparitie.
Limita de detectie: este cea mai mica concentratie care se poate detecta dar nu se poate masura.
Limita de determinare: este cea mai mica concentratie care se poate determina cantitativ.
Mortalitatea: un animal se inregistreaza ca mort atunci cand este imobil, adica atunci cand nu poate sa inoate sau daca nu se observa o miscare a organelor externe sau a post-abdomenului, in 15 secunde de la o usoara agitare a recipientului experimental. (Daca se utilizeaza o alta definitie, aceasta se specifica impreuna cu sursa bibliografica).
PRINCIPIUL METODEI DE TESTARE
Femelele tinere de dafnia (animale parinti), in varsta de mai putin de 24 ore la inceputul testului, sunt expuse la substanta testata, adaugata intr-o o serie de concentratii diferite. Durata testului este de 21 de zile. La sfarsitul testului, se evalueaza numarul total de progenituri in viata produse per animal parinte viu la sfarsitul testului. Aceasta inseamna ca tineretul produs de adultii care mor in timpul testului este exclus din calcule. Capacitatea de reproducere a animalelor parinti se poate exprima in alte moduri (de ex. numarul de progenituri in viata produse per animal per zi, din prima zi in care s-au observat progeniturile), dar acestea se semnaleaza in afara de numarul total de tineret produs per parinte viu la sfarsitul testului. Capacitatea de reproducere a animalelor expuse la substanta testata se compara cu aceea a martorului (rilor) pentru a determina concentratia la care se observa cele mai mici efecte (CMEO) si, din aceasta, concentratia la care nu se observa nici un efect (CFEO). In afara de aceasta si in masura in care este posibil, rezultatele sunt analizate cu ajutorul unui model de regresie pentru estimarea concentratiei care ar putea sa provoace o reducere cu x % a capacitatii de reproducere (adica EC50, EC20 sau EC10).
De asemenea, se semnaleaza supravietuirea animalelor parinti si timpul producerii primilor pui. Se mai pot studia alte efecte aferente substantei asupra unor parametri cum ar fi cresterea (de ex. lungimea) si posibil rata intrinseca de inmultire.
DATE PRIVIND SUBSTANTA TESTATA
Datele unui test de toxicitate acuta (metoda C.2, partea I) efectuat cu Daphnia magna trebuie sa fie disponibile. Rezultatul poate sa fie util la selectarea unui domeniu potrivit de concentratii experimentale in testele de reproducere. Este necesar sa se cunoasca solubilitatea in apa si presiunea de vapori a substantei testate si sa existe o metoda analitica fiabila pentru determinarea cantitativa a substantei in solutiile experimentale, cu eficienta recuperarii si limita de detectie specificate.
Datele privind substanta testata, care pot sa fie utile in stabilirea conditiilor de testare, includ formula structurala, puritatea substantei, stabilitatea la lumina, stabilitatea in conditiile testului, pKa, Poa si rezultatele testului pentru biodegradabilitate imediata (a se vedea metoda C,4).
VALIDITATEA TESTULUI
Pentru ca un test sa fie valid, martorul (martorii) trebuie sa indeplineasca urmatoarele criterii de performanta:
mortalitatea animalelor parinti (femele de dafnia) sa nu depaseasca 20% la sfarsitul testului,
numarul mediu de progenituri vii produse per animal parinte supravietuitor la sfarsitul testului sa fie ≥ 60.
DESCRIEREA METODEI DE TESTARE
Aparatura
Vasele experimentale si alta aparatura care vine in contact cu solutiile experimentale trebuie sa fie realizate in intregime din sticla sau alt material inert din punct de vedere chimic. De obicei, vasele experimentale sunt pahare de laborator.
In afara de acestea, mai sunt necesare urmatoarele aparate:
contor de oxigen (cu microelectrod sau alt dispozitiv corespunzator pentru masurarea oxigenului dizolvat in probe de volum mic),
aparat specific pentru controlul temperaturii,
pH-metru,
aparat pentru determinarea duritatii apei,
aparat pentru determinarea concentratiei totale de carbon organic (COT) in apa sau aparat pentru determinarea consumului chimic de oxigen (CCO),
aparat specific pentru controlul regimului de iluminare si masurarea intensitatii luminii.
Organismul experimental
Specia utilizata in test este Daphnia magna Straus. Se pot utiliza si alte specii de dafnia, cu conditia ca acestea sa indeplineasca criteriile de validitate dupa caz (criteriul de validitate referitor la cpacitatea de reproducere la martori trebuie sa fie relevant pentru speciile dafnia). Daca se utilizeaza alte specii de dafnia, acestea trebuie sa se identifice in mod clar si sa se justifice utilizarea lor.
De preferinta, clonul trebuie sa fi fost identificat dupa genotip. Studiul (1) a aratat ca performanta de reproducere a clonului A (care provine din IRCHA din Franta) (3) satisface complet criteriile de validitate pentru o medie de ≥ 60 progenituri per animal parinte supravietuitor atunci cand se cultiva in conditiile descrise in prezenta metoda. Cu toate acestea, se accepta si alti cloni, cu conditia sa se indice indeplinirea criteriilor de validitate pentru test de catre cultura de dafnia.
La inceputul testului, animalele trebuie sa fie mai tinere de 24 ore si nu trebuie sa fie prima generatie. Acestea trebuie sa provina dintr-o colonie sanatoasa (adica fara semne de stres, cum ar fi mortalitatea mare, prezenta masculilor si ephippia, intarziere in producerea primilor descendenti, animale decolorate etc.). Animalele din colonie trebuie tinute in conditii de cultura (lumina, temperatura, mediu, hrana si numar de animale per unitatea de volum) similare cu cele utilizate in test. Daca mediul de cultura ce urmeaza sa fie utilizat in test este diferit de cel pentru cultura obisnuita de dafnia, este o buna practica sa se includa o perioada de aclimatizare inaintea testului, de obicei de aproximativ trei saptamani (adica o generatie), pentru a evita stresarea animalelor parinti.
Mediul experimental
In prezentul test, se recomanda utilizarea unui mediu bine definit. Acesta poate sa evite utilizarea aditivilor (de ex. plante de mare, extract de sol etc.) a caror caracterizare este dificila si, prin urmare, se imbunatatesc posibilitatile de standardizare intre laboratoare. S-a gasit ca mediile Elendt M4 (4) si M7 (vezi anexa 1) sunt potrivite in acest sens. Cu toate acestea, se pot accepta si alte medii [de ex. (5) (6)], cu conditia sa asigure realizarea unei culturi de dafnia care sa intruneasca criteriile de validitate pentru test.
Daca se utilizeaza medii ce contin aditivi care nu sunt caracterizati, este necesar ca aditivii respectivi sa se specifice clar si, in raportul de testare, sa se prezinte date privind compozitia, in special continutul de carbon, deoarece acesta poate contribui la hrana furnizata. Se recomanda determinarea concentratiei totale de carbonului organic (COT) si/sau a consumul chimic de oxigen (CCO) la prepararea amestecului de aditivi organici si sa se faca o estimare a contributiei rezultate la COT/CCO in mediul experimental. Se recomanda ca valorile COT in mediu (adica inainte de adaugarea algelor) sa fie mai mici de 2 mg/l (7).
Cand se testeaza substante cu continut de metale, este important sa se admita ca proprietatile mediului experimental (de ex. duritatea, capacitatea de chelatizare) ar putea sa aiba legatura cu toxicitatea substantei studiate. De aceea, este de preferat un mediu bine caracterizat. Cu toate acestea, in prezent, singurele medii bine caracterizate care se cunosc ca fiind optime pentru cultura pe termen lung a Daphnia magna sunt Elendt M4 si M7. Ambele medii contin agentul de chelatizare EDTA. Cercetarile (2) arata ca "toxicitatea aparenta" a cadmiului este in general mai mica atunci cand testul de reproducere se realizeaza in mediile M4 si M7 decat in mediile cu continut de EDTA. Prin urmare, M4 si M7 nu se recomanda pentru substantele de proba ce contin metale si, de asemenea, trebuie sa se evite alte medii ce contin agenti de chelatizare cunoscuti. Pentru substantele cu continut de metale, se poate recomanda utilizarea unui mediu alternativ, de ex. apa dura proaspata reconstituita conform ASTM (7), care nu contine EDTA, cu adaos de extract de plante de mare (8). Combinatia mentionata, de apa dura proaspata reconstituita conform ASTM si extract de plante de mare, este potrivita si pentru cultura pe termen lung si testarea Daphnia magna (2), desi aceasta mai exercita o actiune slaba de chelatizare datorita componentei organice din extractul de plante de mare adaugat.
La inceputul si in timpul testului, concentratia oxigenului dizolvat trebuie sa fie mai mare de 3 mg/l. pH-ul trebuie sa aiba valori in domeniul 6-9 si, in mod normal, nu trebuie sa varieze cu mai mult de 1,5 unitati in oricare din incercari. Se recomanda o duritate mai mare de 140 mg/l (exprimata in CaCO3). Testele efectuate la aceasta valoare si la valori mai mari au demonstrat o performanta a reproducerii conforma cu criteriile de validitate (9) (10).
Solutiile experimentale
Solutiile experimentale de concentratiile alese se prepara de obicei prin diluarea unei solutii mama. Solutiile mama se prepara de preferinta prin dizolvarea substantei in mediul experimental.
In unele cazuri, s-ar putea sa fie necesara utilizarea solventilor organici sau a agentilor de dispersie pentru a obtine o solutie mama de concentratia indicata, dar trebuie facut tot posibilul pentru a se evita utilizarea acestor materiale. Ca solventi potriviti se pot utiliza acetona, etanolul, metanolul, dimetilformamida si trietilen glicolul. Exemple de agenti de dispersie potriviti sunt Cremophor RH40, metilceluloza 0,01% si HCO-40. In orice caz, substanta testata in solutiile experimentale nu trebuie sa depaseasca limita de solubilitate in mediul experimental.
Se utilizeaza solventi pentru a obtine o solutie mama care sa se poata doza cu exactitate in apa. La concentratia recomandata a solventului in mediul experimental final (adica ≤ 0,1 ml/l), solventii enumerati anterior nu sunt toxici si nu cresc solubilitatea in apa a unei substante.
Agentii de dispersie pot sa faciliteze dozarea exacta si dispersia. La concentratia recomandata in mediul experimental final (≤ 0,1 ml/l), agentii de dispersie enumerati anterior nu sunt toxici si nu cresc solubilitatea in apa a unei substante.
PROTOCOLUL TESTULUI
Tratamentele se repartizeaza tuturor vaselor experimentale si toata manipularea ulterioara a vaselor experimentale se face in mod aleatoriu. Nerespectarea acestui principiu poate sa aduca prejudicii care pot fi interpretate ca fiind un efect al concentratiei. In special, daca unitatile experimentale sunt manipulate in ordinea tratamentului sau a concentratiei, atunci unele efecte care depind de timp, cum ar fi oboseala operatorului sau alta eroare, ar putea sa genereze efecte mai mari la concentratii mai mari. In plus, daca exista posibilitatea ca rezultatele testului sa fie influentate de o conditie initiala sau de mediu a testului, cum ar fi pozitia in laborator, atunci trebuie sa se aiba in vedere oprirea testului.
MODUL DE LUCRU
Conditii de expunere
Durata
Durata testului este de 21 de zile.
Incarcarea
Animalele parinti se tin individual, cate unul in fiecare vas experimental, care contine 50 -100 ml mediu.
Uneori, s-ar putea sa fie necesare volume mai mari pentru a satisface conditiile procedeului analitic utilizat pentru determinarea concentratiei substantei testate, desi este permisa si unirea probelor duble pentru analiza chimica. Daca se utilizeaza volume mai mari de 100 ml, s-ar putea ca ratia furnizata pentru dafnia sa fie crescuta pentru a asigura o alimentatie adecvata si respectarea criteriilor de validitate. Pentru testele in flux continuu, se pot avea in vedere, din motive tehnice, alte protocoale (de ex. patru grupe de 10 animale intr-un volum de mediu experimental mai mare), dar se specifica orice modificari ale protocolului testului.
Numarul animalelor
Pentru testele semistatice, cel putin 10 animale tinute fiecare la fiecare concentratie experimentata si cel putin 10 animale tinute fiecare in seria martor.
Pentru testele in flux continuu, s-a dovedit ca sunt necesare 40 de animale impartite in patru grupe de cate 10 animale pentru fiecare concentratie experimentata (1). Se pot utiliza mai putine organisme experimentale si se recomanda un minimum de 20 de animale per concentratie, impartite in doua sau mai multe probe identice cu un numar egal de animale (de ex. patru probe identice, fiecare cu cinci daphnide). De retinut ca pentru testele in care animalele sunt tinute in grupe, nu va fi posibila exprimarea capacitatii de reproducere sub forma numarului total de progenituri vii produse per animal parinte in viata la sfarsitul testului, daca animalele parinti mor. In aceste cazuri, capacitatea de reproducere se exprima prin "numarul total de progenituri vii produse per parinte prezent la inceputul testului".
Administrarea hranei
Pentru testele semistatice, hrana se administreaza de preferinta zilnic, dar cel putin de trei ori pe saptamana (adica sa corespunda modificarilor mediilor). Se consemneaza orice abatere de la aceasta regula ( de ex. pentru testele in flux continuu).
Pe durata testului, hrana animalelor parinti este alcatuita de preferinta din celule de alge vii din una sau mai multe din urmatoarele specii: Chlorella sp., Selenastrum capricornutum [acum Pseudokirchneriella subcapitata (11)] si Scenedesmus subspicatus. Regimul alimentar ia in consideratie continutul de carbon organic (C) administrat fiecarui animal parinte. Cercetarile (12) au aratat ca, pentru Daphnia magna, ratiile cuprinse intre 0,1 si 0,2 mg C/dafnia/zi sunt suficiente pentru obtinerea numarului necesar de progenituri care sa satisfaca criteriile de validitate a testului. Ratia se poate administra fie sub forma unei portii constante pe toata perioada testului sau, daca se doreste, se administreaza o portie mai mica la inceput si apoi se creste in timpul testului, tinand cont de cresterea animalelor parinti. In cazul mentionat, ratia tot trebuie sa ramana intre valorile recomandate de 0,1-0,2 mg C/dafnia/zi tot timpul.
Daca urmeaza sa se utilizeze masuri inlocuitoare, de ex. numarul de celule de alge sau absorbanta luminii, la administrarea ratiei (adica pentru usurinta, deoarece masurarea continutului de carbon dureaza mult), fiecare laborator trebuie sa-si realizeze propria nomograma referitoare la masura inlocuitoare pentru continutul de carbon al culturii de alge (a se vedea apendicele 2 pentru recomandarea privind realizarea nomogramei). Nomogramele se verifica cel putin anual si mai frecvent, daca au fost schimbate conditiile de cultura a algelor. S-a gasit ca absorbanta luminii este un inlocuitor mai bun pentru continutul de carbon decat numarul de celule (13).
Pentru a minimiza volumul mediului de cultura de alge transferat in vasele experimentale se administreaza o suspensie de alge concentrata pentru dafnia. Concentratia de alge se poate obtine prin centrifugare urmata de resuspensie in apa distilata, apa deionizata sau mediu de cultura pentru dafnia.
Lumina
16 ore de lumina la o intensitate de maximum 15-20 μE · m-2 · s-1.
Temperatura
Temperatura mediilor experimentale trebuie sa fie cuprinsa intre valorile 18-22oC. Cu toate acestea, pentru nici un test, temperatura nu trebuie sa varieze, daca se poate, cu mai mult de 2oC in limitele specificate (de ex. 18-20, 19-21 sau 20-22oC). S-ar putea sa fie necesara utilizarea unui vas experimental suplimentar pentru urmarirea temperaturii.
Aerarea
Vasele experimentale nu se aereaza in timpul testului.
Concentratia experimentata
In mod normal, trebuie sa existe cel putin cinci concentratii experimentate aranjate in serie geometrica cu un factor de separare de maximum 3,2 si trebuie sa se utilizeze numarul optim de probe identice pentru fiecare concentratie experimentata (a se vedea pct. 1.8.1.3). Daca se utilizeaza mai putin de cinci concentratii, acest lucru se justifica. Substantele nu se testeaza la concentratii mai mari decat limita de solubilitate a acestora in mediul experimental.
La stabilirea domeniului de concentratii, trebuie sa se retina urmatoarele:
(i) daca se urmareste obtinerea CMEO/CFEO, cea mai mica concentratie experimentata trebuie sa fie suficient de mica, astfel incat fecunditatea la aceasta concentratie sa nu fie cu mult mai mica decat aceea din martor. Daca nu este asa, testul va trebui sa fie repetat cu concentratia cea mai mica redusa;
(ii) daca se urmareste obtinerea CMEO/CFEO, cea mai mare concentratie experimentata trebuie sa fie suficient de mare, astfel incat fecunditatea la aceasta concentratie sa fie cu mult mai mica decat aceea din martor. Daca nu este asa, testul va trebui sa fie repetat cu concentratia cea mai mare sporita;
(iii) daca se determina ECx pentru efectele asupra reproducerii, se recomanda utilizarea unor concentratii suficiente pentru stabilirea ECx cu un nivel corespunzator de siguranta. Daca se determina EC50 pentru efectele asupra reproducerii, se recomanda ca cea mai mare concentratie experimentata sa fie mai mare decat EC50 mentionat. In caz contrar, desi va fi posibila inca determinarea EC50, intervalul de siguranta pentru EC50 va fi foarte larg si s-ar putea sa nu fie posibil sa se aprecieze daca modelul este cel indicat;
(iv) este de preferat ca valorile concentratiei experimentate sa nu includa concentratii care au efect important din punct de vedere statistic asupra supravietuirii adultilor, deoarece acest lucru ar modifica natura testului de la un test pur si simplu de reproducere la un test combinat de reproducere si mortalitate care necesita o analiza statistica mult mai complexa.
Cunoasterea in prealabil a toxicitatii substantei testate (de ex. dintr-un test de toxicitate acuta si/sau din studii de gasire a domeniului) ar fi utila in selectarea concentratiilor optime pentru test.
Daca se utilizeaza un solvent sau un agent de dispersie pentru a facilita prepararea solutiilor experimentale (a se vedea pct. 1.6.4), concentratia acestuia in vasele experimentale nu trebuie sa fie mai mare de 0,1 ml/l si trebuie sa fie aceeasi in toate vasele.
Probele martor
In afara de seria pentru test, se mai realizeaza o serie de probe martor pentru mediul experimental si, de asemenea, daca este relevant, o serie de probe martor care contin solventul sau agentul de dispersie. Daca se utilizeaza, concentratia solventului sau agentului de dispersie trebuie sa fie egala cu cea utilizata in vasele ce contin substanta testata. Se utilizeaza numarul optim de probe identice (a se vedea pct. 1.8.1.3).
In general, intr-un test bine realizat, coeficientul de variatie in jurul numarului mediu de progenituri vii obtinute per animal parinte in proba (probele) martor este ≤ 25% si acest lucru se consemneaza in protocoalele testului care utilizeaza animale tinute separat.
Reinnoirea mediului experimental
Frecventa reinnoirii mediului experimental depinde de stabilitatea substantei testate, dar trebuie sa fie de cel putin trei ori pe saptamana. Daca, din testele preliminare de stabilitate (a se vedea pct. 1.4), concentratia substantei testate nu este stabila (adica nu se incadreaza in intervalul 80-120%) din valoarea nominala sau este mai mica de 80% din concentratia initiala masurata) in perioada maxima de reinnoire (adica trei zile), trebuie sa se aiba in vedere o reinnoire mai frecventa a mediului sau sa se utilizeze un test in flux continuu.
Cand un mediu este reinnoit in teste semistatice, se pregateste o a doua serie de vase experimentale si animalele parinti se transfera in acestea cu ajutorul, de exemplu, unei pipete de sticla cu un diametru potrivit. Volumul mediului transferat cu dafnia trebuie sa fie minim.
Observatii
Rezultatele observatiilor facute in timpul testului se consemneaza in fise tehnice (a se vedea exemple in anexele 3 si 4). Daca sunt necesare alte masuratori (a se vedea 1.3 si 1.8.8), s-ar putea sa fie necesare observatii suplimentare.
Progeniturile
Progeniturile produse de fiecare animal parinte se scot de preferinta si se numara zilnic de la aparitia primilor pui, pentru a preveni consumarea de catre acestia a hranei destinate adultilor. In sensul prezentei metode, se numara doar numarul de progenituri vii, dar se consemneaza si prezenta oualor avortate sau a progeniturilor decedate.
Mortalitatea
Mortalitatea in randul animalelor parinti se inregistreaza de preferinta zilnic, cel putin de cate ori se numara progeniturile.
Alti parametri
Desi prezenta metoda este destinata in principal evaluarii efectelor asupra reproducerii, este posibil sa se poata masura si alte efecte suficient pentru a permite o analiza statistica. Masuratorile de crestere sunt de dorit in mare masura, deoarece ofera date privind posibilele efecte subletale, care s-ar putea sa fie mai utile decat determinarea doar a reproducerii; se recomanda masurarea lungimii animalelor parinti (adica lungimea corpului, fara inotatoarea caudala, la sfarsitul testului. Alti parametri care se pot masura sau calcula includ timpul de producere a primului pui (si a puilor ulteriori), numarul si dimensiunea puilor per animal, numarul de pui avortati, prezenta masculilor sau ephippia si rata intrinseca a cresterii populatiei.
Frecventa determinarilor si masuratorilor analitice
Este necesar sa se masoare concentratia oxigenului, temperatura, duritatea si valorile pH-ului cel putin o data pe saptamana, in mediile proaspete si cele vechi, in proba (probele) martor si in concentratiile cele mai mari de substanta testata.
In timpul testului, se determina concentratia substantei testate la intervale regulate.
In testele semistatice, unde se estimeaza o mentinere a concentratiei substantei testate in limitele de ± 20% din cea nominala (adica in intervalul de 80-120% - a se vedea 1.4 si 1.8.4), se recomanda analizarea cel putin a celei mai mari si a celei mai mici concentratii experimentate, atunci cand solutiile sunt proaspat preparate si cand sunt reinnoite in timpul primei saptamani de testare (adica analizele se realizeaza pe o proba din aceeasi solutie - atunci cand este proaspat preparata si la reinnoire). Ulterior, determinarile respective se repeta la intervale de cel putin o saptamana.
Pentru testele in care nu se estimeaza mentinerea concentratiei substantei testate in limitele de ± 20% din cea nominala, este necesara analizarea tuturor concentratiilor experimentate, atunci cand solutiile sunt proaspat preparate si la reinnoire. Cu toate acestea, pentru acele teste in care concentratia initiala masurata a substantei testate nu se situeaza in limitele de ± 20% din cea nominala, dar se pot aduce dovezi care sa indice repetabilitatea si stabilitatea concentratiilor initiale (adica in intervalul de 80-120% din concentratiile initiale), determinarea chimica se poate reduce in saptamanile 2 si 3 de testare la cea mai mare si cea mai mica concentratie experimentata. In toate cazurile, este necesar sa se determine concentratiile substantei testate inaintea reinnoirii doar la un vas din cele identice pentru fiecare concentratie experimentata.
Daca se utilizeaza un test cu flux continuu, se recomanda un regim de prelevare a probelor similar cu cel descris pentru testele semistatice (dar masurarea solutiilor "vechi" nu se aplica in acest caz).Cu toate acestea, ar putea fi recomandabil sa se creasca numarul prelevarilor de probe in prima saptamana (de ex. trei seturi de masuratori) pentru a asigura mentinerea stabilitatii concentratiilor experimentale.La aceste tipuri de testari, trebuie verificat zilnic fluxul diluantului si al substantei testate.
Daca se poate dovedi mentinerea satisfacatoare, pe toata durata testului, a concentratiei substantei testate in limitele de ± 20% din cea nominala sau masurata initial, atunci rezultatele se pot obtine din valoarea nominala sau din cea masurata initial. Daca abaterea de la concentratia nominala sau cea masurata initial este mai mare de ± 20%, este necesar ca rezultatele sa se exprime in functie de media ponderata in timp (a se vedea apendicele 5).
REZULTATELE SI RAPORTAREA
PRELUCRAREA REZULTATELOR
Scopul prezentului test il constituie determinarea efectului substantei testate asupra numarului total de progenituri vii produse per animal parinte in viata la sfarsitul testului. Numarul total de progenituri per animal parinte se calculeaza pentru fiecare vas experimental (adica proba repetata). Daca, in fiecare proba repetata, animalul parinte moare in timpul testului sau se dovedeste a fi mascul, atunci proba repetata se exclude din analiza. Analiza se va face atunci pentru un numar redus de probe identice.
Pentru estimarea CMEO si, prin urmare, a CFEO, pentru efectele substantei chimice asupra capacitatii de reproducere, este necesar sa se calculeze capacitatea medie de reproducere pentru toate probele identice pentru fiecare concentratie si deviatie standard remanenta comuna si acest lucru se poate realiza prin analiza de varianta (ANOVA). Apoi, media pentru fiecare concentratie se compara cu media probelor martor, utilizand o metoda potrivita de comparare multipla. Ar putea sa fie utile testele Dunnett sau Williams (14) (15) (16) (17). Este necesar sa se verifice daca estimarea ANOVA de varianta uniforma este valabila. Se recomanda ca acest lucru sa se faca mai degraba grafic decat printr-un test de importanta oficiala (18); o varianta potrivita este efectuarea unui test Barlett. Daca aceasta estimare (ANOVA) nu este valabila, atunci ar trebui sa se aiba in vedere transformarea datelor pentru a omogeniza variantele inaintea efectuarii ANOVA sau+ efectuarea unei ANOVA ponderate. Se calculeaza si se prezinta dimensiunea efectului detectabil prin utilizarea ANOVA (adica diferenta cea mai putin importanta).
Pentru estimarea concentratiei care ar putea sa genereze o reducere de 50% a capacitatii de reproducere (adica EC50), trebuie sa se realizeze o reprezentare grafica corespunzatoare a datelor, de ex. printr-o curba logaritmica, utilizand o metoda statistica cum ar fi metoda celor mai mici patrate. Curba ar putea sa fie bine caracterizata in functie de parametri, astfel incat sa se poata determina direct EC50 si eroarea sa standard. Aceasta ar usura mult calcularea limitelor de incredere pentru EC50. Cu exceptia cazului in care exista motive intemeiate sa se prefere limite de incredere diferite, se fixeaza limite de incredre de 95% de ambele parti. Este preferabil ca procedeul de trasare a curbei sa ofere un mijloc pentru evaluarea semnificatiei ajustarii incomplete. Acest lucru se poate realiza grafic sau prin impartirea sumei remanente de patrate in "ajustare incompleta" si "componente de eroare pura" si prin efectuarea unui test de importanta pentru ajustarea incompleta. Deoarece exista posibilitatea ca tratamentele care dau o fecunditate mare sa aiba o varianta mai mare a numarului de animale tinere produse decat tratamentele care dau o fecunditate mica, trebuie sa se aiba in vedere ponderarea valorilor observate pentru a reflecta variantele diferite din grupele tratate diferit [a se vedea referinta bibliografica (18) pentru date de baza].
Din analiza datelor din testul final de intercalibrare (2) , s-a trasat o curba logaritmica cu ajutorul modelului prezentat in continuare, desi se pot utiliza si alte modele:
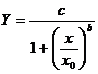
unde:
|
Y: |
numarul total de animale tinere per animal parinte in vaita la sfarsitul testului (calculat pentru fiecare vas) |
|
x: |
concentratia substantei |
|
c: |
numarul preconizat de animale tinere atunci cand x = 0 |
|
x0: |
EC50 in populatie |
|
b: |
panta curbei |
Se pare ca acest model este adecvat unui numar mare de situatii, dar exista teste pentru care nu este potrivit. Este necesara verificarea validitatii modelului recomandat anterior. In unele cazuri, se poate sa fie potrivit modelul hormetic, in care concentratiile mici genereaza efecte sporite (19).
Se mai pot estima si alte concentratii de efect, de ex. EC10 sau EC20, desi ar fi preferabil sa se utilizeze o caracterizare functie de parametri a modelului diferita de cea utilizata la determinarea EC50.
RAPORT DE TESTARE
Raportul de testare trebuie sa includa urmatoarele:
Substanta testata:
natura fizica si proprietatile fizico-chimice relevante,
date de identificare chimica, inclusiv puritatea.
Speciile experimentale:
clonul (daca a fost caracterizat genetic, astfel incat sa corespunda speciei), furnizorul sau sursa (daca se cunoaste) si conditiile de cultura utilizate. Daca se utilizeaza o specie diferita de Daphnia magna, acest lucru se consemneaza si se justifica.
Conditiile experimentale
modul de lucru utilizat (de ex. semistatic sau in flux continuu, volumul, incarcarea in numar de dafnia pe litru),
timpul de expunere la lumina si intensitatea luminii,
protocolul testului (de ex. numarul de probe identice, numarul de parinti pentru fiecare proba repetata),
detalii privind mediul de cultura utilizat,
adaosurile de material organic, daca se practica, inclusiv compozitia, sursa, metoda de preparare, raportul COT/CCO al amestecurilor preparate, determinarea raportului COT/CCO rezultat in mediul experimental
date detaliate privind hrana, inclusiv cantitatea (in mg C/dafnia/zi) si programul (de ex. tipul hranei, care include pentru alge denumirea specifica (specia) si, daca se cunoaste, familia, conditiile de cultura),
metoda de preparare a solutiilor mama si frecventa reinnoirii (daca se utilizeaza un solvent sau agent de dispersie, concentratia acestora).
Rezultatele:
rezultatele oricaror studii preliminare privind stabilitatea substantei testate,
concentratiile nominale experimentate si rezultatele tuturor analizelor pentru determinarea concentratiei substantei testate in vasele experimentale (a se vedea fisele tehnice din apendicele 4); de asemenea, se prezinta eficienta de regenerare a metodei si limita determinarii,
calitatea apei din vasele experimentale (adica pH, temperatura si concentratia oxigenului dizolvat, COT si/sau CCO si duritatea, daca este cazul,
fisa completa cu progeniturile vii pentru fiecare animal parinte (a se vedea exemplul de fisa tehnica din apendicele 3),
numarul de decese printre animalele parinti si ziua in care au avut loc (a se vedea exemplul de fisa tehnica din apendicele 3),
coeficientul de variatie pentru fecunditatea martorului (pe baza numarului total de progenituri vii per animal parinte in viata la sfarsitul testului),
reprezentarea grafica a numarului total de progenituri vii per animal parinte (pentru fiecare proba identica) in viata la sfarsitul testului in functie de concentratia substantei testate,
concentratia la care se observa cele mai mici efecte (CMEO) pentru reproducere, care include o descriere a metodelor statistice utilizate si indicarea dimensiunii efectului care ar putea sa fie detectat si concentratia la care nu se observa nici un efect (CFEO) pentru reproducere; daca este cazul, se consemneaza si raportul LOEC/CFEO pentru mortalitatea animalelor parinti,
daca este cazul, ECx pentru reproducere cu intervalele de incredere si reprezentarea grafica a modelului utilizat pentru calculul acesteia, panta curbei doza-raspuns si erorile standard ale acesteia,
alte efecte biologice observate sau masuratori: se consemneaza orice alte efecte biologice care au fost observate sau masurate (de ex. cresterea animalelor parinti), inclusiv o justificare corespunzatoare,
explicarea oricarei abateri de la modul de lucru.
BIBLIOGRAFIE
OECD Test Guideline Programme, Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, UK, 20-21 March 1993.
OECD Environmental Health and Safety Publications. Series on Testing and Assessment No. 6. Report of the Final Ring Test of the Daphnia magna Reproduction Test Paris. 1997.
Baird D. J., Barber J., Bradley M. C., Soares A. M. V. M. and Calow P. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Strauss. Ecotoxicology and Environmental Safety, 21, pp. 257-265.
Elendt B. P., (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33.
EPA (1993). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. (Fourth ed.). EPA/600/4-90/027F. C. I. Weber (ed), USEPA, Cincinnati, Ohio.
Vigano L., (1991) Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, pp. 775-782.
ASTM (1988). Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates and Amphibians. E729-88a. American Society for Testing and Materials, Philadelphia P.A. 20 pp.
Baird D. J., Soares A. M. V. M., Girling A., Barber J., Bradley M. C. and Calow P. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H. Løkke, H. Tyle & F. Bro-Rasmussen. Eds.), pp. 144-148.
Parkhurst B. R., Forte J. L. and Wright G. P. (1981). Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26, pp. 1-8.
Cowgill U. M. and Milazzo D. P. (1990) The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2), pp. 185-196.
Korshikov (1990). Pseudokirchneriella subcapitata Hindak, F-1990. Biologice Prace, 36, 209.
Sims I. R., Watson S. and Holmes D. (1993). Toward a standard Daphnia juvenile production test. Environmental Toxicology and Chemistry, 12, pp. 2053-2058.
Sims I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, pp. 459-466.
Dunnett C. W., (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, pp. 1096-1121.
Dunnett C. W., (1964). New tables for multiple comparisons with a control. Biometrics, 20, pp. 482-491.
Williams D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, pp. 103-117.
Williams D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, pp. 510-531.
Draper N. R. and Smith H. (1981). Applied Regression Analysis, second edition, Wiley, N.Y.
Brain P. and Cousens R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed Research, 29, pp. 93-96.
Wilson E. O. and Bossert, W. H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers.
Poole R. W. (1974). An Introduction to quantitative Ecology. McGraw-Hill Series in Population Biology, New York, pp. 532.
Meyer J. S., Ingersoll C. G., McDonald L. L. and Boyce M. S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, pp. 1156-1166.
ANEXA 1
PREPARAREA MEDIILOR ELENDT M7 SI M4 COMPLET DETERMINATE
Adaptarea la mediile Elendt M7 si M4
Unele laboratoare au intampinat dificultati la transferul direct al dafniei in mediile M4 (1) si M7. Cu toate acestea, s-au obtinut unele succese in adaptarea treptata, adica transferul din mediul propriu in 30% Elendt, apoi 60% Elendt si apoi in 100% Elendt. Perioadele de adaptare pot sa fie de o luna.
PREPARAREA
Microelementele
Se prepara mai intai solutii mama separate (I) ale fiecarui microelement in apa de puritate corespunzatoare de ex. deionizata, distilata sau purificata prin osmoza inversa. Din solutiile mama mentionate (I), se prepara o solutie mama unica (II), care contine toate microelementele (solutie combinata), adica:
|
Solutiile mama I |
Cantitatea adaugata in apa |
Concentratia (in functie de mediul M4) |
Pentru prepararea solutiei mama combinate II, se adauga urmatoarea cantitate de solutie mama I in apa |
|
|
(o singura substanta ) |
(mg/l) |
(multiplu) |
(ml/l) |
|
|
M4 |
M7 |
|||
|
H3BO3 | ||||
|
MnCl2 · 4 H2O | ||||
|
LiCl | ||||
|
RbCl | ||||
|
SrCl2 · 6 H2O |
| |||
|
NaBr | ||||
|
Na2MoO4 · 2 H2O | ||||
|
CuCl2 · 2 H2O | ||||
|
ZnCl2 | ||||
|
CoCl2 · 6 H2O | ||||
|
KI | ||||
|
Na2SeO3 | ||||
|
NH4VO3 | ||||
|
Na2 EDTA · 2 H2O | ||||
|
Fe SO4 · 7 H2O | ||||
|
Atat solutiile de Na2 EDTA cat si de Fe SO4 se prepara separat, se toarna impreuna si se autoclavizeaza imediat. Rezulta: |
||||
|
solutia 21 Fe-EDTA | ||||
Mediile M4 si M7
Mediile M4 si M7 se prepara din solutia mama II, macroelemente nutritive si vitamine, dupa cum urmeaza:
|
Cantitatea adaugata in apa |
Concentratia (in functie de mediul M4) |
Cantitatea de solutie mama adaugata pentru prepararea mediului |
|||
|
(mg/l) |
(multiplu) |
(ml/l) |
|||
|
M4 |
M7 |
||||
|
Microelementele combinate in solutia mama II | |||||
|
Solutiile mama cu macroelemente nutritive (o singura substanta) |
|||||
|
CaCl2 · 2 H2O | |||||
|
MgSO4 · 7 H2O | |||||
|
KCl | |||||
|
NaHCO3 | |||||
|
Na2SiO3 · 9 H2O | |||||
|
NaNO3 | |||||
|
KH2PO4 | |||||
|
K2HPO4 | |||||
|
Solutie combinata de vitamine | |||||
|
Solutia mama combinata de vitamine se prepara prin adaugarea celor 3 vitamine la 1 litru de apa conform indicatiilor prezentate in continuare. |
|||||
|
Clorhidrat de tiamina | |||||
|
Cianocobalamina (B12) | |||||
|
Biotina | |||||
|
Solutia combinata de vitamine se pastreaza inghetata in mici alicoti. Vitaminele se adauga in medii cu putin timp inaintea utilizarii. |
|||||
|
Note: |
Pentru a evita precipitarea sarurilor in timpul prepararii mediilor complete, se adauga alicoti de solutii mama in aproximativ 500-800 ml apa deionizata si apoi se aduce la un litru. |
||||
|
Prima semnalare a mediului M4 se poate gasi in Elendt, B.P. (1990). Selenium deficiency in crustacea; an ultraastructural appropach to antennal demage in Daphnia magna Straus. Protoplasma, 154, pp. 25-33. |
|||||
ANEXA 2
ANALIZA CONTINUTULUI DE CARBON ORGANIC TOTAL (COT) SI REALIZAREA UNEI NOMOGRAME PENTRU CONTINUTUL COT DIN HRANA PE BAZA DE ALGE
Se accepta ca masurarea continutului de carbon din hrana pe baza de alge sa nu se masoare in mod normal direct, ci din corelarile (adica nomogramele) cu masurile inlocuitoare, de ex. numarul celulelor de alge sau absorbanta luminii).
Este necesar ca masurarea COT sa se efectueze mai degraba prin oxidare la temperatura mare decat prin metodele UV sau cu persulfat. (a se vedea: Determinarea carbonului organic total, a consumului total de oxigen si a determinantilor conecsi cu ajutorul instrumentelor 1979, HMSO 1980; 49 High Holborn, Londin WC1V 6HB).
Pentru obtinerea nomogramelor, algele se separa din mediul de cultura prin centrifugare urmata de resuspensie in apa distilata. Se determina parametrul inlocuitor si concentratia COT in fiecare proba de trei ori. Se analizeaza probele oarbe in apa distilata si concentratia COT se scade din concentratia COT din proba de alge.
Nomogramele trebuie sa fie liniare in domeniul necesar de concentratii ale carbonului. Exemplele sunt prezentate in continuare.
NB: Nomogramele nu se utilizeaza pentru conversiune; este esential ca laboratoarele sa-si elaboreze propriile nomograme.
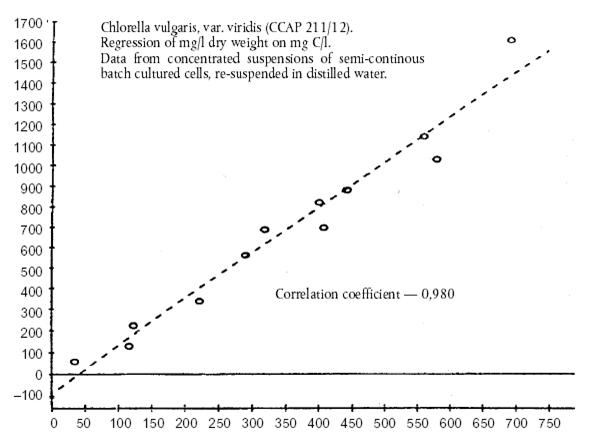
Chlorella
vulgaris, var. viridis (CCAP 211/12). Regresul
substantei uscate in mg /l.pe mg C/l Datele de la
suspensiile concentrate de celule cultivate in serii semicontinue,
resuspendate in apa distilata mg/l
substanta uscata din hrana concentrata din alge Coeficient
de corelatie - 0,980
mg C/l hrana concentrata din alge
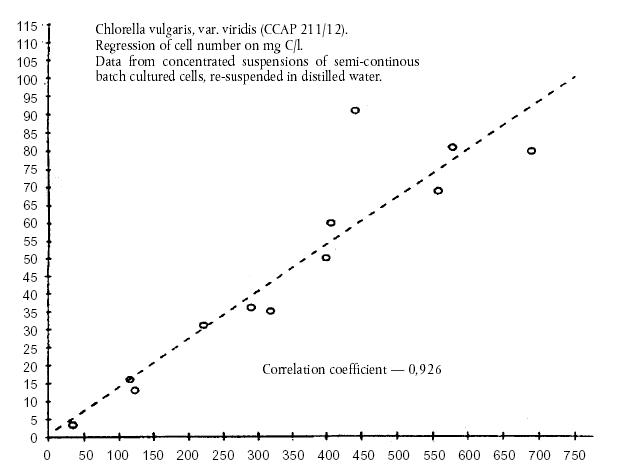
Chlorella
vulgaris, var. viridis (CCAP 211/12) Regresul
numarului de celule pe mg C/l. Datele de la suspensiile concentrate
de celule cultivate in serii semicontinue, resuspendate Nr.
de celule/l Coeficient
de corelatie - 0,926
in apa distilata
(x 108) hrana
concentrata din alge
mg C/l hrana concentrata din alge
Absorbanta la 440 mm pentru
o dilutie de 1/10 a hranei concentrate din alge Chlorella
vulgaris, var. viridis (CCAP 211/12) Regresul
absorbantei pe mg C/l. (lungimea de cale 1 cm) Datele de la suspensiile
concentrate de celule cultivate Coeficient
de corelatie - 0,998
in serii semicontinue, resuspendate
in apa distilata
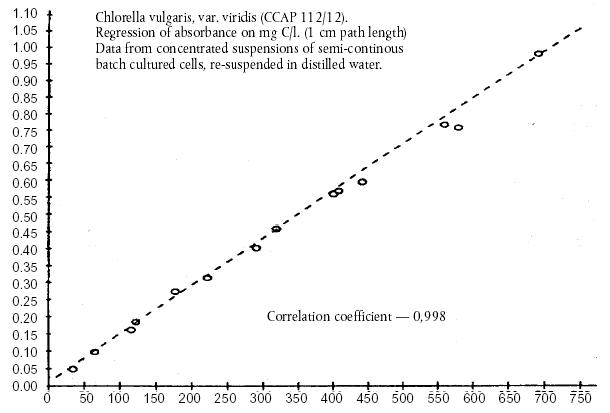
mg C/l hrana concentrata din alge
ANEXA 3
EXEMPLU DE FISA TEHNICA PENTRU INREGISTRAREA REINNOIRII MEDIULUI, DATELE CONTROLULUI FIZIC/CHIMIC, ADMINISTRAREA HRANEI, REPRODUCEREA DAFNIEI SI MORTALITATEA ADULTILOR
|
Nr. experimentari: |
Inceput la data: |
Conul: |
Mediul: |
Tipul hranei: |
Substanta testata: |
Conc. nominala: |
||||||||||||||||||
|
Reinnoirea mediului (se bifeaza) | ||||||||||||||||||||||||
|
PH 1 |
nou | |||||||||||||||||||||||
|
|
vechi | |||||||||||||||||||||||
|
O2 (mg/l)1 |
nou | |||||||||||||||||||||||
|
vechi | ||||||||||||||||||||||||
|
Temperatura (oC) 1 |
nou | |||||||||||||||||||||||
|
vechi | ||||||||||||||||||||||||
|
Hrana administrata (se bifeaza) | ||||||||||||||||||||||||
|
Fara progenituri vii (se bifeaza) 2 |
Total |
|||||||||||||||||||||||
|
Vasul 1 | ||||||||||||||||||||||||
|
| ||||||||||||||||||||||||
|
Total | ||||||||||||||||||||||||
|
Mortalitatea cumulativa a adultilor 3 | ||||||||||||||||||||||||
|
Se indica vasul care s-a utilizat pentru experimentare. |
||||||||||||||||||||||||
|
Puii avortati se consemneaza cu "AV" in casuta respectiva |
||||||||||||||||||||||||
|
Mortalitatea animalelor adulte se consemneaza cu "M" in casuta respectiva |
||||||||||||||||||||||||
ANEXA 4
EXEMPLU DE FISA TEHNICA PENTRU INREGISTRAREA REZULTATELOR ANALIZEI CHIMICE
(a) Concentratiile masurate
|
Conc. nominala |
Proba din saptamana 1 |
Proba din saptamana 2 |
Proba din saptamana 3 |
|||
|
Proaspata |
Veche |
Proaspata |
Veche |
Proaspata |
Veche |
|
(b) Concentratiile masurate sub forma de procente din cea nominala
|
Conc. nominala |
Proba din saptamana 1 |
Proba din saptamana 2 |
Proba din saptamana 3 |
|||
|
Proaspata |
Veche |
Proaspata |
Veche |
Proaspata |
Veche |
|
ANEXA 5
CALCULAREA MEDIEI PONDERATE DE TIMP
Media ponderata de timp
Deoarece concentratia substantei testate poate sa scada in intervalul de timp dintre reinnoiri, este necesar sa se aiba in vedere necesitatea alegerii unei concentratii reprezentative pentru domeniul de concentratii experimentate cu dafnia parinti. Alegerea se face pe principii biologice, cat si statistice. De ex., daca se considera ca reproducerea este afectata cel mai mult de concentratia de varf experimentata, atunci trebuie sa se utilizeze concentratia maxima. Cu toate acestea, daca se considera ca efectul acumulat sau pe termen lung al substantei toxice este mai important, atunci o concentratie medie este mai relevanta. In cazul respectiv, o medie potrivita pentru utilizare este concentratia medie ponderata de timp, deoarece tine seama de variatia concentratiei instantanee in timp.
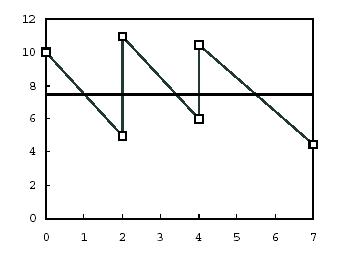
Fig. 1: Exemplu de medie ponderata de timp
Figura 1 prezinta un exemplu de test (simplificat) cu durata de sapte zile cu reinnoirea mediului in zilele 0, 2 si 4.
Linia subtire in zig-zag reprezinta concentratia in orice punct in timp. Se considera ca scaderea concentratiei este urmarea unui proces de descompunere exponentiala.
Cele sase puncte reprezentate grafic arata concentratiile observate, masurate la inceputul si sfarsitul fiecarei perioade de reinnoire.
Linia continua groasa indica pozitia mediei ponderate de timp.
Media ponderata de timp se calculeaza, astfel incat aria de sub media ponderata de timp sa fie egala cu aria de sub curba concentratiilor. Calculul pentru exemplul anterior se prezinta in tabelul 1.
Tabelul 1: Calculul mediei ponderate de timp
|
Reinnoirea nr. |
Zile |
Conc0 |
Conc1 |
Ln(Conc0) |
Ln(Conc1) |
Aria |
|
Total zile:7 |
Aria totala | |||||
|
Media PT | ||||||
"Zile" este numarul de zile din perioada de reinnoire.
"Conc0" este concentratia masurata la inceputul fiecarei perioade de reinnoire.
"Conc1" este concentratia masurata la sfarsitul fiecarei perioade de reinnoire.
"Ln(Conc0)" este logaritmul natural al Conc0.
"Ln(Conc1)" este logaritmul natural al Conc1.
"Aria" este aria de sub curba exponentiala pentru fiecare perioada de reinnoire. Se calculeaza cu:
![]()
Media ponderata de timp ("media PT") este "Aria totala" impartita la " Total zile".
Desigur, pentru testul de reproducere a dafniei, tabelul trebuie marit pana la 21 de zile.
Este clar ca atunci cand observatiile se fac numai la inceputul si sfarsitul fiecarei perioade de reinnoire, nu se poate confirma ca procesul de descompunere este, de fapt, exponential. O curba diferita ar genera un calcul diferit pentru "Arie". Cu toate acestea, un proces de descompunere exponentiala nu este neverosimil si este probabil cea mai buna curba de utilizat in absenta altor date.
Cu toate acestea, este necesar sa se procedeze cu prudenta, daca la analiza chimica nu se reuseste sa se gaseasca nici o substanta la sfarsitul perioade I de reinnoire. Cu exceptia cazului in care este posibil sa se estimeze rapiditatea disparitiei substantei din solutie, este imposibil sa se obtina o arie realista sub curba si, prin urmare, este imposibil sa se obtina o medie ponderata de timp rezonabila.
Copyright © 2025 - Toate drepturile rezervate