 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Termodinamica si cinetica PROCESELOR din sistemELE CARBON-OXIGEN, OXIGEN-HIDROGEN, CARBON-HIDROGEN, CARBON-OXIGEN-HIDROGEN
Termodinamica si cinetica reactiilor chimice principale din sistemele C-O,O-H, C-H si C-O-H, ne arata comportarea diferitilor combustibili, a substantelor organice combustibile refolosibile in procesele de piroliza si ardere, in anumite conditii de temperatura si presiune. Datele termodinamice privind aceste sisteme permit determinare activitatii termodinamice, a marimilor termodinamice, a compozitiei fazelor gazoase si in acelasi timp se pot aprecia proprietatile reducatoare ale unor substante (C, CO, H2) sau proprietatile oxidante ale altor substante (CO2, H2O etc.).
Echilibru reactiilor din sistemul C - O
In conditiile industriale cea mai mare parte a caldurii necesara proceselor care au loc la temperaturi ridicate, inclusiv caldura utilizata pentru incalzirea agregatelor termice, se obtine pe seama arderii unor combustibili organici sau anorganici care pot fi materii prime principale sau materii prime secundare (deseuri).
In conditiile reale, arderea materialelor combustibile se realizeaza cu oxigenul din aerul atmosferic ( 21% O2 si 79% N2) iar in unele cazuri cu aer imbogatit in oxigen.
Reactiile chimice din sistemul C - O
Studiile efectuate asupra acestui sistem pun in evidenta patru reactii chimice principale:
I. 2C + O2 =2CO
Reactia I se mai numeste reactie de ardere incompleta
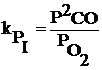
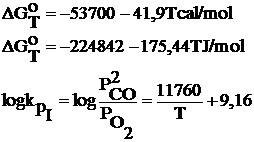
Cu ajutorul acestor relatii se pot determina valorile constantelor de echilibru la diferite temperaturi si inclusiv compozitia fazei gazoase.
In principiu, reactia chimica nr. I va fi favorizata de scaderea presiunii deoarece ea se realizeaza cu o crestere de volum.
Daca se aplica legea fazelor a lui Gibbs ( ν = n+2-φ) rezulta ca sistemul este bivariant:
Daca
se tine seama de aceste date, rezulta ca pentru determinarea
compozitiei fazei gazoase la echilibru, este suficient sa se cunoasca doi parametri din cei patru (
T, Pt,PCO,![]() ) si se pot determina ceilalti doi, respectiv presiunile partiale ale O2 si CO cu ajutorul sistemului de
ecuatii, cand se cunoaste temperatura si presiunea totala:
) si se pot determina ceilalti doi, respectiv presiunile partiale ale O2 si CO cu ajutorul sistemului de
ecuatii, cand se cunoaste temperatura si presiunea totala:
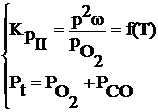
Pentru sistemul care contine cele doua gaze (CO,O2) se poate scrie relatia
%CO+%O2=100% , care impreuna cu
relatiile: %CO=![]() , %O2=
, %O2=![]() permit determinarea compozitiei fazei gazoase.
permit determinarea compozitiei fazei gazoase.
II. C + O2 = CO2
Aceasta reactie se mai numeste si reactia de ardere completa
![]()
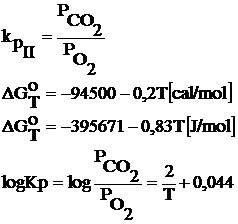
![]()
Aplicand legea fazelor, ν = 2+2-2=2 ,rezulta ca sistemul este bivariant.
Pentru a determina starea sistemului se calculeaza presiunile partiale ale gazelor din faza gazoasa utilizand sistemul de ecuatii:
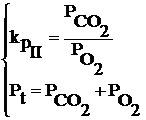
Compozitia fazei gazoase este data de relatiile:
%CO2+%O2=100%
%CO2=![]() 100; %O2=
100; %O2=![]()
Reactia de ardere completa a carbonului se desfasoara la volum constant deci presiunea nu influenteaza desfasurarea reactiei chimice de la stanga la dreapta.
Reactia chimica II fiind puternic exoterma, cresterea temperaturii va avea ca efect micsorarea constantei de echilibru ( faza gazoasa este saraca in CO2)
In conditii reale pe baza valorilor lui ∆GT si log Kp rezulta ca reactiile chimice I si II sunt practic ireversibile.
Intotdeauna pentru aceste reactii chimice concentratiile de oxigen la echilibru (presiunile partiale ale oxigenului la echilibru) sunt foarte mici in timp ce concentratia de CO sau CO2 este foarte mare datorita valorilor ridicate ale constantei de echilibru
III. 2CO + O2 ═ 2CO2
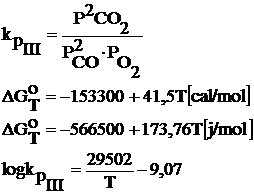
Reactia chimica III se mai numeste si reactia de terminare a arderii carbonului.
Expresia constantei de echilibru in functie de temperatura si de continutul gazelor la echilibru poate fi scrisa:
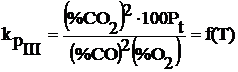
Pt - presiunea totala a fazei gazoase din sistem.
![]()
Daca se aplica legea fazelor pentru acest sistem: ν = 2+2-1=3 (sistem trivariant)
Aceasta inseamna ca din totalitatea
parametrilor care influenteaza echilibru reactiei III ( T, P, ![]() , PCO,
, PCO, ![]() ), este necesar sa se cunoasca numai trei ,
ceilalti doi fiind determinati cu ajutorul urmatorului sistem de
ecuatii cu doua necunoscute:
), este necesar sa se cunoasca numai trei ,
ceilalti doi fiind determinati cu ajutorul urmatorului sistem de
ecuatii cu doua necunoscute:
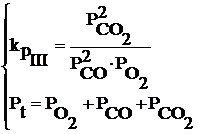
Daca se tine seama de datele termodinamice ale reactiei III, in conformitate cu legea lui Le Chatelier, cresterea temperaturii va avea ca efect scaderea constantei de echilibru deoarece reactia este puternic exoterma.
Din aceasta cauza, odata cu cresterea temperaturii continuturile de CO si O2 din faza gazoasa la echilibru vor fi intotdeauna mult mai mari, astfel ca, cu cat temperatura este mai inalta, cu atat arderea CO va fi mai incompleta.
Reactia III va fi intotdeauna favorizata de cresterea presiunii deoarece reactia se realizeaza cu o micsorare de volum.
Daca tinem seama de legea lui Van t Hoff exprimata prin relatia:
![]() , rezulta ca reactia III fiind o reactie
exoterma (∆H<0), intotdeauna
, rezulta ca reactia III fiind o reactie
exoterma (∆H<0), intotdeauna 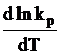 va fi mai mic decat
zero, ceea ce inseamna ca in general cresterea temperaturii,
determina scaderea constantei de echilibru.
va fi mai mic decat
zero, ceea ce inseamna ca in general cresterea temperaturii,
determina scaderea constantei de echilibru.
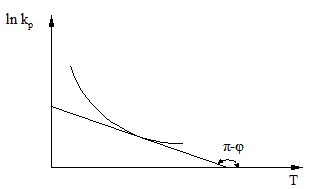
Reprezentarea grafica a lui ln kp = f(T) pentru reactiile chimice exoterme este redata in fig. 1.
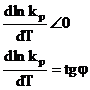
![]() jє[
jє[![]()
Fig. 1. Variatia ln kp functie de temperatura (T)
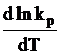 - reprezinta
coeficientul unghiular al curbei intr-un punct dat sau tangenta unghiului de
inclinare al curbei in acel punct.
- reprezinta
coeficientul unghiular al curbei intr-un punct dat sau tangenta unghiului de
inclinare al curbei in acel punct.
Daca se tine seama de datele termodinamice de mai sus se pot aprecia conditiile de stabilitate sau instabilitate a fazelor gazoase rezultate prin arderea carbonului.
Oxidul de carbon va putea avea o actiune reducatoare asupra combinatiilor oxidice prezente in incarcatura agregatului termic.
Pornind de la ecuatia D![]() = - 567500 + 173,76T, temperatura la care reactia
chimica nr. III va ajunge la echilibru (Te) se calculeaza
cu relatia:
= - 567500 + 173,76T, temperatura la care reactia
chimica nr. III va ajunge la echilibru (Te) se calculeaza
cu relatia:
![]() ≈ 3270K
≈ 3270K
Considerand egal cu unitatea numarul initial de moli de CO2 (cazul particular cand sistemul contine initial numai CO2), la diferite temperaturi si presiuni, a molecule de CO2 se descompun ramanand nedescompuse (1 - a) molecule.
Din
cele a
molecule de CO2 descompuse se formeaza a molecule CO si ![]() molecule oxigen.
molecule oxigen.
CO + ½O2 = CO2
![]() 1-
1-
La aparitia starii de echilibru, suma tuturor moleculelor este data de relatia :
![]()
Prin urmare, la starea de echilibru se obtine:
![]() ;
;
![]()
![]()
Cand presiunea totala a fazei gazoase este Pt, presiunile partiale de echilibru ale gazelor se exprima prin relatiile:
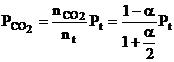
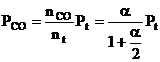
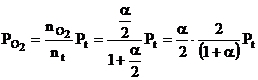
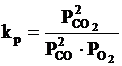
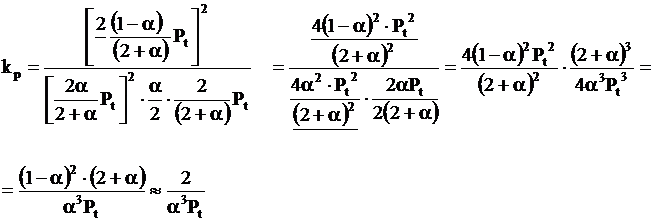
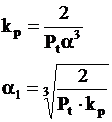
Pt - presiunea totala a fazei gazoase din sistem
α1- gradul de disociere a CO2 calculat pentru reactia chimica nr. III in conditiile in care arderea se realizeaza in O2 in stare pura.
In cazul arderii in aer reactia III devine:
2CO + O2 + 3,762N2 = 2CO2 + 3,762N
In aceste conditii gradul de disociere al CO2 se poate calcula cu relatia:
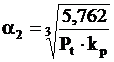
Prin urmare in conditii egale de T si P inlocuirea O2 pur cu aerul atmosferic pentru arderea CO, va avea ca afect cresterea gradului de disociere a CO2 din sistem.
Din aceasta cauza cand arderea se realizeaza cu aerul imbogatit in O2 in functie de gradul de imbogatire, coeficientul α, va avea valori intre a si a
IV. 2CO CO2 + C ; reactia Belle Boudouard
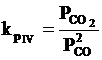

Temperatura de echilibru (Te) este calculata cu ajutorul relatiei lui ΔGoT la echilibru cand ΔGoT are valoarea zero.
![]()
Reactia chimica Belle Boudouard are o importanta deosebita in procesele care au loc la temperaturi ridicate in sistemul C-O. De regula, desfasurarea reactiei nr. IV de la stanga la dreapta are un rol deosebit de important in transportul de caldura din zona inferioara a furnalului (creuzet) sau a cubiloului, unde se formeaza CO, catre partea superioara a agregatului (cuva), unde CO se descompune cu degajare de caldura.
Daca se tine seama de datele termodinamice de mai sus, conform legii lui Le Chatelier, cresterea temperaturii sau micsorarea presiunii va deplasa echilibru reactiei Belle - Boudouard in sensul imbogatirii fazei gazoase in CO. In felul acesta atmosfera respectiva capata proprietati reducatoare, deseori devenind puternic reducatoare.Micsorarea temperaturii intr-o anumita zona a agregatului sau cresterea presiunii va avea ca efect imbogatirea fazei gazoase in CO2.
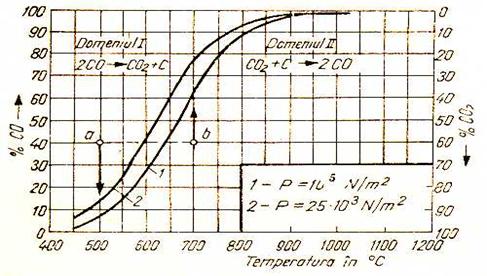
Conditiile
de echilibru ale reactiei Belle-Boudouard in functie de
temperatura si de presiune sunt date sub forma unor curbe in S.
Fig. 2. Variatia echilibrului reactiei Belle -Boudouard cu temperatura si presiunea
In zona II, in domeniul de temperatura 705÷1200oC, atmosfera devine puternic reducatoare, oxizii intr-o astfel de atmosfera fiind practic instabili. Odata cu scaderea presiunii totale ( izobara 0,2 at) la aceeasi temperatura, concentratiile de CO sunt intotdeauna mai mari.
In conditiile reale, la temperaturi mai mari 1100oC, in prezenta carbonului solid, CO2 lipseste in mod practic din faza gazoasa.
In aceste conditii toata cantitatea de CO2 se transforma in CO conform reactiei chimice Belle-Boudouard scrisa in sensul formarii CO (din zona II a graficului).
La temperaturi joase CO avand tensiunea de disociere mare se va descompune. In general sub 400oC in sistem se gaseste practic numai CO2 in faza gazoasa si C solid.
Prin urmare, pe baza datelor termodinamice de mai sus, rezulta ca in zona temperaturilor ridicate concentratia de CO2 in faza gazoasa, in prezenta carbonului incandescent sau a cocsului devine egala cu zero. In schimb, in aceste conditii creste concentratia de CO, atmosfera devenind foarte reducatoare.
La temperaturi joase negrul de fum ( C in stare foarte fina) rezultat in urma descompunerii CO se depune pe faza oxidica din incarcatura agregatului de elaborare. Acest fenomen va avea ca efect favorizarea reactiilor de reducere directa.
Studiile termodinamice privind variatia entalpiei libere pentru reactiile I-IV in functie de temperatura si logKp pentru reactiile I-IV in functie de temperatura, dovedesc stabilitatea foarte mare a CO in procesele pirometalurgice si in acelasi timp faptul ca odata cu cresterea temperaturii, afinitatea C fata de oxigen se mareste in timp ce afinitatile metalelor fata de oxigen se micsoreaza. Tinand cont de acest principiu, teoretic se poate reduce orice oxid al unui metal cu CO, predominand in acest caz reactiile de reducere indirecta. In realitate din cauza disocierii partiale a CO in prezenta vaporilor de apa sau a altor catalizatori, reducerea oxizilor foarte stabili nu poate fi realizata cu CO, ci cu carbon incandescent (reducere directa).
Pe de alta parte aparitia fazelor lichide, deci formarea unor sisteme complexe, va avea ca efect modificarea entalpiilor libere a reactiilor chimice. Din aceasta cauza in astfel de conditii va trebui sa se asigure concentratii mai mari de CO decat concentratiile realizate pe baza calculelor teoretice. Acesta este motivul pentru care in practica, in astfel de conditii se recomanda sa se lucreze cu un exces de carbon in sarja in vederea asigurarii unei atmosfere puternic reducatoare.
Variatia entalpiei libere standard functie de temperatura pentru principalele reactii chimice din sistemul carbon - oxigen
Variatia entalpiei libere standard functie de temperatura pentru principalele reactii chimice din sistemul carbon - oxigen este redata in diagrama din fig.
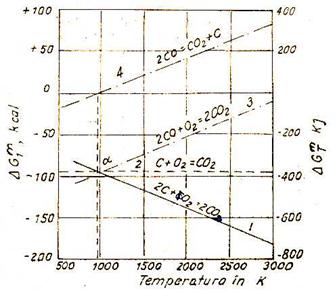
Fig. Variatiile cu temperatura ale entalpiilor
libere standard
pentru reactiile din sistemul C-O
Diagrama pune in evidenta sensul reactiilor din sistemul C-O in functie de temperatura.
Dreptele corespunzatoare reactiilor I, II, III se intersecteaza la 978 K. La temperaturi mai mari de 978 K, variatia entalpiei libere pentru reactia I este mult mai negativa decat pentru reactia II, dovedind ca la temperaturi foarte ridicate afinitatea carbonului fata de O2 este foarte mare. Aceasta explica faptul ca la temperaturi ridicate este posibila reducerea cu C incandescent.
Variatia entalpiei libere pentru reactia II este reprezentata printr-o dreapta aproximativ orizontala (valorile sale difera foarte putin de pozitia orizontala).
Acest fenomen se explica prin faptul ca in timpul desfasurarii reactiei II se constanta o variatie mica de entalpie.
Variatia entalpiei libere standard pentru reactia III ne arata ca odata cu cresterea temperaturii, afinitatea chimica a CO fata de O2 se micsoreaza.
Variatia entalpiei libere pentru reactia IV la temperaturi > 973 K capata valori pozitive ceea ce inseamna ca in absenta catalizatorilor si in prezenta unui exces de C in sarja reactia IV se desfasoara de la dreapta la stanga in sensul formarii CO.
2CO = CO2 + C, pentru T > 978 K
La T > 978K, atmosfera din agregat devine puternic reducatoare, oxizii metalici fiind instabili.
Pentru reactia Belle-Boudouard desfasurata in sensul formarii CO, odata cu cresterea temperaturii creste constanta de echilibru deoarece reactia este endoterma, deci cantitatea de CO in sistem va fi mare.
Pentru reactiile endoterme comparativ cu reactiile exoterme, in fig. 4, este redata variatia ln kp = f(T).
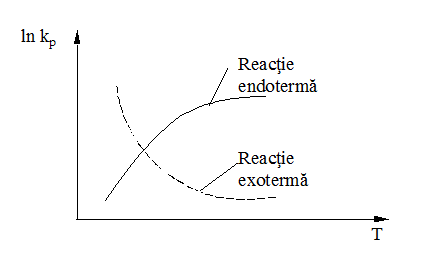
Fig. 4.
Variatia ln kp functie de T pentru reactii exoterme
si endoterme
Daca se tine seama de datele termodinamice, odata cu cresterea temperaturii, intotdeauna in prezenta unui exces de C in sarja, se va asigura o atmosfera puternic reducatoare.
2. Echilibrul reactiilor din sistemul oxigen-hidrogen
Cea mai importanta reactie chimica din acest sistem este reactia de formare a vaporilor de apa.
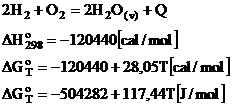
Temperatura de echilibru pentru aceasta reactie, calculata cu ajutorul relatiilor termodinamice va fi egala cu:
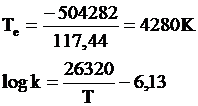
Reactia chimica de formare a vaporilor de apa fiind puternic exoterma, in conformitate cu principiul lui Le Chatelier, odata cu cresterea temperaturii, constanta sa de echilibru se va micsora.
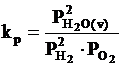
Reactia chimica de formare a vaporilor de apa este o reactie omogena avand trei grade de libertate: ν = 2+2-1 = 3
Avand
in vedere legea lui Gibbs, sistemul fiind trivariant, inseamna ca
daca se cunosc trei parametri cum ar fi: T, Pt, ![]() , ceilalti doi factori (
, ceilalti doi factori (![]() si
si ![]() ) se vor determina pe baza relatiilor din sistemul de
doua ecuatii:
) se vor determina pe baza relatiilor din sistemul de
doua ecuatii:
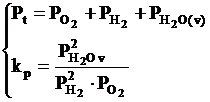
Daca tinem seama de datele termodinamice prezentate mai sus inseamna ca in practica, intotdeauna exista posibilitatea aparitiei vaporilor de apa, care in anumite conditii de temperatura pot exercita o actiune oxidanta asupra celorlalte faze prezente in sistem.
Deseori in sistemele complexe pot sa apara simultan urmatoarele reactii chimice:
1. 2CO + O2 = 2CO2
2H2 + O2 = 2H2O
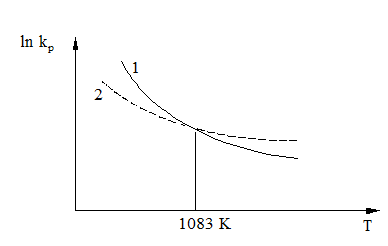
Variatia ln kp functie
de temperatura pentru cele doua reactii exoterme este
redata in figura 5.
Fig.5. Variatia ln kp functie de temperatura pentru reactia de terminare a arderii si reactia de formare a vaporilor de apa
Curbele din diagrama de mai sus arata ca ln kp in functie de temperatura pentru reactiile 1 si 2 se intersecteaza in punctul corespunzator temperaturii 1083K (810oC).
Acest lucru dovedeste ca la 1083 K (810oC) afinitatile CO si ale H2 fata de O2 sunt egale.
La aceasta temperatura CO2 si H2O(v) au intotdeauna aceeasi stabilitate termodinamica.
La temperaturi mai mici de 810oC, ln kp pentru reactia chimica (1) este mai mare decat ln kp reactiei (2).
Rezulta ca in domeniul temperaturilor mai mici de 810sC afinitatea CO fata de O2 este mai mare decat afinitatea H2 fata de O2.
Totodata
se explica faptul ca in aceste conditii CO2 va fi mai
stabil decat H2O(v). La temperaturi mai mari de 810oC, ![]() <
<![]() , ceea ce inseamna ca in aceste conditii se
schimba ordinea afinitatii fata de O2,
adica afinitatea H2 este mai mare decat afinitatea CO.
, ceea ce inseamna ca in aceste conditii se
schimba ordinea afinitatii fata de O2,
adica afinitatea H2 este mai mare decat afinitatea CO.
Conform principiului lui Le Chatelier, reactia chimica de formare a vaporilor de apa are loc cu micsorare de volum, ca urmare reactia se va desfasura de la stanga la dreapta odata cu cresterea presiunii.
Gradul de disociere a vaporilor de apa in functie de temperatura se poate calcula dupa o ecuatie asemanatoare cu ecuatia matematica a gradului de disociere (α) calculat pentru disocierea CO2 din reactia 2CO + O2 = 2CO2 (reactia de terminare a arderii), respectiv:
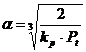
unde:
kp - constanta de echilibru a carei valoare este in functie de temperatura si de participare in reactie a celorlalti componenti din sistem;
Pt - presiunea totala a sistemului.
In timpul arderii H2 pot aparea si o serie de reactii secundare dintre care cele mai importante sunt reactiile de formare a oxidrililor sau a radicalului [OH].
2H2 + 2O2 = 4[OH] - Q1
2H2O = 2[OH] + H2 -Q2
In principiu reactiile de formare a [OH] sunt endoterme, din aceasta cauza odata cu cresterea temperaturii, reactiile 1 si 2 se vor desfasura energic de la stanga la dreapta.
Prezenta radicalului [OH] in sisteme complexe, favorizeaza o serie de reactii chimice secundare si procese chimice, cum ar fi absorbtia gazelor in topitura.
Pentru preintampinarea acestor consecinte negative se recomanda evacuarea rapida a gazelor din sistem.
Echilibrul reactiilor din sistemul carbon - hidrogen
Disocierea gazului metan
Reactia chimica reprezentativa pentru acest sistem este:
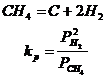
Disocierea CH4 este conditionata in mod deosebit de temperatura si prezenta catalizatorilor.
Pentru reactia chimica de disociere a CH4 valorile entalpiei libere standard sunt:
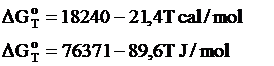
Temperatura de echilibru, Te, este data de relatia:
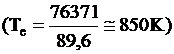
Pe baza datelor termodinamice se poate trage concluzia ca in general peste 850K (577oC) CH4 disociaza, dar procesul de disociere al gazului metan devine energic la T > 650oC.
La temperaturi de 900 - 1000oC disocierea se considera aproape completa.
In prezenta unor catalizatori (metalele in stare pura) temperatura de disociere a CH4 este mult mai redusa.
De exemplu in prezenta fierului disocierea CH4 incepe la 350oC, iar in prezenta Ni la 320oC.
Hidrogenul rezultat in urma disocierii gazului metan va avea o actiune reducatoare foarte puternica asupra oxizilor .
Pe de alta parte, carbonul rezultat din disociere se prezinta intr-o stare foarte fina, in aceste conditii reactiile de reducere directa vor fi predominante fata de reactiile de reducere indirecta.
Produsele rezultate in urma disocierii gazului metan, fiind agenti reducatori, rezulta ca prezenta gazului metan in atmosfera de lucru nu provoaca mari dificultati, exceptie facand metalele sau aliajele care nu trebuie carburate.
4. Echilibrul reactiilor din sistemul carbon - hidrogen - oxigen
Sistemul C-H-O cuprinde mai multe reactii chimice:
Reactia gazului de apa
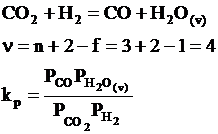
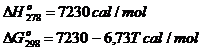
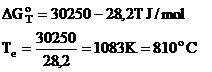
Pe baza datelor termodinamice de mai sus rezulta ca reactia gazului de apa fiind endoterma, cresterea temperaturii va avea ca efect deplasarea echilibrului reactiei de la stanga la dreapta.
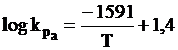
In conditiile practice, intotdeauna cu cresterea temperaturii reactia se va deplasa in sensul cresterii concentratiilor de CO si vapori de apa. In realitate din cauza valorilor mici ale ΔH influenta temperaturii asupra echilibrului reactiei este foarte mica.
Pe de alta parte reactia (a) avand loc fara variatie de volum, presiunea nu va influenta echilibru reactiei gazului de apa. O asemenea reactie se intalneste aproape intotdeauna in procesele metalurgice, ea fiind vizibil intensificata in zona temperaturilor foarte ridicate.
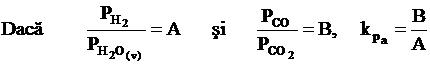
|
|
Relatia de mai sus reprezinta ecuatia unei drepte care trece prin origine si care are coeficientul unghiular egal cu constanta kPa.
Pe
baza acestor interpretari matematice inseamna ca la echilibrul
reactiei (a), fiecarui raport ![]() ii va corespunde un
anumit raport
ii va corespunde un
anumit raport ![]() .
.
Prezenta unei cantitati de C in exces complica procesul din cauza aparitiei reactiei Belle -Boudouard.
b. Reactiile carbonului cu vapori de apa
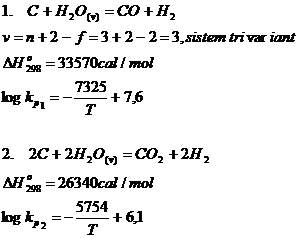
Din punct de vedere termodinamic ambele reactii sunt endoterme si din aceasta cauza constantele de echilibru ale reactiilor 1 si 2 cresc odata cu cresterea temperaturii.
Valorile lui kp1 sunt intotdeauna mai mari decat valorile lui kp2 deoarece ∆HT pentru reactia 1 este mai mare decat ∆HT pentru reactia 2.
Reactiile chimice 1 si 2 se petrec intotdeauna in urma suflarii aburului peste stratul de carbon incandescent, proces realizat in vederea obtinerii unui gaz cu proprietati reducatoare superioare.
Din aceasta cauza reactiile 1 si 2 reprezinta intotdeauna reactiile principale gazogene.
In conditii reale de temperatura (mai mari de 1000oC), carbonul solid reactioneaza intotdeauna intens cu vaporii de apa formandu-se H2 si CO, in conformitate cu reactia 1.
Pe de alta parte reactiile sunt endoterme, au loc de la stanga spre dreapta cu crestere de volum, deci cresterea temperaturii si micsorarea presiunii favorizeaza desfasurarea lor in sensul formarii CO, H2, respectiv CO2 si H2.
In conditiile industriale in zona temperaturilor inalte se va produce reactia chimica nr. 1 deoarece ∆GoT pentru reactia 1 este mult mai negativa decat ∆GoT pentru reactia nr. 2,in schimb la temperaturi joase va predomina reactia 2.
c. Reactiile chimice de oxidare ale gazului metan
Oxidarea gazului metan se poate realiza pe baza urmatoarelor reactii chimice:
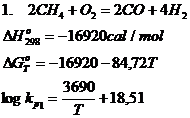
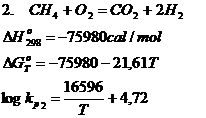
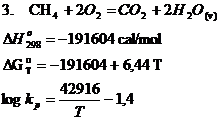
Din punct de vedere termodinamic reactiile de oxidare a gazului metan, (1, 2, 3) sunt exoterme, deci cresterea temperaturii va avea ca efect micsorarea constantelor de echilibru, adica viteza reactiilor desfasurate de la stanga la dreapta in sensul oxidarii gazului metan, va scadea.
Pe de alta parte, reactiile 1 si 2 se desfasoara cu crestere de volum, deci vor fi intotdeauna favorizate de scaderea presiunii in sistem.
Daca se tine seama de conditiile in care se desfasoara reactiile 1 si 3 se poate aprecia posibilitatea de utilizare a CH4 in procesele de oxidare.
d. Reactiile chimice de conversie ale gazului metan
Conversia CH4 se realizeaza in practica in conformitate cu urmatoarele reactii chimice:
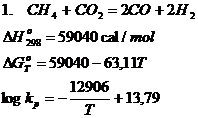
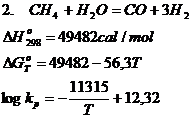
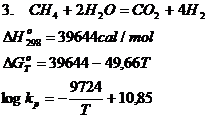
Reactiile chimice 1 si 2 la temperaturi ridicate, joaca un rol foarte important in conditii industriale, cand se creeaza posibilitatea obtinerii unui gaz bogat in H2 si CO, gaze cu capacitati reducatoare remarcabile.
Reactiile chimice de conversie ale gazului metan se desfasoara cu cresteri de volum si din aceasta cauza ele vor fi intotdeauna favorizate de scaderea presiunii in sistem.
Aceste reactii chimice fiind endoterme, cresterea temperaturii va avea intotdeauna ca efect marirea constantelor de echilibru, deci reactiile se vor desfasura energic de la stanga la dreapta.
Mecanismul proceselor de ardere in sistemul carbon - oxigen
Reactiile chimice de oxidare ale carbonului si reactia Belle-Boudouard sunt reactii chimice eterogene; din aceasta cauza suprafata de separatie a fazelor (faze solide si gazoase) va juca un rol foarte important.
Asa se explica faptul ca in asemenea conditii au loc o succesiune de procese de transport de masa si caldura, procese de adsorbtie si desorbtie, procese chimice si cristalochimice.
1. Procese de transport
De regula in interiorul unei faze aceste procese se realizeaza prin difuzie, care la randul sau poate fi moleculara sau convectiva. Forta motrice a difuziei moleculare va fi intotdeauna diferita de potentialul chimic dintre diferite puncte ale fluidului sau ale unei substante in stare solida.
In practica difuziunea moleculara se realizeaza pe baza diferenteide concentratie numai in cazul solutiilor.
De asemenea in regim laminar transportul de substanta se realizeaza intotdeauna prin difuziunea moleculara.
Difuziunea convectiva se realizeaza pe baza curentilor de convectie care la randul lor iau nastere datorita diferentelor de densitate, presiune sau temperatura.
Din aceasta cauza in regimul turbulent difuziunea va avea intotdeauna caracter convectiv. In conditii reale la suprafata fazei solide chiar in regimul turbulent se creeaza un strat laminar in care transportul de substanta se realizeaza intotdeauna prin difuziune moleculara.
Efectul termic al proceselor de oxidare in cazul arderii C va fi in foarte mare masura influentat de calitatile fizico-chimice ale fazei solide si de conditiile de interactiune dintre C incandescent si agentul oxidant.
Viteza transportului de substanta se realizeaza pe baza celor doua legi a lui Fick.
![]()
D - coeficientul de difuzie
J - cantitatea de substanta difuzata care trece in unitatea de timp prin unitatea de suprafata dintr-un plan normal pe directia de difuzie.
Intr-o alta forma ecuatia se prezinta astfel:
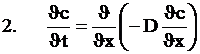
![]()
![]() gradient de concentratie in directie normala
la plan
gradient de concentratie in directie normala
la plan
x - distanta in directia difuziei
t - timpul
Ecuatiile 1 si 2 descriu procesul de difuzie intr-un regim stationar.
Pentru regimul nestationar se foloseste ecuatia nr.
![]()
In conformitate cu ecuatiile 1 - 3 putem sa apreciem procesele de difuzie care apar in sisteme heterogene formate din cel putin doua faze.
2) Procesele de adsorbtie - desorbtie
In conditii reale specifice sistemelor heterogene, deseori reactia chimica principala este precedata de adsorbtia moleculei fluidului pe suprafata fazei solide urmata ulterior de desorbtia produsilor de reactie.
Din aceasta cauza, in practica se pun in evidenta doua tipuri de adsorbtie:
1. Adsorbtia fizica - se caracterizeaza printr-un efect termic relativ mic (5000 cal/mol).
In cazul acestui proces moleculele fluidului se mentin la suprafata fazelor solide pe baza fortelor Wan der Walls.
2. Adsorbtia chimica - se caracterizeaza printr-un efect termic mai mare de ~ 20000 cal/mol.
In acest caz moleculele fluidului se mentin la suprafata fazelor solide pe baza unor legaturi mult mai puternice asemanatoare cu legaturile care se creeaza in urma reactiei chimice principale.
In ansamblu, fenomenele de adsorbtie se supun izotermei lui Langmuire cunoscuta sub forma:
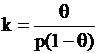
k - constanta de echilibru a procesului de adsorbtie (factor de proportionalitate)
q - fractia de suprafata acoperita (grad de acoperire)
p - presiunea partiala de echilibru a gazului adsorbit.
k = Koe-DHa/RT relatia lui Van't Hoff care da variatia lui k cu temperatura, unde: DHa - caldura de adsorbtie
Ko - coeficient specific
R - constanta generala a gazelor
Mecanismul arderii carbonului in procese pirometalurgice
Carbunele este format din particule de grafit foarte fin dispersate si din substante minerale necombustibile.
Grafitul are o retea hexagonala stratificata. Atomii de carbon sunt plasati in planele de baza fiind dispusi in varfurile unor hexagoane regulate cu latura de 1,42 Ao.
In ultimul plan ca si in interiorul planului de baza legatura atomilor de C este intotdeauna de tip covalent.
Grafitul este opac, are o conductibilitate electrica ridicata care scade cu temperatura.
El are o capacitate mare de reactie deoarece numeroase substante si radicali patrund usor intre planele de baza si dau nastere la diverse combinatii chimice.
Valentele nesaturate creeaza posibilitatea adsorbantei moleculare, gazoase la suprafata grafitului in special adsorbtia O2.
In principiu, pe suprafata grafitului se pot forma doua tipuri de legaturi:
1). C ═ O ; 2). Cretea - O - O - Cretea
Complexul de tipul 1 este mai stabil, oxigenul fiind mai puternic legat de reteaua grafitului.
Cercetari experimentale privind mecanismul arderii C au stabilit ca la temperaturi joase se formeaza numai CO2 deoarece de pe suprafata grafitului se desprind numai complecsii chimici de tipul 2.
La temperaturi mai ridicate produsele de reactie contin din ce in ce mai mult CO din cauza formarii si desprinderii complecsilor de tip 1 de pe suprafata grafitului.
Daca procesul de ardere se realizeaza in strat, in afara de reactia chimica principala de ardere a C apar si reactii chimice secundare formandu-se un amestec de CO2 si CO.
In zonele mai bogate in O2 oxidul de C este trecut in CO2 care intra in contact cu C incandescent conform reactiei Belle-Boudouard.
CO2 + C = 2CO - Q
Reactia chimica de formare a CO este endoterma, de regula aceasta reactie prezinta fenomenul de autoreglare termica.
In interiorul furnalului la elaborarea fontei de prima fuziune sau in interiorul cubilourilor la elaborarea fontei de a doua fuziune, reactia Belle-Boudouard se desfasoara intotdeauna in regim cinetic sau in regimuri intermediare deoarece temperatura suprafetei cocsului nu se mentine suficient de ridicata pentru ca reactia chimica sa nu mai franeze procesul.
Cand faza gazoasa contine ~ 20% CO2 si se gaseste la ~ 1800oC temperatura suprafetei cocsului nu depaseste 1000oC.
Din aceasta cauza cinetica reactiei Belle-Boudouard va fi in mare masura conditionata de temperatura, de puterea de reactie a cocsului si nu va fi influentata de hidrodinamica fazei gazoase, deoarece nu se desfasoara in regim de difuzie.
Cercetari experimentale au aratat ca de obicei la apropierea moleculelor de CO2 de suprafata grafitului, intotdeauna aceste molecule sunt atrase de atomii cu valente nesaturate.
In aceste conditii, moleculele de CO2 se deformeaza si in cele din urma se descompun formandu-se o serie de complecsi de tranzitie la suprafata grafitului.
La temperaturi relativ joase unei molecule de CO2 consumate in proces ii corespunde tot o molecula de CO degajata.
La temperaturi ridicate din cauza slabirii legaturilor dintre atomii din reteaua grafitului, unei molecule de CO2 prin reactie cu C ii corespunde doua molecule de CO, conform reactiei Belle-Boudouard.
Reactia 2CO CO2 + C2 , se realizeaza numai la temperaturi joase si in prezenta catalizatorilor.
In calitate de catalizatori pot fi utilizate unele elemente ca: Fe, Ni, Ca.
In principiu, in prezenta catalizatorului se reduce substantial energia de activare si se favorizeaza desfasurarea reactiei de la stanga spre dreapta.
In furnale si in cubilouri CO intalneste numerosi catalizatori.
Daca se considera ca rolul de catalizator il are Fe, in prima etapa se realizeaza adsorbtia CO la suprafata Fe conform schemei.
CO(g) + Fe → Fe(CO)ads
Distanta dintre atomii de Fe in reteaua cristalina a Fe este de aproximativ de doua ori mai mare decat distanta dintre atomii de C si O din molecula de CO.
Din aceasta cauza moleculele de CO sunt deformate si legaturile dintre C si O sunt foarte mult slabite.
In continuarea procesului, in urma ciocnirii altor molecule de CO pe suprafata catalizatorului se elaboreaza CO2 conform schemei.
Fe(CO)ads + CO(g) → FeC(ads) + CO2(g)
Daca se tine seama de ultima reactie, rezulta ca reactia chimica de disociere a CO este de ordinul I in raport cu CO2 si nu de ordinul al II-lea cum rezulta din reactia Belle-Boudouard.
2CO → CO2 + C
Asa se explica faptul de ce in practica la temperaturi ridicate atmosfera gazoasa este bogata in CO care este un puternic reducator pentru oxizi. In conditii reale pentru a se putea aprecia cinetica oxidarii C trebuie sa se tina seama de etapele principale pe baza carora se realizeaza arderea C. Fiecare etapa se caracterizeaza printr-un anumit grad de transformare a C si implicit printr-o anumita valoare a gradului de reducere a oxizilor.
Cu cat temperatura va fi mai mare, afinitatea C fata de O2 va fi mai mare in timp ce afinitatea metalelor se micsoreaza.
Din aceasta cauza la temperaturi foarte ridicate va fi intotdeauna posibila reducerea oxizilor metalici.
Aparitia topiturilor care au proprietatea de a dizolva acesti oxizi impune intotdeauna o atmosfera mai puternic reducatoare deoarece odata cu micsorarea cantitatii oxidului din topitura, se micsoreaza si tensiunea de disociere a oxidului care in astfel de conditii devine mult mai stabil.
Etapele principale de la arderea C sunt:
Difuziunea O2 din centrul fazei gazoase spre suprafata C (difuziune externa)
Patrunderea O2 in porii C (difuziunea interna)
Adsorbtia chimica a O2 pe suprafata C si in interiorul porilor
Reactia chimica principala intre C si O
Desorbtia produselor de reactie (CO2 si CO)
Difuzia produselor de reactie spre centrul fazei gazoase.
Viteza procesului de ardere pentru unele etape se prezinta astfel:
viteza de difuzie a O2 se poate exprima cu ajutorul urmatoarei ecuatii.
![]()
viteza reactiei chimice principale:
![]()
kd - constanta de viteza a procesului de difuzie
![]() - concentratia
oxigenului in volumul fazei gazoase.
- concentratia
oxigenului in volumul fazei gazoase.
![]() - concentratia O2
la suprafata C
- concentratia O2
la suprafata C
kc - constanta de viteza a reactiei chimice principale
n - ordinul de reactie.
Intr-un regim stationar viteza reala (vr)a procesului este:
vr = vd - vc ![]()
![]()
Daca se tine seama ca reactia chimica principala este de ordinul 1 putem sa calculam care sunt conditiile de ardere a C in regimul cinetic, de difuzie sau in regim intermediar.
Astfel pentru regimul cinetic, kc « kd
Pentru accelerarea procesului, in acest regim va fi necesara ridicarea temperaturii, utilizarea catalizatorilor, activizarea suprafetelor de reactie, cresterea porozitatii fazei solide.
Pentru regimul de difuzie, kd«kc.
In conditiile unei temperaturi foarte ridicate vitezele procesului de ardere sunt mari, reactia chimica principala se desfasoara fara dificultate.
Pentru regimul intermediar, kc kd.
Pentru toate cazurile efectul termic al procesului de ardere va fi in foarte mare masura conditionat de proprietatile chimice ale carbonului.
Copyright © 2025 - Toate drepturile rezervate