 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
DATE EXPERIMENTALE SI CONCLUZII PRIVIND TRATAREA LEVIGATULUI CU MEMBRANA DE TIP NF-90
1. Aparatura folosita


Fig.5.1.Modulul Dead-end
Modulul
dead-end este fabricat din otel inoxidabil si
poate sa fie folosit pentru presiuni de pana la 69
Un alt aparat folosit la filtrare este cel cu curgere incrucisata. Diferenta dintre acest aparat si aparatul dead-end este ca acesta are curgerea incrucisata iar dead-end are curgerea transversala.

Fig.5.2. Aparatul cu curgere incrucisata
Din galeata solutiei de inceput ajunge la celula de membrana, datorita unei pompe care are capacitatea de 420l si o presiune de 30 bari. Pompa este manual controlata.
2.Determinarea pH-ului
Semnificatia si masurarea pH-ului ocupa un loc important in numeroase domenii practice si stiintifice: in analiza chimica, in controlul si reglarea proceselor tehnologice, in studierea echilibrelor chimice, etc. Pentru experti, valoarea pH-ului reprezinta una dintre cele mai importante valori ce caracterizeaza calitatea unui fluid.
Cateva exemple: raurile sau lacurile care sunt prea acide nu sunt propice vietii animale sau vegetale; apa potabila care este prea acida este nesanatoasa si totodata corodeaza tevile de transport ale apei; si in sfarsit, valoarea pH-ului este un factor decisiv pentru o mare varietate de procese din industria chimica, de la obtinerea plasticului pana la desulfurizarea gazului. In multe procese de productie se folosesc solutii de apa din diferite substante care au o reactie neutra, acida sau alcalina. Gradul de aciditate sau alcalinitate a acestor solutii se caracterizeaza prin marimea curentului numit indicator de concentratie activa a ionilor de hidrogen, notat pH.
Gradul de aciditate sau alcalinitate reprezinta unul dintre indicii cei mai importanti ai solutiilor ce intervin in procesele de fabricatie cu caracter chimic, masura sa fiind data de concentratia ionilor de hidrogen. Pentru notarea marimi concentratiei marimilor de hidrogen care caracterizeaza proprietatile solutiilor exista o scala speciala si anume scala pH. Fiecare numar al acestei scale se determina din numarul ionilor de hidrogen continuti in solutie, cifrele scalei sunt logaritm zecimal negativ a concentratiei ionilor activi de hidrogen. Aparatul folosit pentru masurarea pH-ului este ilustrat in figura de mai jos:

Fig.5.3 pH-metru
Punctul central al scalei este pH=7, acest numar corespunde reactiei neutre si proprietatilor neutre ale solutiei. In practica pH=7 este apa chimic pura.
Punctele scalei cu valori mai mari de 7 corespund solutiei care are proprietati alcaline, iar cele mai mici de 7 corespund solutiilor cu caracter acid. Cresterea pH-ului intr-o solutie, corespunde micsorari concentratie ionilor de hidrogen in ea, intrucat la variatia pH-ului cu o unitate ionii de hidrogen se schimba de 10 ori, cu doua unitati de 100 de ori, etc.
3. Conductivitatea
Conductivitatea reprezinta conductivitatea electrica a unui volum de electrolit egal cu volumul unui cub cu latura de un centimetru si caracterizeaza usurinta cu care solutia de electrolit este strabatuta de curentul electric. In principiu, conductivitatea creste cu concentratia, deoarece in solutiile concentrate exista mai multi ioni care conduc curentul electric. Peste o anumita limita a concentratiei conductivitatea scade, fenomenul datorandu-se interactiunilor ionice care apar. Masuratorile de conductivitate se fac cu ajutorul celulelor de conductivitate, care sunt alcatuite din doi electrozi de platina cu suprafata egala, asezati paralel la o distanta fixa. Simbolul folosit pentru aceasta marime este de obiceil, iar unitatea de masura este siemens pe metru (S·m−1). Solutiile de electroliti sunt conductori ionici deoarece transportul curentului electric se realizeaza prin intermediul ionilor existenti in solutii. Relatia pe baza careia se calculeaza conductivitatea este:
![]() ; unde:
; unde:
l = lungimea conductorului sau distanta dintre electrozi;
s = sectiunea conductorului sau suprafata electrozilor;
R = rezistenta specifica;
ρ = rezistivitatea.

Fig. 5.4 Aparat de masurat conductivitatea
Marimea inversa conductivitatii este rezistivitatea electrica, cu simbolul ρ si unitatea de masura ohm metru (Ω·m).
Urmatorii termeni sint inruditi cu conductivitatea electrica dar au semnificatii diferite:
Conductibilitatea electrica este proprietatea materialelor de a permite trecerea curentului electric.
Conductanta electrica este marimea care exprima capacitatea a unui conductor sau circuit dat de a conduce curentul electric. Conductanta se masoara in siemens (S) si este marimea inversa rezistentei electrice masurate in ohmi (Ω
4. Duritatea
Duritatea apei se datoreaza faptului ca exista cationi multivalenti. Apa dura este clasificata dupa ionii gasiti in apa. Duritatea apei este determinata de totalitatea sarurilor de calciu si magneziu solubile, prezente in apa. In functie de natura sarurilor, duritatea apei este de trei feluri:
4.1.Duritatea temporara
Duritatea temporara data de carbonatii acizi de calciu si magneziu dizolvati in apa. Duritatea temporara dispare prin fierbere, deoarece carbonatii acizi sunt transformati in carbonati neutri de calciu si magneziu, care, fiind insolubili, se depun:
(Ca2+ + 2HCO3-) = CaCO3 + CO2 + H2O
(Mg2+ + 2HCO3-) = MgCO3 + CO2 + H2O
Duritatea temporara este cauzata de combinatiile ionilor de Ca cu ionii bicarbonati care se gasesc in apa. Acestea pot fi indepartati prin fierbere. Fierbem carbonatul sau bicacrbonatul de calciu iar precipitatul carbonatului de calciu iese din solutie. Apa dupa aceasta este usoara, nu mai e dura, dupa ce se raceste.
Fierberea apei pentru a indeparta duritatea este lunga pana la precipitarea CaCO solid si indepartarea acestuia. Dupa racire,daca avem suficient timp apa formeaza din nou doza de CO din aer si reactia se produce iar de la stanga la dreapta si CaCO se redizolva in apa.
4.2. Duritarea permanenta
Duritatea permanenta- data de totalitatea celorlalte saruri de calciu si magneziu dizolvate. Duritatea permanenta nu variaza in conditiile obisnuite din natura.
Duritatea permanenta este duritatea care nu poate fi indepartata prin fierbere. Este de obicei cauzata de sulfatul de Ca si Mg sau clorurile care sunt prezente in apa, deoarece sunt mai solubile la temperaturi ridicate. In ciuda numelui, duritatea permanenta poate fi indepartata folosind apa calmanta sau schimbarea coloanei de ioni. Duritatea (apa dura) da un sortiment care da depozite de minerale,acestea se formeaza dupa ce apa dura se evapora. Mai poarta numele acest lucru de limescale. Acest sortiment poate bloca tevile ducand la riscul sanatatii,prin folosirea apei din cafea sau ceai.
In industrie duritatea apei trebuie monitorizata constant pentru evitarea accidentelor la fierbere, racirea tuburilor si alte echipamente ce vin in contact cu apa. Duritatea e controlata prin aditionarea chimica si sortiment larg de zeolit si schimbul ionilor de rasini.
4.3.Duritatea totala
Duritatea totala - este data de duritatea temporara si cea permanenta.
Exprimarea duritatii apei se face cu ajutorul gradelor de duritate germane sau franceze.
Un grad de duritate german corespunde la 10 mg CaO dizolvat intr-un litru de apa iar un grad de duritate francez corespunde la 10 mg CaCO3 dintr-un litru de apa.
4.4. Masurarea duritatii
Este posibila masurarea ridicata a apei obtinute prin testarea apei libere. Deoarece se stie precis mineralele care se dizolva in apa acestea dau pH-ul apei si temperatur. Descrierea duritatii se face dupa:
slab(usor): 0-20mg/L Ca;
slab moderat: 20-40mg/L Ca;
usor ridicat: 40-60mg/L Ca;
ridicat moderat: 60-80mg/L Ca;
ridicat: 80-120mg /L Ca;
foarte ridicat: >120mg/L Ca.
Duritarea se masoara in grade franceze si ea este determinata prin:
50ml apa sau daca nu solutia de analizat + 0.5ml amoniac+ 2 pastile Buffer
Se titreaza cu EDTA 0.1N pana la culoarea verde inchis.
5. Consumul chimic de oxigen
Consumul chimic de oxigen sunt substantele ce se pot oxida atat la rece cat si la cald, sub actiunea unui oxidant. Oxidabilitatea reprezinta cantitatea de oxigen echivalenta cu consumul de oxidant. Substantele organice sunt oxidate la cald iar cele anorganice la rece.
Principiul folosit la determinarea consumului chimic de oxigen din apa analizata:
Substantele oxidabile din apa sunt oxidate de bicromat de potasiu in prezenta sulfatului de argint, la cald, iar excesul de bicromat este titrat cu sarea Mohr in prezenta ortofenentrolinei ca indicator.
Reactivii si materialul necesar:
punem proba de analizat intr-un balon cu fundul rotund de 250 ml peste care se adauga 10ml K Cr O (0.25N) si 0.8mg HgSO
se ataseaza balonul la refrigerentul cu reflux, se adauga 30ml H SO -AgSO peste solutia analizata (dar cu grija, picatura cu picatura), si se porneste instalatia de incalzire. Se fierbe timp de 2 ore;
lasam solutia sa se raceasca apoi adaugam in Erlenmeyer apa distilata pana la volumul de 150ml si 2 picaturi de ortofenantrolina.
titram excesul de bicarbonat de potasiu din solutie cu sarea Mohr pana la culoarea rosie(culoarea vinului)
Consumul chimic de oxigen se calculeaza conform formulei :
![]()
Unde:
D= dilutia factorului de analizat;
Vbl= volumul sarii lui Mohs care a fost folosit la apa distilata;
Val = volumul sarii lui Mohs care a fost folosit la solutia de analizat.
Prepararea consumului chimic de oxigen
Se iau 4 boluri identice si se adauga :
20 ml apa distilata + 10 ml Cr O + 0.8mg HgSO + 30ml Ag SO
20 ml solutie de analizat + 10 ml Cr O + 0.8mg HgSO + 30ml Ag SO
20 ml solutie de analizat + 10 ml Cr O + 0.8mg HgSO + 30ml Ag SO
20 ml solutie de analizat + 10 ml Cr O + 0.8mg HgSO + 30ml Ag SO
Instalatia folosita pentru determinarea consumului chimic de oxigen este prezentata in figura de mai jos:

Fig.5.5.Instalatia pentru determinarea consumului chimic de oxigen
Dupa ce se racesc bolurile se titreaza cu sarea Mohr pana la culoarea rosu.

Fig.5.6. Titrarea cu sarea Mohr

Fig.5.7.Dupa titrare
6. Modul de calcul privind duritatea, conductivitatea si consumul chimic de oxigen
Formula dupa care se face echilibrul maselor este prezentata mai jos:
![]() ;
unde:
;
unde:
F= volumul total al solutiei de analizat;
![]() = valoarea data pentu fiecare caz in parte a solutiei de analizat;
= valoarea data pentu fiecare caz in parte a solutiei de analizat;
P= volumul total al apei pure;
![]() = valoarea data pentru fiecare caz in
parte a apei pure;
= valoarea data pentru fiecare caz in
parte a apei pure;
C= volumul total al concentratului;
![]() =
valoarea data pentru fiecare caz in parte a concentratului.
=
valoarea data pentru fiecare caz in parte a concentratului.
Aceasta ecuatie se aplica pentru a face echilibrul in cazul conductivitatii, a duritatii si a consumului chimic de oxigen.
Pe 5.05.2008 :
Conductivitatea:![]() µScm
µScm
Duritatea :
![]() F
F
Consumul chimic de oxigen:
![]() mgO /L
mgO /L
Pe 6.05.2008:
Conductivitatea pentru concentrat a:
![]() µScm
µScm
Conductivitatea pentru concentrat b:
![]() µScm
µScm
Duritatea pentru proba a:
![]() 0F
0F
Duritatea pentru proba b:
![]() 0F
0F
Consumul chimic de oxigen pentru proba a:
![]() mg
O /L
mg
O /L
Consumul chimic de oxigen pentru proba b:
![]() mg
O /L
mg
O /L
Pe 7.05.2008
Conductivitatea:
![]() µScm
µScm
Duritatea:
![]() F
F
Consumul chimic de oxigen:
![]() mgO /L
mgO /L
7. Calculul respingerii
Se calculeaza tot in cazul duritatii, conductivitatii si a CCO-ului cu urmatoarea formula:
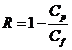 ;unde:
;unde:
R = respingere;
![]() = valoarea apei pure rezultate pe fiecare
caz in parte;
= valoarea apei pure rezultate pe fiecare
caz in parte;
![]() = valoarea solutiei de analizat pe
fiecare caz in parte.
= valoarea solutiei de analizat pe
fiecare caz in parte.
Cand :
![]() = 20mg/L atunci R = 0%
= 20mg/L atunci R = 0%
![]() = 10mg/L atunci R = 50%
= 10mg/L atunci R = 50%
![]() = 5mg/L atunci R = 25%
= 5mg/L atunci R = 25%
![]() = 0mg/L atunci R = 100% = 1.
= 0mg/L atunci R = 100% = 1.
Pe 5.05.2008:
Conductivitatea:
![]() % atunci
% atunci ![]() = 10%
= 10%
Duritatea:
![]()
Consumul chimic de oxigen:
![]() R = 50%
R = 50%
Pe 6.05.2008:
Conductivitatea:
![]() R= 25%
R= 25%
![]() R = 25%
R = 25%
Duritatea:
![]() R=0%
R=0%
![]() R=0%
R=0%
Consumul chimic de oxigen:
![]() R = 25%
R = 25%
![]() R = 25%
R = 25%
Pe 7.05.2008:
Conductivitatea:
![]() R = 50%
R = 50%
Duritatea:
![]() R = 25%
R = 25%
Consumul chimic de oxigen:
![]() R = 25%
R = 25%
8.Date experimentale
In urma cercetari privind tratarea apei de la o statie de epurare locala realizate la Universitatea KU.LEUVEN din Belgia am obtinut urmatoarele valori conform tabelului 5.1.
Tabelul.5.1. Date experimentale privind tratarea levigatului
|
Data |
Solutia |
pH |
Conductivitatea (µScm) |
Duritatea (0F) |
CCO (mg O /L) |
Membrane |
|
Solutia de analizat |
10,2 ml=>2.04 |
Compactare NF-90 |
||||
|
Apa pura | ||||||
|
Concentrat |
14 ml=>2,8 | |||||
|
Solutia de analizat |
10,6 ml=>2,12 | |||||
|
Apa pura (a) | ||||||
|
Apa pura (b) | ||||||
|
Concentrat(a) |
10,8 ml=>2,16 |
| ||||
|
Concentrat(b) |
9,1 ml=>1,82 | |||||
|
Solutia de analizat |
9,5 ml=>1,9 | |||||
|
Apa pura | ||||||
|
Concentrat |
10,8 ml=>2,16 |
Parametrii pe care i-am studiat sunt pH-ul, duritatea, conductivitatea si consumul chimic de oxygen.
9.Interpretarea rezultatelor
S-au luat pentru analiza 3 tipuri diferite de ape uzate, la care s-au studiat pH-ul, conductivitatea, duritatea si consumul chimic.
Proba 1 : toti parametri au indicat valori variabile a apei pure fata de apa de analizat, ceea ce dovedeste eficacitatea membranei folosite.
Se observa, conform tabelului ca pH-ul initial a crescut de la 5.8 la 6.4 in apa pura, obtinuta dupa filtrare. Acesta este slab acid. Acest lucru dovedeste ca sarurile anorganice cu hidroliza acida au fost eliminate, apa apropiindu-se de un pH al unei ape contaminate.
Conductivitatea a scazut de la 634 solutia de analizat la 329 apa purificata, ceea ce indica scaderea continutului de saruri din apa. De asemenea, se observa ca concentratul are conductivitatea 939, ceea ce arata ca sarurile au ramas in concentrat.
Duritatea calculata in 0F dovedeste indepartarea sarurilor solubile din apa purificata. Observam, conform tabelului, ca duritatea concentratului creste pana la 2.8, datorita sarurilor ramase.
Consumul chimic de oxigen la apa purificata are o valoare mica, ceea ce dovedeste indepartarea sarurilor.
Proba 2 : se observa ca pH-ul este acid, acesta avand o valoare initiala de 6.56si creste pana la 6.61.
Conductivitatea apei pure este mai mica decat conductivitatea solutiei de inceput, ceea ce arata ca indepartarea sarurilor solubile din solutie a avut loc. Conductivitatea initiala are o valoare de 692 si scade pana la 453.
Duritatea concentratului creste de la 2.12 la 2.16. ceea ce indica ca sarurile din solutie in urma filtrarii au ramas in concentrat.
Consumul chimic de oxigen indica acelasi lucru, conform valorilor obtinute, prezentate in tabelul de mai sus.
Proba 3 : observam ca pH-ul este tot acid, acesta avand o valoare initiala de 6.45 si creste pana la la 6.57.
Conform valorilor obtinute la conductivitate, dovedeste eficacitatea membranei, aceasta retinand foarte bine sarurile solubile.
Valorile obtinute la duritate si la consumul chimic de oxigen dovedesc acelasi lucru.
Membranele retin sarurile divalente cum ar fi Ca2+ si Mg2+ in proportie de 90% iar sarurile monovalente(Na, K) sunt retinute in proportie de 10-15%.
Membrana NF-90 retine cel mai bine sarurile. La duritate se urmareste concentratia sarurilor divalente mai exact a concentratiei Ca2+ si a Mg2+ din apa. Valorile duritatii normale sunt cuprinse intre 1-4 grade franceze. In mod normal duritatea concentratului este aproximativ de doua ori duritatea solutiei de analizat. Nanofiltrarea nu este un proces bun de indepartare a sarurilor monovalente.
In cazul CCO-ului se observa ca la membrana folosita CCOf>CCOc. Acest lucru arata ca membranele retin cam aceleasi saruri organice.CCO-ul depinde de membranele inalte/joase a ratii moleculare cut-off.
In ceea ce priveste respingerea sarurilor folosind membrana NF-90 este facuta la un grad ridicat. Desi fluxul apei pure este jos respingerea sarurilor este facuta cel mai bine folosind aceasta membrana decat o alta. Folosind aceasta membrana valorile CCO-ului pentru apa pura trebuie sa fie mai mici de 100. Presiunea folosita este de 20 barr. Aceasta metoda s-a folosit pentru a obtine apa de o calitate destul de buna pentru a fi folosita in industrie.
Fig.5.8. Membrana NF-90
La membrana NF-90 apa purificata trebuie sa aiba un pH de 6.17. Micsorarea cationilor de Ca2+ si Mg2+ in apa marilor se datoreaza procesului de nanofiltrare folosind mai multe tipuri de membrane NF. Concentratul la apa pura la NF-90 este de 19 ppm pentru o respingere de un procentaj de 96, fata de o alta membrana NF-70 care are concentratul la apa pura de 84 ppm iar respingerea de 82. Acelasi lucru se petrece si in cazul cationilor de Mg2+. Continutul de Mg2+ este are o valoare redusa in cazul apei pure in cazul folosirii membranei NF-90 (32ppm) cu o respingere de 96%. In cazul in care se foloseste procesul RO concentatia Mg e de 260-425ppm in apa pura. Respingerea in cazul membranelor NF e de 83.3% iar in cazul RO e de 73%. Folosirea membranelor NF au un bun avantaj deoarece acestea resping bine ionii de Ca si Mg din apa purificata.
![]()
Timp(ore)
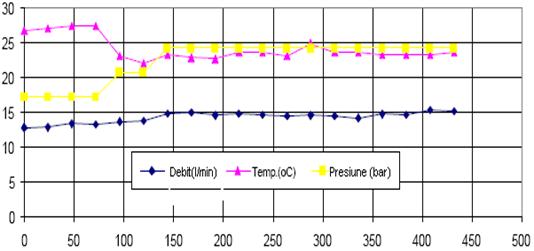
Fig.5.9.Debitul solutiei de analizat, temperatura si presiunea in functie de timp
![]()
Timp(ore)
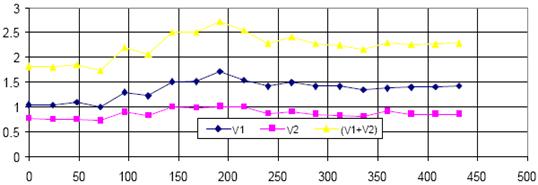
Fig.5.11. Debitul apei purificate in functie de timp
![]()
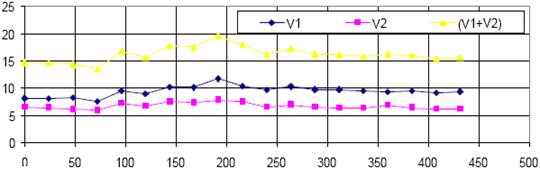
Timp(ore)
Fig 5.12. Recuperarea apei purificatoare
![]()
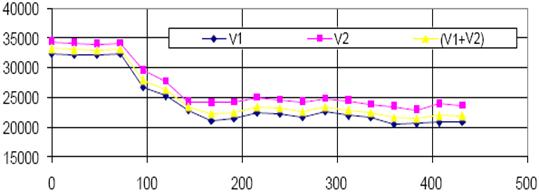
Timp(ore)
Fig.5.13. Conductivitatea
Copyright © 2025 - Toate drepturile rezervate