 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Structura atomului
Atom – cea mai mica parte dintr-o substanta care poate exista ca atare si poate lua parte la o reactie chimica.
O serie de date experimentale au dovedit ca atomul are o structura interna complexa, alcatuita din doua parti distincte:nucleul si invelis de electroni.
Primul pas important in demonstrarea divizibilitatii atomului si in elucidarea structurii lui a fost descoperirea electronului.
Cunoasterea nucleelor atomilor a fost initial legata de descoperirea radioactivitatii.
1.Particulele ![]() emise de atomii radioactivi.
emise de atomii radioactivi.
In 1895, Roentgen descopera
razele X, prin asezarea in calea razelor catodice a unei placi
metalice, inclinata la 45![]() fata
de directia de propagare a razelor catodice. La suprafata placii
metalice iau nastere razele X, diferite de razele catodice, ele sunt
alcatuite din unde electromagnetice ca si lumina, dar au lungimea de
unda mai mica.
fata
de directia de propagare a razelor catodice. La suprafata placii
metalice iau nastere razele X, diferite de razele catodice, ele sunt
alcatuite din unde electromagnetice ca si lumina, dar au lungimea de
unda mai mica.
Razele X nu sunt incarcate electric (nu sufera deviatii in campuri magnetice sau electrice) si pot produce ionizarea gazelor; excitarea fluorescenta si fosforescenta a unor substante; strabat materiale opace pentru razele luminoase (carbon, lemn, carne) si nu trec prin foi groase de metal, oase, etc.
Razele X iau nastere astfel: un e rapid al razelor catodice patrunde pana in straturile profunde (K, L, M) ale unuia dintre atomii foitei metalice, de unde disloca unul din e-. Locul acestuia este luat de un e- din straturile periferice. Acest fenomen este insotit de emisie de energie sub forma de raze X.
In 1896, Becquerel incercand sa obtina raze X, utilizand un compus al uraniului fosforescent, descopera radioactivitatea naturala.
In1899,
Roentgen dovedeste ca un flux de raze X (radiatiile radioactive)
introdus intre placile unui condensator electric sau polii unui magnet, se
scindeaza in 3 fascicole mai mici, unul atras de placa negativa –
radiatiile ![]() , altul atras de placa pozitiva – radiatiile
, altul atras de placa pozitiva – radiatiile
![]() , si al treilea nedeviat – radiatiile
, si al treilea nedeviat – radiatiile ![]()
Radiatiile
![]() sunt radiatii
electromagnetice de tipul razelor X dar cu lungimi de unda mai mici.
sunt radiatii
electromagnetice de tipul razelor X dar cu lungimi de unda mai mici.
Radiatiile
![]() sunt e - in miscare cu viteze
foarte mari, foarte asemanatori cu razele catodice.
sunt e - in miscare cu viteze
foarte mari, foarte asemanatori cu razele catodice.
Radiatiile
![]() sunt
alcatuite din particule cu masa mult mai mare decat a e (masa 4 si sarcina +2). Particulele
sunt
alcatuite din particule cu masa mult mai mare decat a e (masa 4 si sarcina +2). Particulele ![]() cu viteze
foarte mari patrund in materie.
cu viteze
foarte mari patrund in materie.
Particulele ![]() emise de atomii radioactivi.
emise de atomii radioactivi.
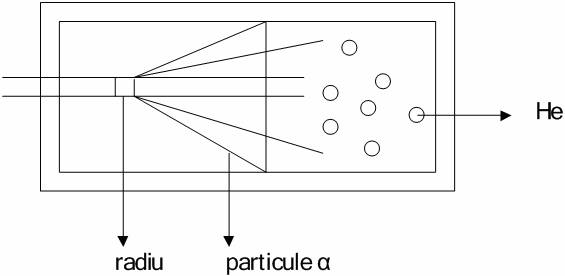
Daca in unul din compartimente se introduce Ra se aduna ,dupa ceva timp, in cel de al doilea compartiment He. Daca peretele metalic este prea gros, He ramane in compartimentul care contine Ra.
Reactia nucleara de dezintegrare a radiului:
Ra![]() Rn+
Rn+![]()
ARa=226; ARn=222 ;AHe =4
radiatiile ![]() sunt
nuclee de heliu.
sunt
nuclee de heliu.
Devierea particulelor α prin metale
In 1911, Rutherford efectueaza un experiment celebru,care dovedeste ca atomul este alcatuit din nucleu si invelis de electroni.
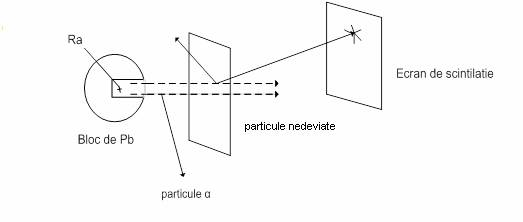
O sare de radiu continuta intr-o cavitate cilindrica,practicata intr-un bloc de Pb,emite radiatii α ,dirijate spre o foita metalica (Au sau alt metal) extrem de subtire (grosime de ~10000 atomi).Majoritatea particulelor strabat foita, cateva sunt deviate. Deplasand ecranul fluorescent s-a stabilit ca radiatiile sunt dispersate in toate partile, unele fiind aproape intoarse din drum.
Experienta a fost interpretata astfel: atomii metalului sunt compusi din nucleu si electroni cu dimensiuni extrem de mici ,diametrul atomului cuprins intre 1∙10-8cm – 4∙10-8cm, nucleele au diametre aproximativ de 10-12cm , iar electonii de 10-13cm.
Particulele α nu sunt deviate de electroni, deoarece acestia au masa mai mica. Faptul ca sunt deviate foarte putine dovedeste ca distanta dintre nuclee este mare. Cand o particula α loveste un nucleu din plin este practic intoarsa din drum. Au loc respingeri electrostatice intre particule cu sarcina pozitiva.
Aparatul lui Rutherford a fost perfectionat, astfel incat din devierea particulelor α, sa se poata evalua sarcinile pozitive ale nucleelor atomice care produc devierea.
La viteze mari, particulele α smulg un numar mare de electroni, ionizand gazul prin care trec. Dupa ce pierd o parte din energia cinetica, capteaza 2e- sa se transforme in He.
Experiente care au demonstrat existenta e-:
1. Raze catodice
In mod normal aerul (in general gazele) nu conduc curentul electric. Daca se aplica o diferenta de potential ~ 10000 V intre doi electrozi metalici de la capetele unui tub de sticla inchis,in care se gaseste aer, nu se observa nici o trecere a curentului electric. Daca cu ajutorul unei pompe de vid se reduce presiunea aerului din tub, se observa trecerea curentului electric, uneori insotita de efecte luminoase (fluorescenta) datorata lovirii peretilor de sticla de catre particule emise de catod – raze catodice.
Aplicand in anod o gaura patrata si asezand in partea opusa catodului un ecran fosforescent, apare pe ecran o portiune patrata luminata A, rezultand ca razele catodice se propaga in linie dreapta.
Tubul este prevazut cu 2 electrozi suplimentari P1 si P2 . Daca se aplica o diferenta de potential, pata se deplaseaza din A in B,deci razele sunt deviate de un camp electric (similar in camp magnetic) rezulta ca razele catodice sunt particule materiale incarcate cu sarcina (-). Un conductor electric izolat plasat in drumul razelor catodice se incarca negativ.
Aceste particulele au fost denumite e-

Tub de raze catodice, prevazut cu electrozi pentru devierea razelor.
Existenta electronilor a fost dovedita si de experiente cum ar fi :
-unele metale aduse la incandescenta emit electroni – efectul termoelectric;
-sub actiunea luminii ultraviolete metalele emit electroni – efectul fotoelectric .
Din experientele descrise s-a demonstrat ca atomul nu este indivizibil , el este format dintr-un nucleu (unde este concentrata sarcina pozitiva si aproape toata masa atomului) si dintr-un invelis electronic a carui sarcina negativa este egala cu cea pozitiva , ceea ce face ca din punct de vedere electric atomul sa fie neutru.
Z-numarul atomic (sarcina nucleara)
A-numarul de masa A=Z+n
Caracteristicile particulelor elementare fundamentale ale atomului.
|
Numele particulei |
Simbol |
Masa |
Sarcina |
Descoperitorul particulei |
||
|
In kg |
u.a.m |
Coulombi |
relativa |
|||
|
Proton |
|
|
1,0072 |
|
+1 |
Rutherford, 1911 |
|
Neutron |
|
|
1,0086 |
0 |
0 |
Chadwick, 1932 |
|
Electron |
|
|
0,000548 |
|
-1 |
Thomson, 1897 |
Modele atomice
Thomson 1904 – model static
Atomul este o sfera de uniforma sarcina pozitiva , in care sunt incorporati electroni astfel incat pe ansamblu atomul sa fie neutru.
Rutherford 1911 – modelul planetar
Ca urmare a experimentului efectuat ,devierea radiatiilor α prin metale, Rutherfod considera ca atomul este alcatuit din nucleu si electroni care se rotesc pe orbite in jurul acestuia. Nu indica numarul sarcinilor pozitive si negative precum distribuirea electronilor. Desi a postulat rotatia rapida a electronului in jurul nucleului,pentru ca forta centrifuga sa echilibreze forta de atractie a nucleului , analogia electron – planeta nu este valabila, deoarece atat nucleul cat si electronul sunt incarcati cu sarcini. Conform electrodinamicii clasice , cand o sarcina electrica efectueaza o miscare de rotatie ea pierde o parte din energie (cedata sub forma de radiatii). De aici rezulta ca electronii ar pierde continuu energie si s-ar apropia de nucleu rotindu-se in spirala pana cand, eventual,vor cadea pe acesta.
1. Modelul lui Bohr 1913
Primul model de natura cuantica a atomului. Preia modelul planetar a lui Rutherford si ii aplica teoria cuantelor. Desi ipotezele introduse de Bohr sunt de natura cuantica , calculele efective ale marimilor specifice atomului sunt clasice.
Rezulta
de aici ca modelul lui Bohr este semicuantic. Modelul este aplicabil
(pentru hidrogen si ionii hidrogenoizi ![]()
![]()
![]() adica ionii care au un singur electron
in campul de sarcina efectiva a nucleului.
adica ionii care au un singur electron
in campul de sarcina efectiva a nucleului.
Postulatele lui Bohr
1. Electronul se roteste numai pe anumite orbite premise , fara a emite sau absorbi energie radianta . Aceste orbite se numesc stari stationare si au o viata infinita si energie constanta. Electronul trece pe alte nivele energetice doar daca este perturbat din exterior. Electronul se mentine pe o orbita stationara datorita compensarii fortei centrifuge cu forta de atractie Coulumbiana ( teorie care explica stabilitatea atomului si este in contradictie cu fizica clasica, conform careia electronul in miscare pierde energie si in final cade pe nucleu ).
2. Electronul emite sau absoarbe energie doar la trecerea dintr-o stare stationara in alta. Radiatia emisa sau absorbita are frecventa data de relatia lui Max Planck
![]() unde :
unde :
![]() Js –
constanta lui Planck ,
Js –
constanta lui Planck , ![]() - frecventa
radiatiei emise / absorbite ,
- frecventa
radiatiei emise / absorbite , ![]() - energiile starilor stationare intre care are loc tranzitia
- energiile starilor stationare intre care are loc tranzitia
Electronul trece dintr-o stare stationara in alta cu energie superioara daca i se transmite o cuanta de energie corespunzatoare diferentei dintre cele doua nivele.
Concluziile teoriei lui Bohr:
-atomul este alcatuit din nucleu si e- care se rotesc in jurul nucleului
-energia unui atom este cuantificata, este determinata de numarul cuantic n =1,2,3…; atomii pot adopta decat anumite valori a nivelului de energie ale caror valori sunt invers proportionale cu n2;
-e- in miscare nu emite, nu absoarbe energie, emisia sau absorbtia are loc numai atunci cand e- sufera o tranzitie intre doua orbite cu nivele de energie diferite.
Deficientele teoriei lui Bohr. Modelul nu poate explica spectrele de emisie si energia de ionizare decat pentru hidrogen si ionii hidrogenoizi. Nu a fundamentat stiintific spectrele unor atomi grei. Nu a explicat formarea legaturii duble. Nu a putut explica scindarea liniilor spectral intr-un camp perturbator.
4. Modelul Bohr-Sommerfeld (1916).
Arnold Sommerfeld a dezvoltat modelul lui Bohr,el a presupus ca orbitele stationare din jurul nucleului nu sunt numai circulare ci si eliptice.
Unei orbite circulare cu numar cuantic principal n ii corespund n-1 orbite stationare eliptice, deci fiecare orbita circulara se descompune in n-1 orbite stationare eliptice.
Pentru numarul cuantic n( care determina energia e-) exista n orbite diferite in care e- are aceeasi energie. Aceste orbite difera prin forma lor: una este circulara si n-1 sunt eliptice cu diferite excentricitati dar cu aceeasi axa mare(diametrul orbitei circulare).
Pentru explicarea structurii fine a liniilor spectrale, a fost necesara admiterea unei subdivizari a fiecarui nivel de energie. Miscarea e- fiind caracterizata de 4 numere cuantice:
-n - numar cuantic principal (indica distanta orbitei e- de nucleu si energia e-
n=1,2,3…,7;
-l -numar cuantic secundar(azimutal) –corespunde momentului cinetic al e- si este o masura pentru semiaxa mica a elipsei. la toate valorile cuprinse intre 0 si n-1;
-m - numar cuantic magnetic- reprezinta proiectia momentului magnetic al e- (creat prin rotatia e-) pe directia campului magnetic exterior.
m-poate avea 2l+1 valori (-l…,0,…+l);
-s - numar cuantic de spin( datorat rotatiei e- in jurul axei sale, s ia doua valori +1/2 si -1/2, dupa cum rotatia e- in jurul axei sale este in acelasi sens sau in sens contrar cu rotatia e- pe orbita.
Concluzii:
invelisul de e- are structura stratificata;
e- cu acelasi numar cuantic principal n se gasesc la aceeasi distanta de nucleu formand un ”strat electronic”. cel mai apropiat de nucleu este stratul cu n=1;
un strat are n2 orbite 2n2 electroni;
toate orbitele cu l=0 sunt circulare, celelalte sunt eliptice;
orbitele sunt caracterizate prin 3 numere cuantice ( n, l, m);
e- este caracterizat de 4 numere cuantice ( n, l, m, s).
Componenta primelor 4 straturi din invelisul de electroni al atomului
|
Numere cuantice |
Tipuri si numar de orbitali |
Nr. de e- |
Simbol |
Strat |
|||
|
n=1 |
l=0 |
m= 0 |
s=± |
1 orbital s |
2 |
1s |
K |
|
n=2 |
l=0 l=1 |
m= 0 m= -1,0,+1 |
s=± s=± |
1 orbital s 3 orbitali p |
2 6 |
2s2p |
L |
|
n=3 |
l=0 l=1 l=2 |
m= 0 m= -1,0,+1 m= -2,-1,0,+1,+2 |
s=± s=± s=± |
1 orbital s 3 orbitali p 5 orbitali d |
2 6 10 |
3s3p3d |
M |
|
n=4 |
l=0 l=1 l=2 l=3 |
m= 0 m= -1,o,+1 m= -1,-2,0,+1,+2 m=-3,-2,-1,0,+1,+2,+3 |
s=± s=± s=± s=± |
1 orbital s 3 orbitali p 5 orbitali d 7 orbitali f |
2 6 10 14 |
4s4p4d4f |
N |
Copyright © 2024 - Toate drepturile rezervate