 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
CARACTERIZARE GENERALǍ A METALELOR TRANZITIONALE DE TIP "d"
Definitie .
Generalitati . Elementele tranzitionale (sau de tranzitie ) de tip "d"se
definesc ca elementele ale caror atomi au nivelele d partial ocupate cu electroni . Sunt considerate
tranzitionale de tip "d" si
elementele ale caror atomi au nivelele d
partial ocupate cu electroni in oricare din starile de oxidare
obisnuite . De aceea , elementele Cu , Ag si Au , la care Cu![]() are
configuratia 3d
are
configuratia 3d![]() , Ag
, Ag![]() are
configuratia 4d
are
configuratia 4d![]() si Au
si Au![]() are
configuratia 5d sunt
considerate elemente tranzitionale de tip "d" .
are
configuratia 5d sunt
considerate elemente tranzitionale de tip "d" .
Dupa definitia
data elementelor tranzitionale de tip "d", zincul , cadmiul si mercurul nu se incadreaza in
clasa acestor elemente , intrucat atat in stare atomica cat si in
starea de oxidare +2(singura posibila) , ele au configuratia
electronica d![]() s
s![]() , respectiv d
, respectiv d![]() s
s![]() . Totusi , din cauza asemanarii lor,
din punct de vedere al comportarii chimice , cu metalele
tranzitionale de tip "d" , ele
sunt studiate in cadrul acestor grupe de elemente .
. Totusi , din cauza asemanarii lor,
din punct de vedere al comportarii chimice , cu metalele
tranzitionale de tip "d" , ele
sunt studiate in cadrul acestor grupe de elemente .
Examinand tabelul periodic al elementelor , din cele 108 elemente cunoscute 30 sunt elemente tranzitionale de tip "d" .
Se considera mai de mult ca proprietatile acestor elemente fac trecerea (tranzitia) intre caracteristicile metalice ale metalelor alcaline si alcalino-pamantoase si cele nemetalice ale elementelor din grupele principale , din dreapta tabelului periodic al elementelor. Din aceasta cauza ele au fost denumite elemente tranzitionale . Pe masura ce proprietatile fizice si chimice ale acestor elemente au fost cunoscute mai bine, s-a constatat ca ele nu au caractere de "tranzitie", ci dimpotriva, sunt metale tipice. Denumirea de elemente (sau metale) tranzitionale s-a pastrat insa. Ea este justificata , de locul pe care il ocupa aceste elemente in tabelul periodic al elementelor .
Elementele tranzitionale de tip "d" prezinta o serie de particularitati, datorita carora formeaza o clasa aparte. Ele au in comun urmatoarele proprietati:
Toate sunt metale ;
Sunt metale dure, cu puncte de topire si de fierbere ridicate si conduc bine caldura si curentul electric ;
Intre ele , precum si cu alte metale , formeaza aliaje ;
Unele dintre ele au potentiale de oxidare atat de mici incat nu sunt atacate de acizi ;
In majoritatea cazurilor , manifesta valente variabile ;
Ionii si compusii lor sunt colorati in una din starile de oxidare (cand au electronii necuplati in orbitali d ) ;
Pot forma compusi paramagnetici avand electroni necuplati .
STARE NATURALǍ . POZITIE IN SISTEMUL PERIODIC
STARE NATURALǍ
Datorita reactivitatii diferite pe care o manifesta metalele tranzitionale de tip ,,d" , formele lor de existenta in natura sunt variate. Metalele foarte putin reactive se gasesc in stare nativa in zacaminte sau in nisipul unor roci ( de exemplu : Au , Ag , Pt ) . Toate celelalte metale se gasesc in minerale sub forma de oxizi , sulfuri , carbonati , silicati , etc. Din care se extrag prin diferite procedee .
Mineralele mai frecvent intalnite si exploatate minier in scopul obtinerii metalelor respective sunt indicate in tabelele 1 si 2 .
In ceea ce priveste abundenta acestor metale in scoarta
terestra , metalele din prima serie , in special cele cu numere atomice
pare , sunt mai raspandite decat cele din seriile urmatoare . De
exemplu , ultimele sase elemente din cea de-a doua si a treia serie ,
la un loc , nu constituie mai mult de 1,5×10![]() % din scoarta Pamantului .
% din scoarta Pamantului .
Abundenta metalelor tranzitionale de tip d in scoarta Pamantului este redusa . Doar aproximativ 5% din aceasta se compune din elementele tranzitionale .
Ferul ocupa un loc aparte fiind singurul element tranzitional mai raspandit , 4,7%, dupa oxigen , siliciu si alumuniu .
Majoritatea metalelor tranzitionale au o abundenta sub 0,01% , iar unele din ele formeaza rar zacaminte , fiind dispersate relativ uniform in scoarta Pamantului .
Tabelul 1 : Unele minerale ale metalelor tranzitionale 3d
|
Scandiu |
Titan |
Vanadiu |
Crom |
Mangan |
|
Sc tortveitita |
TiO Rutilul FeTiO ilmenita CaTiO perovskita BaTi[Si benitonita |
V patronita Pb vanadinita K[UO carnotita |
FeO ∙ Cr cromitul PbCrO crocoita K lopezita |
MnO piroluzita MnO(OH) manganita Mn hausmanita MnCO rodocrozita |
|
Fer |
Cobalt |
Nichel |
Cupru |
Zinc |
|
Fe magnetita Fe hematita FeO(OH) limonita FeCO siderita FeS pirita |
CoAs smaltina CoAsS cobaltina Co linneita |
NiS milerita NiAs nichelina NiAsSb ulmanita |
Cu calcosina CuFeS calcopirita Cu bornita Cu Cuprita CuCO malachita |
ZnS blenda ZnCO calamina Zn willemita |
Tabelul 2 : Unele minerale ale metalelor tranzitionale 4d si 5d
|
Zirconiu Hafniu |
Niobiu Tantal |
Molibden Wolfram |
Reniu |
|
ZrSiO zirconul ZrO baddeleyta |
Fe(Mn)(NbO niobita Fe(Mn)(TaO tantalita YTaO fergusonita |
molibdenita,MoS powellita,Ca(Mo,W)O wulfenita,PbMoO ilsemanita,MoO wolframita,Mn(Fe)WO scheelita,CaWO stolzita,PbWO |
-in unele minerale de molibden, platina sau cupru |
|
Metale platinice |
Argint Aur |
Cadmiu Mercur |
|
|
platina rodifera PtS Cooperit Pd Stibiopaladinita RhS laurita |
platina paladifera platina nichelifera (Pt,Pd,Ni)S braggit Pd stanopaladet PdO galadit |
argentita,Ag proustita,Ag pirargirita, Ag naumanita,Ag silvanita,AuAgTe kerargirita,AgCl bromargirita,AgBr aur nativ |
CdS greenokita CdCO otavita HgS cinabrul Hg calomelul HgSe tiemanita |
POZITIA IN SISTEMUL PERIODIC
Sub denumirea de metale tranzitionale sunt cuprinse toate elementele chimice cu caracter metalic, care din punct de vedere al structurii electronice se caracterizeaza prin prezenta in atomii sau ionii lor a orbitalilor d sau f partial ocupati. Reiese astfel ca dupa natura orbitalilor atomici in curs de completare se disting doua categorii de metale tranzitionale si anume : metale tranzitionale de tip d si metale tranzitionale de tip f.
Se considera ca proprietatile acestor metale fac trecerea (tranzitia) intre caracteristicile metalice ale metalelor alcaline si alcalino-pamantoase si cele nemetalice ale elementelor din grupele principale, din dreapta tabelului periodic. Din aceasta cauza au fost numite elemente tranzitionale. Pe masura ce proprietatile fizice si chimice ale acestor elemente au fost cunoscute mai bine, s-a constatat ca ele nu au un caracter "de tranzitie", ci dimpotriva sunt metale tipice. Denumirea de metale tranzitionale s-a pastrat insa si este justificata de altfel, prin locul ce-l ocupa aceste elemente in tabelul periodic.
In tabelul periodic metalele tranzitionale sunt asezate intre grupa principala 2(IIA) si grupa principala 13(IIIA) , avand numeroase proprietati chimice comune , determinate de electronii s cei mai exteriori , mobili si conducatori de electricitate . Ele formeaza grupele secundare ale tabelului periodic , in numar de opt : grupa 3(IIIB), grupa 4(IVB), grupa 5(VB) , grupa 6(VIB) , grupa 7(VIIB) , grupele 8, 9 si 10(VIIIB) ,grupa 11(IB) si grupa 12(IIB).
Elementele din grupa
12(IIB) :zinc, cadmiu si mercur nu sunt cuprinse in seria metalelor
tranzitionale de tip d , conform
definitiei date . Aceste trei metale au orbitalii d complet ocupati
atat in stare atomica cat si in combinatii unde apar numai in
starea de oxidare +2 . Elementele din aceasta grupa se
aseamana din punct de vedere chimic cu metalele tranzitionale ,
in special prin capacitatea lor de a forma complexi si de aceea vor fi
discutate impreuna cu acestea . Apare de asemenea justificata
tratarea acestor elemente dupa grupa 11(IB) , caci ionii lor ( Zn![]() ,Cd
,Cd![]() ,Hg
,Hg![]() ) au aceeasi structura electronica ( d
) au aceeasi structura electronica ( d![]() )ca ionii monopozitivi ai elementelor din grupa 11(IB) :
Cu
)ca ionii monopozitivi ai elementelor din grupa 11(IB) :
Cu![]() ,Ag
,Ag![]() , Au
, Au![]() .
.
Elementele tranzitionale d sunt dispuse in tabelul periodic in patru serii, de cate zece elemente , cate o serie in fiecare dintre perioadele 4 , 5 , 6 si 7 . Ultima serie , cea din perioada 7 este incompleta , din ea cunoscandu-se pana in prezent doar sapte elemente .
CONFIGURATIA ELECTRONICǍ
In procesul de completare a orbitalilor atomici , electronul distinctiv ocupa acea pozitie vacanta , care conduce la realizarea starii energetice cele mai joase, starea fundamentala a atomului respectiv . De aceea , pentru stabilirea ordinei de ocupare cu electroni a orbitalilor atomici este necesar sa se cunoasca ordinea succesiunii energetice relative ale acestora .
Discutarea acestei probleme permite intelegerea aparitiei seriilor de metale tranzitionale ca o consecinta a unui mod special de completare cu electroni a nivelelor energetice .
Energia fiecarui nivel depinde intr-un mod special de ocuparea cu electroni a celorlalte nivele . Se constata ca energia diversilor orbitali atomici scade cu numarul atomic , intr-un mod care depinde de natura acestora .
Descresterea observata in energia orbitalilor atomici este o consecinta a faptului ca masura in care un electron dintr-o orbitala data este ecranat fata de sarcina nucleara de catre ceilalti electroni din atom , nu este suficienta pentru a impiedica o crestere continua a sarcinii nucleare efective cu numarul atomic . Datorita acestei ecranari incomplete fiecare electron este supus actiunii unei sarcini nucleare efective mai mari si pe baza relatiei :
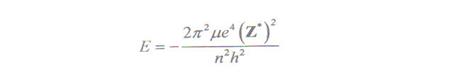
care reprezinta variatia energiei unui electron intr-un astfel de sistem , se poate aprecia ca energia acestuia scade cu cresterea sarcinii nucleare efective Z٭, la care este supus .
Pana la numarul atomic 18(Ar) , orbitalii se completeaza in ordinea numarului cuantic principal n , adica se completeaza mai intai orbitalii cu n=1 (1s) , apoi cei cu n=2 (2s,2p) , etc . La elementul cu Z= 19 (K) in loc sa inceapa ocuparea orbitalilor 3d , se ocupa nivelul 4s deoarece acesta este mai sarac in energie . Orbitalul 4s este complet ocupat la Ca (Z=20) .
La elementul cu Z=21 (Sc)
ocuparea cu electroni a orbitalilor cu numarul cuantic principal 4 este
intrerupta si se ocupa un orbital cu numarul cuantic
principal mai mic , anume 3d , deoarece acesta are energia mai
scazuta . Atomul de scandiu are deci configuratia
electronica [![]() Ar]3d
Ar]3d![]() 4s
4s![]() . In continuare se ocupa cu electroni cei cinci orbitali
3d, care pot primi maximum 10 electroni. Astfel se formeaza prima serie de
10 metale tranzitionale de tip d ( Sc - Zn ) .
. In continuare se ocupa cu electroni cei cinci orbitali
3d, care pot primi maximum 10 electroni. Astfel se formeaza prima serie de
10 metale tranzitionale de tip d ( Sc - Zn ) .
Dupa completarea orbitalilor 3d incepe ocuparea cu electroni a orbitalilor 4p si apoi 5s , care se incheie la elementul cu Z=38 (Sr) . In acest punct la elementul cu Z=39 (Y) orbitalii 4d devin mai stabili din punct de vedere energetic decat orbitalii 5p si se formeaza a doua serie de metale tranzitionale d , care cuprinde 10 elemente ( Y - Cd ) .
De la numarul atomic 49 incepe ocuparea orbitalilor 5p si apoi 6s cu formarea de elemente ce fac parte din grupele principale , pentru ca la elementul cu Z=57 (La) electronul distinctiv sa ocupe un orbital 5d mai sarac in energie decat orbitalii 6s . Lantanul este deci primul reprezentant al celei de-a treia serii de metale tranzitionale de tip d .
La elementul urmator , ceriul , orbitalii 4f devin mai stabili ca 5d , astfel incat seria tranzitionala d este intrerupta . Dupa acest element urmeaza ocuparea orbitalilor 4f cu formarea seriei de 14 elemente a lantanidelor . Aceasta se incheie la elementul cu Z=71 (Lu) . La urmatorul element (Hf) orbitalii 5d sunt din punct de vedere energetic cei mai stabili orbitali neocupati , astfel incat se continua cea de-a treia serie de metale tranzitionale d care se incheie cu elementul cu Z=80 (Hg) . Intre numerele atomice 81 - 88 apar din nou elemente ce apartin grupelor principale .
Elementul cu Z=89 (Ac) este primul reprezentant al celei de-a patra serii de metale tranzitionale de tip d . In continuare se ocupa orbitalii 5f , deveniti mai stabili decat 4d , si se formeaza a doua serie de elemente tranzitionale f , actinidele , care se incheie la elementul cu Z=103 (Lr) . Elementele cu Z= 104 - 107 si 109 obtinute pe cale artificiala in ultimii ani , fac parte din a patra serie de metale tranzitionale de tip d , care este incompleta .
In succesiunea completarii cu electroni a orbitalilor d se observa , la elementele Cr , Cu , Nb , Mo , Tc , Ru , Rh , Ag , Pt si Au o serie de neregularitati . Devierile observate in ordinea asteptata de completare cu electroni a acestor nivele au fost atribuite stabilitatii suplimentare indusa de prezenta unui nivel d jumatate sau complet ocupat cu electroni . Aceasta explicatie este valabila pentru elementele din prima serie de tranzitionale d ( Cr si Cu ) . si nu este fara indoiala singura .
In realitate energiile nivelelor 3d si 4s sunt suficient de apropiate pentru ca in anumite cazuri, configuratiile electronice ale elementelor respective sa fie diferite de acelea prezise pe baza energiilor orbitalelor relative . O configuratie electronica cu un nivel 5s partial ocupat , caracteristica celor mai multe elemente din cea de-a doua serie de metale tranzitionale , poate fi corelata si cu faptul ca energia nivelului 4d este exact sub aceea a nivelului 5s .
Regularitatea mai mare observata la elementele celei de-a treia serii de metale tranzitionale d ar putea fi atribuita faptului ca separarea energetica intre nivelele 5d si 6s creste cu numarul atomic .
La o analiza mai profunda , se ajunge la concluzia ca pentru un atom in stare fundamentala , configuratia electronica depinde de mai multi factori . Datorita acestui fapt , pe langa ecranarea unui electron dat , fata de sarcina nucleara , de catre ceilalti electroni , la determinarea configuratiei electronice trebuie luate in seama si interactiile directe intre electroni .
Interactiile interelectronice sunt cele care determina scindarea unei configuratii electronice date in termeni . Cand diferenta intre energiile a doi orbitali atomici este comparabila sau mai mica decat energia ce rezulta din interactiile interelectronice , configuratia electronica nu poate fi stabilita numai prin considerarea energiilor orbitalilor si in acest caz este necesara o tratare mai riguroasa .
Astfel , de exemplu , devierile
observate in configuratiile electronice ale elementelor din cea de-a doua
serie de metale tranzitionale d , nu mai pot fi explicate in modul simplu
in care s-au explicat devierile observate la elementele din prima serie .
Configuratiile electronice ale Mo si Ag ar putea fi interpretate ca
indicand o preferinta pentru configuratia 4d![]() , respectiv 4d
, respectiv 4d![]() .
.
Cu toate acestea ,
configuratia electronica a technetiului (4d![]() 5s
5s![]() ) arata ca in interiorul acestei serii ,
tendinta pentru realizarea unui orbital d pe jumatate sau complet
ocupat nu poate fi factorul determinant al configuratiilor adoptate de
elementele respective . Aceasta inseamna ca stabilirea
configuratiilor electronice pentru aceste elemente impune considerarea
tuturor interactiilor care pot avea o contributie in acest sens
si care in ordinea importantei lor sunt : atractia intre nucleu
si electron , ecranarea unui electron de catre ceilalti
electroni , repulsiile interelectronice si fortele de schimb .
) arata ca in interiorul acestei serii ,
tendinta pentru realizarea unui orbital d pe jumatate sau complet
ocupat nu poate fi factorul determinant al configuratiilor adoptate de
elementele respective . Aceasta inseamna ca stabilirea
configuratiilor electronice pentru aceste elemente impune considerarea
tuturor interactiilor care pot avea o contributie in acest sens
si care in ordinea importantei lor sunt : atractia intre nucleu
si electron , ecranarea unui electron de catre ceilalti
electroni , repulsiile interelectronice si fortele de schimb .
In tabelul 3 sunt prezentate configuratiile nivelelor electronice exterioare pentru atomii metalelor tranzitionale de tip d .
Tabelul 3 : Configuratia electronica a nivelurilor energetice exterioare a elementelor tranzitionale de tip d
|
Element |
Structura electronica |
Element |
Structura electronica |
Element |
Structura electronica |
|
Sc |
3d |
Y |
4d |
La |
5d |
|
Ti |
3d |
Zr |
4d |
Hf |
5d |
|
V |
3d |
Nb |
4d |
Ta |
5d |
|
Cr |
3d |
Mo |
4d |
W |
5d |
|
Mn |
3d |
Tc |
4d |
Re |
5d |
|
Fe |
3d |
Ru |
4d |
Os |
5d |
|
Co |
3d |
Rh |
4d |
Ir |
5d |
|
Ni |
3d |
Pd |
4d |
Pt |
5d |
|
Cu |
3d |
Ag |
4d |
Au |
5d |
|
Zn |
3d |
Cd |
4d |
Hg |
5d |
Din examinarea acestor date se
constata ca pe langa configuratia ( n − 1)d![]() ns
ns![]() , unele elemente adopta configuratia ( n − 1)d
, unele elemente adopta configuratia ( n − 1)d![]() ns
ns![]() .
.
La elementele din prima serie , devieri de la configuratia electronica asteptata se constata la Cr , pentru care configuratia starii fundamentale este
[![]() Ar] 3d
Ar] 3d![]() 4s
4s![]() si la Cu [
si la Cu [![]() Ar] 3d
Ar] 3d![]() 4s
4s![]() .
.
La elementele din cea de-a doua serie de metale tranzitionale d se constata o tendinta mai pronuntata pentru completarea in stare fundamentala a nivelelui 4d pe seama electronilor 5s . In aceasta serie numai primele doua elemente , Y ( Z=39) si Zr (Z=40) contin o orbitala 5s complet ocupata .
Pentru elementele celei de-a treia serii de metale tranzitionale s , ordinea de ocupare cu electroni a nivelului 5d este mult mai regulata decat pentru celelalte doua serii , singurele devieri fiind , dupa cum indica si tabelul 3, platina si aurul .
RELATIA INTRE CONFIGURATIA ELECTRONICǍ SI POZITIA IN SISTEMUL PERIODIC
Configuratia electronica a atomului unui element poate da informatii asupra pozitiei acestuia in sistemul periodic al elementelor ( perioada si grupa din care face parte elementul) .
Regulile de stabilire a pozitiei elementelor in tabelul periodic sunt diferite pentru elementele din grupele principale, pentru elementele tranzitionale de tip d si pentru elementele tranzitionale de tip f .
Regulile de stabilire a pozitiei elementelor tranzitionale de tip d in functie de configuratia electronica a atomului elementului sunt urmatoarele :
Numarul
perioadei este dat de numarul cuantic principal ce indica ultimul
strat ocupat cu electroni . Exceptie face Pd a carui
configuratie electronica stabila este [![]() Kr]4d
Kr]4d![]() 5s
5s![]() , care desi nu are electroni in substratul 5s se
gaseste in perioada 5 .
, care desi nu are electroni in substratul 5s se
gaseste in perioada 5 .
In ceea ce priveste grupa in care metalul tranzitional d se gaseste, regulile de determinare a acesteia in functie de configuratia electronica a atomului elementului depind de modul de notatie al grupei . O notatie mai veche , dar inca folosita a grupelor secundare consta in notarea acestora cu cifre romane de la I la VIII , urmate de litera B . O notatie actuala a grupelor secundare le numeroteaza pe acestea cu cifre arabe de la 3 la 12 . Pentru a stabili numarul grupei secundare folosind notarea acestora cu cifre arabe se foloseste regula conform careia numarul grupei este egal cu numarul obtinut prin insumarea numarului de electroni de pe substraturile exterioare ns si (n-1)d ale fiecarui atom .
Ex : Sc : [![]() Ar]3d
Ar]3d![]() 4s
4s![]() nr.grupei este : 1+2=3 →grupa 3
nr.grupei este : 1+2=3 →grupa 3
Os : [![]() Xe]4f
Xe]4f![]() 5d
5d![]() 6s
6s![]() nr.grupei este : 6+2=8 →grupa 8
nr.grupei este : 6+2=8 →grupa 8![]()
Pentru determinarea grupei secundare notate cu cirfe romane de la I la VIII , urmate de litera B , se foloseste urmatoarea regula : se aduna numarul electronilor de pe substraturile exterioare ns si (n-1)d ale fiecarui atom . Daca numarul obtinut este egal cu 3 , 4 , 5 , 6 sau 7 , atunci elementul se va gasi in grupa IIIB , IVB , VB , VIB , respectiv VIIB . Daca numarul obtinut este 8 , 9 sau 10 , elementul se gaseste in grupa VIIIB , in primul , al doilea , respectiv al treilea sir al acestei grupe . Daca numarul obtinut este mai mare de 10 , adica 11 sau 12 , din el se scade 10 , acesta fiind numarul grupei , adica IB respectiv IIB .
Ex : Ti : [![]() Ar]3d
Ar]3d![]() 4s
4s![]() nr.grupei este : 2+2=4 →grupa IVB
nr.grupei este : 2+2=4 →grupa IVB
Mo : [![]() Kr]4d
Kr]4d![]() 5s
5s![]() nr.grupei este :5+1=6 →grupa VIB
nr.grupei este :5+1=6 →grupa VIB
Fe : [![]() Ar]3d
Ar]3d![]() 4s
4s![]() nr.grupei este :6+2=8 →grupa
VIIIB
nr.grupei este :6+2=8 →grupa
VIIIB
( primul sir )
Rh : [![]() Kr]4d
Kr]4d![]() 5s
5s![]() nr.grupei este :8+1=9 →grupa VIIIB
nr.grupei este :8+1=9 →grupa VIIIB
( sirul al doilea )
Ni : [![]() Ar]3d
Ar]3d![]() 4s
4s![]() nr.grupei este :8+2=10 →grupa
VIIIB
nr.grupei este :8+2=10 →grupa
VIIIB
( sirul al treilea )
Ag : [![]() Kr]4d
Kr]4d![]() 5s
5s![]() nr.grupei este :
(10+1)-10=1→grupa IB
nr.grupei este :
(10+1)-10=1→grupa IB
Hg :[![]() Xe] 4f
Xe] 4f![]() 5d
5d![]() 6s
6s![]() nr.grupei este :(10+2)-10=2→grupaIIB
nr.grupei este :(10+2)-10=2→grupaIIB
1.4. PROPRIETǍTI FIZICE GENERALE
Metalele tranzitionale prezinta toate proprietatile fizice generale ale metalelor ( luciu metalic , opacitate , densitate , duritate , maleabiliatte , ductilitate , etc .) .
Datorita naturii particulare a electronilor d , care joaca un rol important in comportarea lor generala , aceste eleemnte prezinta si o serie de proprietati prin care se deosebesc de metalele reprezentative , ca si de metalele tranzitionale de tip f .
Metalele tranzitionale d , sunt metale tipice ce se remarca prin duritati , densitati , puncte de topire si de fierbere , conductibilitati termice si electrice mari , precum si posibilitati de a forma aliaje cu celelelte metale .
Compusii
lor in majoritatea cazurilor sunt paramagnetici , proprietate ce pledeaza
pentru o structura cu electroni d necuplati. Prezenta unui
numar de 1- 5 electroni necuplati in orbitalii d , le atribuie
si alte proprietati cum ar fi : culoarea foarte
variata a ionilor , proprietati feromagnetice la Fe , Co , Ni
sau antiferomagnetice la Cr , MnF![]() , Fe
, Fe![]() O
O![]() , FeS , etc . De asemenea unele combinatii din clasa
oxizilor , nitrurilor , sulfurilor , telururilor si altele au excelente
proprietati semiconductoare . Spre deosebire de ionii metalici cu
configuratii d
, FeS , etc . De asemenea unele combinatii din clasa
oxizilor , nitrurilor , sulfurilor , telururilor si altele au excelente
proprietati semiconductoare . Spre deosebire de ionii metalici cu
configuratii d![]() si d
si d![]() care sunt incolori , ionii cu alte structuri se prezinta
foarte variat colorati , proprietate patronata si de
posibilitatea de hidratare a ionilor respectivi .
care sunt incolori , ionii cu alte structuri se prezinta
foarte variat colorati , proprietate patronata si de
posibilitatea de hidratare a ionilor respectivi .
In continuare vor fi tratate mai pe larg cateva dintre proprietatile fizice fundamentale ale metalelor tranzitionale de tip d .
PROPRIETǍTI MAGNETICE
Majoritatea metalelor tranzitionale d sunt paramagnetice deoarece au in orbitalii d , electroni cu spinul neimperecheat .
Paramagnetismul unei substante este determinat de campurile magnetice asociate spinului electronilor si miscarii lor orbotale . Datorita acestui fapt , pentru un atom sau ion dat marimea acestei proprietati rezulta din insumarea contributiilor orbitale si de spin ale tuturor electronilor impari.
Momentul magnetic al atomilor ionilor sau moleculelor se exprima in unitati numite magnetoni Bohr ( simbol MB ) .
Pentru un singur electron momentul magnetic de spin e dat de relatia :
µ![]() = g
= g ![]() µ
µ![]() ( 1 )
( 1 )
unde : s - valoarea absoluta a numarului cuantic de spin
g - asa numitul factor Lande care pentru un electron liber are
valoarea 2,00023 .
Pentru un sistem ( atom sau ion ) polielectronic , momentul magnetic de spin poate fi determinat printr-o relatie analoaga celei de mai sus , in care numarul cuantic de spin s , este inlocuit de numarul cuantic de spin S care se refera la intregul sistem , adica :
µ![]() = 2
= 2 ![]() =
= ![]() µ
µ![]() ( 2
)
( 2
)
unde : n - numarul de electroni impari
µ![]() − magnetonul Bohr , unitatea magnetica
elementara
− magnetonul Bohr , unitatea magnetica
elementara
cuantica ;
1µ![]() = 9,3∙10
= 9,3∙10![]() gauss∙cm
gauss∙cm![]()
Pe baza proprietatilor magnetice , respectiv a determinarilor de momente megnetice se poate stabili numarul electronilor necuplati si implicit numarul orbitalilor ce contin cate un electron in cazul unui anumit compus chimic . Paramagnetismul combinatiilor metalelor tranzitionale este un criteriu important pentru determinarea structurii electronice a acestor compusi .
Momentele magnetice ale metalelor tranzitionale de tip d rezulta numai din contributia de spin si sunt date de relatia ( 2 ) . Spre deosebire de acestea , pentru elementele tranzitionale de tip f , momentele magnetice rezulta atat din contributiile de spin cat si orbitale si se calculeaza cu alta relatie . Aceasta diferenta in comportarea magnetica a celor doua tipuri de metale tranzitionale , d respectiv f , este o consecinta a gradului diferit de ecranare a electronilor care genereaza paramagnetismul .
Pentru ionii metalelor tranzitionale de tip d acesti electroni sunt situati in stratul exterior ( de valenta ) fiind supusi influentei campurilor electrice create in vecinatatea ionului metalic . Datorita acestui fapt contributia orbitala a acestor electroni este in majoritatea cazurilor neglijabila , deoarece interactia lor cu vecinatatea impiedica orientarea momentului orbital intr-un camp magnetic exterior si in consecinta momentul magnetic rezulta numai din spinul electronilor necuplati .
In tabelul 4 sunt indicate valorile momentelor magnetice ale unor ioni ai metalelor tranzitionale 3d . Dupa cum indica datele din acest tabel , pentru elementele din prima jumatate a seriei , concordanta intre momentele magnetice calculate si cele experimentale este foarte buna ; pentru elementele din a doua jumatate insa , valorile experimentale tind sa depaseasca valorile teoretice obtinute numai din contributia de spin . Aceste devieri mici arata ca pentru sistemele respective , contributia orbitala nu este efectiv zero .
Tabelul 4 : Momentele magnetice ale unor ioni ai metalelor tranzitionale 3d
|
Ion |
Configuratie |
Electroni impari |
µ ( MB ) |
|
|
calculat |
experimental |
|||
|
Sc |
d |
| ||
|
Ti |
d | |||
|
Ti |
d | |||
|
V |
d | |||
|
Cr |
d | |||
|
Mn |
d | |||
|
Fe |
d |
5pana la5,5 |
||
|
Co |
d |
4,5pana la 5,2 |
||
|
Ni |
d |
2,9pana la 3,4 |
||
|
Cu |
d |
1,8pana la 2,2 |
||
|
Zn |
d | |||
Unele metale tranzitionale si anumiti compusi simpli ai acestora au proprietati feromagnetice . Substantele feromagnetice se magnetizeaza foarte puternic , chiar si in campuri slabe . Magnetii elementari se orienteaza paralel si orientarea se pastreaza si la indepartarea campului . Feromagnetismul este astfel un paramagnetism care se pastreaza si in absenta campului magnetic exterior . Sunt feromagnetice : Ferul , cobaltul , nichelul . Feromagnetismul metalelor dispare brusc cand acestea sunt incalzite peste o anumita temperatura ( temperatura Curie ) .
RAZE ATOMICE SI IONICE
Pentru un atom izolat marimea razei este direct proportionala cu patratul numarului cuantic principal si invers proportionala cu Z . De aceea , este de asteptat ca de-a lungul unei perioade cu n dat , volumul atomic sa scada cu Z , iar in interiorul unei grupe sa creasca cu n .
Contractia de volum observata la metalele tranzitionale de tip d este atribuita cresterii sarcinii nucleare efective de-a lungul fiecarei serii ; care la randul ei este o consecinta a ecranarii relativ slaba a unui electron d prin altul . De aceea in atomii metalelor tranzitionale electronii exteriori numai partial ecranati simt cresterea in sarcina nucleara .
Pe baza celor discutate ar fi de asteptat ca in interiorul seriilor de metale tranzitionale de tip d razele atomice sa prezinte o descrestere continua . In realitate insa , situatia nu este intru totul aceasta , asa cum indica si diagramele din fig .1 care reprezinta variatia razelor metalice obtinute din distantele internucleare determinate pentru retele metalice .
Din examinarea acestor diagrame se desprind tendintele :
O scadere in raza atomica cu cresterea numarului atomic , iar spre sfarsitul seriilor se constata o usoara crestere in valoarea razei ;
O diferenta foarte mica intre razele atomice ale elementelor 4d si 5d ca o consecinta a contractiei lantanidice .
Descresterea usoara in capacitatea de ecranare a electronilor de-a lungul unei de metale tranzitionale este de asteptat sa conduca la o contractie a razei ionice . Cu toate acestea asa cum indica diagrama din fig . 2 valorile experimentale obtinute pentru razele cristaline ale ionilor dispozitivi ai metalelor tranzitionale din seria 3d , se abat de la variatia observata pentru ionii in stare gazoasa .
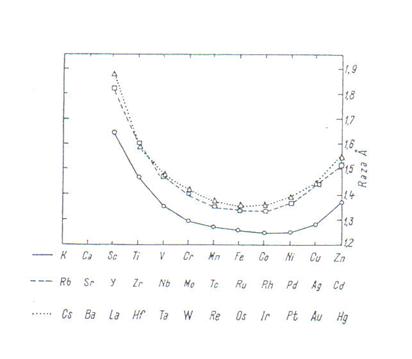
Fig . 1 :Variatia razelor atomice ale metalelor tranzitionale "d" functie de numarul atomic
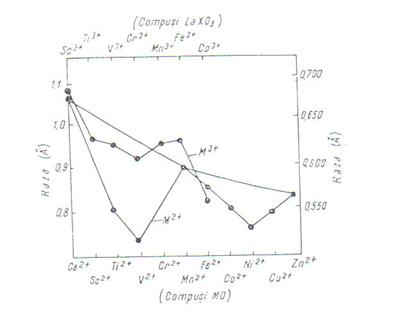
Fig . 2 :
Variatia razelor ionice ale elementelor 3d fata de sarcina
nucleara ( notatia din
dreapta pentru ionii M![]() )
)
Valorile razelor ionice prezentate in diagrama din fig . 2 sunt obtinute din determinari efectuate asupra oxizilor de forma MO , care cristalizeaza intr-o retea cubica de tip NaCl , ceea ce permite compararea lor.
Din examinarea acestei diagrame
se constata prezenta a doua minime ce apar la ionii V![]() (d
(d![]() ) si Ni
) si Ni![]() ( d
( d![]() ), iar razele ionilor Ca
), iar razele ionilor Ca![]() ( d
( d![]() ) , Mn
) , Mn![]() ( d
( d![]() ) si Zn
) si Zn![]() ( d
( d![]() ) sunt situate pe o curba care descreste regulat .
) sunt situate pe o curba care descreste regulat .
Variatia observata in razele ionice ale acestor elemente in stare solida este o consecinta a efectului campului cristalin .
In reteaua de tip NaCl , a
oxidului respectiv ( MO ) ionul metalic se gaseste in campul slab de
simetrie octaedrica , realizat de sase ioni O![]() . In aceste conditii orbitalele d echivalente din punct
de vedere energetic in ionul liber se scindeaza in doua nivele ,
diferite din punct de vedere energetic , unul triplu degenerat de energie mai
joasa t
. In aceste conditii orbitalele d echivalente din punct
de vedere energetic in ionul liber se scindeaza in doua nivele ,
diferite din punct de vedere energetic , unul triplu degenerat de energie mai
joasa t![]() , alcatuit din orbitalele dxy, dxz, dyz si al doilea dublu degenerat de
energie mai inalta , alcatuit din orbitalele d x
, alcatuit din orbitalele dxy, dxz, dyz si al doilea dublu degenerat de
energie mai inalta , alcatuit din orbitalele d x![]() - y
- y![]() si
dz
si
dz![]() . La
primele trei elemente Sc
. La
primele trei elemente Sc![]() , Ti
, Ti![]() si V
si V![]() electronii vor ocupa nivelul triplu degenerat t
electronii vor ocupa nivelul triplu degenerat t![]() mai stabil , care la ionul V
mai stabil , care la ionul V![]() cu configuratia
cu configuratia
t![]() e
e![]() este jumatate ocupat . Datorita orientarii
orbitalelor t
este jumatate ocupat . Datorita orientarii
orbitalelor t![]() , electronii care ocupa aceste orbitale interactioneaza
slab cu vecunatatea , astfel incat raza ionica scade ca o
consecinta a cresterii sarcinii nucleare .
, electronii care ocupa aceste orbitale interactioneaza
slab cu vecunatatea , astfel incat raza ionica scade ca o
consecinta a cresterii sarcinii nucleare .
Ocuparea cu unul sau doi
electroni a orbitalelor e![]() la ionii Cr
la ionii Cr![]() ( d
( d![]() ) si Mn
) si Mn![]() ( d
( d![]() ) conduce la o interactie mai mare a electronilor
ionului metalic cu vecinatatea , ceea ce conduce la cresterea razei
ionice . Pentru urmatoarele elemente fenomenul se repeta in sensul
ca dupa ce ambele grupe de orbitale au fost jumatate ocupate ,
are loc ocuparea fiecarei orbitale cu cel de-al doilea electron .
) conduce la o interactie mai mare a electronilor
ionului metalic cu vecinatatea , ceea ce conduce la cresterea razei
ionice . Pentru urmatoarele elemente fenomenul se repeta in sensul
ca dupa ce ambele grupe de orbitale au fost jumatate ocupate ,
are loc ocuparea fiecarei orbitale cu cel de-al doilea electron .
Cresterea razei ionice
observata pentru ionii cu configuratia d![]() respectiv d
respectiv d![]() ( Cu
( Cu![]() si Zn
si Zn![]() ) este o consecinta a ocuparii nivelului e
) este o consecinta a ocuparii nivelului e![]() cu cel de-al treilea respectiv al patrulea electron .
cu cel de-al treilea respectiv al patrulea electron .
O tendinta asemanatoare se observa si pentru razele ionilor tripozitivi ai acestor elemente , a caror variatie este indicata de asemenea in fig . 2 .
POTENTIALE DE IONIZARE
Din examinarea potentialelor de ionizare pentru atomii si ionii metalelor tranzitionale 3d , 4d , si 5d se desprind urmatoarele concluzii :
Valoarea potentialelor de ionizare creste in general cu numarul atomic de-a lungul fiecarei serii de metale tranzitionale d ;
Cu putine exceptii , potentialele de ionizare ale metalelor tranzitionale 5d , incepand cu elementul 72 , au valori mai mari decat acelea ale omologilor lor 4d . Tinand seama de faptul ca metalele tranzitionale 4d si 5d au raze atomice si ionice foarte asemanatoare , comportarea observata reflecta efectul sarcinii nucleare mai mari asupra speciilor 5d ;
Configuratiile
care prezinta valorile maxime ale potentialelor de ionizare , pentru
toate cele trei procese de ionizare considerate , par sa fie acelea de
forma d![]() , d
, d![]() si d
si d![]() s
s![]() .Acest lucru a fost interpretat ca indicand efectul
stabilitatii suplimentare a unui nivel electronic jumatate sau
complet ocupat .
.Acest lucru a fost interpretat ca indicand efectul
stabilitatii suplimentare a unui nivel electronic jumatate sau
complet ocupat .
O caracteristica a metalelor tranzitionale din punctul de vedere considerat este faptul ca potentialele lor de ionizare prezinta o variatie relativ mica in comparatie cu potentialele elementelor reprezentative . Aceasta comportare este o consecinta a actiunii mai multor factori , dintre care pot fi mentionati : localizarea electronului distinctiv intr-un orbital d , apropierea energetica a orbitalilor ns si ( n-1)s , etc .
PROPRIETǍTI CHIMICE GENERALE
CARACTER ELECTROCHIMIC
Elementele tranzitionale sunt metale tipice. Ele au unc aracter electropozitiv, datorita tendintei de a ceda electroni si de a se transforma in ioni pozitivi. Aceasta tendinta este evaluata numeric prin valoarea potentialelor lor normale, care reprezinta o masura a caracterului reducator sau oxidant in sisteme redox.
De-a lungul seriilor de metale tranzitionale caracterul electropozitiv (metalic) scade de la stanga la dreapta. In grupe, caracterul electropozitiv scade de sus in jos. Astfel, cuprul este cel mai electropozitiv in comparatie cu aurul, primul aflandu-se imediat dupa hidrogen in seria de activitate a metalelor, iar aurul la sfarsitul seriei.
Metalele tranzitionale au un caracter electropozitiv slab, iar in combinatiile lor apar in cele mai multe stari de oxidare. Starile de oxidare tipice sunt cele pozitive, iar starile de oxidare negative sau starea de oxidare zero, apar mai rar, numai in combinatii complexe.
STǍRI DE OXIDARE
Cea mai importanta caracteristica din punct de vedere al metalelor tranzitionale este proprietatea lor de a functiona in mai multe stari de oxidare (vezi tabelul 5 ).
Multiplicitatea starilor de oxidare observata la metalele tranzitionale este o consecinta a faptului ca energia nucleara pentru indepartarea succesiva a electronilor este aproximativ de acelasi ordin de marime ca si energia care se obtine din formarea unui numar mare de legaturi.
In ceea ce priveste variatia acestei proprietati de-a lungul seriilor de metale tranzitionale se constata urmatoarea tendinta :
primii membri ai fiecarei serii de metale tranzitionale prezinta un numar relativ mic de stari de oxidare, pentru ca spre centrul seriei, numarul starilor de oxidare sa creasca mai mult sau mai putin regulat, atingand un maximum, dupa care ultimii membri ai seriei sa descreasca. In ceea ce priveste starea de oxidare maxima se constata ca pentru elementele din prima serie de metale tranzitionale aceasta creste regulat de la trei pentru scandiu la sapte pentru mangan, dupa care scade la doi pentru zinc. In ce-a dea doua si a treia serie de metale tranzitionale starea de oxidare cea mai inalta (opt) este atinsa de elementele ruteniu si osmiu, dupa cum arata si datele din tabelul 5.
Tabelul 5 : Stari de oxidare ale metalelor tranzitionale de tip d
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
|
| |||||||||
|
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Aceasta tendinta observata in variatia starilor de oxidare ale metalelor tranzitionale poate fi explicata pe baza particularitatii acestor elemente.
Cu tot caracterul artificial al conceptului de stare de oxidare, se poate afirma ca starea de oxidare maxima a metalelor tranzitionale poate fi corelata cu numarul electronilor d si s disponibili pentru legatura. Astfel, de exemplu, elementele din prima jumatate a fiecarei serii de metale tranzitionale folosesc in realizarea starilor lor de oxidare toti electronii d si s, adica starea de oxidare maxima a acestor elemente ca si numarul starilor de oxidare pe care acestea le pot realiza, creste cu numarul electronilor d.
Pentru elementele din cea de-a doua jumatate a seriilor insa, numarul electronilor d impari descreste progresiv cu numarul atomic. In acelasi sens creste separarea energetica intre nivelele d si s , ceea ce determina descresterea disponibilitatii electronilor d pentru legatura si in consecinta descresterea numarului de stari de oxidare pe care aceste elemente le pot realiza.
Din analiza starilor de oxidare ale elementelor din prima serie tranzitionala se desprind urmatoarele :
Elementele din a doua si a treia serie tranzitionala sunt mai dificil de oxidat decat analogii lor din prima serie. De asemenea, ca si in prima serie, oxidarea elementelor din aceste doua serii devine progresiv mai dificila cu cresterea numarului atomic.
Speciile corespunzatoare
starilor de oxidare inferioare pot exista ca ioni monoatomici atat in
solutie, cat si in stare cristalina. Ionii corespunzatori
unei stari de oxidare superioare, de exemplu : V![]() , Cr
, Cr![]() , Mn
, Mn![]() se caracterizeaza printr-o actiune polarizanta
foarte puternica, astfel incat specii de aceasta forma nu pot
exista ca atare, ci numai sub forma unor sisteme poliatomice, intr-o
inconjurare de elemente puternic electronegative ca oxigenul si fluorul.
se caracterizeaza printr-o actiune polarizanta
foarte puternica, astfel incat specii de aceasta forma nu pot
exista ca atare, ci numai sub forma unor sisteme poliatomice, intr-o
inconjurare de elemente puternic electronegative ca oxigenul si fluorul.
Cationii simpli ai metalelor tranzitionale din prima serie se caracterizeaza printr-o stabilitate mult mai mare decat a elementelor din ce-a de-a doua si a treia serie. Ionii elementelor din aceste ultime serii se caracterizeaza printr-o tendinta foarte pronuntata de a forma combinatii compleze, chiar in solutiile apoase ale sarurilor lor simple. De aceea, se poate spune ca, pentru multe din aceste elemente, forma de existenta in solutie apoasa sunt speciile complexe .
REACTIVITATE CHIMICǍ
1)Reactia cu nemetalele
In conditii normale , metalele tranzitionale de tip d sunt in general putin reactive fata de nemetale ca oxigenul, halogenii, sulful, azotul, hidrogenul etc. La temperaturi ridicate insa, aceastea reactioneaza mai mult sau mai putin energic.
In ceea ce priveste variatia reactivitatii chimice de-a lungul unei serii, se constata ca primii membri ai unei serii sunt in general mai reactivi, in sensul ca formeaza usor compusi stabili, in timp ce ultimii membri sunt mai putin reactivi.
Indicatii asupra reactivitatii metalelor sunt date de pozitia ocupata de ele in seria activitatii electrochimice :
Deci, in cadrul unei serii de metale tranzitionale, primii membri sunt mai reactivi, adica formeaza mai usor compusi stabili decat ultimii membri ai seriei.
Halogenii si oxigenul au caracter electronegativ accentuat si pot accepta usor electroni de tip d, astfel incat prezinta in compusii obtinuti prin combinare stari de oxidare superioare. Sulful, mai putin electronegativ decat halogenii si oxigenul, conduce prin reactii directe la compusi in care metalele au numere de oxidare mai mici.
2Fe + 3Cl![]()
![]() 2FeCl
2FeCl![]() Cu
+ Cl
Cu
+ Cl![]()
![]() CuCl
CuCl![]()
3Fe + 2O![]()
![]() Fe
Fe![]() O
O![]() 2Cu + O
2Cu + O![]()
![]() 2 CuO
2 CuO
Fe + S![]() FeS 4Cu + O
FeS 4Cu + O![]()
![]() 2Cu
2Cu ![]() O
O
Metalele tranzitionale formeaza cu hidrogenul, borul, azotul si carbonul compusi interstitiali, deci compusi in care atomii mici ai nemetalelor ocupa golurile tetraedrice sau octaedrice din reteaua metalica. In urma reactiei se formeaza hidruri, boruri, azoturi si carburi cu caracter metalic.
2)Reactia cu acizi
Comportarea metalelor fata de acizi este determinata de pozitia lor in raport cu hidrogenul in seria de activitate. Majoritatea metalelor de tip d se afla situate inaintea hidrogenului in seria de activitate(in cazul primei serii de metale tranzitionale toate metalele cu exceptia cuprului). Acestea se comporta ca agenti reducatori ai ionilor de hidrogen, provocand degajarea hidrogenului din solutii de acid. Reactia nu decurge insa la fel pentru toate metalele si cu toti acizii.
Unele metale tranzitionale reactioneaza usor cu toti acizii diluati si cu acizii concentrati care nu au caracter oxidant (de exemplu: Fe, Co, Ni , Zn , Mn).
Fe + H![]() SO
SO![]()
![]()
![]() FeSO
FeSO![]() + H
+ H![]() ↑
↑
Zn + H![]() SO
SO![]()
![]()
![]() ZnSO
ZnSO![]() + H
+ H![]() ↑
↑
Fe + 2HCl![]() FeCl
FeCl![]() + H
+ H![]() ↑
↑
Zn + 2HCl![]() ZnCl
ZnCl![]() + H
+ H![]() ↑
↑
Deci, in general :
Metal situat
inaintea + acid ![]() sare + H
sare + H![]()
hidrogenului
In contact cu acidul azotic concentrat si cu apa regala, unele metale ca Fe, Co, Ni si Zn sufera fenomenul de pasivare : se acopera cu un strat de oxid care protejeaza metalul fata de atacul ulterior al acizilor.
Metalele situate in seria activitatii chimice dupa hidrogen nu-l pot dezlocui din acizi. Ele reactioneaza numai cu acizii cu actiune oxidanta. In acest caz nu se mai degaja hidrogen, deoarece reactiile de oxido-reducere au loc intre metal si nemetalul din acid. De exmeplu, reactia dintre cupru si acid sulfuric concentrat la cald , are loc in 2 etape :
Cu + H![]() SO
SO![]()
![]() CuO + SO
CuO + SO![]() ↑ + H
↑ + H![]() O
O
CuO + H![]() SO
SO![]()
![]() CuSO
CuSO![]() + H
+ H![]() O
O
Ecuatia generala a reactiei chimice dintre Cu si acidul sulfuric concentrat va fi urmatoarea :
Cu + 2 H![]() SO
SO![]()
![]() CuSO
CuSO![]() + SO
+ SO![]() ↑ + 2H
↑ + 2H![]() O
O
Deci, in general :
Metal situat Acid Oxid de nemetal
dupa + cu caracter ![]() sare + cu
N.O. < decat in acid + H
sare + cu
N.O. < decat in acid + H![]() O
O
hidrogen oxidant
Unele metale, cum ar fi Pt, Au, nu se "dizolva" decat in apa regala.
3)Reactia cu apa
Metalele cele mai reactive, situate inaintea hidrogenului in seria activitatii electrochimice, il pot dezlocui din apa, la temperatura ridicata, transformandu-se in hidroxizi sau oxizi hidratati (de exemplu : Sc, Ti-curatat de stratul de oxid, Mn, Fe, Ni, Zn).
temp
Fe + 4 H![]() O
O ![]() Fe
Fe![]() O
O![]() + 4 H
+ 4 H![]() ↑
↑
Ni + H![]() O
O ![]() NiO + H
NiO + H![]() ↑
↑
Unele metale sunt atacate de umiditatea din aer, la temperatura obisnuita. Reactiile au loc cu viteze diferite de la un metal la altul , astfel incat efectele ei se observa in timp. In toate cazurile fenomenul are ca urmare un proces de coroziune a metalului, cunoscut mai ales pentru fer sub denumirea de ruginire si pentru cupru sub denumirea de coclire. Pentru protejarea acestora se acopera suprafata metalica cu un strat de vopsea de ulei, cu email sau cu un strat de metal rezistent la coroziune.
4)Reactia cu bazele
Majoriatea metalelor de tip d nu reactioneaza cu bazele.
Zincul reactioneaza lent cu solutiile de hidroxizi alcalini, dovedind un caracter amfoter. In urma reactiei, se formeaza hidroxocomplexul anionic al metalului si se degaja hidrogen :
Zn + 2NaOH + 2 H![]() O
O ![]() Na
Na![]() [Zn(OH)
[Zn(OH)![]() ] + H
] + H![]() ↑
↑
5)Reactia cu compusi ai altor metale
Orice metal poate reduce ionii tuturor metalelor situate dupa el in seria activitatilor electrochimice si poate fi redus, la randul sau, din compusi, de catre metalele care il preced in serie .
temp
Cu + HgO ![]() CuO + Hg ↓
CuO + Hg ↓
Fe + CuSO![]()
![]() FeSO
FeSO![]() + Cu ↓
+ Cu ↓
Cu + 2AgNO![]()
![]() Cu(NO
Cu(NO![]() )
)![]() + 2Ag ↓
+ 2Ag ↓
Deci, in general :
Metal![]() + sare de metal
+ sare de metal![]()
![]() sare de metal
sare de metal![]() + metal
+ metal![]()
Metal![]() + oxid de metal
+ oxid de metal![]()
![]() oxid de metal
oxid de metal![]() + metal
+ metal![]()
Conditia ca reactiile
dintre un metal si o sare sau oxid al altui metal sa aibe loc este ca metalul![]() sa fie situat inaintea metalului
sa fie situat inaintea metalului![]() in seria reactivitatii chimice a metalelor .
in seria reactivitatii chimice a metalelor .
Copyright © 2025 - Toate drepturile rezervate