 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Termodinamica starilor de echilibru
Termodinamica starilor de echilibru, specifica sistemelor inchise, studiaza legile generale ale fenomenelor termice, avand la baza trei principii (descoperite in urma unor studii experimentale laborioase).
Prin principiu se intelege un enunt legic rezultat din generalizarea unor constantari experimentale, care nu poate fi demonstrat, insa poate fi verificat experimental.
1. Principiul I al termodinamicii
Interactiunea unui sistem cu mediul exterior are drept consencinta schimbarea starii sistemului. Aceasta poate avea loc prin doua modalitati: prin efectuarea unui lucru mecanic (L) fie de sistem, fie de forte exterioare si prin schimb de caldura (Q) intre sistem si mediul exterior. Prin conventie s-a stabilit ca lucrul mecanic efectuat de sistem si caldura primita de sistem sunt pozitive (L > 0; Q > iar pentru procesele inverse sunt negative (L < 0; Q <
Lucrul mecanic si cantitatea de caldura se numesc marimi de transformare (de proces). Ele depind de transformarea suferita de sistem si sunt forme ale schimbului de energie dintre sistem si mediul exterior.
Functia de stare care caracterizeaza transferul de energie, respectiv schimbarea starii unui sistem, este energia interna U = f(T).
Energia interna este o marime macroscopica de natura statistica si depinde direct proportional de temperatura, precum si de de masa si compozitia sistemului.
Experimental s-a constatat ca in cazul efectuarii unui proces termodinamic, dintr-o stare initiala intr-o stare finala, lucrul mecanic (L) si caldura (Q) sunt diferite pentru diverse cai, insa diferenta lor ramane constanta pe orice drum, reprezentand tocmai variatia energiei interne a sistemului.
Variatia energiei interne DU a unui sistem, care primeste caldura Q din exterior si efectueaza un lucru mecanic L, suferind o transformare de la starea initiala (1) caracterizata prin energia interna U1 la starea finala (2) caracterizata prin energia interna U2, este data de relatia:
DU = Q - L (1.1)
sau pentru variatii infinitezimale:
dU = dQ - dL (1.2)
Relatiile (1.1) si (1.2) reprezinta principiul I al termodinamicii pentru variatii finite, respectiv infinitezimale.
Daca relatia (1) se scrie sub forma Q = DU + L, se poate spune ca atunci cand un sistem primeste caldura Q in timpul unui proces, o parte din ea (DU) ramane in sistem, modificand energia interna, iar restul (L) paraseste sistemul sub forma de lucru mecanic efectuat de sistem asupra mediului inconjurator.
Deci, modificarea energiei interne a unui sistem prin participarea schimbului de caldura are drept rezultat variatia energiei interne a mediului extern.
Energia interna U este o functie de stare, variatia ei depinzand numai de starea initiala si finala a sistemului, pe cand lucrul mecanic L si caldura Q, fiind marimi de transformare, depind de drumul parcurs in timpul procesului. Toate cele trei marimi U, Q si L au in Sistemul International (SI) aceeasi unitate de masura joule (J). Este acceptata si o unitate tolerata numita calorie (cal), intre cele doua existand relatia 1cal = 4,185 J.
Observatie : Principiul I al termodinamicii exclude posibilitatea construirii unui perpetuum mobile de speta I-a, care sa furnizeze lucru mecanic fara consum de energie.
1.1. Entalpia
Marea majoritate a proceselor biologice se desfasoara la presiune constanta
(p = 1 atm), din acest motiv se introduce o noua functie de stare,
numita entalpie H, care prin
definitie este:
H = U + p V (1.3)
Intr-un proces izobar (p = const.) variatia entalpiei este:
DH = DU + p DV (1.4)
sau pentru variatii infinitezimale:
dH = dU + p dV (1.5)
DH = DQp sau dH = dQp (1.6)
Relatia (1.6) exprima semnificatia fizica a entalpiei si anume: variatia entalpiei intre doua stari reprezinta caldura schimbata de sistem intr-un proces izobar.
Entalpia unui sistem creste (DH >0) atunci cand primeste caldura si scade (DH < 0) cand cedeaza caldura mediului exterior.
Reactiile chimice, respectiv biochimice se numesc exotermice daca degaja caldura (DH <0) si endotermice daca absorb caldura (DH >
2. Principiul II al termodinamicii
Principiul I al termodinamicii si functiile de stare definite pe baza lui (U si H) exprima legea conservarii energiei interne in cazul particular al proceselor termice, insa nu pot da nici o indicatie despre conversia energiei dintr-o forma in alta si despre sensul in care se poate desfasura un proces ireversibil.
Generalizarea multor studii experimentale au condus la formularea principiului II al termodinamicii. Exista mai multe formulari ale acestui principiu exprimate de catre Carnot, Clausius si Kelvin, dintre care amintim:
nu este posibil un proces termodinamic in care intreaga cantitate de caldura absorbita de sistem sa fie transformata in lucru mecanic;
intr-un proces ciclic reversibil, caldura nu se poate transforma integral in lucru mecanic, o parte din caldura primita de la sursa calda fiind trecuta sursei reci;
trecerea caldurii de la o sursa rece la una calda se poate realiza numai prin consum de lucru mecanic;
este imposibila trecerea caldurii, de la sine, de la un corp mai rece la un corp mai cald.
Observatie: Principiul II al termodinamicii exclude posibilitatea realizarii unui perpetuum mobile de speta a II-a, care sa transforme integral cantitatea de caldura absorbita in lucru mecanic sau, cu alte cuvinte, este imposibil sa se realizeze o masina termica pe baza unei singure surse de energie.
Un motor termic poate sa efectueze un lucru mecanic (Fig.1.2) numai daca exista o diferenta de temperatura intre sursa calda (T1) de la care sistemul primeste o cantitate de caldura Q1 si sursa rece (T2) caruia ii cedeaza o cantitate de caldura Q2 (T1 > T2).
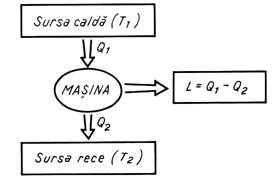
Fig. Schema unui ciclu ideal
Pentru o masina termica ideala (Fig.1.3.), formata din doua izoterme si doua adiabate, Carnot a stabilit expresia randamentului ca fiind:
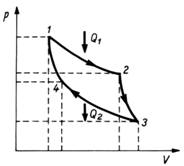
Fig. 1.3. Ciclul Carnot
![]() (1.7)
(1.7)
deci:
![]() (1.7a)
(1.7a)
Se poate constata ca randamentul este subunitar (h < 1) si nu depinde de natura substantei de lucru, ci numai de temperatura sursei calde (T1) si a sursei reci (T2). Aceasta concluzie a fost denumita teorema lui Carnot.
2.1. Entropia
Pentru a exprima cantitativ pierderile de energie si tendinta de evolutie spontana a unui sistem termodinamic se introduce o noua functie de stare numita entropie (S).
In general se masoara variatia de entropie DS, care se defineste:
DS = ![]() (1.8)
(1.8)
In cazul proceselor reversibile, variatia entropiei este nula: DS = 0 (1.9)
iar in cazul proceselor ireversibile variatia totala de entropie este pozitiva:
DS > (1.10)
In concluzie, entropia unui sistem izolat nu se modifica intr-un proces reversibil si creste intr-un proces ireversibil: DS
3. Principiul III al termodinamicii
Entropia este o functie de stare. Teoretic sau experimental se poate determina numai variatia de entropie. Nernst a stabilit valoarea absoluta a entropiei intr-o stare particulara, enuntand principiul III al termodinamicii: la temperatura de zero absolut entropia oricarui sistem este nula (la T = 0K T S = 0).
3.1. Interpretarea statistica a entropiei
Semnificatia fizica a entropiei poate fi inteleasa daca se recurge la interpretarea statistica data de Boltzmann, care a corelat aceasta marime cu structura atomo-moleculara, si anume cu gradul de ordonare al particulelor componente ale unui sistem.
Pentru aceasta se defineste probabilitatea termodinamica a unui sistem ca fiind numarul de stari microscopice distincte care realizeaza o stare macroscopica data. Deci, starile microscopice distincte pot fi considerate configuratiile distincte in care se pot plasa particulele sistemului in aceeasi stare macroscopica.
Observatie Probabilitatea termodinamica nu trebuie confundata cu probabilitatea matematica de realizare a starii macroscopice.
Fie un sistem termodinamic format dintr-un numar mare N de particule identice, care pot avea n nivele energetice distincte si pe fiecare nivel energetic exista Ni particule, astfel incat aNi = N. Raportul pI = Ni/N reprezinta probabilitatea ocuparii unui nivel energetic. Astfel, in functie de probabilitatea termodinamica, entropia poate fi definita:
S = - k a pI ln pi (1.11)
unde k = 1,38 10-23 J/K, fiind constanta lui Boltzmann.
Din punct de vedere al ordonarii orice sistem termodinamic se afla in doua situatii limita:
stare perfect ordonata - in care toate particulele sunt in aceeasi stare energetica, deci i = 1, Ni = N, iar entropia sistemului devine nula S = 0;
stare de dezordine maxima - in care fiecare particula se afla intr-o stare energetica diferita, astfel incat Ni = 1, iar entropia are valoare maxima, deci S = k lnN.
Astfel, se poate constata ca entropia este o masura a dezordinii unui sistem.
Cu ajutorul entropiei se poate da un nou enunt principiului II al termodinamicii, enunt care permite stabilirea sensului de evolutie al proceselor termodinamice: pentru un sistem fizic izolat exista o functie de stare univoca numita entropie, a carei valoare ramane constanta pentru un proces reversibil si creste pentru un proces ireversibil. Un proces termodinamic se desfasoara pana cand entropia atinge valoarea maxima. Starile de echilibru sunt stari de entropie maxima.
In concluzie, cu cat un sistem are un grad de organizare mai mare, cu atat entropia lui este mai mica si tinde in mod spontan spre o stare mai dezordonata, de entropie mai mare.
4. Energia libera
Dupa cum s-a constatat, evolutia spontana a unui proces termodinamic este in sensul cresterii entropiei, insa entropia S nu poate fi masurata direct experimental. Din acest motiv, in raport cu conditiile experimentale de desfasurare a procesului, a fost necesara introducerea unor noi functii de stare, si anume energia libera Helmholtz (F) si energia libera Gibbs (G).
In cazul sistemelor termodinamice vii, unde procesele se desfasoara in conditii de presiune si volum constante, se utilizeaza entalpia libera Gibbs definita prin relatia:
G = H - T S (1.12)
Iar variatia entalpiei libere este:
DG = DH - T DS (1.13)
Se poate observa ca termenul T DS defineste cantitatea de caldura consumata pentru cresterea entropiei, adica DQ = T DS. Deci, rezulta ca entalpia libera este acea parte din entalpia sistemului care poate fi transformata in lucru mecanic.
In concluzie, cresterea entropiei si scaderea entalpiei libere definesc sensul evolutiei spontane a oricarui sistem termodinamic.
Obsevatie: In cazul sistemelor termodinamice vii se utilizeaza entalpia libera Gibbs, deorece procesele se desfasoara in conditii de presiune si volum constante.
O reactie chimica sau biochimica se poate desfasura spontan numai daca duce la scaderea entalpiei libere, G. O astfel de reactie se numeste exergonica, iar o reactie care duce la cresterea entalpiei libere este endergonica, insa ea nu poate avea loc spontan, ci numai cu consum de energie. Termenii exergonic/endergonic nu sunt sinonimi cu exotermic/endotermic, notiuni care nu dau nici o indicatie privind sensul desfasurarii spontane a reactiei.
De exemplu, in cazul reactiei de ardere a glucozei:
C6H12O6 + 6O2 6CO2 + 6H2O cu DH = - 673 kcal si DG = - 690 kcal
se constata ca entalpia libera G scade mai mult decat entalpia H, iar diferenta de 17 kcal corespunde cresterii entropiei. Acest lucru se datoreaza ruperii unor legaturi chimice, cand se trece de la o structura organizata, complexa si bine determinata, la o structura mai dezorganizata, mai relaxata. Deci, reactia in sens invers nu se poate desfasura spontan, deoarece in timp ce prin arderea glucozei se elibereaza numai 673 kcal, pentru sinteza ei trebuie sa se consume 690 kcal.
Variatia entalpiei libere (DG) a reactiilor chimice depinde de natura reactantilor si de concentratiile lor molare, conform relatiei:
DG = DG0 + RT lnke (1.14)
unde DG0 este variatia entalpiei standard si reprezinta variatia entalpiei libere a reactiei in conditii standard (p0 = 1 atm, pH = 7, T = 298 K si concentratiile reactantilor de 1M), iar ke este constanta de echilibru a reactiei.
La echilibru termodinamic DG = 0, iar variatia entalpiei standard devine:
DG0 = -RT ln ke (1.15)
Din punct de vedere energetic, pentru ca o reactie chimica sa poata avea loc, reactantii trebuie sa posede energia necesara depasirii unei anumite bariere de potential, energie numita energie (entalpie) de activare.
In figura 1.4. sunt prezentate entalpiile libere in cazul unei reactii chimice si a unei reactii mediate enzimatic.
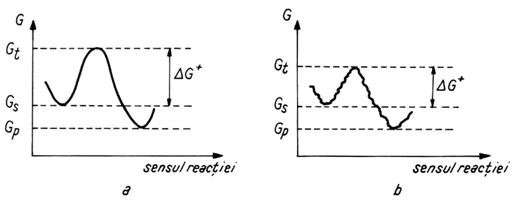
Fig.1.4. Variatia entalpiei libere si a energiei de activare: (a) intr-o reactie
chimica si (b) intr-o reactie mediata enzimatic.
Se constanta ca, in cazul unei reactii chimice, un substrat (S) cu entalpie libera GS formeaza un produs (P) a carui entalpie libera GP este mai mica (GP < GS). Pentru ca reactia sa decurga in mod spontan, se trece printr-o stare de tranzitie de entalpie Gt, mai mare decat a substratului si a produsului (Gt >GS >GP). Reactia are loc doar atunci cand o parte semnificativa din moleculele substratului poseda o energie suficienta pentru a atinge starea de tranzitie necesara trecerii barierii de potential. In starea de tranzitie exista o probabilitate mare sa se formeze sau sa se desfaca o legatura chimica. Diferenta dintre entalpia libera a starii de tranzitie Gt si entalpia libera a substratului GS reprezinta tocmai energia (entalpia) libera de activare DG+:
DG+ = Gt - GS (1.16)
In cazul participarii si a enzimelor la reactie, acestea se combina cu substratul creind cai noi de reactie, in care entalpia starii de tranzitie este mult mai mica. In acest fel, energia de activare DG+ scade, bariera energetica se micsoreaza, iar probabilitatea reactiei si a vitezei ei cresc.
5. Cai de mentinere a entropiei scazute in sistemele vii
Toate procesele care se desfasoara in organismele vii necesita consum de energie, care este de natura chimica. Aceasta energie se obtine prin arderea substantelor ingerate si se inmagazineaza in legaturile macroergice ale moleculelor de ATP (adenozintrifosfat), GTP (guanozintrifosfat), ADP (adenozindifosfat) etc., ea fiind eliberata in functie de necesitatile organismului. In general, acumularea de energie si realizarea proceselor negentropice au loc prin mecanisme biochimice.
Principalele cai de mentinere a entropiei scazute in organismele vii sunt:
cuplarea reactiilor biochimice - in organism au loc in paralel procese cuplante, producatoare de entropie si procese cuplate, negentropice consumatoare de energie;
scaderea energiei de activare care se poate realiza prin mecanisme enzimatice;
procese de reglare homeostatica a parametrilor fiziologici;
exces de ordine - existenta structurilor disipative face ca organismul sa produca mai multa ordine decat strictul necesar, astfel incat aceasta sa se pastreze chiar si in cazul aparitiei unor perturbatii;
utilizarea informatiei genetice pe baza careia se sintetizeaza macromolecule, care se organizeaza in celule, tesuturi, organe si determina aparitia proceselor de reglare;
reactiile autocatalitice care permit formarea de structuri disipative;
autoinoirea - in organismele vii, pe masura ce are loc maturizarea si imbatranirea celulelor, datorita proceselor ireversibile entropia lor creste, iar structurile disipative se deterioreaza, si atunci ele sunt inlocuite cu celule tinere a caror entropie este mica.
Copyright © 2025 - Toate drepturile rezervate