 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Studiul prin spectroscopie in infrarosu al legaturilor de hidrogen in solutie
1.Consideratii teoretice
![]()
Legatura de hidrogen are doua caracteristici geometrice importante:
a) Cei trei atomi implicati in legatura (X, H si Y) se dispun coliniar, orientare in care taria legaturii este maxima. Se spune ca legatura de hidrogen este directiva. Studiul unui numar mare de substante biologice, in care aceste legaturi au o importanta deosebita, arareori a semnalat devieri mai mari de 20° de la geometria liniara a legaturii de hidrogen.
b) Lungimea legaturii de hidrogen este, de asemenea, riguros respectata.
Cei mai obisnuiti donori de legaturi de hidrogen sunt atomii de O si N. Cei mai buni acceptori sunt tot atomii de O si N.
Energia legaturii de hidrogen este cu ceva mai mare decat energia termica medie (RT/1 1,3 kJ/mol):
N - H . 0 10 kJ/mol
O - H . 0 25 kJ/mol
In consecinta, legaturile de H se pot desface si reforma rapid sub influenta agitatiei termice. Pentru comparatie, energia legaturii covalente este cuprinsa intre 100-400 kJ/mol.
Apa este cel mai bun donor si acceptor de legaturi de H, moleculele de apa putand interactiona atat cu substantele dizolvate in ea cat si intre ele, formand "structuri" proprii. Posibilitatea formarii de legaturi de H cu apa se traduce printr-o solubilitate relativ buna a substantei respective in apa. Fiecare molecula de apa poate dona doua legaturi de H si accepta alte doua, intrucat atomul de oxigen poseda doi orbitali sp3 cu cate o pereche de electroni neparticipanti. Toate aceste legaturi sunt satisfacute in cazul structurii ghetii (fig.1.).
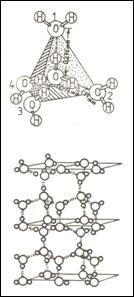
Fig.1. Structura ghetii
Caracterul restrictiv al legaturii de hidrogen din punct de vedere geometric ii confera acestuia un rol important in organizarea materiei vii, intervenind in procesele biofizice de recunoastere moleculara.
Evidentierea formarii legaturilor de hidrogen in solutie,
prin spectroscopie IR calitativa
Formarea legaturilor de H poate fi pusa in evidenta prin spectrofotometrie in infrarosu, observand modificarile pe care le sufera benzile de absorbtie coespunzatoare grupelor chimice implicate in legatura.
La formarea unei legaturi de H intr-o molecula donoare si una acceptoare, datorita interactiunii favorabile dintre atomii de hidrogen si atomul acceptor, slabeste forta cu care atomul de H este atras catre restul moleculei donorului, ceea ce conduce la o scadere a frecventei vibratiilor ce se desfasoara in lungul acestei legaturi chimice (vibratii de valenta, de tip "stretching") si deci la o deplasare ("shift") a benzii de absorbtie IH corespunzatoare catre energii si numere de unda mai mici. In acelasi timp creste frecventa vibratiilor de deformare care se executa transversal pe directia legaturii chimice (intrucat creste forta cu care atomul de H este readus in pozitia de echilibru), ceea ce conduce la o deplasare a benzii de absorbtie corespunzatoare spre energii si numere de unda mai mari.
In prezenta lucrare se vor studia efectele formarii legaturilor de H la dimerizarea alcoolului etilic prin cresterea concentratiei acestuia in tetraclorura de carbon.
In solutii foarte diluate de alcool etilic (C2H5-O-H) in tetraclorura de carbon (CCl4) (vezi fig. 2, curbele 1 si 2), moleculele de alcool sunt dispersate astfel ca spectrele inregistrate corespund absorbtiei din partea monomerilor de alcool etilic. Banda de absorbtie din jur de 3850 cm-1 se atribuie vibratiei de valenta n O-H a alcoolului. La cresterea concentratiei, creste si intensitatea acestei benzi.
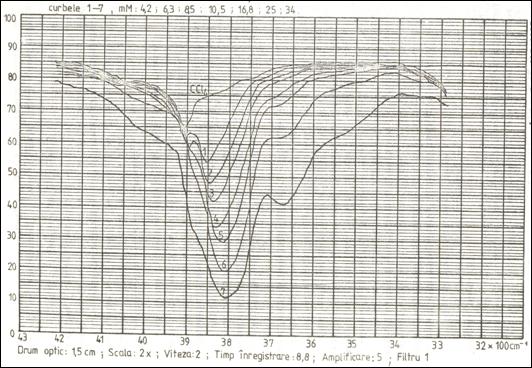
Fig.2.Alcool etilic in CCl4
La cresterea concentratiei de alcool peste o anumita limita, alcoolul poate forma dimeri, prin stabilirea unei legaturi de hidrogen intre gruparea OH a unei molecule si oxigenul celei de a doua. Experimentatorul poate controla proportia dedimeri din solutie, crescand concentratia totala de alcool. (Acest lucru se poate deduce din eecuatia (2), observand ca, in domeniul concentratiilor mici, daca se substituie concentratia de monomeri (M), prin concentratia totala de alcool, (Total), concentratia de dimeri formati (D), devine proportionala cu patratul concentratiei totale de alcool: (D) = K (Total)2.
Figura 2 prezinta spectrele de transmisie IR al unor solutii de concentratii crescatoare de alcool etilic in CCl4. In spectrul IR, formarea dimerilor se traduce prin aparitia unei a doua benzi de absorbtie deplasata spre numere de unda mai mici (3675 cm-1). Se remarca ca la cresterea concentratiei de alcool etilic creste amplitudinea ambelor benzi de absorbtie, dar cea asociata cu legatura de N creste mai rapid, in detrimentul benzii asociate cu absorbtia monomerilor
Spectroscopie cantitativa: caracterizarea echilibrului de asociere a alcoolului etilic in tetraclorura de carbon
Legea fundamentala a spectroscopiei cantitative este legea lui Beer, care leaga absorbanta (extinctia) intr-o anumita banda de absorbtie (E) de concentratia speciei chimice care absoarbe in acea banda.
![]()
In care I este intensitatea luminoasa transmisa de proba, Io este intensitatea luminoasa transmisa de solvent in absenta moleculelor dizolvate (linia de baza), e este coeficientul de extinctie, iar d este lungimea drumului optic (grosimea cuvei).
In aceasta lucrare, legea lui Beer va fi utilizata pentru a extrage date cantitative pentru caracterizarea reactiei de dimerizare a alcoolului etilic in CCl4. In solutie exista un echilibru dinamic intre numarul monomerilor si al dimerilor, guvernat de legea echilibrelor chimice, conform careia produsul concentratiilor substantelor obtinute intr-o reactie chimica de echilibru (in cazul de fata o singura substanta, dimerul) este proportional cu produsul concentratiilor reactantilor:
[D] = K [M]2
in care [D] este concentratia la echilibru de dimeri, iar [M], de monomeri. Ecuatia (2) defineste constanta de asociere K, care are dimensiunile inversului concentratiei.
Valoarea constantei de asociere reflecta capacitatea de asociere a moleculelor dizolvate. Inversul acestei constante, K-1 (constanta de disociere) reprezint o concentratie si anume concentratie totala de molecule ce trebuie dizolvate pentru ca 50% sa ramana in stare monomerica si 50% sa dimerizeze.
Semnificatia biofizica a observatiilor
Este cunoscut ca daca entalpia libera a unei stari A a unui sistem este mai mare cu DGo fata de entalpia libera a starii B, luata ca referinta, atunci la echilibru la temperatura T vor fi de nB/nA ori mai multe molecule in starea B decat in starea A, conform ecuatiei:
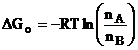
Numeric, inseamna ca daca entalpia libera a doua stari difera prin DGo=6 kJ/mol, atunci la temperatura mediului ambiant vor fi aproximativ de 10 ori mai multe molecule in starea cu energia mai scazuta (nB/nA= exp (6/2,6)= 10), pentru fiecare 6 kJ/mol in plus obtinandu-se o alta putere a lui 10.
Folosind ecuatia se poate estima care este probabilitatea desfacerii unei legaturi intr-un sistem aflat la temperatura T.
In cazul legaturilor de hidrogen (10-25 kJ/mol) la temperatura mediului ambiant, aceasta probabilitate este finita.
Energia de 10 kJ/mol este insa suficienta pentru a cere ca o legatura de H dintr-un sistem sa fie satisfacuta, fie chiar si cu moleculele solventului (apei).
Aceasta inseamna proprietate a legaturii de H, si anume faptul ca desi labila, ea trebuie sa fie satisfacuta, impreuna cu proprietatea amintita de directivitate a legaturii, sunt importante in procesul de "recunoastere" din biofizica moleculara.
Prin "recunoastere moleculara" se intelege asocierea specifica a doua molecule (de exemplu, recunoasterea reactantilor de catre enzima, sau complementaritatea celor doua lanturi ale dublului helix al acizilor nucleici).
Presupunand ca recunoasterea a doua molecule implica si o legatura de H (adica cele doua molecule poseda grupari donoare si acceptoare dispuse in orientarea optima pentru formarea unei legaturi de H), atunci un partener fals (neadecvat din punct de vedere chimic sau geometric) care nu poate forma aceasta legatura de H si impiedica totopdata formarea acestei legaturi cu solventul, ar ridica energia sistemului la valoarea energiei unei legaturi de H. Astfel, partenerul fals este respins pe motive de ordin energetic.
Metoda experimentala
1.Evidentierea formarii legaturilor de hidrogen la dimerizarea alcoolului etrilic in tetraclorura de carbon
Se asambleaza cuva de masura cu ferestre tip KRS5, avand lungimea drumului optic 1-1,5 cm, iar in cuva de referinta se monteaza fereastra de compensatie. Se inregistreaza o familie de spectre de transmisie pentru o serie de solutii de alcool etilic in tetraclorura de carbon, avand concentratiile cuprinse in domeniul 0-40 mM.
Sa se schiteze formula chimica a dimerului de alcool etilic, respectand dispunerea geometrica corecta a atomilor, ceruta de proprietatea de directivitate a legaturii si sa se indice directia dupa care se executa vibratia de valenta nO-H
Sa se explice de ce are loc deplasarea benzii de absorbtie spre numere de unda mai mici la cresterea concentratiei de alcool.
2.Determinarea coeficientului de extinctie pentru banda de absorbtie a monomerilor de alcool etilic
Constanta de proportionalitate dintre valoarea absorbantei corespunzatoare monomerilor si concentratia acestora este ed.
Sa se calculeze pentru fiecare spectru valoarea absorbantei corespunzatoare benzii monomerilor, completand coloanele 1-4 din tabelul de mai jos, si apoi sa se reprezinte grafic absorbanta E in functie de concentratia totala de alcool din proba.
|
| ||||||
|
[Totala] |
|
I unit. atrib. |
|
ed (mm)-1 |
[M] mm |
|
|
Conc. totala alcool |
Intensitatea transmisa de solvent |
Intensit. trans. de proba |
Absorbanta probei in banda monomerilor |
Conc. de monomeri |
Se determina valoarea produsului ed din panta primei portiuni a graficului (regiune in care este valabila aproximatia [M] [Total]).
3.Determinarea constantei de echilibru pentru dimerizarea alcoolului etilic
Pentru determinarea constantei de asociere K (ecuatia 2), apelam la o metoda grafica. Pentru aceasta este necesar sa se cunoasca valorile atat a concentratiilor de monomer [M], cat si a concentratiilor de dimer [D] din fiecare proba. Se observa ca concentratia de dimeri se poate calcula din diferenta dintre concentratia totala, cunoscuta, de alcool etilic din proba, si concentratia de monomeri, prin relatia:
![]()
Concentratia de monomeri se calculeaza din valorile experimentale ale absorbantei probelor in banda monomerilor si valoarea produsului ed determinate anterior, prin relatia:
![]()
Un mod convenabil de a reprezenta datele este cel bazat pe urmatoarea relatie:
![]()
care
reprezinta o dreapta ce trece prin punctul ordonata la origine
0,5 si a carei panta este K,
Sa se determine valoarea constantei de asociere K si a constantei de disociere K-1, explicand sensul fizic al rezultatului astfel obtinut.
Copyright © 2025 - Toate drepturile rezervate