 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Determinarea caldurilor specifice
I. Notiuni teoretice
Cand unui sistem termodinamic i se transmite o cantitate de caldura sau cand aceasta cedeaza o cantitate de caldura, temperatura lui poate sa se modifice, fie sa creasca, fie sa scada. Legatura dintre caldura schimbata de sistem cu mediul si variatiile sale de temperatura este data de coeficientii calorici:
capacitatea calorica C=![]() C SI=J/K -
caracteristica termica a corpului
C SI=J/K -
caracteristica termica a corpului
caldura
specifica c=![]() c SI=J/kg.K) -
caracteristica de material.
c SI=J/kg.K) -
caracteristica de material.
In general,
caldura specifica de pinde de temperatura, dar daca
lucram pe intervale de temperatura nu prea mari,
putem considera caldura specifica
Caldura transferata unui sistem sau cedata de aceasta depinde de conditiile in care are loc schimbul de caldura, izobar sau izocor, astfel incat si caldurile specifice vor avea valori diferite. Diferente mari se obtin pentru gaze. La lichide si solide, se poate considera ca valorile caldurilor specifice sunt egale. Astfel, putem scrie expresia caldurii sub formele:
Q=m.c.DT respectiv Q=C.DT
Daca doua sau mai multe corpuri sunt aduse in contact termic si izolate termic de mediul exterior, dupa un interval de timp temperaturile lor devin egale, realizandu-se echilibrul termic. Corpurile schimba caldura doar intre ele, fara ca aceasta sa se piarda partial inspre mediul extern corpurilor. Conform legilor de conservare a energiei putem scrie urmatoarea relatie numite ecuatia calorimetrica:
Qabs + Qced = 0
Tinand cont de conventia de semne vom avea: Qabs = /Qced/
Pe aceasta relatie se bazeaza metoda calorimetrica de determinare a coeficientilor calorici. Daca se determina caldurile specifice atunci metoda poarta numele de metoda amestecurilor. Tot calorimeric se pot determina si caldurile latente ale diferitelor transformari de stare.
Principiul metodei
Pentru realizarea conditiilor transferului de caldura in sisteme izolate fata de mediu se se foloseste colorimetrul (fig.16). Aceasta consta din doua vase concentrice izolate termic unul de altul printr-un strat de aer (rau conducator de caldura), si care formeaza invelisul adiabatic, respectiv realizeaza izolarea termica a incintei interioare. Calorimetrul este prevazut cu un capac prin care sunt practicate doua orificii, folosite pentru montarea unui termometru necesar la masurarea temperaturii, si a unui agitator, folosit, pentru amestecarea continutului astfel incat temperatura sistemului sa fie aceeasi in orice punct.
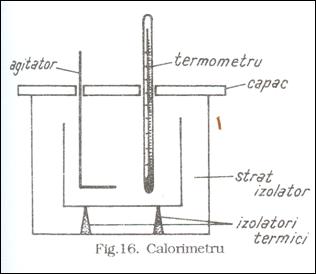
Intreg ansamblul are o anume capacitate calorica, ce este o caracteristica a sa si care se determina experimental. De regula se cauta ca aceasta sa fie suficient de mica pentru ca sa nu influenteze puternic corpurile din interiorul calorimetrului.
Determinarea capcitatii calorice a ansamblului
Calorimetrul este in contact termic cu mediul din interiorul sau, astfel incat temperatura va fi aceeasi cu a mediului intern. Se foloseste ca mediu intern un lichid, de regula apa, cu masa cunoscuta, m1, si temperatura cunoscuta, t1. Se aduce in contact in interiorul calorimetrului o alta cantitate de apa, m2, la o temperatura t2, diferita de cea din interior. Dupa un interval de timp se realizeaza echilibrul termic, sistemul ajungand la aceeasi temperatura, te. Ecuatia calorimetrica va fi:
(m1.ca).(te-t1)=m2ca.(t2-te)
iar expresia capacitatii calorice va fi:
C=m2.ca(t2-te)/(te-t1)-m1ca. Unde: ca=4181 J/kg/K - caldura specifica a apei.
Determinarea caldurii specifice a unui corp solid
Se trateaza asemanator cu cazul anterior, corpul solid cu masa ms si temperatura ts, se aduce in contact cu mediul intern al calorimetrului, ansamblul avand caracteristicile de la punctul precedent. Ecuatia calorimetrica este:
(m1ca+C).(te-t1)=mscs(ts-tc)
iar expresia caldurii specifice a corpului devine:
cs=(m1ca+C).(te-t1)/ms(ts-te) in care se cunoaste caldura specifica a apei, capacitatea calorica a calorimetrului precum si masele si temperaturile necesare.
Determinarea caldurii specifice a lichidelor. Dependenta de concentratie
In calorimetru se introduce lichidul necunoscut de masa m3, si temperatura t3, iar cantitatea de apa ma la temperatura t1 se va introduce ulterior. Metoda practic este aceeasi ca si la cele anterioare, si consta in aducerea in contact a celor doua lichide, apa respectiv lichidul necunoscut. Vom avea ecuatiile calorimetrice:
-lichid in calorimetreu (m3c3+C)(te-t3)=maca(t1-te) cu
c3=(1/m3).(maca(t1-te)/(te-t3)-C)
-apa in colorimetru (maca+C)(te-t1)=m3c3(t3-te) cu
c3=(maca+C)(te-t1)/m3(t3-te)
Determinarea concentratiilor cu ajutorul calorimetriei se face stiind ca pentru a incalzi o solutie intre temperaturile t1 si t2 trebuie sa-i furnizam acesteia o cantitate de caldura egala cu suma cantitatilor de caldura necesare pentru a incalzi componentele solutiei intre aceleasi temperaturi. Consideram: Dt = t2-t1, m - masa solutiei, r - concentratia solutiei si deci masa solvitului, iar masa solventului (1-r).m, c1 si c2 - caldurile specifice ale solventului, respectiv solvitului in stare pura, cs - caldura specifica a solutiei. Putem scrie:
mcsDt=r.m.c2Dt+(1-r)m.c1Dt de unde se obtine:
r=(cs-c1)/(c2-c1)
Astfel se determina caldurile specifice pentru solventul pur, solvit si solutie folosind metoda descrisa pentru lichide. Daca solventul este tot apa atunci, se determina doar caldurile specifice ale solvitului pur si solutiei.
O alta posibilitate de determinare a concentratiei unei solutii este: se determina caldurile specifice ale solutiilor de concentratii cunoscute si a acelora de concentratii necunoscute. si a celora de concentratii necunoscute. Astfel se obtine o curba de variatie a caldurii specifice cu concentratia, respectiv o curba de etalonare din care se poate determina fie diferite concentratii necunoacute, fie calduri specifice alte concentratii cunoscute.
Metoda de lucru
a.Determinarea capacitatii calorice a calorimetrului
-Se cantaresc doua cantitati de apa m1 si m2.
-Se introduce m2 in calorimetru, se monteaza capacul si se asteapta pana cand indicatia de temperaura a termometrului este stabilita. Se citeste t1.
-Separat se incalzeste cantitatea de apa m2, pana la temperatura t2, de regula pana la temperatura de fierbere. Folosirea acestei temperaturi este utila deoarece ea este constanta atata vreme cat apa fierbe si masuratoarea este mai exacta.
-Se introduce cantitatea de apa incalzita in calorimetru, se monteaza capacul si cu ajutorul agitatorului se amesteca bine; se asteapta pana la echilibru si se citeste temperatura de echilibru - valoare aproximativ constanta.
-Se calculeaza C.
-Datele experimentale se trec in tabel:
|
m1 (kg) |
m2 (kg) |
t1(0C) |
t2(0C) |
t4(0C) |
C(J/grd) |
b.Determinarea caldurii specifice la diferite solutii
-Se cantaresc masele de apa mase egale de solutii de diferite concentratii;
-Apa se introduce in calorimetru si se asteapta pana la stabilirea echilibrului cu aceasta notandu-se apoi temperatura cu t1;
-Se incalzeste solutia de concentratie r1 la temperatura t2;
-Se introduce solutia in calorimetru, se monteaza capacul acestuia, se agita continutul lui si se citeste temperatura de echilibru;
-Se calculeaza caldura specifica;
-Se repeta operatiile cu toate solutiile de concentratii cunoscute;
-Se reprezinta grafic caldurile specifice in functie de concentratii, obtinandu-se curba de etalonare;
-Se determina asemanator caldura specifica a unei solutii de concentratie cunoscuta si din curba de etalonare se citeste valoarea concentratiei;
Datele se trec in tabel:
|
ma (kg) |
ms (kg) |
r% |
t1(0C) |
t2(0C) |
t3(0C) |
C5(J/grd) |
Surse de erori de masura:
izolarea inperfecta a calorimetrului;
amestecare imperfecta;
citirea temperaturii din colorimetru cu rezolutie prea mica a termometrului;
modificarea temperaturii (scaderea) corpului incalzit pana la introducerea in lichidul din calorimetru.
Copyright © 2025 - Toate drepturile rezervate