 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Transmiterea informatiei genice
Metabolismul acizilor nucleici
Replicarea este procesul prin care se sin-tetizeaza o molecula dublu spiralata(duplex) de ADN 'fiica' identica cu molecula duplex ADN 'mama' care a servit ca matrice de sinteza.
In 1957 Arthur Kornberg si colegii sai au izolat o enzima din E. coli care catalizeaza sinte-za ADN. Azi o numim ADN-polimeraza ADN-dependenta sau ADN-polimeraza I deoarece de atunci incoace s-au descoperit si alte ADN-poli-meraze. Ea catalizeaza reactia:
(ADN)n + dNTP (ADN)n+1 + PPi,
unde dNTP sunt: dATP, dGTP, dTTP si dCTP. In figura 46 este prezentata schematic aceasta reactie. Replicarea ADN nu poate avea loc in absenta unei catene matrice(mama). Ea constituie suportul sintezei noii catene, numita catena fiica.
La incheierea sintezei rezulta un duplex format dintr-o catena mama si o catena fiica ceea ce arata ca replicarea este semicon-servativa. Aceasta proprietate a fost demonstrata in experi-mentul Meselson-Stahl(fig. 45).
Figura 45. Rezultatele
experimentului Meselson-Stahl efectuat pe E. Coli. In eprubetele de
centrifuga sunt trasate benzile reprezentand ADN de diferite
densitati. Catenele ADN mama contin izotopul greu al
azotului(15N) si de aceea moleculele duplex ale acestuia sunt
numite ADN greu in figura. Intrucat in conditiile experimentului
replicarea are la dispozitie nucleotide 'usoare',
adica nucleobaze cu izotopul usor al azotului(14N), catenele
de ADN nou sintetizate in generatiile urmatoare sunt usoare.
Moleculele duplex formate din catene usoare sunt numite ADN usor in
figura. Moleculele mai dense au o viteza de sedimentare
superioara in camp centrifugal, adica le corespund benzi situate mai
aproape de fundul eprubetei. Prezenta unei benzi intermediare in cele 3
generatii de ADN si aparitia unei fractiuni tot mai
consistente de ADN usor sunt dovada experimentala a caracterului semiconservativ al
replicarii la proca-riote. 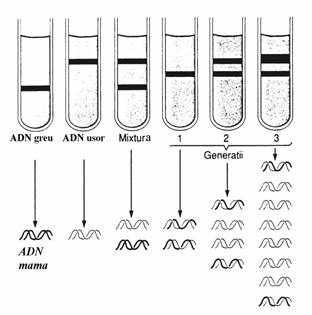
Atasarea deoxiribonucleotidelor la capatul catenei fiice, in cursul elongarii acesteia, se face pe principiul complementaritatii bazelor (Watson -Crick).
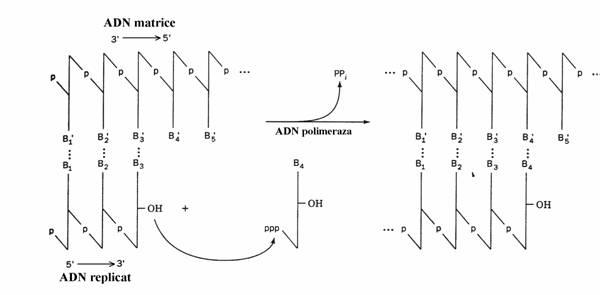
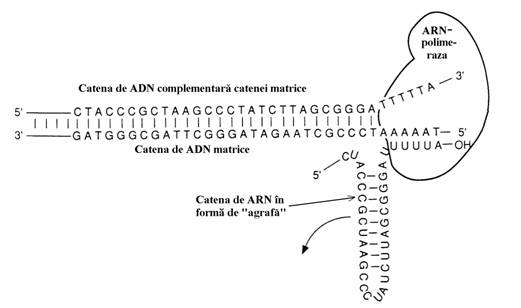
Sinteza ADN nu poate incepe daca nu este prezenta o secventa de ARN formata din 4-12 nucleotide numita primer. Sinteza acestuia are loc in sensul 5' 3' si este catalizata in E. Coli de ARN polimeraza, enzima implicata in transcriptie, si de primaza, enzima codificata de gena numita dnaG. Avand in vedere ca primul nucleo-tid din catena ADN fiica se ataseaza la capatul 3΄ al primerului, se spune ca sinteza acestei catene, adica replicarea, are loc in sensul 5' 3' (fig. 46).
Reactia de condensare se produce numai daca baza nucleotidului dNTP este in relatie de complementaritate cu baza nucleotidului dNMP din catena matrice la care primul urmeaza sa se ataseze (fig. 47).
Figura 47. ADN polimerazele ansambleaza deoxinu-cleozid trifosfatul nou sosit pe matricea catenei de ADN mama ceea ce face ca noua catena sa creasca in directia 5'
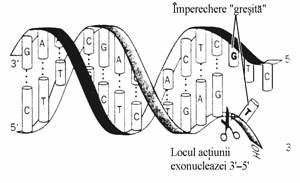
Daca baza nucleotidului dNTP incalca principiul Watson-Crick al complementaritatii si nucleo-tidul este totusi incorporat, intervine activitatea 3' 5' exonucleazica a unei subunitati a polime-razei I care repara greseala(fig. 48) in procesul supranumit 'corectare'.
Figura 48. Functia de 'corectare' a 3' 5' exonucleazei, componenta a ADN polimerazei I, consta in a indeparta nucleotidul 'gresit' a carei baza incalca principiul complementaritatii nucleo-bazelor. Aceasta activitate se exercita 'in spalt', adica inainte ca noua catena sa se finalizeze. Locul actiunii exonucleazei este indicat de foarfeca
ARN-primer este excizat la sfarsitul sintezei catenei de ADN. ADN polimeraza I (Pol I) are nevoie de un ARN-primer pentru inceperea sin-tezei ADN datorita activitatii 3 exonuclea-zice reparatorii in timp ce ARN-polimeraza nu dispune de o activitate reparatorie. Prin urmare, aceasta din urma, poate incepe sinteza ARN ca sinteza de novo. Folosirea ARN-polimerazei pentru initierea sintezei ADN este explicabila si d.p.d.v. evolutionar deoarece probabil ca ARN a aparut cu mult inaintea ADN, ca depozitar sigur de informatie.
O alta activitate a polimerazei I este 5' 3' exonucleazica care determina indepartarea primer-ului ARN dupa sinteza catenei ADN si umplerea locului ramas cu o secventa de ADN atunci cand ea actioneaza in tandem cu activitatea 5' 3' polimerazica. Asa cum se vede in figura 49 exonucleaza 5' 3' excizeaza un fragment de cateva nucleotide.
Figura 49. Activitatea 5' 3' exonucleazica, componenta a ADN polimerazei I. Aceasta excizeaza un fragment monocatenar cu pana la 10 nucleotide incepand cu capatul 5' al segmentului de catena intrerupta. Locul actiunii exonucleazei este indicat de foarfeca.
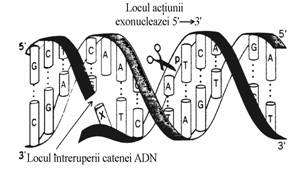
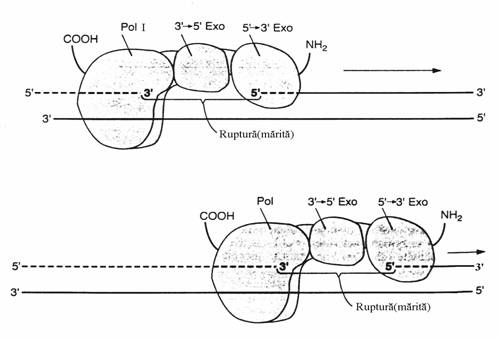
In tandem cu activitatea 5' 3' polimerazica, activitatea 5' 3' exonucleazica determina deplasarea intreruperii(rupturii) catenei ADN in directia 3' 5'(fig. 50), proces prin care o catena ADN poate fi 'reparata' si in interiorul ei.
Figura 50. Deplasarea rupturii(nick-translation). Actiunea simultana a activitatilor 5 '3' exonuclea-zica si polimerazica determina deplasarea in directia 3' 5' a rupturii. In partea de sus este prezentat complexul enzimatic Pol I cu cele 3 activi-tati ale sale, la inceputul actiunii sale asupra catenei ADN rupte. In partea de jos se vede cum acest complex s-a deplasat de-a-lungul catenei ADN. Sunt indicate capetele C-terminala si N-terminala a proteinelor enzimatice.
1.2. ADN polimerazele II si III
In tabelul 4 sunt prezentate comparativ cateva proprietati ale polimerazelor procariotice cunoscute: Pol I, Pol II si Pol III.
Tabelul Proprietatile polimerazelor din E. Coli.
|
Proprietate |
Polimeraza I |
Polimeraza II |
Polimeraza III |
|
Masa moleculara(kD) |
109 |
120 |
140 |
|
Molecule/celula |
400 |
? |
10-20 |
|
Numar de turnover* |
600 |
30 |
9000 |
|
Gena structurala(codificatoare) |
polA |
polB |
polC |
|
Polimeraza 5' |
+ |
+ |
+ |
|
Exonucleaza 3 |
+ |
+ |
+ |
|
Exonucleaza 5' |
+ |
+ |
*Exprimat in nucleotide polimerizate / minut · molecula (la 37oC).
La procariote replicarea incepe la nivelul
unei secvente ADN numita origine(ori). OriC este
singurul tip de origine a replicarii la E. Coli. Proteina dnaA, specifica
E. coli, este necesara initierii replicarii in origine.
Ea se leaga la un anumit segment al oriC si, in prezenta
altor componente ale replicarii si cu consum de ATP,
initiaza replicarea. Sinteza duplexului principal (leading
strand) are loc prin sinteza continua a unei catene fiice in directia
5' 3', catalizata de Pol III. Sinteza duplexului
'intarziat'(lagging strand), sub actiunea catalitica a Pol
I are loc tot in directia 5' 3' insa
nu in mod continuu: catena mama matrice isi expune succesiunea de
nucleobaze segment cu segment, pe care se sintetizeaza catena fiica
fragment cu fragment, deoarece molecula mama se despiralizeaza
buca-ta cu bucata. Natura intermitenta a sintezei duple-![]() xului 'intarziat' se datoreaza imposibilitatii
de-spiralizarii intregului duplex mama deodata ceea
xului 'intarziat' se datoreaza imposibilitatii
de-spiralizarii intregului duplex mama deodata ceea ![]() ce ar necesita o mare cantitate de energie. In acest fel bifurcatia
replicarii avanseaza pas cu pas(fig. 51). Acest mecanism determina un
'gol'(gap) pe catena matrice pe care are loc sinteza
'intarziata', gol care este umplut prin sinteza de ADN
fiica
ce ar necesita o mare cantitate de energie. In acest fel bifurcatia
replicarii avanseaza pas cu pas(fig. 51). Acest mecanism determina un
'gol'(gap) pe catena matrice pe care are loc sinteza
'intarziata', gol care este umplut prin sinteza de ADN
fiica
![]()
![]()
![]() abia dupa despiralizarea unui fragment de ADN mama de cateva
spire. Pol I indeparteaza ARN primer si il inlocuieste cu
ADN prin activitatile sale 5' 3'
exonucleazica si 5' 3'
polimerazica realizand o operatie de nick-translation(fig.
50). Fragmentele de ADN numite fragmente Oka-zaki, dupa numele
celui care le-a pus in evidenta, sunt apoi 'sudate' de
catre ADN ligaza, enzima care catalizeaza formarea
unei legaturi fosfodi-esterice. Dupa faza de initiere,
replicarea poate a-
abia dupa despiralizarea unui fragment de ADN mama de cateva
spire. Pol I indeparteaza ARN primer si il inlocuieste cu
ADN prin activitatile sale 5' 3'
exonucleazica si 5' 3'
polimerazica realizand o operatie de nick-translation(fig.
50). Fragmentele de ADN numite fragmente Oka-zaki, dupa numele
celui care le-a pus in evidenta, sunt apoi 'sudate' de
catre ADN ligaza, enzima care catalizeaza formarea
unei legaturi fosfodi-esterice. Dupa faza de initiere,
replicarea poate a-
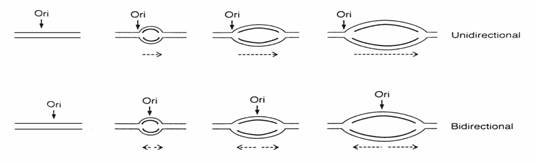
vea loc uni- sau bidirectional(fig. 53) si, la euca-riote, ea poate fi initiata simultan in mai multe puncte(origini) ceea ce asigura o mare viteza a replicarii. Bifurcatiile replicarii constituie zone de duplex matrice(mama) despiralizate in care catenele complementare de ADN nou sinte-tizate(fiice) se spiralizeaza pentru a forma duple-xurile fiice.
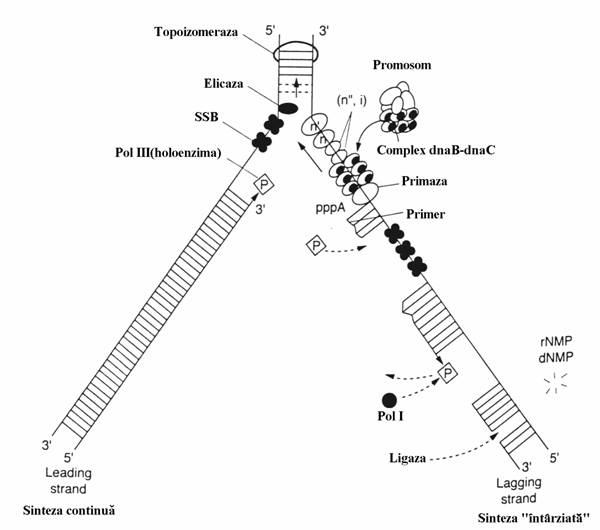
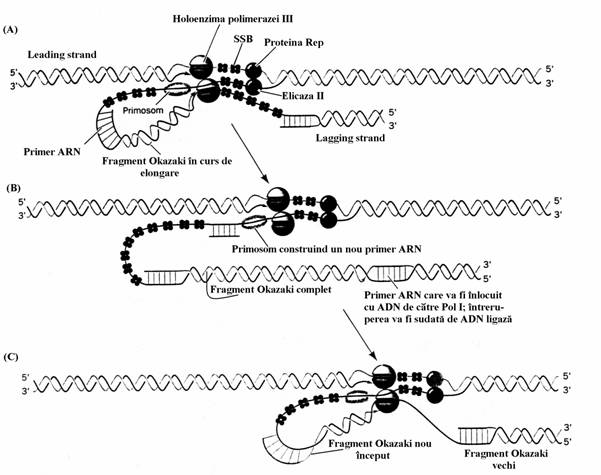
Figura 51. Procesele moleculare de la nivelul bifurcatiei replicarii la E. coli. Holoenzima polime-razei III este forma oligomerica, integrala, a polime-razei. Primosomul este un complex de proteine care cuprinde primaza, un hexamer al proteinei dnaB (elicaza), proteina dnaC si alte proteine (n,n',n',i). dNMP = deoxiribonucleozid monofosfat; rNMP = ribonucleozid monofosfat; pppA = capatul 5' trifosfo-ric al primerului(contine adenozina notata cu A); SSB = single-strand binding protein[A. Kornberg, T.A. Baker: DNA Replication, 2nd edition, WH Freeman, New York, 1992].
1.3. Alti factori implicati in propa-garea bifurcatiei replicarii
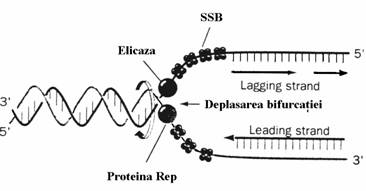
Elicazele sunt enzime care catalizeaza despiralizarea helixului ADN, folosind energia furnizata de nucleotide trifosforice in special ATP. Un numar de proteine cu activitate elicazi-ca au fost izolate, cele mai multe jucand un rol in repararea ADN, recombinare sau replicarea la bacteriofagi. Principala elicaza a E. Coli este codificata de gena dnaB, enzima fiind compo-nenta a unor agregate moleculare ale bacteriei numite primosomi(promosomi). Elicaza actio-neaza impreuna proteina Rep(codificata de gena rep) si cu o proteina(SSB) care mareste activi-tatea elicazei II si se asociaza la catenele ADN pentru a le mentine separate, tendinta acestora fiind de a se incolaci una in jurul celeilalte daca sunt in relatie de complementaritate. Proteina Rep separa catenele duplexului ADN despiralizat prin miscare de-a-lungul catenei matrice princi-pale in directia 3' 5' cand consuma 2 molecule de ATP per pereche de baze desfacuta. In mod similar elicaza II se misca de-a lungul catenei matrice a replicarii 'intarziate'(lagging strand) in directia 5'
Prescurtarea SSB provine din denumirea single-strand binding protein. Numeroase copii ale acestei proteine invelesc cooperativ catenele ADN izolate mentinandu-le desperechiate iar pe de alta parte le protejeaza ca sa nu fie degradate sub actiunea nucleazelor. Moleculele de SSB se disociaza de catenele ADN matrice pe masura ce are loc sinteza catenelor fiice. Cele 3 proteine actioneaza concertat(fig. 52) cu consum de ATP.
Figura 52. Despiralizarea ADN sub efectul combinat al proteinei Rep, elicazei II si proteinei SSB.
Primosom-ul este un complex de proteine format din primaza, un hexamer al proteinei dnaB (elicaza), proteina dnaC si alte proteine(n', n', i). Functia primosomului este aceea de a pregati sinteza ADN in origine. Cu consum de ATP primosomul se deplaseaza odata cu bifurcatia replicarii sintetizand ARN primer necesar sintezei fragmentelor Okazaki. Se crede ca enzimele si factorii replicarii fac parte dintr-un amplu complex macromolecular numit replisom. S-a sugerat faptul ca replisomul poate fi atasat la membrana si ca in loc ca el sa se deplaseze de-a lungul duplexului ADN in timpul replicarii, ADN-ul este trecut prin replisomul fixat la suprafata membranei. Terminarea replicarii con-sta in formarea prin unei secvente specifice, sec-venta ter, la care se asociaza o proteina specifica (ter-binding protein) care blocheaza actiunea proteinei dnaB(elicaza) de despiralizare a ADN.
Figura 53. Replicarea uni- si bidirectionala pornind de la o singura origine a replicarii(Ori).
Descolacirea ADN este un interesant aspect al replicarii prin problemele mecano-biochimice pe care le ridica. Viteza de deplasare a bifurcatiei in timpul replicarii ADN din E.coli este de 50.000 resturi nucleotidice/minut la 37 C. Intrucat fieca-re spira contine 10 nucleotide viteza de desco-lacire a ADN este de 5.000 r.p.m. Aceasta viteza mare ridica problema ca fara un mecanism special de rotatie, toata partea de cromozom de dinaintea bifurcatiei ar trebui sa se roteasca cu aceasta frecventa. Celula a rezolvat aceasta pro-blema prin ruperea temporara si descolacirea une-ia din cele 2 catene ale ADN doar cu cateva spire inaintea bifurcatiei, sub actiunea concertata a girazei si elicazei. Astfel sistemul enzimatic giraza-elicaza-SSB functioneaza ca un "deschi-zator de fermoar", fermoarul fiind ADN-ul a carui deschidere se face cu minimum de energie metabolica. Noile catene de ADN se asociaza si se rasucesc cu cele vechi fara vreun aport de energie, fara interventia vreunei enzime "de rasucire", intr-un proces spontan d.p.d.v. termo-dinamic.
Figura 5 Replicarea ADN la E. Coli prezentata pe etape: (A) Replisomul ADN de E. coli, care se crede ca contine 2 holoenzime Pol III, realizeaza atat sinteza 'intarziata' (lagging strand) cat si cea de pe catena principala a ADN matrice(leading strand). Catena ADN a sintezei 'intarziate' trebuie sa faca o bucla pentru a permite holoenzimei Pol III atasata sa produca elongarea catenei fiice 'intarziate' initiata de primosom. (B) Holoenzima elibereaza catena matrice a sintezei 'intarziate' atunci cand intalneste capatul unui fragment Okazaki sintetizat anterior. Acesta semnaleaza primosomului sa initieze sinteza unui nou primer necesar sintezei lagging strand. (C) Holoenzima re-asociaza catena care codifica lagging strand si incepe sa sintetizeze un nou fragment Okazaki pe primerul ARN nou creat. Nota: modelul replisom prezentat releva faptul ca sinteza leading strand are loc in aceiasi directie cu sinteza lagging strand.
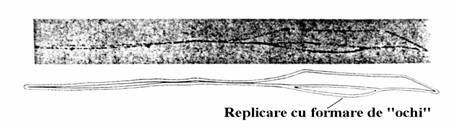
Cromozomul de E. coli se replica in modul θ bidirectional pornind de la o singura origine de replicare. Litera θ vine de la asa-zisa structura θ care se refera la autoradiogramele obtinute de J. Cairns folosind timina tritiata(3H-timina)(fig. 55) in care apar 'ochi' deoarece, cum am vazut, du-plexul ADN se replica printr-o separare progre-siva a catenelor sale insotita de sinteza catenelor complementare pentru a rezulta doua duplexuri fiice replicate semiconservativ. Litera θ seamana cu 'ochii' din figura.
Figura 55. O autoradiograma(figura de sus) si schita ei(figura de jos) al replicarii cromozomului de E. coli. Bacteria a fost cultivata pe un mediu continand timina tritiata care impresioneaza emulsia fotografica. [J. Cairns, Cold Spring Harbor Lab., USA].
1.5. Replicarea la eucariote
Exista multe asemanari intre mecanis-mele replicarii la procariote si eucariote. Totusi, exista mai multe diferente. In primul rand com-plexitatea replicarii eucariotelor este mult mai mare decat a replicarii procariotelor.
Sunt de remarcat cateva diferente la nivelul ciclului celula. Acesta este o secventa de evenimente care se deruleaza in 4 faze distincte. Considerand ca ciclul este de 24 de ore, etapele lui se pot reprezenta ca in figura 56.
Faza M este cea mai dramatica perioada, in care are loc mitoza si fisiunea(diviziunea) celulara. In cursul acestei faze membrana nucle-ara (la eucariote) se sparge, continutul nuclear condenseaza in cromozomi vizibili iar micro-tubulii se reorganizeaza pentru a forma fusul mitotic care eventual va separa cromozomii. In timpul mitozei celula pare ca ia o scurta 'pauza' in starea numita metafaza in care cromozomii duplicati se aliniaza pe fusul mitotic capacitat sa produca segregarea cromozomilor. Separarea cromozomilor duplicati marcheaza inceputul anafazei in timpul careia cromozomii se depla-seaza catre polii fusului, unde ei se de-conden-seaza si formeaza doi nuclei intacti (telofaza). In cursul fisiunii celula mama se divide in doua celule fiice identice.
Figura 57 prezinta detaliat faza M. Ima-ginile schematice ale celulei care parcurge fazele ciclului celular sunt similare imaginilor electro-nomicroscopice.
Figura 56. Etapele si fazele ciclului celular la eucariote. Diviziunea este etapa care corespunde fazei M(mitoza) care dureaza 1 ora. Interfaza se intinde pe parcursul a 3 faze: G1, S si G2 dintre care numai in timpul fazei S(7 ore) are loc replicarea. Faza G1 are cea mai lunga durata(10 ore), ea este pregatitoare pentru replicare. Faza G2(6 ore) pregateste mitoza. Figura sugereaza fisiunea celulara prin prezentarea scindarii unei celule mame in doua celule fiice in faza M
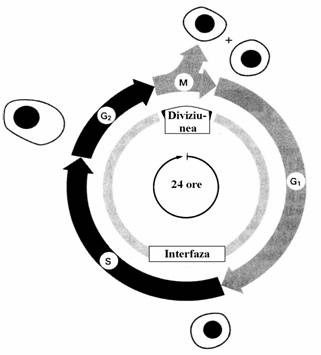
Figura 57. Sus: mitoza si fisiunea celulara, care constituie impreuna faza M, ocupa doar o mica parte din ciclul celular. In cursul acesteia au loc importante transformari biochimice prin care dintr-o celula rezulta doua celule fiice. Jos:
imagini electronomicroscopice ale celulelor in diferite faze ale ciclului celular.[reprodusa dupa B. Alberts, et al., Molecular Biology of the Cell, Garland Publ., 1994].


Faza G1 acopera cea mai lunga perioada din ciclul celular. Faza S este la eucariote, spre deosebire de celulele procariote, singura perioada a ciclului celular cand se sintetizeaza ADN. Faza G2 este perioada in care celula tetraploida se pregateste de mitoza.
Ciclul celular pentru celulele din culturi ocupa de obicei 16-24 ore. In cazul diferitelor celule ale organismelor multicelulare acesta variaza de la 8 ore la 100 de zile, in special datorita variatiei fazei G1. 'Decizia' ireversibila de a prolifera este luata de celula eucariota in timpul fazei G1. Starea de repaos in care celula nu prolifereaza, corespunzatoare fazei G0, se men-tine daca este intrerupta alimentarea cu nu-trienti sau daca celula este in contact cu alte celule (inhibitie de contact). Din contra, replicarea poate fi indusa de substantele cancerigene sau de virusi
tumorali care declanseaza proliferarea necontro-lata a celulelor. Ea poate fi indusa si de indepar-tarea chirurgicala a tesutului care este urmata de regenerarea rapida a lui sau de proteine mito-gene care se asociaza la receptori de suprafata si induc diviziunea celulara.
Alte diferente intre replicarea pro- si euca-riotelor sunt cele de la nivelul ADN polimera-zelor. Am vazut ca la procariote exista polime-razele I, II si III. Celulele animale si umane contin cel putin 4 ADN polimeraze: α, β, γ si δ (tab. 5). Studierea acestor enzime s-a facut in special cu ajutorul unor inhibitori. Pol α apare numai in nucleul celular unde participa la repli-carea ADN cromozomial. Ea este strans asociata cu enzima primaza. Aceasta enzima este lipsita de activitatile exonucleazice pe care le au polime-razele procariotice si de aceea activitatea de
Tabelul 5. Localizarea si proprietatile ADN polimerazelor animale.
|
α |
β |
γ |
δ |
|
|
Localizare |
nucleu |
nucleu |
mitocondrie |
nucleu |
|
Efectul unor inhibitori: Afidicolina Arabinozil NTP N-etilmaleimida |
+ puternic puternic |
- slab slab |
- slab puternic |
+ puternic puternic |
corectare a erorilor de polimerizare este asigurata pe alte cai. Pol δ, enzima nucleara, seamana cu Pol α din punctul de vedere al sensibilitatii fata de inhibitori. In schimb nu este asociata cu primaza si prezinta activitatea corectoare 3' 5' exonucleazica. Pol γ apare exclusiv in mitocon-drie unde participa la replicarea ADN mitocon-drial. Diferentele dintre celulele procariote si cele eucariote la nivel cromozomial sunt remarcabile. Cromozomii eucariotice au mai multe origini a replicarii, spre deosebire de cromozomii procari-otici unde replicarea are o singura origine(oriC). Pol α sintetizeaza ADN cu o viteza de 3000 nucleotide/minut adica de 20 de ori mai lent decat polimerazele procariotice. Tinand cont de faptul ca un cromozom eucariotic contine de cca. 60 de ori mai mult ADN decat unul procariotic replicarea unui cromozom eucariotic pornind de la o singura origine ar necesita o luna. Microsco-pia electronica arata ca, totusi, in cursul replicarii cromozomii eucariotici contin mai multe origini (fig. 58) si, in consecinta, faza S a replicarii lor dureaza doar cateva ore.
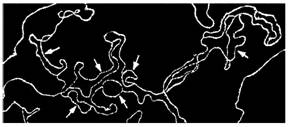
Figura 58. Micrografie indicand prin sageti mai multi 'ochi' de replicare, adica mai multe origini pe un fragment de ADN de Drosophila melanogaster [adaptata dupa Kreigstein, H.J., Hogness, D.S., Proc.Natl. Acad. Sci. USA, 71:136, 1974]
Un alt nivel de diferentiere intre replicarile pro- si eucariotica este cel al transcriptiei inverse. Retrovirusurile cum este virusul imunodeficientei umane(HIV) infecteaza doar celule eucariotice. Descoperita in 1970 de Howard Temin si David Baltimore, revers transcriptaza este o ADN polimeraza ARN-dependenta care actioneaza asemanator cu Pol I, adica sintetizeaza ADN in sensul 5' 3' pe baza unei matrici cu primer. Diferenta fata de Pol I este aceea ca matricea nu este o catena de ADN ci o molecula de ARN. Descoperirea revers transcriptazei a creat o anu-mita controversa in comunitatea biochimistilor deoarece ea a fost perceputa de unii ca fiind o 'abatere' de la dogma centrala a biologiei mole-culare(fig. 59). Totusi, s-a demonstrat ca trans-criptia inversa nu incalca principiile termo-dinamicii. In anumite conditii, chiar si Pol I poate cataliza sinteza ADN complementar(ADNc) pe ARN matrice.
Figura 59. Dogma centrala a biologiei moleculare. Sagetile continue indica tipurile de transfer a informatiei genetice care se intalnesc in toate celulele. Transferurile speciale de informatie genetica sunt indicate prin sageti intrerupte: ARN polimeraza ARN-dependenta apare in unele virusuri ARN si in unele plante(enzima cu functie necunoscuta), ADN polimeraza ARN-dependenta(revers transcriptaza) apare in alte virusuri ARN. Codificarea directa a unei proteine de catre ADN nu a fost evidentiata inca, dar nu este exclusa cel putin din motive de simetrie. Celelalte tipuri de transfer de informatie, proteina ADN, proteina ARN si proteina protei-na nu sunt posibile deoarece proteinele nu pot sa fie donatoare ci numai recipiente de informatie genetica.
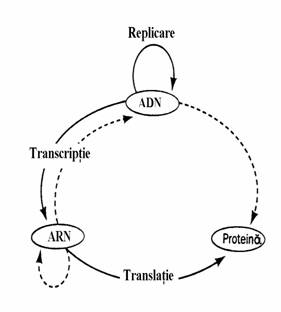
In timpul infectarii retrovirale revers transcrip-taza catalizeaza sinteza unei catene de ADNc care cu catena matrice formeaza duplexul hibrid ARN-ADNc. Activitatea ribonucleazica a revers transcriptazei hidrolizeaza catena ARN iar ADNc, prin replicare, va forma duplex ADN care va finaliza infectia virala.
1.6. Precizia replicarii
ADN-polimerazele pot corecta erorile de imperechere a bazelor nucleotidice. S-a determi-nat experimental ca replicarea ADN-ului in E.coli are loc cu o eroare de cel mult 1:1010. Totusi, analize recente arata ca, daca fidelitatea replicarii ar depinde doar de precizia de imperechere a bazelor, eroarea ar fi mai mare 1:105. Raspunsul a venit prin cercetarea proprietatilor ADN-polimerazelor. Daca activitatea polimerazica 5' 3' a inserat un nucleotid 'gresit', activitatea exo-nucleazica 3 hidrolizeaza legatura fosfoes-terica nou-formata si elimina nucleotidul. Eroarea cu care activitatea exonucleazica face corectarea este de 1:105. Iata deci ca 1:(105x105) = 1:1010 adica regasim eroarea replicarii. Erorile de transcriptie si translatie sunt mult mai bine tolerate deoarece ele afecteaza ARN-ul sau o pro-teina dintr-o singura celula fara sa altereze intreaga descendenta a speciei celulare.
Anumite medicamente antibacteriene sau antivirale precum si unele medicamente chimio-terapeutice inhiba replicarea. In functie de mecanismul actiunii ele se clasifica in cateva categorii:
Antimetabolitii reduc sau inhiba produ-cerea nucleotidelor precursoare ale sintezei acizilor nucleici. Exemple sunt 5-fluorouracilul, metotrexatul, 6-mercaptopurina, 6-tioguanina prezentate la metabolismul nucleotidelor.
Analogii substratului sunt nucleotide asemanatoare celor naturale. Ele 'pacalesc' poli-merazele care le incorporeaza in structura ADN. Acizii nucleici care contin in structura lor acesti analogi nu se pot replica in continuare. Un exem-plu este azidotimidina in care o grupare azido inlocuieste gruparea hidroxil 3' din structura nucleozidului timidina. Substanta este un puter-nic medicament antiviral folosit in tratamentul SIDA sub numele de zidovudina. In stare trifosforilata zidovudina este un antiviral puternic deoarece ea este acceptata de catre revers trans-criptaza virala mai bine decat de catre ADN poli-merazele din celulele umane. Sinteza ADNc este intrerupta deoarece analogul nucleotid nu dispune de gruparea 3'-OH si deci nu poate forma urma-toarea legatura fosfoesterica cu un alt nucleotid. Alt exemplu este arabinozil citozina (citarabi-na), puternic antileucemic utilizat in leucemia non-limfocitara(mielogena) in asociere cu 6-tio-guanina si daunorubicina. Ca nucleotid trifosforic (ara-CTP) intrerupe, ca si zidovudina, elongarea lantului de ADN.
Inhibitori care interactioneaza direct cu ADN. Unele din aceste substante sunt capa-bile sa se intercaleze intre bazele imperecheate modificand conformatia ADN sau blocand proce-sele in care este implicat acesta. Daunorubicina si doxorubicina(adriamicina), derivatul hidroxi-lat al daunorubicinei, sunt glicozide antracicline cu activitate antibiotica datorata efectului blocant asupra replicarii si transcriptiei.
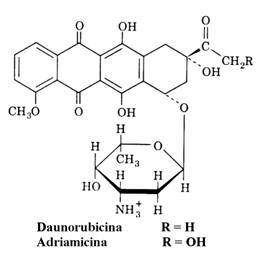
O alta functie a acestor antibiotice este cea de generare a anionului superoxid, O2¯. CitP450 re-ductaza, prezenta in membrana nucleara, catali-zeaza reducerea antraciclinelor pana la starea de radicali semichinonici care, la randul lor, reduc oxigenul molecular la O2¯. Anionul superoxid, specie reactiva a oxigenului, produce ruperea unei catene din ADN. Tesuturile cu activitate crescuta a superoxid dismutazei(SOD) si catala-zei sunt protejate de actiunea nociva a acestor specii reactive ale oxigenului. Tumorile contin cantitati mici de SOD, de aceea ele sunt agresate de anionul superoxid ceea ce explica activitatea antitumorala a antraciclinelor. Cordul este sarac si in catalaza ceea ce explica cardiotoxicitatea acestora. Un antibiotic din clasa fenoxazonelor, actinomicina D, produs de Streptomyces antibio-ticus, blocheaza atat replicarea cat si transcriptia
ADN prin intercalarea nucleului fenoxazonic intre guanina si citozina. Ea este folosita, in asociere cu vincristina si radioterapia in trata-mentul tumorii Wilms. Impreuna cu metotrexatul este eficienta in tratamentul coriocarcinomului gestational. Intre inhibitorii replicarii care inte-ractioneaza direct cu ADN sunt agentii de alchi-lare, unii complecsi coordinativi ai platinei si bleomicinele. Mecloretamina (fig. 60) este un agent de alchilare care realizeaza punti transver-asale datorita carora este blocata replicarea si transcriptia.
Figura 60. Mecanismul de actiune a mecloretaminei.
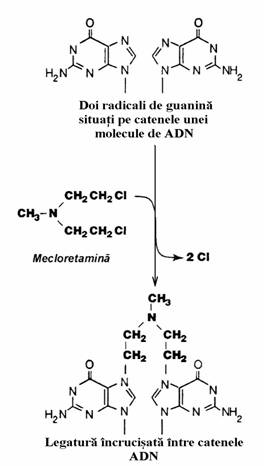
Mecloretamina a fost folosita ca substanta toxica de lupta(arma chimica) cu efect veziculant(azot mustar) inca din Primul Razboi Mondial. Capaci-tatea de a produce limfocitopenie a determinat utilizarea ei in tratamentul cancerelor limfatice. In prezent se utilizeaza in tratamentul bolii Hodgkin. Ciclofosfamida este alt agent alchilant folosit in tratamentul limfomului Burkitt si a cancerului mamar. Este folosit si in tratamentul unor afectiuni non-neoplazice cum sunt sindro-mul nefrotic si poliartrita reumatoida. Dintre complecsii coordinativi ai platinei, cisplatinul realizeaza punti transversale intre atomii N9 din structura radicalilor de guanina. Este folosit in tratamentul tumorilor solide cum sunt carcinomul testicular metastatic si carcinomul ovarian. Este folosit ca monoterapie in tratamentul carcinomu-lui vezicii urinare. Bleomicinele sunt glicopep-tide care formeaza complecsi cu ADN si ionii Fe(II) care se oxideaza transformandu-se in com-plecsi ADN-bleomicina-Fe(III). Electronii rezul-tati formeaza cu oxigenul anioni superoxid care scindeaza catenele ADN determinand aberatii cromozomiale. Bleomicinele sunt utilizate in tra-tamentul tumorilor testiculare.
1.8. Mutatii genetice induse de xenobiotice si radiatii de inalta energie
Tulburarile replicarii sunt critice datorita caracterului permanent al defectului genetic. Bacteriile cu activitate exonucleazica 3 sufera mutatii cu o viteza foarte mare. Totusi, viteza mutatiilor unei specii a fost optimizata in cursul evolutiei. Viteze prea mari ar conduce la progenituri neviabile in timp ce viteze prea mici ar diminua diversificarea genetica prin mutatii spontane care este principala sursa a evolutiei propriu-zise. Substantele mutagene pot fi catego-risite in doua categorii:
(i) analogi ai nucleobazelor
(ii) mutageni chimici.
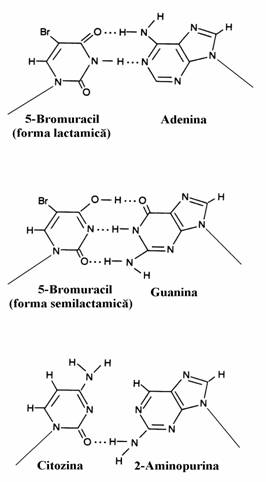
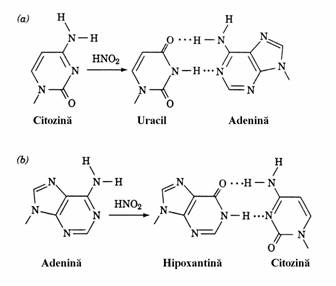
Exemple din prima categorie sunt 5-bromuracilul si 2-aminopirina. Derivatul bro-murat este un analog al timinei si atomul de Br, atom electronegativ, face ca forma semilactamica sa fie predominanta fata de forma lactamica, spre deosebire de timina la care predomina forma lactamica deoarece grupa metilica exercita un efect de lactimizare mai slab(fig. 62). In conse-cinta, dupa incorporarea in ADN, 5-Br-uracilul nu se imperecheaza cu timina(2 punti de hidro-gen) ci cu guanina(3 punti de hidrogen) ceea ce determina substitutia AT GC. 2-Aminopurina este un analog al adeninei dar ea nu se impere-cheaza cu timina prin doua punti de hidrogen ci cu citozina printr-o singura punte de hidrogen. Insertia ei in locul adeninei produce substitutia GC AT.
Mutagenii chimici se pot imparti in agenti alchilanti (azot mustar), nealchilanti (acidul azotos, formaldehida, hidroxilamina) si agenti de intercalare cum sunt de exemplu acridinele, substante cu caracter teratogen care cauzeaza insertia unor baze suplimentare in cur-sul replicarii.
Acidul azotos altereaza unele nucleobaze din ADN. El converteste citozina in uracil si adenina in hipoxantina(fig. 62). In timpul replicarii aceste nucleobaze se imperecheaza cu adenina respectiv citozina ceea ce face ca in urmatoarea generatie sa se produca substitutiile GC AT respectiv AT GC. Azotitul de sodiu este de mult timp utilizat pentru conservarea carnii din carnaciori, salam, etc. Observarea faptului ca multi mutageni sunt cancerigeni, cum se va vedea mai jos, a condus la idea ca prepara-tele de carne cu nitriti sunt periculoase pentru om. Sprijinitorii conservarii carnii cu nitriti sunt, insa, de parere ca eliminarea acestui xenobiotic ar
putea conduce la consecinte si mai grave deoarece ar putea creste incidenta bolii fatale numite botulism datorata ingestiei neurotoxine-lor secretate de bacteria anaeroba Clostridium botulinum. Formaldehida realizeaza legaturi incrucisate in ADN, ARN si proteine. Hidroxil-amina reactioneaza cu citozina in ADN si da nas-tere unui derivat care se imperecheaza cu ade-nina cauzand astfel substitutia GC AT.
Mutagenii chimici prezentati au fost utili in descoperirea rolului jucat de tripletii de nucleobaze (codoni) in codul genetic.
Figura 62. Stanga: analogi ai nucleobazelor care produc substitutii in secventa catenelor ADN. 5-Bromuracilul, analog al timinei, se imperechiaza cu guanina. 2-Aminopurina, analog al adeninei, se imperecheaza cu citozina. Dreapta: reactia cu acidul azotos determina conversia (a) citozinei in uracil care se imperecheaza cu adenina; si (b) adeninei in hipoxantina care se imperecheaza cu citozina.
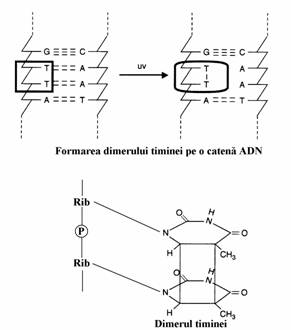
Sub actiunea luminii UV(200-400 nm) perechile de baze timina vecine dimerizeaza(fig. 63) iar structurile dimerice rezultate afecteaza conformatia ADN, inhiba transcriptia sau blo-cheaza replicarea pana cand activitatea repara-torie elimina dimerii timinei. Radiatiile ionizante cum sunt razele X si γ produc deschiderea nucle-elor purinice si ruperea legaturilor fosfodiesteri-ce.
Figura 63. Formarea dimerului timina-timina sub actiunea razelor ultraviolete. A = adenina; C = citozina; G = guanina; T = timina.
Mai multe substante mutagene pot cauza cancerul adica sunt cancerigene. Testul Ames serveste la determinarea potentialului cancerigen al substantelor, chiar daca acestea sunt rapid inactivate inca inainte de a interactiona cu ADN. Acest test utilizeaza o tulpina mutanta de Salmonella typhimurium care necesita histidina in mediul de cultivare. Aceasta tulpina revine cu o mica viteza la tipul normal('salbatic') care nu necesita histidina. Viteza acestui proces de reconversie este mult crescuta de prezenta unui mutagen. Mutagenicitatea unei substante este, deci, proportionala cu viteza de revenire la nor-mal a tulpinei de Salmonella.
Unele substante nu sunt mutagene in forma in care patrund in organism, ele sunt transformate in forme mutagene prin metabo-lizare in ficat. O serie de substante lipofilice care patrund in organism sunt hidroxilate sub actiunea unor sisteme enzimatice citP450 - dependente asociate la reticulul endoplasmatic din hepatocite. In acest fel ele devin hidrofile, usor excretabile. Deseori aceste modificari convertesc substantele nemutagene in compusi puternic mutageni. Testul Ames poate fi aplicat si acestor substante indirect mutagene. Pentru aceasta in mediul de cultura din stratul de agar se adauga extracte hepatice ce contin sisteme enzimatice detoxifica-toare citP450-dependente. Experienta a aratat ca in proportie de 80% substantele dovedite a fi cancerigene prin testare pe animale sunt mutagenice prin testul Ames. Furilamida, folosita ca aditiv antibacterian alimentar in anii 1960-70 in Japonia, a trecut cu bine 2 teste pe animale pana s-a descoperit ca este mutagenica. Substante cancerigene nu sunt numai cele produse indus-trial, unele pot fi naturale. Aflatoxina B1 (figura de mai jos), una din cele mai puternice substante cancerigene cunoscute, este produsa de mucega-iul care creste pe arahide si porumb.
Carnea fripta si painea prajita contin mai multi agenti care pot altera ADN. Se pare ca este indreptatita afirmatia lui Ames cu referire la cancerogeneza, 'natura nu este benigna'. Pe de alta parte, curbele doza-raspuns biologic, care se obtin prin testarea unui compus dat la mai multe concentratii, sunt liniare indicand faptul ca in mutageneza nu exista concentratii-prag.
1.10. Procese de reparare a ADN
ADN nu este o molecula inerta asa cum ar putea fi considerata din punctul de vedere naiv al stabilitatii genomului. Mediul celular reactiv, o multime de substante toxice, expunerea la radiatii UV pot cauza injurii chimice prin care nucleo-tidele sa fie excizate, bazele si scheletul fosfo-diesteric sa fie modificate. De exemplu, in conditii fiziologice cca 10.000 de legaturi fosfoesterice din genomul fiecarei celule umane sunt clivate prin hidroliza spontana in fiecare zi. Orice alterare a moleculelor de ADN trebuie sa fie inlaturata prin reparare pentru mentinerea integritatii mesajului genetic. Aceasta reparare este posibila deoarece informatia genetica a ADN are un caracter redundant. Principalele procese de reparare a ADN in E. coli sunt similare din punct de vedere chimic celor din celulele mamiferelor. Ele sunt de 3 tipuri:
reparare directa,
excizie-reparare,
recombinare.
1. Asa cum am vazut, radiatiile UV produc dimeri pirimidinici cum ar fi ditimina(fig. 63). Acesti dimeri pot fi reconvertiti in forma monomerica anterioara sub actiunea unei enzime numita ADN-fotoliaza care este activata de lumina vizibila din domeniul 400-600 nm. Acesta ar fi un mecanism de reparare directa. Tot in aceasta categorie poate fi inclusa si activitatea de corectare 'in spalt' a 5' 3' exonucleazei.
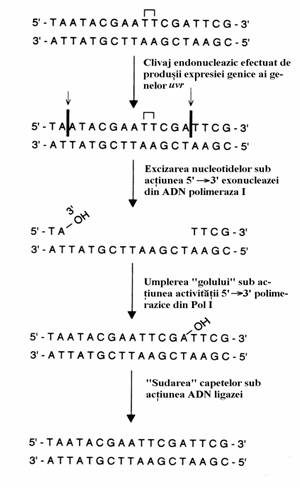
2. In ce priveste mecanismul excizie-reparare, in celulele procariote exista o familie multigenica numita gene uvr ai carei produsi recunoasc si excizeaza dimerii de timina printr-un proces care implica urmatorii pasi(fig. 64):
(i) descolacirea duplexului ADN la nivelul dime-
rului;
(ii) clivarea catenei de o parte si alta a dimerului
cu pana la 7 nucleotide;
(iii) digestia acestui segment sub actiunea 5'
exonucleazei din componenta polimerazei I;
(iv) activitatea 5' 3' polimerazice a Pol I umple
golul produs de exonucleaza iar o ligaza
'sudeaza' capetele.
Figura 6 Mecanismul excizie-reparare de eliminare a dimerului timina-timina la procariote.
O boala canceroasa a pielii omului, xeroder-ma pigmentosum, este o boala transmisa gene-tic, cauzata de deficitul de activitate 5' 3' exo-nucleazica. Pielea homozigotului este foarte sensibila la lumina solara, in special la razele ultraviolete. Cancerul se dezvolta in mai multe locuri ale organismului, pacientii mor inainte de 30 ani datorita metastazelor. Cercetarile efectuate pe culturi de fibroblaste au aratat ca, daca acestea sunt normale, jumatate din dimerii produsi de razele UV sunt excizati in mai putin de 24 ore. Din contra, nici un dimer de acest fel nu este excizat la fibroblastele provenite de la bolnavi cu xeroderma pigmentosum. Aceasta boala ne demonstreaza caracterul foarte impor-tant al proceselor de reparare a alterarilor ADN. Un alt exemplu de reparare prin excizie-reparare a ADN alterat este cel realizat de ADN glicozilaze im-preuna cu alte enzime celulare. Bazele ADN pot fi modificate prin reactii care au loc in conditii fiziologice sub actiunea unor agenti din mediu. Spre exemplu adenina si citozina se pot deamina spontan cu viteze finite pentru a rezulta hipoxan-tina respectiv uracilul. S-adenozilmetionina poate metila neenzimatic o nucleobaza purinica pentru a rezulta 3-metil-adenina sau 7-metilguanina. Razele ionizante pot deschide ciclurile nucleoba-zelor. Toate aceste transformari determina modi-ficarea proprietatilor de imperechere a nucleo-bazelor normale. Celulele contin o clasa de ADN glicozilaze care pot cliva legatura N-glicozidica a nucleotidelor alterate prin transformarile aratate mai sus. Prin aceasta deoxiriboza ramasa in structura catenei de ADN constituie asa-zisele centre apurinice sau apiri-midinice(AP) (fig. 65). Acestea pot fi eliminate impreuna cu mai multe nucleotide adiacente sub actiunea AP endonucleazelor si a activitatilor exonucleazice ale polimerazelor. 'Golul' ramas este umplut de activitatea polimerazelor si a ADN ligazei.
Figura
65. ADN glicozilazele hidrolizeaza
legaturile N-glicozidice ale nucleobazelor alterate pentru a produce
centre AP. Pu= baza purinica 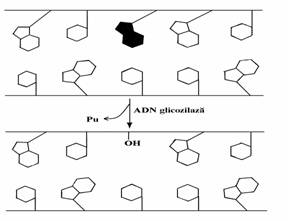
3. ADN alterat poate suferi replicare inainte ca leziunea sa fie eliminata prin mecanismele de reparare directa sau excizie-reparare. Replicarea ADN care contine un dimer pirimidinic(timina-timina) este intrerupta de aceasta distorsiune a catenei matrice si reinitiata in aval de dimerul perturbator. Rezulta, deci, o catena fiica care contine un 'gol' in dreptul dimerului. Aceasta leziune genetica nu poate fi eliminata prin excizie-reparare deoarece acest mecanism este posibil doar pe catene intacte, fara 'goluri'. Totusi, aceasta catena intacta exista in duplexul construit la aceiasi bifurcatie prin replicarea catenei complementare si leziunea poate fi corec-tata printr-un proces numit reparare post-repli-care sau recombinare. Acest proces consta in transferul unui oligonucleotid de la duplexul fiica normal la duplexul fiica care contine 'golul'.
Acest gol nu poate fi umplut deoarece catena mama contine la acel nivel dimerul pirimidinic. In continuare noul 'gol' creat poate fi umplut prin actiunea 5' 3' polimerazei deoarece catena matrice a acestui duplex este intacta. Global, acest mecanism permite replicarea duplexului mama cu formarea a 2 duplexuri fiica, unul 'reparat' si celalalt identic lezat ca si duplexul mama. Exista alternativa ca dimerul T-T din acest duplex fiica sa fie eliminat prin fotoreacti-vare cu ADN-fotoliaza sau prin excizie-reparare. In figura 66 sunt prezentate etapele repararii prin recombinare.
Figura 66. Repararea prin recombinare a catenei ADN care contine dimer pirimidinic(timina-timina).
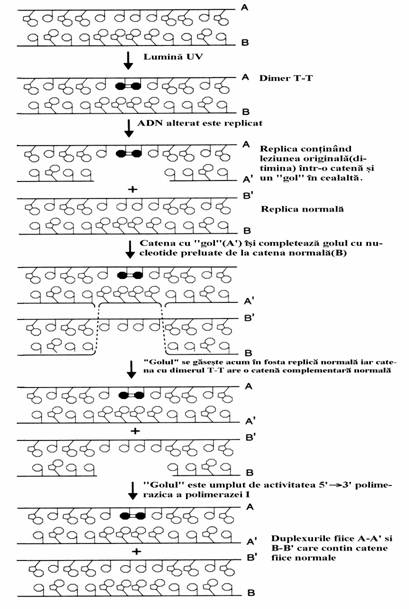
Exista multe asemanari intre repararea prin recombinare si recombinarea generala (genetica). Ambele procese sunt mediate in E. coli de catre proteina RecA, o nucleaza de 38 kDa care catalizeaza schimbul segmentelor omo-loage de ADN intre duplexurile surori. Celulele de E. coli care contin forme mutante, nefunc-tionale, ale genei recA sunt incapabile de reparare prin recombinare si de recombinare genetica. Ele sunt extrem de sensibile la razele UV. In general, recombinarea este un proces in care are loc transferul unor segmente oligonucleotidice omo-loage intre doua molecule de ADN. Cercetari genetice si citologice au aratat ca aceste procese de incrucisare se petrec in organismele superi-oare in timpul meiozei. Meioza este un tip special de diviziune celulara prin care se produc ovule si spermatozoizi prin diminuarea materialului gene-tic. Ea cuprinde doua diviziuni nucleare succe-sive dintre care numai una implica replicarea ADN si prin care pornindu-se de la o celula initiala diploida se ajunge la 4 celule fiice haplo-ide. Bacteriile, care in mod normal sunt celule haploide, au elaborat si ele mecanisme de schimb a informatiei genetice. Ele pot dobandi ADN strain prin conjugare, transductie si transfor-mare. In toate aceste procese ADN strain se instaleaza in cromozomul recipient (gazda) sau in plasmida prin recombinare generala. Pentru a putea fi propagata informatia ADN strain trebuie ca el sa apartina unui replicon, adica sa fie asociat la o origine a replicarii cromozomului, plasmidei sau virusului. Aceste notiuni vor fi dezvoltate in cadrul disciplinelor de genetica moleculara si biologie celulara.
1.12. Tehnologia ADN recombinant. Clonarea
In sens biologic, notiunea de clona se re-fera la celule cu genotip identic. In tehnologia ADN recombinant o clona se refera la celule identice care contin in genotip aceiasi molecula de ADN recombinant. Strategia clonarii este prezentata in figura 67. Primul pas al clonarii este obtinerea unei molecule recombinante care sa fie inserata sau clonata intr-o celula gazda potrivita. Vectorii de clonare pot fi plasmide bacteriene sau bacteriofagi. Plasmidele contin propria origine si se pot replica in celula bacteriana gazda. Ele pot contine gene care codifica proteine care confera celulei gazda rezistenta la antibiotice. Genele care codifica rezistenta la antibiotice sunt markeri selectabili.
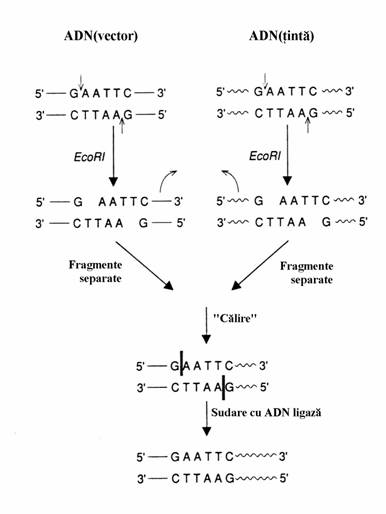
Insertia vectorului de clonare in molecula de ADN tinta se bazeaza pe manipularile prezentate in figura 68.
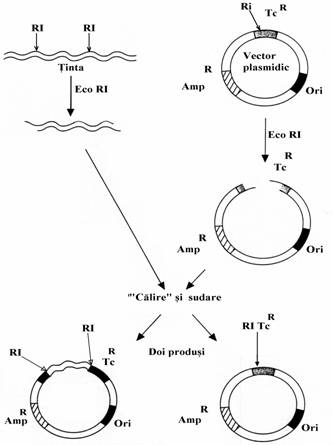
Figura 67. Strategia clonarii. O molecula de ADN recombinant se formeaza cu un vector de clonare si o molecula de ADN tinta prin 'calire' si sudare. Molecula de ADN recombinant se introduce intr-o celula gazda prin transformare sau transfectie. Propa-garea (multiplicarea) moleculei are loc in celula gazda. Prezenta unui vector de clonare in celula gazda este detectata pe baza rezistentei la antibiotice pe care acesta o confera celulei gazda. ADN tinta este selectat prin hibridizare.
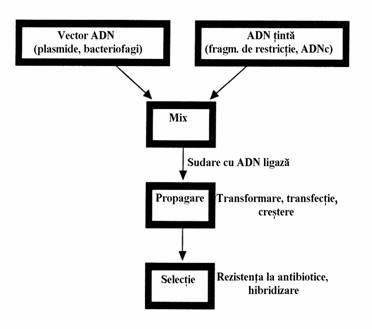
Figura 68. Formarea unei molecule de ADN recom-binant. Fragmentele de ADN din cele doua surse se pot obtine prin clivaj cu aceiasi endonucleaza de restrictie(EcoRI). Capetele lor sunt complementare ceea ce permite sa fie 'calite' la temperatura scazuta si sudate cu ADN ligaza
Clonarea plasmidelor este prezentata schematic in figura 69. Activarea insertionala permite sa se distinga intre un vector care a revenit la structura sa circulara normala si nu contine un ADN tinta si un vector care contine ADN tinta inserat. Plasmidele ar putea contine gene pentru 2 markeri selectabili diferiti, de exemplu rezistenta la ampicilina si rezistenta la tetraciclina. Locusul de insertie, adica locusul de clonare pentru ADN tinta, ar putea fi in una din genele marker selecta-
bile, de exemplu in gena rezistentei la tetraci-clina. Clonele care contin ADN inserat, adica cu gena pentru rezistenta la tetraciclina 'intrerupta', vor fi sensibile la tetraciclina, in timp ce celelalte care au revenit la forma normala(nu contin ADN inserat) raman rezistente la tetraciclina. Prin clo-nare cu plasmide se pot obtine usor si in cantitati mari medicamente de tip polipeptidic, de exem-plu insulina, prin simpla cultivare pe medii adec-vate a celulelor transformate cu vector de clonare care contine inserata gena care codifica insulina.
Figura 69. Clonarea unui fragment tinta de ADN, obtinut prin clivaj cu EcoRI, in locusul creat prin clivaj tot cu EcoRI intr-un vector plasmidic. Acest vector contine doua gene: una care codifica rezistenta la tetraciclina(TcR), care contine locusul de clonare creat prin clivaj cu EcoRI si o alta care codifica rezis-tenta la ampicilina(AmpR). Vectorul contine o origine a replicarii(Ori). Dupa 'calirea' si sudarea unui amestec de vector cu ADN tinta, vectorul poate sa contina sau sa nu contina ADN tinta inserat. Celulele gazda transformate cu un vector care contine ADN tinta sunt rezistente la ampicilina dar sensibile la tetraciclina deoarece gena care codifica rezistenta la tetraciclina a fost alterata prin insertia ADN tinta (activare insertionala). Celulele gazda transformate cu un vector revenit la forma normala(fara ADN tinta) sunt rezistente atat la ampicilina cat si la tetraciclina.
2. Transcriptia
Transcriptia este procesul de sinteza a ARN pe o matrice de ADN si ea are 3 faze: initi-erea, elongarea si terminarea.
2.1. Initierea transcriptiei
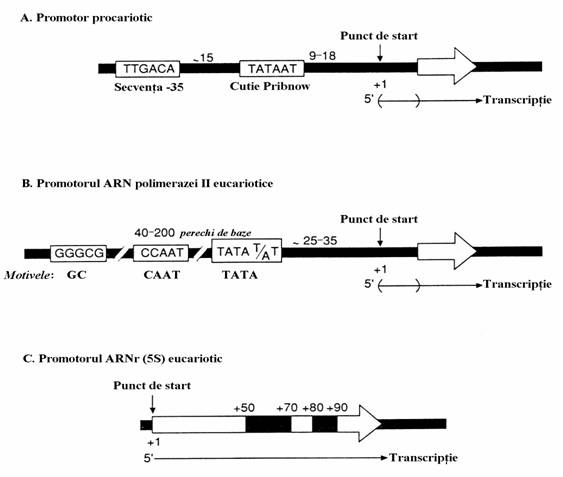
Spre deosebire de replicare, initierea trans-criptiei nu necesita un primer. Asa-numitele gene promotoare (promotori) determina ARN polimeraza ADN-dependenta (transcriptaza), enzima descoperita independent de Samuel Weiss si Jerard Hurwitz in 1960, care catalizeaza sinteza ARN, sa initieze transcriptia intr-un anumit punct. La procariote secventele promotoare sunt gene constituite din 3 elemente(fig. 70):
(i) punctul de initire sau pozitia 1 a genei este intotdeauna o purina, in special adenina, care corespunde capatului 5' al catenei de ARN care se sintetizeaza;
(ii) "cutia' lui Pribnow (David Prib-now, 1975) care este de obicei o secventa de 10 perechi de baze numita si "secventa -10"). Sem-nul minus indica situarea ei in amonte de punctul de start. Motivul acestei secvente este TATAAT
(iii) secventa-35, care este formata din 35 perechi de baze. Motivul ei este TTGACA
Holoenzima ARN polimerazei de E. coli, adica forma functionala, oligomerica a acesteia, are compozitia α2ββ'σ si este una din cele mai mari enzime solubile, ~ 100Å in diametru, vizi-bila la microscopul electronic. Ea se asociaza la promotor care este recunoscut de protomerul (factorul) σ al ei. Dupa initierea transcriptiei fac-torul de initiere σ se disociaza de miezul enzimei α2ββ') care, in continuare, catalizeaza procesul de polimerizare a ARN. Factorul σ se poate asocia la alt complex miez-ADN-ARN pentru a initia un nou punct de transcriptie.
La eucariote sunt 3 tipuri de ARN polimeraze, I, II si III(tab. 6) care difera prin sensibilitatea fata de α-amanitina (vezi mai jos), localizare si natura ARN a caror sinteza o catali-zeaza.
Tabelul 6. ARN polimeraze nucleare eucariotice. Indicii inferiori t, nh, r si nm semnifica 'de transport', 'nuclear heterogen', 'ribozomal' respectiv 'nuclear mic'. S este simbolul unitatilor de sedimentare in camp centrifugal(Svedberg).
|
Tipul polimerazei |
Sensibilitatea la α-amanitina |
Localizare |
Produsii transcriptiei |
|
I |
insensibila |
nucleol |
ARNr(45S) |
|
II |
foarte sensibila la nivele mici |
nucleoplasma |
ARNnh, ARNm, ARNnm |
|
III |
sensibila la nivele mari |
nucleoplasma |
ARNt, ARNr(5S,7S), ARNnm |
Promotorii utilizati de polimerazele I si II sunt similari celor din procariote prin aceea ca ei sunt situati in amonte de punctul de initiere. Promo-torii folositi de polimeraza III sunt aparte deoa-rece ei se situeaza in aval(+) de punctul de start.
(i) punctul de start este, ca si la procario-te, o purina;
(ii) in timp ce, ca si la procariote, la eucariote exista un singur tip de promotor pentru polimeraza I, pentru polimeraza II exista o multi-tudine de promotori. Totusi, acesti promotori au secvente comune(fig. 70), este vorba de motivele TATA CAAT si GC
(iii) datorita diversitatii lor, promotorii polimerazei III initiaza sinteza mai multor tipuri de ARN. Astfel, promotorul pentru sinteza ARNt (5S) este format din doua secvente, una cu perechile de baze de la pozitia 50 la 70 si cealalta cu bazele 80-90, ambele situate in aval(+) fata de punctul de start (fig. 70). Un alt exemplu il constituie promotorii pentru ARNt cu secventele de baze +8 +30 si +50
Figura 70. Secvente promotoare din structura ADN procariotic si eucariotic. Secventele conservate (comune) sunt indicate cu initialele bazelor unei singure catene din duplexul ADN. (A) Promotorul procariotic. (B) Un promotor tipic al ARN polimerazei II la eucariote. (C) Un promotor al ARN polimerazei III eucariotice care initiaza sinteza ARNr (5S). Pe duplexul ADN este indicat numarul de perechi de baze din structura unor segmente ale promotorilor. Prin semnul (+) este indicata pozitia in aval, fata de punctul de start, a perechilor de baze promotoare. In cazul promotorilor (A) si (B) punctul de start precede regiunile care codifica ARN ce se sintetizeaza, de aceea acest ARN are la capatul 5' o regiune necodificata. Sagetile albe incorporate in duplexul ADN indica capetele 3' ale segmentelor de ADN care codifica transcriptia.
Daca la procariote am intalnit doar factorul de initiere σ, la eucariote initierea necesita cel putin 4 factori plus ARN polimeraza II cu care sa poata fi initiata transcriptia de la promotorii cu motivul TATA. Cei 4 factori de initiere a transcriptiei sunt IIA, IIB, IID si IIE. Si polimerazele I si III necesita factori specifici pentru initierea trans-criptiei.
2.1.1. Inhibitia initierii transcriptiei
Exista putine medicamente care afecteaza numai transcriptia, cele mai multe interactioneaza direct cu ADN cum am vazut ca sunt intercalatori ca acridinele si glicozidele antraci-cline. Rifamicina B, produsa de Streptomyces mediterranei si derivatul sau de semisinteza, rifampicina, sunt importanti agenti antibacte-rieni. Rifamicina B se asociaza la subunitatea β a holoenzimei ARN polimerazei si inhiba specific initierea transcriptiei(nu si elongarea). Ea nu are efect asupra ARN polimerazelor eucariotice.
2.2. Elongarea catenei de ARN
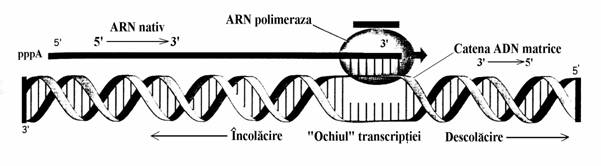
Mecanismul elongarii ARN este, in linii mari, acelasi la procariote si eucariote. Matricea sintezei este o catena ADN iar substraturile sunt cei 4 ribonucleozid trifosfati, ATP, GTP, CTP si UTP. Directia sintezei ARN este 5' 3', acest lucru fiind dedus din cercetarile facute cu nucleotide marcate cu 32P si din folosirea cordicepinei, un antibiotic analog al adenozinei care inhiba sinteza ARN bacterian. Diferenta structurala fata de adenozina este lipsa gruparii hidroxil in pozitia 3' a ribozei, datorita careia cordicepina impiedica elongarea ARN in sensul 5' 3' daca nucleozidul este incorporat la capatul 3' al acestuia. Actiunea antibiotica a lui confirma acest sens de elongare. Mecanismul chimic elementar al elongarii(fig. 71) este similar cu cel prezentat la replicare. Elongarea ARN necesita ca duplexul ADN sa se deschida pentru ca una din catenele sale, catena matrice, sa poata fi trans-crisa. Pentru aceasta catena nativa de ARN trebuie sa formeze un scurt duplex hibrid ADN-ARN. Complexul de initiere al transcriptiei, polimeraza-ADN-ARN, se formeaza la nivelul 'ochiului' rezultat prin deschiderea duplexului ADN(fig. 72).
Figura 71. Cresterea in sensul 5' 3' a catenei ARN prin atacul capatului 3' al acesteia de catre un ribonucleozid trifosfat.
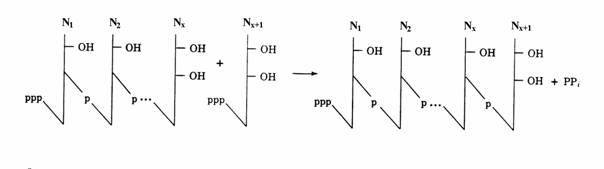
Figura 72. Mecanismul elongarii ARN in cursul transcriptiei. In regiunea care contine gena ce se transcrie dublu helixul ADN se descolaceste cca. o spira pentru a permite catenei transcriptibile sa-si expuna bazele si sa formeze un scurt dublu helix hibrid ADN-ARN. Pe masura ce polimeraza avansea-za de-a lungul catenei matrice de ADN(in figura de la stanga catre dreapta) duplexul ADN se descolaceste in dreptul capatului 3' al ARN nativ si apoi se incolaceste eliberand catena de ARN nativ din duple-xul hibrid.
In vivo viteza transcriptiei in E. coli este de 20-50 nucleotide/secunda la 370C. De indata ce o mole-cula de polimeraza a initiat transcriptia si s-a deplasat inainte pornind de la nivelul promotoru-lui, o alta molecula de polimeraza o poate urma. Sinteza ARN care este solicitat de celule in canti-tati mari, spre exemplu ARNr, este initiata pe cat posibil mai des, in jur de una pe secunda. Frecventa erorilor de sinteza a ARN este de cca 1:104 nucleotide. Aceasta rata de eroare este tolerabila datorita faptului ca mai multe gene sunt transcrise in mod repetat, ca codul genetic contine multe sinonime si, in plus, numeroase substitutii de aminoacizi datorate acestor erori, sunt inofensive.
2.2.1. Inhibitia elongarii
Reprezentant al amatoxinelor, octapep-tidul biciclic α-amanitina(figura alaturata din ciuperca otravitoare Amanita
phalloides, raspun-zatoare de majoritatea otravirilor fatale
cu ciuperci, formeaza cu polimeraza II un strans complex 1:1 (K=10-8 M) iar cu polimeraza III unul mai slab (K=10-6
M) si in acest fel blocheaza specific elongarea ARN. In ciuda toxicitatii foarte mari a
amatoxinelor(5-6 mg de α-amani-tina, care se gasesc in cca. 40 g
de ciuperca proaspata, sunt suficiente pentru a ucide un om
adult), ele actioneaza lent. Moartea, datorata de obicei afectarii
ficatului, survine dupa mai multe zile de la data ingestiei ciupercilor.
Aceasta intar-ziere reflecta turnover-ul lent al ARNm
si proteinelor. 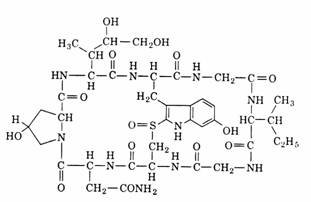
2.3. Incheierea transcriptiei
La procariote exista doua cai prin care este incheiata transcriptia:
(i) anumite secvente ale ADN pot determina terminarea transcriptiei. Aceste sec-vente au cateva caracteristici cum este prezenta unei regiuni palindrom bogata in perechi de baze G+C urmata de perechi A+T(cu A pe catena matrice). Secventa ARN, rezultata prin trans-criptia acestei regiuni, are tendinta de a se curba in forma de 'agrafa' in care bazele formeaza un sir de perechi G+C intramoleculare foarte stabile (ARN-ARN) urmat de un sir de perechi A+U intermoleculare slabe(ADN-ARN) (fig. 73).
Figura 73. Incheierea transcriptiei independenta de factorul ρ. In timpul pauzei din activitatea ARN polimerazei are loc formarea curburilor 'agrafa'
stabilizate de legaturile de hidrogen dintre perechile G+C si desprinderea ARN nativ de complexul polime-raza-ADN-ARN.
In timpul transcrierii acestei regiuni polimeraza face pauze de ordinul mai multor secunde. Incheierea transcriptiei devine favorabila in timpul acestor pause cand curburile 'agrafa' induc deplasarea ARN de pe catena matrice de ADN iar legaturile slabe dintre perechile A+U permit desprinderea ARN nativ de pe catena ADN matrice. Natura acestui mecanism explica de ce nu exista anumite baze care sa incheie transcriptia, spre deosebire de translatie unde vom vedea ca exista codoni specifici care incheie acest proces. Adica diferite molecule de ARN nativ au un numar diferit de resturi de uracil la capatul 3'.
ii) exista o enzina numita factorul ρ care capaciteaza anumite secvente de duplex ADN, care nu par a prezenta regularitati structurale, sa incheie transcriptia. Factorul ρ catalizeaza desco-lacirea duplexurilor ADN-ARN si ARN-ARN pe seama energiei furnizate de hidroliza ATP (acti-vitate ATP-azica). La eucariote mecanismul in-cheierii transcriptiei este mai putin cunoscut. Ea este corelata cu regiunile poliadenilate din ARN rezultat.
2. Reglarea transcriptiei la proca-riote
Celulele procariote raspund la modifica-rile bruste ale mediului inconjurator cum ar fi influxul de substante nutritive, prin inducerea sintezei unor proteine. Aceste raspunsuri au loc dupa doar cateva minute de la producerea modificarilor deoarece transcriptia si translatia la procariote sunt strans cuplate. Ribozomii incep translatia aproape de capatul 5' al ARNm nativ dupa ce acesta s-a desprins de ARN polimeraza. In plus, mai multe molecule de ARNm sunt degradate enzimatic la 1-3 minute de la sinteza lor, in acest fel fiind eliminata sinteza proteinelor care nu mai sunt necesare dupa producerea modificarilor de mediu. La celulele eucariote inductia unor noi proteine necesita ore sau zile deoarece transcriptia are loc in nucleu iar ARNm rezultat trebuie sa fie transportat in citoplasma unde are loc translatia.
Unele proteine sunt necesare tot timpul indiferent de conditiile de mediu si genele lor sunt exprimate in mod constant in aproape toate speciile celulare din organism. Ca exemple sunt enzimele care catalizeaza etape ale cailor centrale ale metabolismului, cum sunt cele ale ciclului citric. Genele cere codifica aceste proteine se nu-mesc gene constitutive. Produsii acestor gene sunt de obicei in concentratii relativ mici si constante. Proteinele induse de modificarile me-diului sunt codificate de genele inductibile sub actiunea unor substante specifice numite induc-tori.
E.coli nu utilizeaza lactoza daca mediul contine suficienta glucoza, principala sursa de atomi de carbon a celulei microbiene. Aceasta celula, situata intr-un mediu cu glucoza, contine doar cateva copii ale b-galactozidazei, enzima catabolica care cliveaza lactoza in glucoza si galactoza. Plasata intr-un mediu de cultura care contine doar lactoza ca sursa de atomi de carbon, celula de E. Coli va incepe sa sintetizeze imediat cantitati de sute de ori mai mari de b-galacto-zidaza, enzima indusa de schimbarea conditiilor de mediu ale celulei. Acest model experimental a stat la baza unui stralucit studiu, prin simplitate si ingeniozitate, efectuat de doi cercetatori de la Institutul Pasteur din Paris, François Jacob si Jacques Monod, din a carui rezultate ei au elabo-rat teoria operonului lac [F. Jacob, J. Monod, Genetic regulatory mechanisms in the synthesis of proteins, J. Mol. Biol., 3:318-356, 1961] a controlului genetic al biosintezei proteice la procariote. Aceasta le-a adus premiul Nobel pentru fiziologie si medicina in 1965.
2.1. Operonul lac
Odata cu b-galactozidaza sunt si alte enzime cum sunt galactozid permeaza, o enzima asociata la membrana plasmatica a bacteriei implicata in transportul lactozei si altor galac-tozide catre interiorul acesteia si tiogalactozid transacetilaza, o enzima care catalizeaza trans-ferul in vitro a unei grupari acetil de la acetil-CoA la gruparea hidroxil a atomului de carbon 6' al unui tiogalactozid. Functia in vivo a acestei transacetilaze inca nu este cunoscuta.
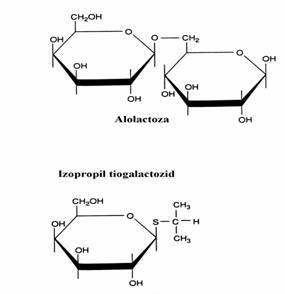
Inductorul b-galactozidazei, permeazei si transacetilazei s-a crezut initial ca este insasi lactoza din mediul de cultura. Totusi, s-a vazut ca inductorul natural este alolactoza, un izomer al lactozei care se formeaza in cursul hidrolizei lactozei sub actiunea celor cateva molecule de b-galactozidaza, prezente in celulele bacteriene neinduse. Unele galactozide, cum ar fi izopropil tiogalactozidul, sunt inductori puternici ai enzimei fara a fi substraturi pentru aceasta. Acest tip de inductori sunt supranumiti inductori "gra-tuiti".
Prin definitie, un operon este un grup de gene reglate coordonat ale caror produsi catali-zeaza o cale metabolica multienzimatica. In cazul operonului lac enzimele(b-galactozidaza si per-meaza) sunt necesare metabolizarii lactozei. Acesti produsi sunt rezultatul expresiei genelor structurale din cadrul operonului, ei fiind enzime sau molecule de structura cum sunt ARNr, proteine ribozomale. O alta categorie este cea a genelor reglatoare care, in ciuda faptului ca sunt situate departe de genele structurale pe care le controleaza, sunt elemente cheie ale ope-ronilor. Operonul lac este o regiune a ADN din genom care contine:
a. Trei gene structurale: lacZ care codifica b-galactozidaza, lacY pentru permeaza si lacA pentru transacetilaza.
b. O gena promotoare(promotor) care initiaza transcriptia(vezi mai sus). Genele structurale enumerate sunt rezultatul unui mesaj policistronic al acestui promotor comun.
c. O gena operatoare(operator) situata in vecinatatea promotorului.
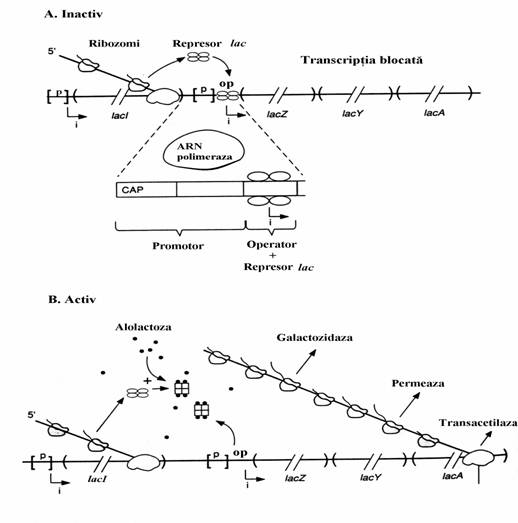
O proteina reglatoare numita represor lac este strans asociata(Kd = 10-13 M) la operator si blocheaza initierea transcriptiei genelor structurale prin stanjenirea asocierii ARN polimerazei la promotor. Proteina este un produs difuzibil al genei lacI, a carei secventa ADN este vecina cu operonul lac si care are propriul ei promotor. Gena lacI este constitutiva, expresia ei mentinand represorul la nivele foarte mici, totusi suficiente pentru reglarea operonului lac. Adica, in absenta lactozei celula bacteriana nu are nevoie de b-galactozidaza si permeaza iar repre-sorul lac impiedica exprimarea genica a opero-nului lac. Aceasta reglare este, prin urmare, una de tip negativ.
Prezenta inductorului, alolactoza sau izopropil tiogalactozidul, diminueaza reglarea negativa exercitata de represor. Prin asocierea inductorului la represor, acesta din urma sufera o modificare conformationala datorita careia el se desprinde de operator si, in consecinta, ARN polimeraza initiaza transcriptia genelor structu-rale. Avand in vedere ca celulele procariote nu dispun de membrana nucleara, transcriptia si translatia sunt cuplate. Ribozomii se asociaza la ARNm policistronic(ARNm lac) si initiaza trans-latia chiar inainte ca transcriptia operonului lac sa se fi incheiat. Cistronii lacZ, lacY si lacA sunt translatati independent, fiecare dispunand de propriul codon de incheiere(vezi la translatie). Atata timp cat lactoza este prezenta, ca unica sur-sa de atomi de carbon, inductorul este prezent si transcriptia operonului continua. Imediat dupa indepartarea inductorului exprimarea operonului inceteaza deoarece, asa cum este cazul celor mai multi ARNm procariotici, ARNm lac este instabil si dispare in cateva minute.
Sumarizand cele aratate putem spune ca operonul lac este inductibil si reglat negativ. Acest operon mai suporta un tip de reglare, reglarea pozitiva, adica exista o proteina reglatoare care, spre deosebire de represorul lac, intensifica transcriptia genelor structurale ale acestui operon. Aceasta proteina, numita CAP (catabolite activator protein), in asociere cu AMPc stimuleaza transcriptia operonilor catabo-lici, adica a operonilor care controleaza sinteza enzimelor catabolice(inclusiv operonul lac).
Complexul AMPc-CAP se asociaza la o secventa ADN din vecinatatea promotorului operonului, secventa numita centru de legare a CAP, si permite asocierea ARN polimerazei la promotor pentru initierea transcriptiei. In absenta AMPc, CAP nu se poate asocia la acel centru si initierea transcriptiei de la nivelul promotorului este foarte scazuta. Este de mentionat faptul ca, printr-un mecanism inca neclar, nivelul AMPc este invers proportional cu nivelul glucozei. In concluzie, pentru ca transcriptia operonului lac sa poata fi initiata trebuie ca in cultura microbiana de E. Coli concentratia lactozei sa fie semnifi-cativa iar glucoza sa fie prezenta in cantitati neglijabile. Lactoza produce alolactoza care dereprima operatorul iar nivelul scazut al gluco-zei determina nivelul crescut al AMPc care susti-ne asocierea CAP la centrul sau de legare si initi-erea transcriptiei. Numai satisfacerea simultana a acestor 2 conditii permite inceperea transcriptiei. In figura 74 este prezentat operonul lac in cele doua stari ale sale, inactiva si activa.
Figura 7 Starile operonului lac. In ambele imagini(A si B) apar genele structurale(lacZ, lacY si lacA), gena reglatoare lacI, promotorul([p]) si operatorul(op). Cistronii operonului lac sunt delimi-tati prin paranteze rotunde. Locurile in care se initia-za transcriptia sunt indicate de sagetile frante(i). Sinteza proteica a represorului, codificata de gena lacI, cat si a enzimelor codificate de genele structu-rale, este reprezentata prin linii(ARNm) la care sunt asociate particule ribozomale. Represorul lac, prote-ina tetramerica, apare in stare neasociata cat si aso-ciata cu moleculele de alolactoza(.). (A) In stare inac-tiva operonul lac contine represorul asociat la opera-tor, ceea ce impiedica legarea ARN polimerazei la promotor si initierea transcriptiei genelor structu-rale. Sagetile curbate indica deplasarea acestuia de la nivelul masinariei de biosinteza(ARNm, ribozomi) la nivelul operatorului. Secventa ADN cu rol de centru de legare a CAP, notata prescurtat (CAP) este plasat in structura promotorului (segmentul marit al opero-nului). (B) Starea activa a operonului rezulta ca ur-mare a asocierii inductorului (alolactoza) la represor si desprinderea acestuia de pe operator. In conse-cinta ARN polimeraza produce un ARNm policistronic care este translatat pentru a rezulta β-galactozidaza, galactozid permeaza si tiogalactozid transacetilaza.
2.2. Operonul araBAD
L-Arabinoza, glucid vegetal, poate fi si ea folosita de bacterii ca sursa de atomi de carbon in locul glucozei. Oamenii nu metabolizeaza si nici nu absorb aceasta pentoza. Prin urmare celulele de E. coli prezente in intestinul uman sunt periodic participante la 'banchetul' acestei pentoze. Operonul arabinozei este inductibil si reglat pozitiv si negativ de catre aceiasi proteina. Enzimele si genele structurale ale operonului ara care le codifica sunt arabinozo izomeraza (araA), ribulozo kinaza (araB) si ribulozo 5-fosfat epimeraza (araD) (fig.75). Proteina regla-toare este proteina AraC, produs al genei regla-toare araC. Aceasta proteina regleaza negativ expresia operonului araBAD in absenta arabi-nozei din mediul de cultura si o regleaza pozitiv in prezenta pentozei. Operonul araBAD contine doua regiuni operatoare (nu una ca in operonul lac), araO1 si araO2. In plus exista doua centre de legare a proteinei AraC, araI1 si araI2. Mai exista centrul de legare a CAP.
Figura 75. Harta genetica a operonilor araBAD si araC din E. Coli.
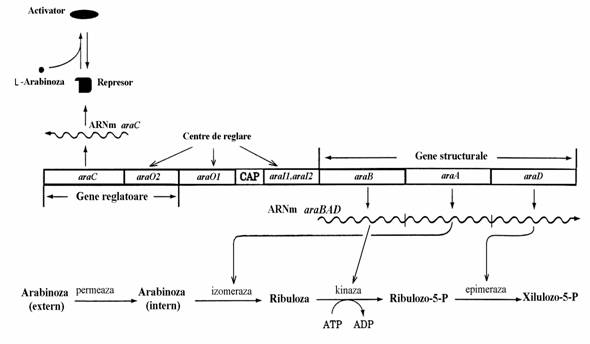
In functie de moleculele cu care se asociaza, proteina AraC adopta diferite conformatii care interactioneaza cu diferite elemente reglatoare ale operonului. Reglarea negativa se realizeaza in absenta arabinozei, cand o molecula de proteina AraC se asociaza la araI1 iar o alta se asociaza la araO2. Aceste molecule interactioneaza si intre ele determinand ca ADN sa formeze o ansa care inhiba transcriptia. Reglarea pozitiva se realizea-za in prezenta arabinozei cand pentoza se asocia-za la proteina AraC determinand-o sa adopte o conformatie care se stabilizeaza prin asociere la araI1 si araI2. In plus, moleculele complexului arabinoza - AraC realizeaza o punte intre regiu-nile araO1 si araO2. In acest fel este stimulata transcriptia genei araC si intensificarea productiei de proteina AraC. Formarea comple-xului AMPc-CAP-ADN, in absenta glucozei ca si la operonul lac, in combinatie cu formarea com-plexului arabinoza - AraC - araI si a puntii araO1 - araO2, permite initierea transcriptiei (fig. 76).
Figura 76. Starile operonului araBAD. In ambele imagini(A si B) apar genele structurale(araB, ara A si araD) care codifica transformarea arabinozei in xilulozo-5-P. In structura operonului exista 4 elemente reglatoare: regiunile operatoare araO1 si araO2 si inductoare, araI1 si araI2. Cu aceste regiuni interac-tioneaza proteina reglatoare AraC care poate contine asociate molecule de arabinoza. (A) In starea inactiva a operonului araBAD, moleculele dimerilor proteinei AraC se asociaza la araI1 si araO2 si prin aceasta blocheaza transcriptia.(B) In prezenta arabinozei, dimerii proteinei AraC formeaza complexe cu molecule de pentoza care le schimba conformatia si se asociaza la toate elementele reglatoare, ceea ce stimuleaza transcriptia genei araC si intensificarea sintezei proteinei AraC. In conditiile unui nivel ridicat al proteinei AraC, formarea complexului AMPc-CAP-ADN la nivelul centrului de legare a CAP creaza conditiile ca proteina AraC cu arabinoza sa induca transcriptia operonului araBAD.
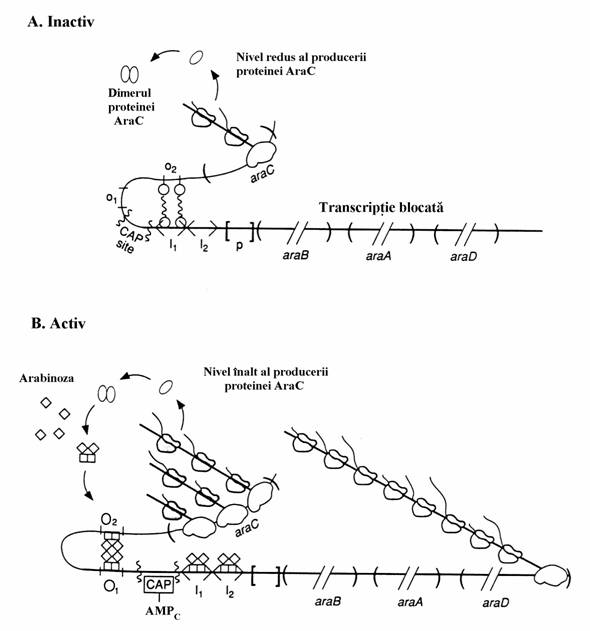
Operonul trp si alti operoni ai biosintezei aminoacizilor sunt reglati prin alt mecanism. Bacteriile pot sintetiza toti cei 20 de aminoacizi proteinogeni insa o fac in mod economicos. Ge-nele care codifica enzimele implicate in sinteza mai multor aminoacizi sunt continute in operoni represibili reglati negativ iar aminoacizii produsi de interventia acestor enzime functioneaza drept corepresori ai acestor operoni. Trasatura carac-teristica a acestei reglari este atenuarea trans-criptionala. In cazul operonului trp aceasta in-seamna ca la concentratii mici de triptofan ope-ronul produce intregul ARNm care codifica enzi-mele necesare sintezei Trp, iar la concentratii mari de triptofan transcriptia este prematur inche-iata.
3. Translatia
Translatia este biosinteza polipeptidelor si proteinelor, dirijata de ARNm. In ciuda faptului ca reactia de formare a legaturii peptidice este relativ simpla, translatia este un proces complex care implica participarea coor-donata a peste 100 de macromolecule (proteine, acizi nucleici).
3.1. Codul genetic
O secventa de baze din structura unei catene de ADN poate determina o secventa de aminoacizi din structura unei catene proteice in mai multe moduri imaginabile. Pentru ca numai cele 4 nucleobaze sa codifice cei 20 de amino-acizi proteinogeni, teoretic este necesara gruparea a cate cel putin 3 baze. In adevar, gruparea a cate 2 baze ar constitui in total 42 = 16 dubleti, insuficient pentru a codifica toti aminoacizii. Gruparea a cate 3 baze, ceea ce constituie 43 = 64 tripleti, acopera necesarul de 'cuvinte' nucleobazice care sa 'denumeasca' fiecare aminoacid, chiar mai mult. 'Excesul de cuvinte' determina caracterul degenerat al codului genetic. Un grup de 3 baze se numeste codon(tab. 7). Un mister este modul in care masinaria de biosinteza a unui polipeptid grupeaza in codoni secventa continua de baze a ARNm. De exemplu, codul ar putea sa faca o acoperire topologica. Adica, in secventa de baze: ABCDEFGHIJ, ABC ar putea codifica un aminoacid, BCD sa codifice al doilea aminoacid, CDE sa-l codifice pe al treilea, s.a.m.d. Sau sa nu faca o acoperire topologica, adica tripletii de baze care specifica in ordine aminoacizii sunt: ABC, EFG, HIJ, s.a.m.d. Codul ar putea sa contina 'semne de punctuatie', dupa cum urmeaza: ABC,DEF,GHI, de exemplu virgule care sa reprezinte baze sau secvente de baze. O intrebare este, cum poate specifica codul genetic inceputul si sfarsitul unei catene polipeptidice? In prezent se cunoaste faptul ca,
Codul genetic este degenerat, neacoperitor topo-logic, fara semne de punctuatie, de tip triplet. El este aproape universal.
Cuasiuniversalitatea codului genetic rezida din cele cateva exceptii slabe. Astfel mitocondria umana codifica diferit Trp, Met si 2 puncte stop. La procariote exista o coliniaritate a genelor cu produsii lor. Produsul unei gene este polipeptidul specificat de secventa regiunilor exprimate a unei gene. La procariote exista o re-latie liniara intre secventa de baze a unei gene si secventa de aminoacizi a produsului ei. La eucariote aceasta coliniaritate este deseori intre-rupta de secvente de nucleobaze neexprimabile numite introni. Intronii sunt eliminati in timpul procesarii produsului primar al transcriptiei (ARNnh) pentru a rezulta ARNm.
Tabelul 7. Codul genetic este relatia dintre amino-acizi si codonii ARNm. Pentru a gasi codonul cores-punzator unui aminoacid se citeste prima baza a codonului(coloana primei pozitii) corespunzatoare aminoacidului, apoi a doua baza(coloana celei de-a doua pozitii) si apoi a treia baza(coloana celei de-a treia pozitii). Codonii Stop indica ARN polimerazei ca a ajuns la capatul mesajului genetic.
|
Cea |
de-a |
doua |
pozitie | ||
Prima pozitie |
U |
C |
A |
G |
A treia pozitie |
U |
Phe Phe Leu Leu |
Ser Ser Ser Ser |
Tyr Tyr Stop Stop |
Cys Cys Stop Trp |
U C A G |
C |
Leu Leu Leu Leu |
Pro Pro Pro Pro |
His His Gln Gln |
Arg Arg Arg Arg |
U C A G |
A |
Ile Ile Ile Met |
Thr Thr Thr Thr |
Asn Asn Lys Lys |
Ser Ser Arg Arg |
U C A G |
G |
Val Val Val Val |
Ala Ala Ala Ala |
Asp Asp Glu Glu |
Gly Gly Gly Gly |
U C A G |
Faptul ca celula 'traduce' limbajul secventei de baze in cel al secventei de aminoacizi ridica problema interactiunii ADN cu aminoacizii. Insa acizii nucleici nu asociaza specific aminoacizii si a fost necesara 'ipoteza adaptorului', emisa de F. Crick in 1955. Toate organismele contin cel putin cate o specie de ARNt pentru fiecare din cei 20 de aminoacizi proteinogeni, care activeaza ami-noacizii si mediaza atasarea acestora la ARNm. Translatia necesita doi pasi importanti de recu-noastere moleculara:
(i) alegerea aminoacidului corect pentru a fi legat covalent la ARNt,
(ii) selectia moleculei de aminoacil-ARNt speci- ficata de codonul ARNm.
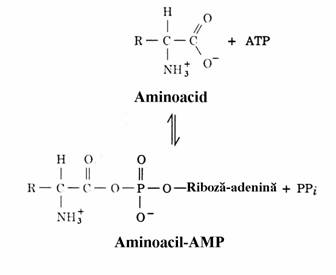
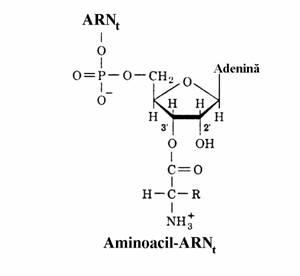
Primul pas, catalizat de enzime specifice aminoacizilor numite aminoacil-ARNt sintetaze, consta in condensarea gruparii carboxil a amino-acidului cu gruparea 3'-hidroxil a ARNt. Aceasta se face in doua etape. In prima are loc activarea aminoacidului sub forma de aminoacil-AMP, prin reactia cu ATP iar apoi anhidrida mixta reactioneaza cu capatul 3' al ARNt pentru a forma aminoacil-ARNt(fig. 77) prin reactia:
aminoacil-AMP+ARNt→aminoacil-ARNt+ AMP
Ambele etape sunt catalizate de sinteta-zele mentionate. In afara de inalta specificitate fata de aminoacizi, sintetazele dispun si de o acti-vitate suplimentara pentru corectarea erorilor de activare a acestora. Astfel, daca este activat un aminoacid gresit, sintetaza il poate dezactiva prin hidroliza anhidridei mixte sau il poate desprinde de pe ARNt.
Al doilea pas de recunoastere moleculara consta in recunoasterea codon-anticodon. Nu-cleoba-zele unui anticodon din bucla frontala a unei molecule de ARNt se imperecheaza antipa-ralel cu bazele din codonul complementar din ARNm, pentru a realiza o pereche codon-anticodon. Adica baza 1 a codonului se imperecheaza cu baza 3 a anticodonului. Primele doua baze ale codonului se imperecheaza cu ultimele doua baze ale anticodonului strict pe principiul comple-mentaritatii Watson-Crick (guanina cu citozina si adenina cu uridina). Imperecherea bazei 3 a codonului cu baza 1 a anticodonului se supune unor regului mai putin rigide ceea ce permite unor molecule de ARNt sa se poata imperechea cu mai multi codoni.
Figura 77. Activarea aminoacidului cu ATP si structura aminoacil-ARNt.
In tabelul 8 apar posibilitatile de imperechere codon-anticodon. Cand prima baza a anticodo-nului este citozina sau adenina, pentru impere-chere este obligatoriu ca in a treia pozitie a codo-nului sa fie baze complementare, guanina sau uracilul. Daca prima baza a anticodonului este uracilul, guanina sau hipoxantina, sunt recunos-cuti 2, 2 respectiv 3 codoni. Aceste imperecheri multiple sunt posibile datorita caracterului dege-nerat al codului genetic.
Tabelul 8. Posibilitati de imperechere in pozitia 3 a perechii codon-anticodon.
|
Prima baza a anticodonului |
A treia baza a codonului |
|
C |
G |
|
A |
U |
|
U |
A sau G |
|
G |
U sau C |
|
I |
U, C sau A |
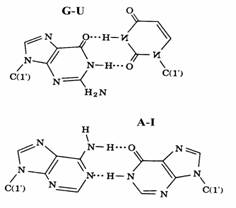
O consecinta este posibilitatea formarii unor pe-rechi de baze non-Watson-Crick cum ar fi G-U si A-I unde I vine de la ipoxantina (hipoxantina cu litera h aspirata) (vezi formulele din dreapta). Hi-poxantina apare in structura ARNt ca si alte baze nestandard, derivate ale bazelor standard. Struc-turile nucleozidelor continand baze nestandard apar in figura 78.
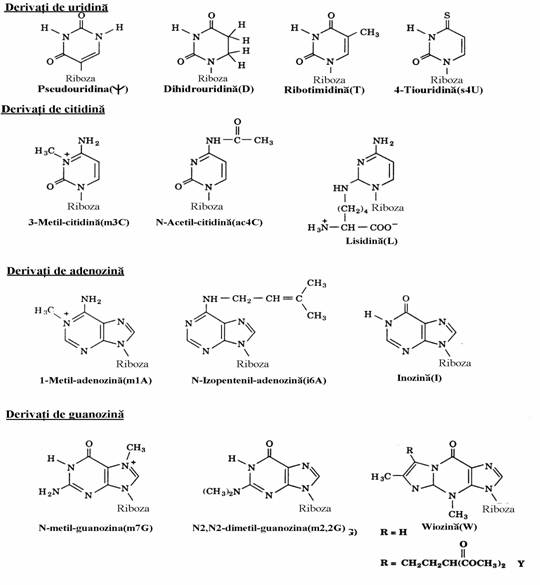
Figura 78. Derivati de nucleozide care apar in structurile ARNt.(formulele de jos).
3.3. Ribozomii procariotici si eucari-otici
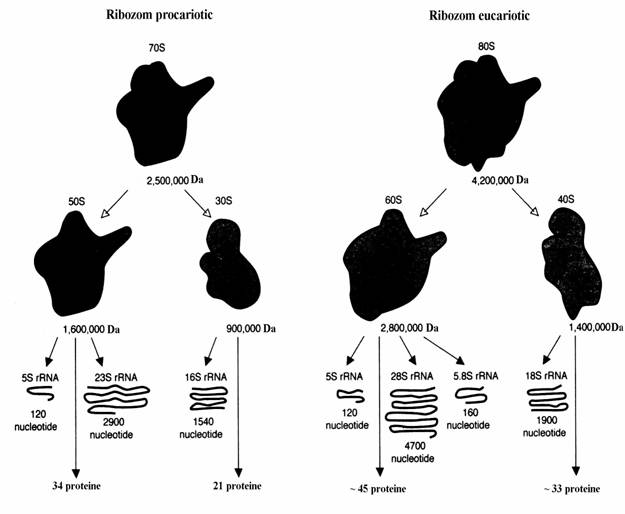
Ribozomul de E. coli este o particula mare de forma aproape sferica cu diametrul ma-xim de 25 nm, masa moleculara de 2,5 Mda si un coeficient de sedimentare 70 S. El este constituit din doua subunitati: 50 S si 30 S. Subunitatea 50 S este constituita din 34 proteine plus particulele de ARN ribozomal 23 S si 5 S. Molecula de ARNr 5 S este constituita din 120 ribonucleotide. Ribozomii eucariotici sunt mai mari si mai complecsi decat cei procariotici. Au coeficientul de sedimentare 80 S si masele moleculare intre 3,9 - 4,5 MDa. In figura 79 apare compozitia ribozo-milor procariotici si eucariotici.
Figura 79. Compozitia ribozomilor procariotici si eucariotici.
3. Sinteza proteinelor in procariote
Sinteza proteinelor la procariote parcurge 3 etape:
(a) initierea;
(b) elongarea;
(c) incheierea.
In figurile 81 si 82, apar mecanismele initierii, elongarii si incheierii sintezei la procariote si cateva referiri la eucariote.
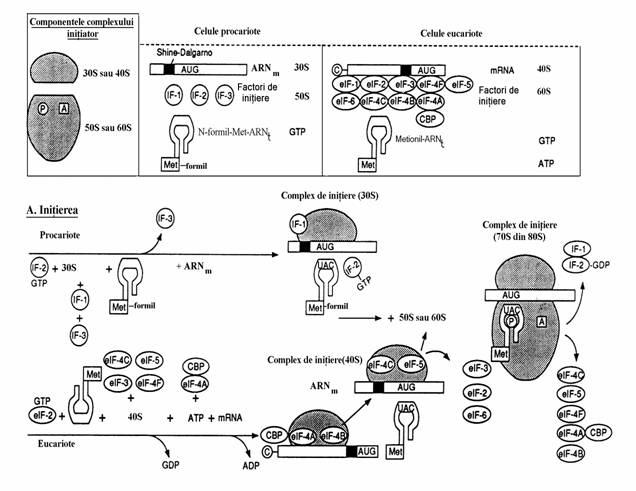
Formarea complexului de initiere(30 S) este primul eveniment al sintezei proteice. Compo-nentele lui sunt(fig. 81, partea incadrata):
(i) ARNm,
(ii) 3 factori de initiere(IF-1, IF-2, IF-3) si GTP,
(iii) subunitatea ribozomala 30 S care se diso-cia-za din ribozomul integral(70S) gratie interventiei factorilor de initiere IF-1 si IF-3. Prin disociere rezulta, alaturi de 30S, subunitatea 50S,
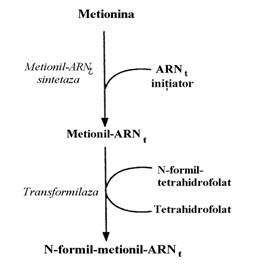
(iv) N-formil-metionil-ARNt format prin activa-rea si cuplarea metioninei la un ARNt initiator, sub actiunea metionil-ARNt sintetaza si apoi
transferul gruparii formil de la N10-formil-tetra-hidrofolat la gruparea amino a Met sub actiunea transformilazei (fig. 80).
Secventa acestui ARNt difera de cea a ARNt care vehiculeaza metionina pentru a fi inserata in po-zitii interne ale catenei polipeptidice.
Figura 80. Sinteza N-formil-metionil-ARNt
Cum se vede in figura 81A, subunitatea 30S, impreuna cu cei 3 factorii de initiere, se asociaza la ARNm. O secventa bogata in purine, numita secventa Shine-Dalgarno, identica sau aproape identica cu secventa AGGAGGU, aflata la o distanta de 10 nucleotide de codonul initiator (AUG), se cupleaza cu secventa complementara (bogata in pirimidine) din structura ARNr(16S). Acesta este semnalul declansarii initierii sintezei proteice. Pentru a se completa complexul de initi-ere, N-formil-metionil-ARNt se asociaza la sub-unitatea 30S, ceea ce determina disocierea fac-torului IF-3. Eliberarea factorului de initiere IF-3 permite subunitatii 50S sa se asocieze la com-plexul de initiere (30S) pentru a forma com-plexul de initiere 70S. Din acesta se vor desprinde apoi factorii IF-1 si IF-2, precum si GDP si Pi care rezulta din hidroliza GTP. Pe ribozomul 70S format exista doua centre active in timpul elongarii: situsul peptidului(P) si situsul aminoacidului (A). Centrul P este ocupat cu N-formil-metionil-ARNt al carui anticodon este im-perechiat cu codonul initiator(AUG) cu care este complementar. Codonului AUG i se mai spune codon start.
Figura 81. Faza de initiere a translatiei la procariote si eucariote.
3.2. Elongarea
In centrul A patrunde unul din cei 20 de aminoacil-ARNt standard si anume cel al carui anticodon este complementar cu codonul adiacent codonului initiator.
Este curios faptul ca 'dogma' celor 20 de aminoacizi standard nu este valabila la toate or-ganismele. Unele microorganisme folosesc pen-tru sinteza proteica 21(recent s-a gasit si al 22-lea) de aminoacizi 'standard". Al 21-lea este seleno-cisteina din E. coli.
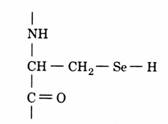
Sa presupunem ca codonul din centrul A este UUU, deci anticodonul complementar este AAA. ARNt care contine acest anticodon este specific fenilalaninei, pe carea atasata-o anterior la capatul 3' al catenei sale sub actiunea sintetazei. Odata cu aceasta completare a masinariei de sinteza proteica incepe procesul de elongare(fig. 82B). Procesului ii sunt necesari 3 factori de elongare: EF-Tu, EF-Ts si EF-G. Acestia sunt proteine prezente in mari cantitati(5-10% din totalul proteinelor) in celulele bacteriene. Patrun-derea Phe-ARNt in centrul A este facilitata de factorul EF-Tu, actiunea lui avand drept suport energetic hidroliza unei molecule de GTP. GDP rezultat din aceasta hidroliza ramane asociat la EF-Tu pana cand va fi deplasat de EF-Ts. EF-Tu si EF-Ts formeaza in aceasta faza un complex care va fi scindat prin asocierea la EF-Tu a unei noi molecule de GTP. Acest ciclu, a carui functionare are drept rezultat patrunderea tuturor aminoacil-ARNt(cu exceptia celui initiator, N-formil-metionil-ARNt) in centrul A, este vizibil in figura.
Aminoacidul activat de ARNt initiator, adica N-formil-metionina, este transferat pe gruparea amino a Phe atasata la ARNt din centrul A. Reactia are ca rezultat formarea unei legaturi peptidice si este catalizata de peptidil transfe-raza, enzima care face parte integranta din subunitatea ribozomala 50S. Produsul de reactie va fi un dipeptid(N-formil-metionil-fenil-alanina) atasat la ARNt din centrul A. ARNt initiator va parasi centrul P in etapa translocarii.
In continuare ribozomul(70S) se deplaseaza cu 3 nucleotide de-a lungul ARNm in directia 5' → 3', iar aceasta miscare determina eliberarea ARNt initiator din centrul P si desprinderea lui din complexul de elongare. Totodata, ARNt la care este atasat dipeptidul, plasat inca in centrul A, este repozitionat in centrul P. Se creaza, deci, un centru A gol la nivelul urmatorului codon de pe ARNm. Aceasta translocare este catalizata de factorul EF-G cu aportul energetic al hidrolizei unei molecule de GTP.
Parcurgerea repetata a ciclului format din etapele: patrunderea unui aminoacil-ARNt → formarea unei legaturi peptidice → translocare → eliberarea ARNt precedent, al carei rezultat este sinteza unui polipeptid, se opreste atunci cand complexul de elongare intalneste pe catena de ARNm pe care o parcurge, un codon Stop.
Figura 82. Fazele de elongare si incheiere a translatiei la procariote cu cateva referiri la eucario-te.

3.5. Sinteza proteinelor la eucariote
Mecanismul sintezei proteice la eucariote este asemanator cu cel de la procariote. Totusi, unele diferente, relevate in figurile 81 si 82, exis-ta ca o consecinta a faptului ca structura celule-lor eucariote este mai complexa decat cea a celulelor procariote.
Complexul de initiere are la baza subunitatea ribozomala 40S care necesita urmatoarele com-ponente (fig.82, partea incadrata):
(i) ARNm care este monocistronic si care contine codonul initiator AUG. ARNm eucariotic nu utilizeaza secventa Shine-Dalgarno pentru de-clansarea initierii,
(ii) factorii de initiere sunt in numar de 10, simbolizati cu literele eIF,
(iii) subunitatea ribozomala 40S este asociata cu factorul de initiere eIF-4C iar 60S este asociata cu eIF-6. Cei doi factori joaca un rol in asocierea-disocierea celor doua subunitati,
(iv) ARNt initiator activeaza la eucariote metio-nina nemodificata pe care o transporta la complexul de initiere(40S). Prin urmare exista inca un ARNt care activeaza metionina care va fi inserata in pozitii interne ale catenei polipeptidi-ce. Ambele forme ale ARNt ataseaza metionina sub actiunea aceleiasi sintetaze, metionil-ARNt sintetaza,
(v) la eucariote energia metabolica necesara translatiei este extrasa atat din GTP, ca la proca-riote, cat si din ATP.
Formarea complexului de initiere(40S) incepe cu un complex de preinitiere, ceea ce la procariote nu se intampla. Acest complex este constituit prin asocierea eIF-2-GTP si metionil-ARNt la subunitatea 40S. Mecanismul legarii complexului de preinitiere a ribozomului la ARNm este mult mai complex la eucariote decat la procariote. El nu este cunoscut in intregime, totusi, se presupune implicarea unor factori (3, 4A, 4B, 4C, 4F, 5), se cunoaste ca factorul 4A contine o subunitate care actioneaza ca o proteina asociatoare la capatul 5' al ARNm, notata CBP. Se stie cu certitudine ca CBP faciliteaza asocierea factorilor 4A si 4B la ARNm. Prin hidroliza ATP se obtine energia necesara ca factorul 4A sa faciliteze descolacirea (intracatenara) a ARNm pentru a putea fi translatat. In acest fel rezulta complexul de initiere(40S) propriu-zis.
Initierea se realizeaza in regiunea primului codon AUG de la capatul 5' al ARNm. Cu toate ca nu este prezenta o secventa Shine-
Dalgarno (specifica procariotelor), la eucariote exista secvente care includ codonul start de forma AXXAUGGG, unde X este o nucleobaza oare-care. Acestea functioneaza ca secvente initiatoa-re.
Subunitatea ribozomala 40S se asociaza aproape de capatul 5' al ARNm si il scaneaza in directia 5' → 3' pana cand intalneste primul co-don start(AUG). Hidroliza ATP furnizeaza ener-gia necesara acestei scanari. Formarea comple-xului de initiere(80S) are loc prin cuplarea 40S+ 60S facilitata de factorii de initiere eIF-4C si eIF-5. Ultimul factor determina eliberarea altor fac-tori (2-GDP, 3 si 6) din complexul initiator. Ulte-rior factorul eIF-2-GDP va fi convertit in eIF-2-GTP. Odata cu aceasta cuplare se elibereaza mai multi factori(fig. 81).
Exista o inalta similitudine intre elongarea la procariote si cea de la eucariote. Pentru elongare, la eucariote sunt necesare urmatoarele compo-nente ale complexului de elongare:
(i) complexul de initiere(80S),
(ii) aminoacil-ARNt,
(iii) GTP,
(iv) Factorii de elongare eEF-1α, eEF-1β si eEF-2.
Factorul eEF-1α este omologul eucariotic al fac-torului procariotic EF-Tu iar eEF-1β este omolo-gul factorului EF-Ts. Cum se vede in figura 82, translocarea, adica repozitionarea A→P a cen-trelor ribozomale, la eucariote este catalizata de factorul eEF-2.
3.5.3. Antibiotice inhibitoare ale sintezei proteice
Am vazut ca antibioticele au un larg spectru de inhibitie metabolica. Astfel, unele din ele inhi-ba replicarea si/sau transcriptia, altele inhiba sin-teza peretelui bacterian(penicilina). Majoritatea din antibioticele cunoscute blocheaza translatia. Aceasta situatie este probabil o consecinta a enor-mei complexitati a masinariei translationale care o face sa fie atat de vulnerabila. Unele antibioti-ce, spre exemplu puromicina, au fost folosite in analiza mecanismelor care implica ribozomi prin blocarea selectiva a functiilor subunitatilor aces-tora.
Cum se vede in figura de mai sus, puromici-na este un analog al capatului 3' al tirozil-ARNt. Ea intra in competitie cu acest aminoacil-ARNt si, fara sa necesite factori de elongare, intra in centrul ribozomal A. Printr-o reactie normala de transpeptidare se formeaza peptidil-puromicina care blocheaza urmatoarea reactie de transpepti-dare deoarece in locul gruparii esterice a Tyr-ARNt se gaseste o grupare aminica, improprie activitatii transpeptidazei(discurile hasurate in figura). Puromicina a permis evidentierea celor 2 centre ribozomale P si A. In figura 83 sunt prezentate cateva antibiotice care actioneaza ca inhibitori ai translatiei. Streptomicina, membra a unei familii de antibiotice numite amino-glicozi-de, la concentratii mari inhiba initierea sintezei la procariote prin impiedicarea intrarii N-formil-metionil-ARNt in centrul P al complexului de initiere. Aceasta blocare se produce datorita interactiunii antibioticului cu proteina S12 din subunitatea ribozomica 30S. Unele celule bacte-riene mutante(strR) au ribozomi cu o proteina S12 modificata fata de bacteriile sensibile la antibiotic (strS). Cloramfenicolul este primul antibiotic cu 'spectru larg'. El se asociaza la subunitatea ribozomica 50S si inhiba activitatea peptidil transferazei a bacteriilor. Totusi, utilizarea clinica a cloramfenicolului este limitata doar la infectiile severe datorita efectelor toxice ale lui. Tetraci-clina este un alt inhibitor translational care se asociaza la subunitatea 30S si inhiba legarea aminoacil-ARNt la complexul 70S. Cicloheximi-da se utilizeaza mai degraba in cercetarea transla-tiei eucariotice deoarece ea se asociaza la sub-unitatea 60S si inhiba peptidil transferaza euca-riotica.
Figura 83. Structurile unor antibiotice inhibitoare ale translatiei
Toxinele inhibitoare ale translatiei sunt o alta categorie de substante. Toxina difterica este codificata de un bacteriofag(corinefagul β) care infecteaza bacteria Corynebacterium diphtheriae si este produsa de aceasta bacterie. Aceasta toxina infecteaza regiunea nazo - faringiana a tractului respirator uman si poate cauza moartea. Difteria a fost una din principalele cauze ale morta-litatii infantile pana spre sfarsitul secolului trecut, cand, a putut fi prevenita prin imunizare. Toxina difterica inactiveaza specific factorul de elongare eucariotic eEF-2 prin ADP-ribozilarea (figura 84) unui radical de histidina modificata, numita diftamida si prin aceasta inhiba etapa de translocare a elongarii eucariotice. Diftamida apare numai in structura factorului eEF-2 ceea ce indica specificitatea actiunii toxinei. Intrucat moleculele de eEF-2 din toate speciile eucariote contin diftamida, acest rest este esential pentru activitatea biologica normala a factorului. Ricina este o proteina produsa de boabele de ricin. Ea este o N-glicozidaza care elimina o singura mole-cula de adenina din subunitatea 28S a ARNr eucariotic (fig. 79). Prin urmare subunitatea 60S, care contine subunitatea 28S, isi pierde functio-nalitatea si elongarea se blocheaza. Ricina se gaseste in uleiul de ricin, un laxativ dezagreabil, care se administreaza uneori la copii. Intrucat ricina este foarte toxica, este interzisa administra-rea uleiului pe perioade lungi de timp deoarece
Figura 8 Sus: inactivarea prin ADP-ribozilare a factorului eEF-2. Jos:structura unui rest de diftamida ADP-ribozilat.

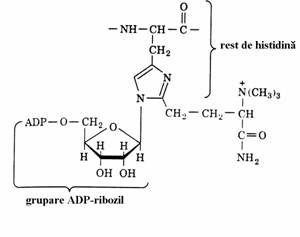 ar conduce
la diarei persistente si pierderea func-tiilor intestinale care poate
fi letala.
ar conduce
la diarei persistente si pierderea func-tiilor intestinale care poate
fi letala.
Exista cateva ribonucleaze ribozomale care inhiba translatia prin clivajul ARNr. α-Sarcina (accent pe i) este o toxina fungica care cliveaza subunitatea ribozomala 28S. Colicina E3 este secretata de anumite tulpini de E. coli si inhiba sinteza proteica procariotica prin clivajul ARNr din subunitatea 16S, ceea ce determina inhibitia initierii translatiei.
In celulele eucariotice cele mai multe prote-ine apar in citoplasma. Un numar mai mic de pro-teine sunt localizate pe membrana reticulului endoplasmatic rugos(RER). Cateva exemple de proteine sunt:
(i) proteinele secretoare(de exemplu colage-nul din matricea extracelulara) si proteinele serice (imunoglobuline, hormoni peptidici),
(ii) proteinele din organite celulare,
(iii) proteine membranare integrale.
Proteinele sintetizate pe membrana RER sunt ela-borate intr-o forma precursoare care este proce-sata inainte ca ele sa ajunga la destinatie. Teoria semnalarii spune ca ele au au in structura o secventa semnal de 15 - 30 aminoacizi cu radi-cali predominant hidrofobi, incepand cu capatul N-terminal. Aceasta secventa dirijeaza sinteza acestor proteine. Recunoasterea secventei semnal de catre particule de recunoastere a semnalu-lui(SRP) precede asocierea complexului ribo-zom-SRP la RER si continuarea sintezei proteice in lumenul RER. Incheierea sintezei proteice se face pe fata interna a membranei RER. Procesa-rea post-translationala a acestor proteine consta intr-un numar de modificari intre care mai impor-tante sunt:
(a) plierea in conformatii tertiare si cuaternare,
(b) glicozilarea in RER,
(c) glicozilarea in aparatul Golgi si
(d) activarea proteolitica
Un exemplu este sinteza si procesarea post-translationala a insulinei. Insulina este sintetizata in celulele β ale insulelor Langerhans din pan-creas. La om ARNm codifica un polipeptid cu 110 aminoacizi, numit preproinsulina. Segmentul de 24 aminoacizi de la capatul N-terminal constituie secventa semnal care este indepartata in timpul sintezei pe RER. Catena polipeptidica de 86 ami-noacizi ramasa este polipeptidul numit pro-insulina. Dupa transportarea la aparatul Golgi, proinsulina este impachetata in granule secre-torii. In granulele secretorii o endoproteaza si o exoproteaza hidrolizeaza specific legaturi ale pro-insulinei formand insulina activa, peptidul C inactiv si 4 aminoacizi. Moleculele de insulina activa si peptid C sunt secretate in plasma sangui-na in functie de necesitati.
Un alt exemplu este glucagonul care este sintetizat in celulele α ale insulelor Langerhans sub forma unui precursor voluminos numit pre-proglucagon. Peptidul semnal al preprogluca-gonului este indepartat in timpul sintezei in RER pentru a rezulta proglucagon. In granule secre-toare se elibereaza catena polipeptidica de 29 aminoacizi a glucagonului activ din proglucagon prin clivaj endoproteazic.
Reglarea expresiei genice la eucariote
Exista diferente in ce priveste reglarea trans-miterii informatiei genetice intre procariote
si eucariote. In primul rand mecanismele reglarii la diferite nivele de transmitere a informatiei sunt mult mai complexe la eucariote. Pe de alta parte, in timp ce la procariote nu se pune problema unei reglari a translatiei datorita timpului de viata scurt a ARN procariotic, la eucariote sunt tot mai multe dovezi in favoarea existenta acestui nivel de reglare.
1. Reglarea transcriptionala
Reglarea transcriptionala este un mod im-portant de control al transmiterii informatiei ge-nice la eucariote. Ea se realizeaza pe doua nive-luri:
(i) impachetarea cromozomilor
(ii) reglarea genelor individuale.
(i) celulele eucariote pot face ca, anumite regiuni cromozomiale sau chiar cromozomi intregi, sa fie inaccesibile masinariei de transcriptie si factorilor regulatori, prin formarea heterocroma-tinei inactive. Pe de alta parte, regiuni cromozo-miale pot fi facute accesibile transcriptiei prin formarea eucromatinei active. Un caz dramatic de inactivare genica prin impachetare stransa a ADN in heterocromatina se vede in formarea corpilor Barr. Metilarea ADN eucariotic poate juca un rol in mentinerea lui in stare de hetero-cromatina.
(ii) reglarea transcriptionala a genelor individuale la eucariote este similara reglarii transcriptionale a operonilor la procariote. Principala diferenta este aceea ca la eucariote numarul de secvente ADN si de factori reglatori este mult mai mare decat la procariote. Secventele reglatoare(nu este vorba de promotori de transcriptie) sunt de doua tipuri: intensificatori si elemente de raspuns. Primul tip sunt secvente scurte de 10-20 perechi de baze care deseori prezinta simetrie diadica. Unii din ei maresc viteza transcriptiei, dar sunt si unii care o micsoreaza. Elementele de raspuns sunt secvente reglatoare comune pentru o grupa de gene. Ele faciliteaza reglarea coordonata a acestor gene. Exemple de gene reglate de ele-mente de raspuns sunt genele reglate de hor-monii steroizi. Acesti hormoni se asociaza la proteine numite receptori intracelulari. Un receptor consta din doua domenii, unul prin care asociaza steroidul si celalalt prin care el se asociaza la elementul de raspuns. In absenta hormonului steroid receptorul nu se asociaza la elementul de raspuns. Adica, numai complexul hormon-receptor se asociaza la elementul de raspuns, care in acest caz se numeste element de raspuns hormo-nal (HRE). In figura 85 este prezentata asocierea unui complex steroid-receptor intracelular la HRE. Rezultatul este stimularea transcriptiei genelor corelate cu HRE.
Figura 85. Actiunea unui hormon steroid asupra nucleului celular. HRE =element de raspuns hormonal.
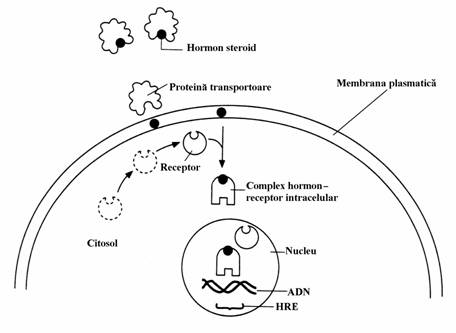
2. Reglarea post-transcriptionala
Reglarea post-transcriptionala este un impor-tant tip de reglare la celulele eucariote si ea se realizeaza la doua nivele:
(i) imbinare alternativa
(ii) reglarea stabilitatii ARN.
(i) se cunoaste ca mai multe gene eucariotice sunt capabile sa dea nastere la diferiti produsi de transcriptie prin aceasta imbinare. Un exemplu este cel prezentat in figura 86. In glanda tiroida gena calcitoninei da nastere unui produs de transcriptie care codifica calcitonina, hormon implicat in homeostazia calcemiei. Aceiasi gena este exprimata in neuroni(SNC) si da nastere unui produs de transcriptie care codifica peptidul co-relat genic cu calcitonina(CGRP). Cele doua molecule de ARNm, care codifica acesti doi pro-dusi, au aceiasi primii 2 exoni codificatori(C1 si C2). Ei difera prin al treilea exon codificator, el codifica calcitonina in tiroida. In SNC el codifica CGRP. Moleculele de ARNm difera si prin punctele de adenilare, indicate in figura cu sageti.
(ii) la un alt nivel, cel al reglarii stabilitatii ARN, anumite specii de ARN cum ar fi ARNhn in nu-cleu si ARNm in citoplasma, au timpi de viata prin care se pot controla produ;sii lor de transla-tie. Astfel, unele gene codifica produsi de trans-criptie in cantitati mari si cu timp de viata lung, cum este cazul genei care codifica β-globina.
Figura 86. Produsul de transcriptie primar al genei calcitoninei este procesat pentru a produce un segment de ARNm care codifica calcitonina in celulele tiroidiene. Prin imbinare alternativa si poliadenila-re(Poli A↑) acelasi produs de transcriptie primar este procesat in neuroni pentru a produce proteina corelata genic cu calcitonina (CGRP).
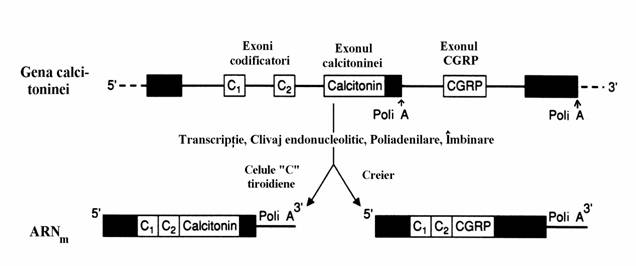
3. Reglarea translationala
Pana in prezent nu exista dovezi ca viteza translatiei la procariote ar depinde de modificari ale conditiilor de mediu de cultura.
Expresia genetica la procariote este in intregime controlata la nivel transcriptional (operoni).
Avand in vedere ca timpii de viata ai ARNm pro-cariotici sunt de cateva minute, se pare ca pro-cariotele nu au nevoie de reglare translationala. La eucariote reglarea transcriptionala este in mare masura destinata diferentierii celulare. Exista, totusi, indicatii tot mai clare ca celulele eucariote reactioneaza fata de propriile necesitati prin reglare translationala. Acest lucru este posibil deoarece timpii de viata ai ARNm eucariotici sunt de ordinul orelor sau zilelor. Un exemplu
il constituie reglarea sintezei hemoglobinei de catre hem. In reticulocite sinteteza proteica se reduce exclusiv la cea a hemoglobinei. Sinteza hemoglobinei in reticulocitele proaspat lizate are loc timp de mai multe minute insa apoi se opreste brusc datorita inhibarii initierii translationale si dezagregarii poliribozomilor. Aceasta oprire poa-te fi evitata prin adaugarea hemului(care in acest sistem in vitro nu poate fi sintetizat). Continuarea sintezei hemului in aceste conditii indica faptul ca sinteza globinei este reglata de disponibilitatea hemului. Mecanismul acestui control are la baza o cascada de fosforilari a proteinelor(fig. 87). Factorul eucariotic de initiere eIF-2 este inactivat atunci cand este fosforilat de catre o protein kinaza numita inhibitor controlat de hem(HCI),
Figura 87. Mecanismul prin care hemul blocheaza o cascada de fosforilari care conduce la inhibitia factorului de initiere eucariotic eIF-2. cAMP = AMP ciclic; 2R2Ci = protein kinaza cAMP-dependenta in stare inactiva; 2R-cAMP = partea reglatoare a pro-tein kinazei care asociaza cAMP; Ci = subunitate enzimatica a protein kinazei in stare inactiva; Ca = subunitate enzimatica a protein kinazei in stare activa; HRI = inhibitor controlat de hem; HRI(PO4)a = inhibitor controlat de hem activat prin fosforilare; eIF-2 = factor de initiere eucariotic 2; eIF-2 - PO4= factor de initiere eucariotic fosforilat; eIF-2B = factor de initiere eucariotic 2B.
kinaza care, la randul ei, a fost fosforilata (activa-ta) de catre o alta protein kinaza, AMP ciclic-dependenta. Modul de activare al acestei protein kinaze a fost tratat la metabo-lismul glicogenului (vol.II). Aceasta cascada este inhibata de hem care blocheaza disocierea si, deci, activarea pro-tein kinazei AMPc-dependente. Prin aceasta hemul inactiveaza factorul eIF-2, adica determina
activarea sintezei proteice, adica a sintezei globinei.
Nota: Figurile din acest volum au fost scanate folosindu-se sursele bibliografice 1, 5 si 13.
Copyright © 2024 - Toate drepturile rezervate