 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
PREPARATE PARENTERALE CU ACTIUNE PRELUNGITA
GENERALITATI
Preparatele cu actiune sustinuta (modulata, prelungita, retard, depozit, programata) asigura obtinerea de efecte terapeutice prelungite prin realizarea nivelului sanguin eficace pentru o perioada de timp mai indelungata decat aceea care poate fi obtinuta cu aceeasi substanta in forma conventionala.
In mod ideal, administrarea unui preparat cu actiune prelungita trebuie sa conduca la stabilirea rapida a unei concentratii sanguine eficace pentru obtinerea efectului terapeutic dorit si la mentinerea acestei concentratii la un nivel constant, eficient, pe o perioada destul de lunga, pentru a permite reducerea semnificativa a frecventei de administrare a medicamentului (comparata cu frecventa de administrare a aceluiasi medicament in forma conventionala).
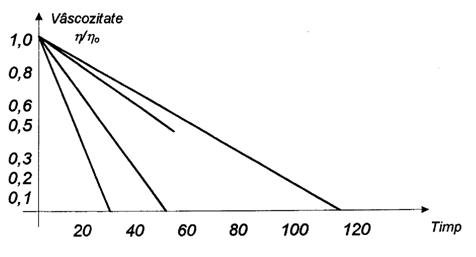
Pentru a ilustra cele afirmate, vom arata comparativ dinamica concentratiei sanguine la administrarea aceleiasi substante active in forma conventionala si retard.
In cazul administrarii unei doze de medicament in forma conventionala, concentratia substantei medicamentoase in sange atinge un maxim (varf), dupa care descreste mai mult sau mai putin repede, prin excretia directa sau prin degradarea substantei. Administrand la intervale de timp determinate noi doze de medicament, fenomenul se va repeta; vom asista deci la atatea maxime (varfuri) si minime, cate doze de medicament au fost administrate (figura 1).
Figura 1
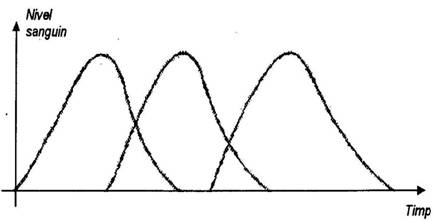
Medicatia retard urmareste eliminarea maximelor si minimelor, deci gasirea unei metode care sa aiba ca efect transformarea curbei astfel incat aceasta sa aiba un traseu pe cat posibil liniar pe o perioada de timp determinata.
In practica insa, nu va fi posibila obtinerea unei linii drepte; esential este ca maximele si minimele sa fie cuprinse in intervalul terapeutic al substantei medicamentoase (figura 2).
Figura 2

Unul dintre avantajele preparatelor retard este reducerea incidentei si intensitatii efectelor toxice care pot fi cauzate de maximele de concentratii ce apar la administrarea formelor conventionale. Mentinerea unor nivele sanguine relativ constante poate reduce, pe de alta parte, fluctuatiile de concentratie in tesuturi si la locul de actiune si astfel se poate obtine un raspuns farmacologic mai uniform.
Administrarea parenterala a substantelor medicamentoase pe cale intravenoasa, intramusculara si subcutanata permite un acces relativ rapid in circulatia generala, care totusi este insotita adesea de o reducere la fel de rapida a concentratiei sanguine.
Pentru a se mentine o concentratie utila de substanta medicamentoasa pe un interval mai lung de timp, se alege deci perfuzia continua care asigura o dirijare foarte exacta a concentratiei de substanta medicamentoasa in sange.
Problemele de tipul absorbtiei necorespunzatoare sau efectul primului pasaj hepatic pot fi evitate prin acces direct in circulatia sistemica. Din pacate insa, administrarea sub forma de perfuzie a substantei medicamentoase presupune spitalizarea pacientilor si datorita riscurilor, necesita o supraveghere permanenta.
Cedarea controlata a substantei active din formele parenterale depot reduce dezavantajele administrarii parenterale repetate. Concentratiile terapeutice constante, prelungite in sange, care pot fi obtinute cu o singura injectie sau cu mai multe, constituie avantajul principal al acestor preparate. Exemple de astfel de preparate sunt: penicilina depot, insulina depot, vitamina B12 depot.
t2 CLASIFICAREA FORMELOR INJECTABILE DEPOT
Posibilitatile de prelungire a actiunii formelor depot ce urmeaza sa fie administrate intramuscular sau subcutanat pot fi clasificate schematic in trei grupe conform figurii 3:
Figura 3 - Clasificarea schematica a produselor injectabile depot
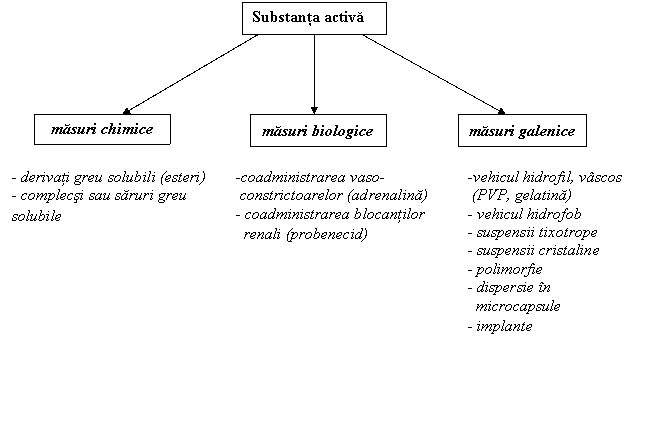
Acest capitol se refera la prodroguri. In tabelul urmator prezentam unele posibilitati din acest punct de vedere.
Tabelul 1 - Exemple de substante active modificate din punct de vedere chimic
Esteri greu solubili |
Saruri greu solubile |
|
- acizi carbonici monofunctionali C2 -C20 steroizi - androgeni - estrogeni - gestageni - corticosteroizi - antipsihotice |
- antibiotice - penicilina G - procaina - antagonisti ai narcoticelor - pamoat de naloxona - tanat de naltrexona-Zn - vitamine - tanat de ciancobalamina-Zn - hormoni peptidici - complex: insulina-protamina-Zn - complex: vasopresina-tanat - complex: ACTH-Zn-tanat |
De cele mai multe ori acesti derivati se folosesc in combinatie cu unele masuri galenice in vederea prelungirii actiunii.
In acest sens se poate conta pe modularea urmatoarelor proprietati:
hidrofilia/lipofilia vehiculului
modificari cristaline (polimorfism)
distributia marimii cristalelor
Desi frecvent intalnite in practica medicala, asocierile de substante medicamentoase ce urmaresc marirea duratei de actiune a medicamentelor pot determina aparitia unor efecte nedorite care in conditiile unei actiuni prelungite pot prezenta un risc foarte mare. Este cazul asocierii anestezicelor locale (procaina, lidocaina) cu vasoconstrictoare (adrenalina), penicilinei cu probenecid (inhibitor al excretiei tubulare a penicilinei).
C. MASURI GALENICE
Cedarea treptata a substantelor medicamentoase incluse in preparate parenterale poate fi realizata si cu ajutorul unor masuri galenice prezentate in figura 3:
Figura 3: Masuri galenice pentru prelungirea actiunii preparatelor
parenterale
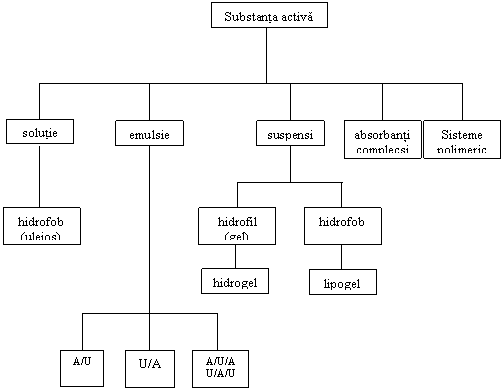
In cazul substantelor medicamentoase hidrosolubile, pentru obtinerea unor preparate parenterale cu actiune prelungita, se poate recurge la una din urmatoarele masuri:
folosirea unui vehicul hidrofob (masura galenica), deci obtinerea unei
suspensii uleioase;
folosirea unui vehicul hidrofil dupa prealabila transformare a substantelor medicamentoase in derivati greu solubili (masura chimica). Se obtin astfel suspensii apoase care, spre deosebire de cele uleioase, nu sunt atat de dureroase la administrare.
Prezentam in continuare o subclasificare a suspensiilor in functie de cantitatea de substanta solida din suspensie, astfel:
Suspensii cu un continut de substanta activa mai mic de1%
Reprezentantii tipici ai acestei categorii sunt hormonii peptidici hidrosolubili ca de exemplu: insulina, ACTH.
La adaosul ionilor de zinc, insulina formeaza un produs cristalizat zinc-insulina. Proteinele bazice cum ar fi: globulina, albumina, duc la prelungirea actiunii zinc-insulinei prin formare de sare.
ACTH-ul formeaza cu ionii de zinc un complex cristalizat prin absorbtia acestuia pe o sare de zinc insolubila, amorfa si cu caracter bazic.
Suspensii cu un continut de substanta activa solida cuprins
intre 1-5%
Aceasta grupa este reprezentata de suspensiile cu steroizi. Prepararea acestor suspensii cristaline necesita cunoasterea perfecta a tehnologiei 'know how' pentru a se putea realiza un spectru de marimi de particule care sa influenteze capacitatea de suspendare si de injectare. Este absolut obligatoriu sa se gaseasca calea de franare a cresterii cristalelor si a formarii aglomeratelor.
Suspensii cu un continut de substanta activa de peste 5%
Aceasta grupa are drept reprezentanti tipici preparatele cu penicilina (40-70% GA/). Suspensia trebuie preparata cu putin timp inainte de folosire prin adaugarea vehiculului, datorita problemelor de stabilitate.
Suspensiile concentrate cu penicilina G - procaina in vehicul apos prezinta o comportare tixotropa. Dupa injectie se formeaza un depozit solid, coerent, cu o rata redusa de cedare a substantei active.
Tabelul urmator prezinta efectele care se pot obtine prin folosirea masurilor chimice si galenice in vederea obtinerii unui preparat retard cu penicilina G.
|
Nr. crt |
PREPARAT |
TIPUL MODIFICARII |
MASURA LUATA |
VEHICUL |
DURATA ACTIUNII |
OBSERVATII |
|
Penicilina G |
solutie apoasa |
3-4 h |
nota bibliografica |
|||
|
t |
Penicilina G Procaina |
chimica |
saruri greu solubile |
suspensie apoasa |
18-20 h | |
|
Penicilina G Procaina |
galenica |
marimea particulelor 150-250mm |
suspensie apoasa |
cea. 72 h |
principiul macrochstalelor |
|
|
Penicilina G Procaina |
galenica |
lipofilia vehiculului |
suspensie uleioasa |
cca. 17h |
uleiul ramane ca depot |
|
|
Penicilina G Procaina |
galenica |
vehicul cu vascozitate tip ulei |
lipogel |
cca. 62 h |
adaos 2% stearat de Al; marimea particulei substanta activa >50 mm |
|
|
Penicilina G Procaina |
galenica |
marimea particulelor |
lipogel |
cca. 132 h |
adaos 2% stearat de Al; marimea particulei substanta activa <5mm |
|
|
Penicilina G Procaina |
galenica |
cantitate mare de substanta solida |
suspensie apoasa tixotropa |
>100h |
substanta solida din suspensie este de 40-70% |
Particulele cu dimensiuni mai mici din suspensiile cristaline uleioase prezinta un efect de retardare mai puternic. De aceea s-a propus formarea de micele.
t3 MICROENCAPSULAREA
Aceasta tehnica a fost pentru prima oara experimentata in tehnica farmaceutica in anii 1930 de catre Green.
Pentru realizarea acestui proces trebuie sa se tina seama de interactiunea stransa dintre substanta activa, polimer si tehnologia de lucru.
Respectiva idee este ilustrata si prin schema urmatoare:
Figura 4 - Diagrama microencapsularii

t3.1 Prepararea microcapsulelor
Microcapsulele contin gaze, lichide sau substante solide cu un grad fin de dispersie. Diametrul mediu al acestor particule este cuprins intre 1 si 5000 mm, dar cele mai folosite sunt substantele cu un diametru cuprins intre 1 si 250 mm. Peretii microcapsulelor sunt formati din polimeri naturali si/sau sintetici care formeaza invelisuri etanse, permeabile sau semipermeabile.
Microcapsuleie se pot obtine prin urmatoarele procedee:
procedee mecanico-fizice
procedee de polimerizare la interfata
procedee de separare a fazelor
Procedee mecanico-fizice
Uscarea prin pulverizare - tehnica de lucru se bazeaza pe evaporarea unei emulsii sau dispersii cu ajutorul unui gaz inert si fierbinte cu formarea unui invelis de polimer ce inconjoara strans materialul ce formeaza nucleul.
Procedeul de polimerizare la interfata
Aceasta metoda foloseste pentru obtinerea peretilor microcapsulelor procesele de policondensare sau poliaditie.
In figura 5 este prezentata schema polimerizarii la interfata.
Figura 5 - Polimerizarea la interfata

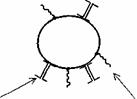
Procesul de polimerizare la interfata presupune formarea unei membrane la interfata A/U sau U/A prin 'solidificarea emulsiilor sau a sistemelor micelare'.
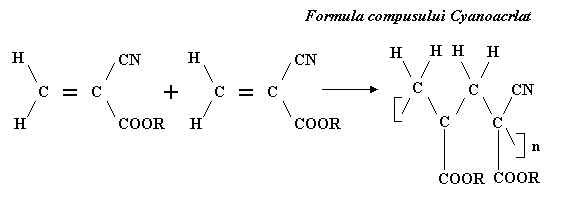
Trebuie sa se prevada conditiile toxicologice maxime pentru reziduurile rezultate din monomerii reziduali si radicalii initiali si trebui evitata includerea substantelor active cu greutate moleculara mica in procesul polimerizarii. Din aceasta cauza au fost folositi monomeri care polimerizeaza spontan si complet in prezenta umiditatii si anume cianoacrilatii.
Formulele complecsilor cianoacrilat si Nylon 6-10 sunt prezentate in urmatoarea figura:
 Figura 6
Figura 6
Se poate folosi si metoda includerii celulelor, tesuturilor, proteinelor intr-un gel de alginat de calciu cu formarea unei membrane biodegradabile, semipermeabila din L-polilizina. Au fost obtinute astfel de microcapsule cu celule din insulele pancreasului care au fost implantate in corpul sobolanilor diabetici si care au redat functionalitatea acestora in circa trei saptamani. In 'vitro' aceste microcapsule au functionat 90-100 de zile.
c) Procedeul de separare a fazelor
Acest procedeu numit si coacervare se bazeaza pe prepararea unei dispersii alcatuite din materialul ce constituie nucleul si solutia de polimer care va constitui peretele microcapsulei. In figura urmatoare este prezentata diagrama coacervarii.
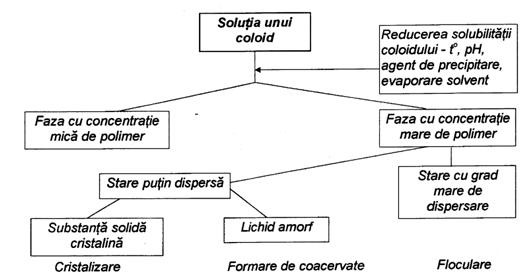
Separarea fazelor se poate face prin modificarea temperaturii, a pH-ului, evaporarea solventului sau prin adaosul de agenti de precipitare.
Polimerii care pot fi utilizati in aceasta metoda sunt: gelatina, etilceluloza, nitratul de celuloza.
In figura urmatoare sunt exemplificate etapele procesului de separare a fazelor pentru gelatina.
Figura 8 - Diagrama de curgere a unui proces de separare de faza.
Coacervarea simpla a gelatinei


t3.2 Polimerii folositi pentru formarea peretilor microcapsulelor de
uz parenteral
Materialul din care este alcatuit peretele microcapsulei prezinta o deosebita importanta deoarece aceasta, in conditiile blande care exista in "vitro", trebui sa se descompuna pe cale hidrolitica sau enzimatica in produse netoxice dupa un anumit interval de timp.
In figura urmatoare sunt prezentati polimerii biodegradabili folositi la obtinerea microcapsulelor de uz parenteral.
Figura 9 - Polimeri potentiali descompusi biologic
Activitatea polimerilor C-C
Exemplu: policianoacrilati

) Poliamide, poliuretane
Exemplu: proteine

3) Poliesteri, policarbonati
 Exemplu: poliglicoid
Exemplu: poliglicoid
4) Poliacetale, poliketale, poliortoesteri
Exemplu: poliacetal
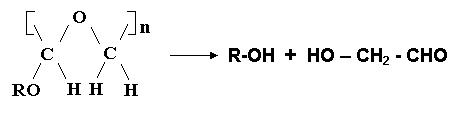
5) Polimeri naturali
Polizaharide - xantinderivati
amiloderivati
detranderivati
Proteine - colagen
albumina
Figura urmatoare prezinta seria degradarii hidrolitice a diverselor
conglomerate de polimeri
 Figura
10 - Seria teoretica a degradarii hidrolitice a diverselor conglomerate de
Figura
10 - Seria teoretica a degradarii hidrolitice a diverselor conglomerate de
polimeri
Aceasta clasificare este insa usor modificata in practica datorita efectelor substituentilor, lipofiliei precum si a unor proprietati fizice dintre care mentionam:
comportarea la difuziune si penetrare; aceasta proprietate influenteaza cedarea substantei active precum si mecanismul biodegradarii;
cristalinitatea polimerului; aceasta proprietate mareste rezistenta
mecanica a polimerului, dar influenteaza negativ procesul de
difuziune, iar particulele amorfe favorizeaza hidroliza;
dimensiunea fizica; important este raportul dintre suprafata si
volumul materialului implantat.
In figura urmatoare sunt prezentate unele din proprietatile fizice importante ale poliesterilor tipici.
Figura 11 - Structuri chimice si proprietati fizice relevante ale unor poliesteri
Poly(Glycolic
Acid) Tn=230o Tg=36o
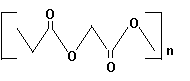 tipici
tipici
Poly(D Lactic
Acid) Tn=180o Tg=67o Poly(DL
Ethylglycolic Acid) Tg=16o

Poly(DL - Lactic
Acid) Tg=57o Poly(DL - e Decalactone) Tn=230o Tg=36o Poly (Akylene
Adipate) x=2 Tn=50o Tg=-50o x=3 Tn=45o Tg=-59o x=10 Tn=77o Tg=-56o


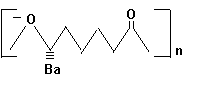
Poly (Ethylene
Tereftalat) Tn=256o Tg=67o

S-au constatat urmatoarele:
viteza hidrolizei neenzimatice scade odata cu cresterea lungimii
catenei alchil;
hidroliza este influentata de substituentii alchil sau arii din catenele
laterale prin fenomenul de franare sterica.
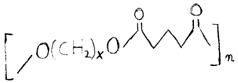
In figura urmatoare este prezentata viteza de descompunere relativa a diversilor poliesteri alifatici.
Figura 12 - Viteza de descompunere relativa a diversilor poliesteri alifatici
Greutatea moleculara = 30000. Polimer (e - caprolactama
t3.3 Proprietatile microcapsulelor
t3.3.1 Aspecte fizice
Marimea microgranulelor prezinta importanta la administrarea lor prin injectare si influenteaza cedarea substantei medicamentoase.
In functie de tehnica de lucru folosita la prepararea microcapsulelor si de solubilitatea substantei active in polimer, se deosebesc trei tipuri de microcapsule:
'microsfere', in care substanta activa nu este solubila in polimer si
este dispersata in matrita polimerului;
'microsfere', in care substanta activa este solubila in polimer si
reprezinta tipul solutiei solide;
'microcapsule' cu nucleul in stare lichida sau solida si cu invelisul de
tip polimeric.
Toate acestea se pot observa si in figura urmatoare.
Figura 13 - Aspecte morfologice ale microcapsulelor.

'microsfere' (dispersie solida)
diametrul = 0,1-250 mm
'microsfere' (solutie solida)
diametrul = 0,1-250 mm

'microcapsule'
diametrul = 1-250 mm

'structura complexa'
'structura complexa'
(agregate de microcapsule)
Marimea microcapsulelor prezinta importanta la administrarea prin injectare si influenteaza cedarea substantei medicamentoase.
t3.3.2 Mecanisme de cedare a substantei active din sistemele
polimerice
In tabelul urmator este prezentata o clasificare generala a mecanismelor posibile de cedare.
Tabelul 3
|
Cedare controlata prin difuziune |
sisteme rezervor (membrana) matrite (sisteme macrolitice) |
|
|
t |
Cedare controlata pe cale chimica |
sisteme bioerodabile conjugati de tip polimer/substanta activa |
|
Sisteme controlate prin umflare |
||
|
Sisteme reglabile |
||
Sistemele rezervor sunt alcatuite dintr-un 'nucleu' de substanta activa care poate fi lichid sau solid si un invelis de polimer gonflabil sau nu. Faza determinanta de viteza este reprezentata de difuziunea substantei active dizolvate prin membrana polimerului. Exemple de astfel de sisteme sunt: capsulele, membranele, microcapsulele 'adevarate', lipozomii si fibrele goale in interior.
Difuziunea prin membrana poate fi descrisa prin legea lui Fick:
![]()
I* = fluxul molar al substantei active
D = coeficientul de difuziune independent de concentratie
![]() = gradientii concentratiei substantei active in membrana
= gradientii concentratiei substantei active in membrana
Poate fi obtinuta o viteza constanta de cedare a substantei active atunci cand grosimea membranei si concentratia raman nemodificate.
Avantajul foarte mare al sistemelor rezervor consta in usurinta cu care se poate obtine o cinetica de ordinul O sau apropiata de aceasta. Dintre dezavantajele sistemelor rezervor, citam:
polimerii utilizati: cauciucul pe baza de siliconi, hidrogeluri (Hydron si acetatul de etilenvinil) nu sunt biodegradabili si trebuie indepartati dupa utilizare pe cale chirurgicala;
unele substante cu greutate moleculara de peste 600, cum ar fi insulina, au viteza de difuziune mica si nu pot fi folosite in terapeutica;
daca in membrana sistemului se produce o fisura, se poate elibera
toata substanta activa ceea ce duce la o posibila intoxicatie.
Aceste sisteme rezervor prezinta un cost de fabricatie ridicat in comparatie cu altele.
Sistemele cu matrita au substanta activa dispersata sau dizolvata uniform intr-o retea de polimer. Viteza de cedare a substantei active din aceste sisteme este dependenta de difuziunea substantei active prin reteaua polimerului si pentru aceste sisteme nu se mai aplica o cinetica de ordinul 0, ci se poate aplica cea de-a doua lege a lui Fick si anume:
![]()
Rata cedarii este proportionala cu radacina patrata a timpului de cedare.
Sistemele biodegradabile se caracterizeaza prin distributia uniforma a substantei active, iar mecanismul cedarii acesteia se bazeaza pe un proces de dizolvare a matritei. Pe masura biodegradarii invelisului, substanta activa este cedata organismului. Dupa un anumit timp aceste sisteme dispar, nemaifiind necesara interventia chirurgicala.
Pentru a se obtine o cinetica de ordinul 0 este obligatoriu sa se obtina o eroziune reala a suprafetei care trebuie sa ramana constanta.
Pentru a se putea realiza o cedare controlata a substantei active se poate utiliza tranzitia unui polimer de la starea vitroasa la una asemanatoare cauciucului in prezenta unui solvent penetrant. Substanta activa este dispersata sau dizolvata omogen si dupa indepartarea solventului matrita se afla intr-o stare vitroasa. In acest caz, prin patrunderea apei in matrita, polimerul se umfla si temperatura de tranzitie la sticla Tg scade. Daca aceasta temperatura este mai mica decat 37°C sistemul umflat trece intr-o stare asemanatoare cauciucului si substanta activa poate difuza. Foarte frecvent se folosesc teofilina si alcoolul polivinilic ce se prezinta sub forma unor retele cu un numar mare de legaturi transversale.
Acest mecanism este caracterizat ca nefiind o difuziune Fick si cedarea de ordinul 0 a fost atinsa aproximativ.
In tratamentul bolilor metabolice cum ar fi diabetul sau guta, substanta activa trebui sa fie cedata proportional cu un parametru biochimic deviat de la normal si dupa normalizarea acestuia cedarea sa fie intrerupta. Astfel de sisteme autoreglabile au fost realizate sub forma 'pancreasului artificial'.
Au fost obtinute astfel de sisteme reglabile formate dintr-o matrita alcatuita dintr-un copolimer al metil-vinil-eterului cu anhidrida acidului maleic iar substanta activa, hidrocortizonul, putea fi cedat controlat prin intermediul hidrolizei dependente de pH. In domeniul alcalin acest polimer prezinta o puternica eroziune a suprafetei sale. Daca aceste sisteme sunt acoperite cu un strat de uree se observa ca cedarea hidrocortizonului are loc in functie de concentratia de uree si de anionii pusi in libertate prin scindarea enzimatica a ureei catalizeaza hidroliza matritei de polimer.
In figura urmatoare sunt reprezentate diferitele tipuri de mecanisme posibile de cedare ale substantelor active din sistemele polimerice vehiculate. Se observa ca in realitate exista o combinatie de mai multe mecanisme.
Figura 14 - Mecanisme posibile de eliberare a substantei active din
microcapsule
|
SISTEME REZERVOR |
SISTEME CU MATRITA |
SISTEME CU MATRITA |
SUBSISTEME BIODEGRA- DABILE |
SISTEME CONTROLATE PRIN UMFLARE |
T=O; I=X |
|
|
|
|
|
| |
|
|
|
|
|
| |
Difuziune Fickprin membrana |
Difuziune Fickprin matrice |
Difuziune Fickprin pori |
Bioeroziunea matricei |
Difuziune clasa II |
Mec. de cedare |
|
|
|
n> | |||
|
constant |
constant |
± constant |
Nu este constant |
nu este constant |
geometrie |
|
posibil |
posibil |
numai cu geometrii speciale |
aproape imposibil |
posibil |
cinetica 0 |
|
inalt |
scazut |
scazut |
mediu |
mediu inalt |
preparate |
|
la defecte ale membranei, eliminare rapida a substantei active |
nepotrivita pentru macro-molecule (peptide) cu eliminarea propr. t1/2 |
eliminare posibila de peptide si proteine eliminarea propr. t1/2 |
eliminare mecanica deoarece eroziunea si difuzia au loc simultan |
alegere limitata a polimerilor |
t3.3.3 Biodegradarea microcapsulelor si examene toxicologice
Polimerii folositi pentru obtinerea peretilor biodegradabili sau biostabili ai microcapsulelor se inscriu in clasa biomaterialelor. Aceste biomateriale administrate prin implantare pot prezenta urmatoarele fenomene toxicologice:
reactie locala a tesuturilor;
actiune toxica sistemica;
reactii alergice;
actiuni cancerigene, teratogene si/sau mutagene.
Examenul toxicologic trebui sa se faca in trei faze:
faza l - teste preclinice in 'vivo' si pe animale;
faza 2- teste pe animale in forma galenica prevazuta pentru administrarea pe oameni;
faza 3 - formele care au trecut de primele doua faze trec la experimentarea clinica pe oameni.
Studiul toxicologic trebuie sa se faca atat asupra substantei active din microcapsule, cat si asupra vehiculelor folosite la administrarea acestora.
In cazul polimerilor biodegradabili trebuie sa se identifice daca ei sunt eliminati din corp fara sa prezinte efecte toxice dupa un anumit timp.
t3.4 Exemple de substante active ce pot fi incorporate in polimeri
biodegradabili
In tabelul urmator au fost reunite exemple de polimeri si substante active care pot forma preparate parenterale retard precum si tehnica folosita la prepararea lor.
Tabelul 4 - Exemple de substante active care au fost incorporate In
polimeri biodegradabili
|
1. CONTRACEPTIVE |
|||
|
Polimer |
Substanta activa |
Tehnica |
Conditii |
|
L-lactid |
d-norgestrel |
film | |
|
L-lactid |
noretilsteron |
implant |
cca. 20 |
|
DL-lactid |
progesteron |
microcapsule | |
|
DL-lactid |
progesteron |
film | |
|
e-caprolactama |
progesteron |
microcapsule | |
|
glutamin sare/etilglutamat |
progesteron |
implant | |
|
t ANTAGONISTI-NARCOTICE |
|||
|
Polimer |
Substanta activa |
Tehnica |
Conditii |
|
L-lactid tributilcitrat |
cyclozocin |
film | |
|
L-lactid tributilcitrat |
cyclozocin |
film | |
|
DL-lactid |
cyclozocin |
microcapsule | |
|
L-lactid / tributilcitrat |
naltrexon |
film | |
|
DL-lactid |
naltrexon pamoat |
microcapsule | |
|
L-lactid / glicolid |
naltrexon pamoat |
film | |
O.M.S. a stimulat interesul pentru obtinerea unui preparat parenteral depot cu actiune anticonceptionala. Se urmareste obtinerea unei forme galenice care sa fie activa cel putin o jumatate de an si care sa nu mai oblige pacienta sa respecte strict o schema de administrare orala.
In tabelul de mai sus au fost trecute substantele care sunt active in doze mai mici de 500 mg/zi, deoarece in caz contrar cantitatea introdusa in microcapsule ar fi prea mare.
Figura urmatoare prezinta modificarea concentratiei sanguine a noretilsteronei dupa injectarea i.m. a unei doze de 300 mg microcapsule ce contin 75 mg substanta activa si acid DL-polilactic.
Marimea granulelor pentru microcapsule este urmatoarea:
A = 10-240 mm
B = 65-125 mm
C = 10- 40 mm
A=10-240 mm, B=65-125 mm, C=10-40mm
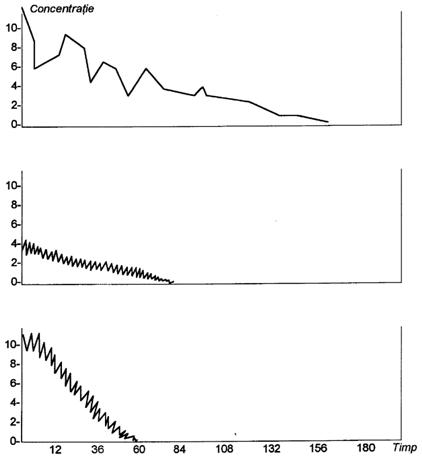
Capsulele au fost obtinute printr-un proces de separare a fazelor si prezinta o activitate cuprinsa intre 60-180 de zile.
In scopul micsorarii perioadei de reabilitare dupa suprimarea drogurilor s-a propus obtinerea de preparate depot continand antagonisti ai narcoticelor. S-a urmarit obtinerea unui sistem cu activitate de 1-3 luni cu urmatoarele substante active: cyclazocin, naloxon, metadona. Sisteme de acest fel se gasesc in experimentare clinica.
In ultimii ani s-au inregistrat progrese importante in ceea ce priveste realizarea preparatelor parenterale cu actiune prelungita. In viitor se asteapta rezolvarea problemelor existente, explicarea unor fenomene mai putin cunoscute in prezent, ca si gasirea de metode care sa conduca la obtinerea de noi preparate parenterale cu actiune prelungita.
Copyright © 2024 - Toate drepturile rezervate