 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Lizozimul este un agent antibacterian natural ce se gaseste in lacrimi si in albusul oului.
Lizozimul din albusul oului de gaina este
un monomer cu 129 de aminoacizi.Aceasta a fost prima enzima a carei structura
tridimensionala a fost determinata , de catre David Philips si colegii in
1965.In structura lui exista patru legaturi bisulfidice stabilizatoare si o
fanta in care se gaseste situsul activ( fig 6-24a,). 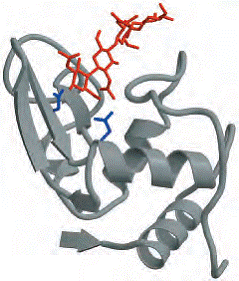
Timp de mai mult de cincii decenii de
studiere a lizozimului au dezvaluit structura detaliata si activitatea enzimei
si o poveste interesanta despre cum a progresat biochimia Substratul
lizozimului este peptioglicanul, un carbohidrat ce se gaseste in majoritatea
peretilor celulari . 
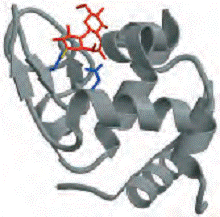
Lizozimul cliveaza legatura glicozidica
C-O ( β1→4) dintre cele doua resturi glucidice din molecula, acidul
N-acetilmuramic ( Mur2Ac) si N-acetilglucozamina (GlcNAc), numite de obicei NAM
si NAG, in literatura de specialitate-enziologie ( fig 6-24b).Sase resturi
alternante de Mur2Ac si GlcNAc in legatura peptidoglicanului se unesc in
situsul activ, in locursurile notate de
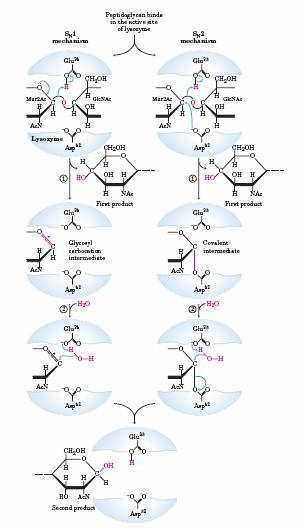
Avand structurile situsurilor active identificate si detaliate ale enzimei, calea spre a intelege mecanismul reactiei parea sa fie deschisa in anii 1960.Totusi, dovezile evidente pentru elucidarea mecanismului au aprut de abia dupa 4 decenii.Exista daoua mecanisme chimice plauzibile ce ar putea genera produsul clivarii legaturii glicozidice.Philips si colegii au propus un mecanism disociativ ( de tip SN1) ( fig 6-25a) in care GlcNAc disociaza initial in pasul nr. 1 pentru a pierde un cation glicozil ( carbocation) ca intermediar.In acest mecanism GlcNAc este protonat prin cataliz acida de catre Glu 35 , localizata intr-un buzunar hidrofilic ce ii ofera gruparii carboxil o pKa neobisnuit de ridicata.arboxicationul este stabilizat prin rezonanta ( ?) implicand inelul de oxigen adiacent, cat si prin interactiunea electrostatica cu incarcatura negativa a Asp alaturat.In pasul nr. 2 apa ataca la C-1 al Mur2Ac pentru a rezulta produsul final.Mecanismul alternativ (fig 6-25a, drepta) implica doua dislocuiri directe succesive.1.Asp 52 ataca C-1 al Mur2Ac pentru a disloca GlcNAc.Ca si in mecanismul anterior, Glu 35 acioneaza ca un acid general si protoneaza GlcNAc.In pasul 2 apa rectioneaza cu C-1 al Mur2Ac pentru a scoate Asp 52 si a obtine produsul final.
Mecanismul descris de Philips SN1 bazat pe considerente structurale si completat cu o serie de studii depre legarea cu sbstraturi artificiale, a fost general acceptat pentru mai mult de trei decenii.Totusi, unele controverse au persistat si testele au continuat.Metoda stiintifica uneori promoveaza incet o idee si uneori un experiment relevant este greu de conceput.Unele dintre argumentele timpurii ale teoriei lui Philips au fost sugestive dar nu suficeint de convingatoare.De exemplu, timpul de injumatatire al cationului glicozil era destul de lung, estimat la aproximativ 10 -12 secunde, mai lung decat vibratia moleculara dar nu suficeint de lung pentru difuziunea necesara moleculelor.Mai mult, lizozimul face parte din familia de enzime numita « glicozidaze de retinere/fixare », care catalizeazareactii in care produsul are aceeasi configuratie anomerica ca si substratul si despre care se cunoaste ca au internediari rectivi covalenti asa cum este prezentat in calea alternativa ( SN2) .Prin urmare, mecanismul Philips era in contradictie cu descoperile experimentale legate de enzime asemanatoare.
Un experiment convingator a scimbat in mod decisiv parerea despre calea SN2, efectuat de Stephen Withers si colaboratorii in 2001.Folosind o enzima mutanta ( inlocuid restul din pozita 35 de Glu cu Gln) si substraturi artificiale, care combinate au incetinit viteza de reactie a etapelor chieie, au reusit sa stabilizeze intermedairul covalent derutant.Aceasta le-a permis sa observe intermediarul direct, folosind spectrometria « both mass » si cristlografia cu raze x ( fig 6-25b).
Este acum mecamismul de actiune al
lizozimului ? Nu. O caracteristica esentiala a cercetarii stiintifice a
fost enuntata de Albert Einstein « Nu exista suficiente expermente care
sa dovedeasca ca am dreptate ; dar un singur experiment poate sa
dovedeasca ca m-am inselat ».In cazul mecanismului lizozimului un argument
puternic ( si unii il sustin) este acela ca substraturile artificiale, cu
substitutia flurinei

Copyright © 2024 - Toate drepturile rezervate