 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Influenta unor substante medicamentoase asociate cu socul termic si extracte vegetale asupra diviziunii celulare la Allium cepa
Aceasta lucrare are drept scop observarea mecanismelor diviziunii celulare si testarea unor substante ce pot influenta, in diferite moduri acest proces vital existentei. Ca metoda de lucru am ales metoda teoretica, prin consultarea unei vaste bibliografii, si metoda practica, prin care vom evidentia atat diviziunea celulara normala, cat si cea influentata de anumiti factori. Se incearca obtinerea unor rezultate care sa deschida o cale spre o cercetare mai complexa in urma careia sa reiasa anumite proprietati sau diferite efecte pe care factorii testati le au asupra procesului de diviziune celulara.
A. Diviziunea propriu-zisa
Diviziunea celulara are mai multe modalitati de desfasurare. Dintre acestea, P. Grasse (1952) remarca existenta a doua tipuri fundamentale: pleuromitoza si ortomitoza.
Mitoza propriu-zisa (sau ortomitoza adevarata) reprezinta cea de-a patra perioada a ciclului celular (sau perioada mitotica - M), in care se desfasoara procesele distributive. Lungimea totala a materialului genetic este foarte mare (o celula umana tipica are aproximativ 2 m de ADN - o lungime de aproape 250.000 de ori mai mare decat diametrul celulei ), si de aceea distributia echilibrata a materialului genetic si a altor substructuri celulare este un proces complex ce se desfasoara continuu, dar pentru usurarea intelegerii este secventializat in mod conventional in 4 faze: profaza, metafaza, anafaza si telofaza, in timpul carora au loc transformari biochimice si morfologice caracteristice, care determina in final formarea a doi nuclei fii si a doua celule fiice cu acelasi numar de cromozomi cu al celulei ce s-a divizat.
|
|
|
Foto 1: Interfaza Profaza Prometafaza |
|
|
|
Foto 2: Metafaza Anafaza Telofaza |
Profaza
Profaza se caracterizeaza prin individualizarea cromozomilor, la inceput sub forma unor filamente duble, subtiri, intim asociate, formand asa numitul spirem (ghem), dispersate in toata masa nucleului. In tot cursul profazei cromatidele sufera un proces de spiralizare, care are drept consecinta condensarea, scurtarea si ingrosarea acestora, cromozomii devenind din ce in ce mai evidenti. Datorita spiralizarii si condensarii, are loc scurtarea filamentelor cromatidice la cca. 1/9 - 1/10 din lungimea lor initiala. Pe masura ce profaza inainteaza, spirele isi maresc diametrul si se reduc ca numar, dand posibilitatea evidentierii lor la microscop.
In profaza diviziunii mitotice, cromatidele raman unite la nivelul centromerului, se rasucesc strans una in jurul alteia, separarea lor realizandu-se cu mare greutate. Acest mod de spiralizare este denumit plectonemica.
Cromozomii sunt in contact permanent cu invelisul nuclear. In timp ce ciclul de rasucire continua, nucleolul (sau nucleolii) isi micsoreaza volumul, se fragmenteaza, iar la sfarsitul profazei se dezorganizeaza. In stadiul final al profazei are loc, de asemenea, dezorganizarea invelisului nuclear, fuziunea carioplasmei cu hialoplasma si formarea mixoplasmei.
Sunt studii care arata ca o parte a materialului nuclear intra in compozitia cromozomilor iar condensarea partiala a lor s-ar datora depunerii de ARNn.
La inceputul profazei, sau inaintea acesteia, centrozomul constituit din doi centrioli (diplozom), se inconjoara de aster si se dedubleaza. Cei doi centri celulari rezultati, fiecare alcatuit din doi centrioli, se indeparteaza unul de altul si se plaseaza la cei doi poli opusi ai celulei. In jurul fiecarui diplozom se dispun fibre ce constituie asterul.
In timpul deplasarii centriolilor, are loc biosinteza de microtubuli care vor forma firele (fibrele) fusului de diviziune. Se considera ca fusul este constituit din doua tipuri de fibre ce se deosebesc prin origine, mod de formare si functii. S-au identificat fibre continue, care sunt dispuse intre cei doi diplozomi fara a fi in legatura cu acestia si fibre cromozomice. Fibrele continue formeaza fusul central (sau primar). Studiul la microscopul electronic a demonstrat ca aceste fibre sunt constituite din numerosi microtubuli cu diametrul de 200-250 A. In lumina polarizata, fusul de diviziune este birefringent, ceea ce demonstreaza natura chimica si orientarea paralela a celor doua tipuri de fibre (continue si cromozomice). Natura fibrilara a fusului este demonstrata si de vascozitatea mai mare fata de cea a hialoplasmei inconjuratoare.
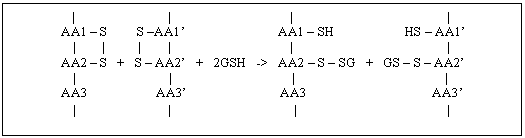 Analiza
chimica a fusului de diviziune a evidentiat prezenta in
cantitate mare a proteinelor asociate cu lipide si a unei enzime care
actioneaza asupra ARN si ATP. S-a evidentiat faptul ca
diferentierea fusului de diviziune coincide cu o crestere a
proportiei gruparilor -SH legate de proteine. La inceputul mitozei,
legaturile -S-S- care asigura legarea aminoacizilor in lantul
polipeptidic in zona in care se diferentiaza fusul se rup, in
prezenta gruparilor sulfhidrice -SH, datorita interventiei
glutationului G-SH.
Analiza
chimica a fusului de diviziune a evidentiat prezenta in
cantitate mare a proteinelor asociate cu lipide si a unei enzime care
actioneaza asupra ARN si ATP. S-a evidentiat faptul ca
diferentierea fusului de diviziune coincide cu o crestere a
proportiei gruparilor -SH legate de proteine. La inceputul mitozei,
legaturile -S-S- care asigura legarea aminoacizilor in lantul
polipeptidic in zona in care se diferentiaza fusul se rup, in
prezenta gruparilor sulfhidrice -SH, datorita interventiei
glutationului G-SH.
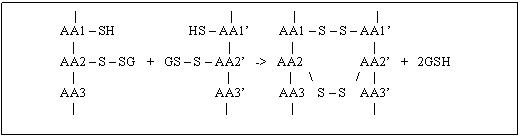 Aceste fragmentari
explica alungirea lanturilor proteice si transformarea lor in
molecule fibrilare lungi ce vor constitui fibrele fusoriale. Acestea
capata o orientare specifica datorita noilor legaturi
care se stabilesc intre moleculele proteice.
Aceste fragmentari
explica alungirea lanturilor proteice si transformarea lor in
molecule fibrilare lungi ce vor constitui fibrele fusoriale. Acestea
capata o orientare specifica datorita noilor legaturi
care se stabilesc intre moleculele proteice.
Glutationul este o tripeptida importanta cu o raspandire universala in celule. Se gaseste in cantitate mai mare in drojdia de bere, in ficat (170mg %), in splina (100mg %) si joaca rol de coenzima a unei serii intregi de enzime. Datorita usurintei cu care se oxideaza functia -SH din molecula, glutationul joaca un important rol in procesele de oxidoreducere din cadrul metabolismului.
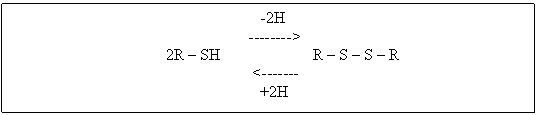
Oxidarea formei tiolice (R-SH) este realizata cu usurinta de oxigenul molecular cu participarea catalitica a urmelor unor metale, iar reducerea formei disulfurice (R-S-S-R) se realizeaza prin participarea unei enzime specifice - glutationreductaza, prezenta in celulele tuturor organismelor.
Fusul nuclear este o structura alcatuita din filamente intinse intre cei doi poli ai celulei, care apare in prometafaza diviziunii celulare. Fibrele fusului sunt compuse din microtubuli lungi, cilindrici. Cromozomii se ataseaza de fibrele fusului prin intermediul unei regiuni specializate numite chinetocor. Migrarea cromozomilor este determinata de fortele contractile ale microtubulilor.
In profaza timpurie si mijlocie continua sinteza de ARN si de proteine nonhistonice cu rol contractil, molecule ce vor contribui la structuralizarea cromozomilor si edificarea aparatului acromatic. In profaza tarzie se constata intreruperea sintezei de ARN si proteine care coincide cu dezorganizarea nucleolului. Blocarea sintezelor este explicata pe baza observatiilor ca cromozomii condensati sunt inactivi din punct de vedere genetic.
Metafaza
In metafaza timpurie are loc deplasarea cromozomilor catre regiunea centrala a celulei. In aceasta etapa, care constituie prometafaza, cromozomii se afla intr-o continua miscare, apropiindu-se cand de un pol al celulei, cand de celalalt. Observatiile arata ca miscarile oscilatorii pe care le executa cromozomii se datoreaza probabil acelorasi forte ce determina deplasarea cromozomilor in zona centrala. Miscarea lor catre centrul celulei si orientarea lor sunt determinate partial de fibrele fusului acromatic. Cu toate ca miscarile cromozomilor sunt sincrone, fiecare cromozom actioneaza independent de ceilalti. In metafaza propriu-zisa are loc desavarsirea fusului acromatic, iar cromozomii se dispun in regiunea ecuatoriala a celulei unde formeaza un inel in jurul fusului de diviziune, numit "coroana" sau "placa ecuatoriala", care este perpendiculara pe axa fusului de diviziune si la distanta egala de polii celulei.
|
|
|
Foto 3 |
Cromozomii se fixeaza prin intermediul centromerului (chinetocorului) de fibrele cromozomice. Se considera ca fibrele fusului de diviziune sunt rezultatul interactiunii dintre chinetocori si centrioli.
La speciile care au atat cromozomi mari cat si mici, cei mari sunt aproape intotdeauna dispusi periferic, iar cei mici central.
In metafaza se continua spiralizarea cromozomilor. Spirele somatice au in aceasta faza diametrul cel mai mare, sunt in numar mai mic, iar spirele relationale dispar. Disparitia spirelor relationale se datoreaza in primul rand scurtarii cromozomilor si transformarii lor in spire somatice. Ca urmare, cromatidele nu mai sunt rasucite una in jurul celeilalte, ci sunt dispuse alaturat. In aceasta faza, cromozomii realizeaza condensarea maxima, ceea ce faciliteaza evidentierea lor la microscopul fotonic si distributia echilibrata a produsilor de replicatie. La sfarsitul prometafazei are loc clivarea chinetocorului, iar cromatidele surori devin independente.
Sfarsitul anafazei este marcat de gruparea tuturor cromozomilor la cei doi poli ai celulei. Este posibil ca in unele celule sa continue procesul de spiralizare si in anafaza, astfel incat cromozomii sa devina chiar mai condensati decat in metafaza, dar de regula se constata o diminuare a spiralizarii, insotita de o usoara crestere in lungime a cromozomilor. Pe masura ce cromozomii se deplaseaza spre polii celulei, in zona ecuatoriala apar fibre paralele ce se alungesc si a caror infrastructura corespunde cu a microtubulilor. In timpul deplasarii cromozomilor, fibrele cromozomale ale fusului se scurteaza, iar cele continue se dezorganizeaza prin fragmentare in zona ecuatoriala.
|
|
|
Foto 4: Deplasarea cromozomilor |
In legatura cu mecanismul deplasarii cromatidelor, respectiv al cromozomilor la cei doi poli, parerile sunt contradictorii. Ipoteza potrivit careia deplasarea este rezultatul interventiei unei forte de "atractie" sau "repulsie" de natura electronica a fost abandonata in ultimul timp. Mai demna de luat in considerare este presupunerea ca miscarea cromozomilor se datoreaza modificarii macromoleculelor fusoriale. In timpul ascensiunii cromozomilor are loc contractia fibrelor cromozomice care se scurteaza si astfel trag spre cei doi poli cromatidele fiice. Se presupune ca fibrele fusului de diviziune se scurteaza prin depolimerizarea microtubulilor.
|
Foto 5: Experiment |
Experimente asupra fusului de diviziune, in care acesta a fost marcat cu substante fluorescente iar apoi intre poli si ecuator cu ajutorul laserului a fost stinsa fluorescenta, au demonstrat ca microtubulii chinetocorali se scurteaza la capatul la care sunt atasati cromozomii monocromatidici. Acesta este doar unul din experimentele in sprijinul ipotezei depolimerizarii microtubulilor de catre chinetocori in timpul anafazei. Chinetocorii au in structura lor o proteina motor care in timpul depolimerizarii elibereaza subunitati de tubulina din fibrele fusului, astfel se realizeaza deplasarea cromozomilor fii spre cei doi poli. |
Indiferent de modul in care se realizeaza ascensiunea cromozomilor, se considera ca chinetocorul functioneaza ca un element motor al cromozomilor, inactivitatea lui prin iradiere UV ducand la blocarea ascensiunii polare a cromozomilor
Telofaza
Cromozomii ajunsi la polii celulei sufera numeroase transformari, parcurgand un proces invers celui din profaza. Cromozomii se prezinta la inceputul telofazei sub forma unor fibre fine, alungite si incolacite unele in jurul altora, iar ulterior formeaza o masa compacta pierzandu-si individualitatea optica. In aceasta perioada se continua despiralizarea cromozomilor si se reface starea interfazica, evidentiindu-se heterocromatina si eucromatina. Desi nu se cunosc modificarile care au avut loc la nivelul centromerilor, se presupune ca ei raman intr-o stare condensata. In telofaza se reorganizeaza nucleolul (nucleolii) si invelisul nuclear si are loc dezorganizarea aparatului acromatic.
Citokineza (citodiereza)
Sfarsitul telofazei coincide cu diviziunea citoplasmei, fenomen cunoscut sub numele de citokineza. Aceasta se realizeaza prin diferentierea unui nou perete celular a carui edificare poate fi centripetala sau centrifugala.
|
|
|
Foto 6 |
Citokineza centripetala este caracteristica multor grupe de plante inferioare (alge, ciuperci.) precum si la celula animala. Are loc prin diferentierea centripeta a peretelui celulei mame sub forma unui pliu ce se inchide treptat, similar unei diafragme iris. Locul de initiere a peretelui difera, astfel diviziunea putand fi centrica sau excentrica.
Citokineza centrifugala. Este prezenta in special la celula vegetala. In timp ce are loc organizarea nucleilor fii, fusul de diviziune constituit in exclusivitate din filamentele continue (necontractile) persistente in telofaza, se scurteaza si se dilata in zona ecuatoriala pana ating peretii celulei mama. Masa plasmatica in care este inglobat fusul de diviziune rezidual constituie fragmoplasmul. In zona centrala a fragmoplasmului se diferentiaza placa celulara la formarea careia participa veziculele golgiene si ale RE, care se acumuleaza in regiunea ecuatoriala a celulei. Placa celulara este perpendiculara pe axul fusului de diviziune, la distante egale de cei doi poli ai fusului; se dezvolta din centru spre periferie si se incheie in momentul sudarii cu peretii celulei mama.
R. Buvat si A. Puissant (1958) au observat in celulele merismatice de Allium cepa acumularea in regiunea ecuatoriala a celulei a unor vezicule printre care se intercaleaza fragmente de RE. Veziculele pectice se aglomereaza mai mult in zona centrala unde procesul de formare a placii celulare este mai avansat si progreseaza catre laturi pana atinge peretii celulei mama. In acest mod se formeaza peretele primordial care imparte celula initiala in doua celule fiice. De o parte si de alta a placii celulare, protoplastii celor doua celule isi elaboreaza peretii primari proprii; din acest moment peretele primordial
|
|
|
Foto 7 |
devine lamela mijlocie.
Peretele despartitor atinge simultan peretele celulei mama sau succesiv, in ultimul caz peretele celular inainteaza centrifugal si atinge peretele celulei mama decalat.
Dupa diviziune fiecare celula fiica creste pana ce atinge aproximativ marimea celulei mama. In timpul diferentierii peretelui despartitor, organitele celulare (plastidele, mitocondriile, dictiozomii.), dupa ce au suferit un proces de diviziune, se repartizeaza egal sau aproape egal la cele doua celule fiice.
Sunt cunoscute cazuri in care diviziunea celulara nu este insotita de plasmodiereza. Asa este cazul ciupercilor din ordinul Siphonomycetes si al algelor Siphonales. In alte cazuri, dupa un anumit numar de diviziuni nucleare se observa aparitia simultana de celule in masa citoplasmatica plurinucleata. Acest fenomen a fost denumit de E. Strassburger "diviziunea libera a nucleului cu formare multipla de celule" si observat la formarea sacului embrionar de la angiosperme.
Mitoza este un proces cu desfasurare foarte regulata, controlat genetic. Aproape fara exceptie, prin diviziunea mitotica se formeaza doi nuclei identici citologic si genetic cu nucleul din care au provenit. Acest mecanism de diviziune celulara are o semnificatie biologica foarte importanta. Se considera ca si "reintinerirea" celulei sau prevenirea imbatranirii sunt rezultatul diviziunii celulare. Cresterea si diferentierea tesuturilor si organelor sunt rezultatul diviziunii celulare.
B. Actiunea unor factori fizici si chimici asupra diviziunii celulare
Numeroase cercetari intreprinse nu au reusit sa elucideze cauzele care determina declansarea diviziunii celulare. Declansarea mitozei nu se datoreaza numai unei cresteri a celulei, cresterea nefiind un factor determinant al mitozei. Pentru desfasurarea normala a mitozei un rol important il au PH-ul, oxigenul, lumina, temperatura, dar acesti factori nu au un rol decisiv in declansarea mitozei. De asemenea, diferitele sinteze ce au loc in interfaza (ADN, ARN, histone) nu sunt obligatoriu urmate de diviziunea celulara.
Studiile "in vitro" au evidentiat existenta unei game largi de substante chimice cu rol in declansarea si stimularea diviziunii mitotice.
Auxina - acidul b-indolilacetic (C H O N)
- Auxina este un fitohormon care deriva din triptofan. Auxinele sunt elaborate in celulele tinere din regiunile terminale ale plantei si controleaza procesele fiziologice care determina reglarea cresterii, controleaza elongatia celulelor si diverse tropisme.
- Experientele efectuate pe culturi de tesuturi vegetale de la dicotiledonate au demonstrat actiunea stimulatoare a auxinei asupra diviziunii celulare. S-a constatat ca tesuturile care nu elaboreaza auxina sunt incapabile sa se multiplice spontan, dar intra in diviziune daca sunt "crescute" in prezenta auxinei. Celulele tinere, daca sunt crescute in medii lipsite de auxina, ele prolifereaza, datorita capacitatii lor de a sintetiza auxina, pe cand celulele mature nu cresc in absenta auxinei datorita incapacitatii acestora de a o elabora.
Kinina si citokinina
- Acestia sunt compusi sintetici care, in anumite conditii, au un rol stimulator asupra diviziunii celulare la plante. Kinina si citokinina sunt diferite 6-aminopurine, dintre care unele sunt naturale, ca de exemplu: zeatina 6(4-hidroxi-3-metilbutenil) adenina, identificat la Zea mays si 6(3-metil-butenil) adenina in Corynebacterium fascians. S-a constatat ca kinetina, in concentratii foarte mici, inhiba sinteza acizilor nucleici. Sub actiunea kinetinei timp de 12h inhiba sinteza de ARN, iar o expunere de 24h inhiba complet sinteza acizilor nucleici (ADN si ARN). Citokinina inhiba si anumite enzime, actionand ca depresor al genelor.
- Zeatina este mult mai activa decat kinetina. In concentratie de 0.1mg/l stimuleaza diviziunea parenchimului la morcov, in timp ce kinetina are acelasi efect in concentratie de 1mg/l.
- Kinetina si auxina, in anumite concentratii, determina alungirea peretelui celular, inhiba sau stimuleaza dezvoltarea mugurilor si radacinilor, avand si alte efecte morfogenetice. Kinetina si auxina, impreuna, maresc adesea activitatea mitotica mai mult decat fiecare administrata separat.
Giberelinele
- Sunt produsi ai metabolismului ciupercii Gibberella fujikuroi, care paraziteaza plantele tinere de la Oryza sativa. Giberelinele stimuleaza diviziunea celulara si intervin in numeroase procese fiziologice, ca, spre exemplu, in procesul de inflorire al plantelor. Se presupune, de asemenea, ca giberelinele actioneaza ca depresor al genelor care controleaza sinteza de ARNm si determina modificarea echipamentului enzimatic al celulei. Giberelinele actioneaza numai in prezenta auxinei. J. Wildiers (1901) a semnalat un factor indispensabil cresterii drojdiilor, denumit bios. Analiza chimica a demonstrat ca acest factor este constituit din 4 substante: eso-inositol, vitamina B1, biotina si acidul pantotenic. Bios favorizeaza diviziunea celulara si catalizeaza sinteza protoplastului.
Acidul "traumatic" ("traumatina")
- Este o substanta cu actiune hormonala care intervine in cazul ranirii plantei, grabind cicatrizarea zonei respective.
Fitohemaglutinina si tiroxina
- Acestia sunt factori ce declanseaza si stimuleaza diviziunea celulei animale.
Probabil mai sunt si alti compusi naturali care, in anumite concentratii, stimuleaza diviziunea celulei vegetale si animale.
Studiile intreprinse pe culturi de celule sau tesuturi merismatice cu o gama larga de agenti fizici si substante antimitotice au dus la gruparea lor in trei clase: cu actiune mitorepresiva, mitoclasica si radiomimetica.
Substante cu actiune mitorepresiva
antipirina - blocheaza complet intrarea nucleilor in profaza, acestia ramanand in interfaza
izoniazida - impiedica declansarea profazei si incetineste desfasurarea sa
hidrazida maleica - inhiba intrarea nucleilor in profaza, dar da posibilitatea desfasurarii in continuare a diviziunii incepute deja
Substante cu actiune mitoclasica
- Actioneaza asupra fusului de diviziune, blocand formarea acestuia. In afara colchicinei, studiata intens si utilizata pentru inducerea experimentala a poliploidiei, din acest grup fac parte acenaftenul, fenilmetanul, a-monofluoronaftalena, a‑monocloronaftalena, a‑monobromonaftalena, a-monoiodonaftalena.
- Sub actiunea colchicinei, diviziunea celulara capata un aspect caracteristic denumit C-mitoza si, respectiv, C-meioza. Actiunea chimica a colchicinei se exercita asupra structurii submicroscopice si microscopice a fibrelor fusului acromatic, provocand o dezorganizare a acestora si o inhibare a formarii fusului de diviziune celulara. Colchicina nu blocheaza formarea profazei si clivarea cromozomilor. In absenta fusului de diviziune, cromozomii nu au posibilitatea sa migreze catre polii celulei, si se imprastie in citoplasma, fara a mai forma placa ecuatoriala, avand de a face in acest caz cu o "pseudo-metafaza". Cromatidele surori ale fiecarui cromozom raman unite la nivelul centromerului, avand aspectul literei "X". Urmeaza separarea cromatidelor in regiunea centromerului, unde se dispun paralel sub forma unei perechi de schiuri (A. Levan, 1938). Procesul de diferentiere a cromozomilor continua, astfel ca cele doua cromatide ale fiecarui cromozom devin cromozomi independenti si, in final, in interiorul celulei initiale se formeaza un nucleu de restitutie. In constitutia acestui nucleu intra un numar dublu de cromozomi, fata de celula initiala; supusa actiunii colchicinei, va lua nastere o celula tetraploida. Daca actiunea colchicinei continua, rezulta celule 8-ploide, 16-ploide, etc. Acest fenomen de blocare a fusului acromatic si de formare a nucleului de restitutie a fost denumit statmocineza.
Agentii radiomimetici
- Intarzie intrarea celulelor in diviziune prin blocarea sintezei ADN sau depolimerizarea ADN deja sintetizat. Radiatiile ultraviolete, razele X si gamma au efect asupra desfasurarii normale a diviziunii celulare. Prin iradiere are loc o perturbare a metabolismului acizilor nucleici, ceea ce determina o acumulare de ARN in citoplasma celulei. Radiatiile inhiba diviziunea celulara, iar perioada in care celulele nu se divid este proportionala cu doza. Blocarea diviziunii este doar temporara si, dupa un anumit timp, celula isi recapata capacitatea de diviziune.
- S-au identificat numeroase substante radiomimetice, ca de pilda: trietilenmelanina, trietilenfosforamida, uretanul, iperita, diferite antibiotice (sulfamida, actinomicina D, cloramfenicolul, mitomicina C, etc.). Un rol radiomimetic il au analogii bazelor pirimidinice si purinice (5-fluoruracil; 6-azauracil; 2-tio-5-metilcitozina; 6-azatimina; 6-mercaptopurina; 8-azaguanina; 6-tioguanina; 6-cloropurina; etc.). Analogii bazelor pirimidinice si purinice, avand o structura asemanatoare cu aceea a bazelor pirimidinice si purinice, pot fi incorporati in macromoleculele acizilor nucleici, in locul acestora, avand drept rezultat aparitia mutatiilor.
- Se pot testa si alte substante cu potential inhibitor sau stimulator al mitozei. In experimentul meu am folosit medicamentul colchicina respectiv un extract alcoolic din planta Chelidonium majus.
A) Metoda rapida de colorare cu solutie de carmin acetic a cromozomilor mitotici la plante
Materiale necesare
Sticla cu dop rodat si cilindri gradati de diferite capacitati (100 pana la 1000ml), vase Erlenmayer, baloane de sticla, palnii de sticle, lampi de spirt, sticle de ceas sau cristalizoare mici (25ml), fiole de sticla, lame si lamele microscopice, hartie de filtru, pense, ace spatulate, microscop de laborator. Dintre substante sunt necesare: alcool etilic absolut, acid acetic glacial, a-bromnaftalen (C H Br), colchicina, carmin, acid clorhidric normal (HCl 82,5ml la 1000ml apa distilata). Ca material biologic se pot folosi bulbi de ceapa, seminte de ceapa, cariopse de secara, orz, etc.
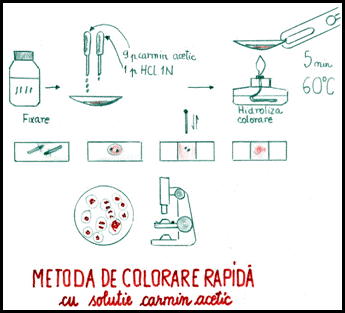 Mod de lucru
Mod de lucru
1. Prepararea emulsiei de a-bromnaftalen: intr-o sticla cu dop rodat se pun 75% apa distilata si 25% a‑bromnaftalen. Se agita puternic si apoi se lasa cateva minute ca excesul acestei substante chimice sa se depuna la fundul sticlei. Cu o pipeta se ia apoi emulsia din partea superioara si se pun 2-3cm in mici fiole de sticla (5cm lungime, diametru de 10-12mm). In aceasta emulsie se introduc varfurile de radacini embrionare si se lasa 3-5 ore.
2. Prepararea fixatorului: varianta a - alcool etilic absolut 3 parti + 1 parte acid acetic glacial; varianta b - apa acetica (45ml acid acetic glacial + 55ml apa distilata).
3. Prepararea colorantului: carmin acetic 2% (apa acetica 100ml + 2g carmin pulbere). Se amesteca intr-un balon de sticla, se lasa sa fiarba cca. 30min, apoi se raceste, se filtreaza si se pastreaza in sticle brune cu dop rodat.
4. Pregatirea materialului biologic. Intrucat cromozomii se diferentiaza in timpul diviziunii celulare, pentru evidentierea lor se folosesc tesuturi cu diviziuni numeroase cum sunt meristemele radiculare. Pentru aceasta se pun bulbii de ceapa cu discul (tulpina adevarata) in pahare cu apa la incoltit sau seminte de ceapa, cariopse de orz, secara, etc., la germinat in cutii Petri, pe hartie de filtru umectata cu apa. Cand radicelele au cca. 1cm lungime, se recolteaza in fiole cu solutie de colchicina (0.5%) sau emulsie de a-bromnaftalen.
a) Prin acest tratament se realizeaza prefixarea care are rolul de a distruge fusul de diviziune si de a opri diviziunea celulara in stadiul de metafaza , cand cromozomii sunt condensati la maximum si pot fi identificati morfologic.
b) Dupa 3 ore se indeparteaza solutia in care s-a facut prefixarea.
Radicelele se trec intr-o sticla de ceas sau o capsula de sticla cu solutie de carmin-acetic 2% la care se adauga cateva picaturi de acid clorhidric normal (9 parti solutie carmin-acetica + 1 parte acid clorhidric normal). Se incalzeste la flacara unei lampi de spirt (5min radicelele de ceapa si 10-14min cele de cereale), evitand fierberea. Prin acest tratament se realizeaza concomitent fixarea (omorarea celulelor si pastrarea nealterata a morfologiei constituentilor citoplasmatici), hidroliza (inmuierea tesuturilor prin distrugerea partiala a lamelelor celulozopectice dintre celule) si colorarea cromozomilor.
5. Efectuarea de preparate microscopice proaspete, prin metoda squash. Pe o lama microscopica se asaza o radicela de la care se detaseaza numai zona merismatica din varf (cca. 3mm) cu un ac spatulat. Se pune o picatura de carmin acetic 2% (fara HCl) si se aplica deasupra o lamela. Apoi cu un bat se bate usor pentru a evita spargerea si a etala celulele intre lama si lamela, astfel incat sa fie un strat uniform celular; se face in acelasi timp o buna etalare a cromozomilor.
La microscop se vor observa: nucleele interfazice, celule in profaza, celule in metafaza si, cu o frecventa mai mica, celule in anafaza sau telofaza.
B) Metoda Feulgen de evidentiere a cromozomilor mitotici la plante
Materiale necesare
Cele necesare pentru metoda descrisa anterior, frigider, termostat reglat la 60 C, fuxina bazica, metabisulfit de potasiu (K S O ), carbune vegetal.
Mod de lucru
1. Prepararea colorantului. Reactivul Schiff se prepara astfel:
se ia 1g de fuxina bazica sub forma de cristale, se transforma in pudra si se pune intr-un balon de sticla; peste aceasta pudra se toarna apa distilata 200cm3 la 100 C, se agita puternic si se lasa sa se raceasca la 50 C; se filtreaza si se adauga apoi 30cm3 acid clorhidric normal; se adauga 3g metabisulfit de potasiu (K S O ) sub forma de cristale (se evita preparatul sub forma de pudra care se altereaza repede prin pierderea de SO
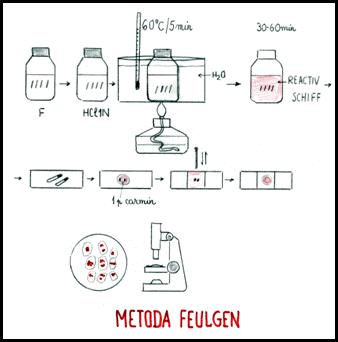 se lasa solutia 24 de ore intr-o sticla
bine inchisa la intuneric si la rece. Dupa acest timp,
solutia are o culoare rosie-violacee.
se lasa solutia 24 de ore intr-o sticla
bine inchisa la intuneric si la rece. Dupa acest timp,
solutia are o culoare rosie-violacee.
pentru decolorarea solutiei se adauga 0.5g carbune vegetal; se lasa aproximativ un minut si se filtreaza repede prin hartia de filtru;
solutia se poate pastra timp indelungat la intuneric si la rece (4 C)
2. Pregatirea materialului.
Prefixarea se realizeaza in emulsie de colchicina (0.5%) timp de 3 ore. In experimentul meu am folosit medicamentul colchicum ce contine colchicina 1mg per comprimat. Acesta este folosit in accesul de guta, fiind antiinflamator si citostatic. Pentru a-i spori efectul l-am asociat cu socul termic.
3. Preparatele microscopice se fac prin etalarea materialului intre lama si lamela intr-o picatura de apa acetica sau carmin acetic (fara HCl), la fel ca in cazul precedent.
La microscop se observa nucleele si cromozomii colorati in rosu-violaceu, iar citoplasma aproape incolora.
C) Tehnica realizarii microfotografiilor
Materiale necesare
Modul de lucru
Se analizeaza preparatele microscopice si se aleg imaginile cele mai bune care corespund scopului lucrarii.
q Se ataseaza aparatul fotografic la microscop prin intermediul piesei intermediare.
q Se are in vedere ca sursa de lumina a microscopului sa fie corespunzatoare si campul microscopic sa fie uniform luminat.
q Pentru a afla timpul de expunere se fac fotografii succesive, stabilind, dupa developarea filmului si analiza imaginilor de proba valoarea optima a acestuia.
q Pentru actionarea sistemului de expunere am folosit un declansator flexibil.
q Filmul astfel obtinut cu imaginile microscopice a fost prelucrat la un atelier foto in sistem computerizat.
|
Conditii de germinare :- t = 24 C inregistrata cu un termometru de camera cu alcool ; - T = 48h - U = 70% inregistrata cu higrometru didactic |
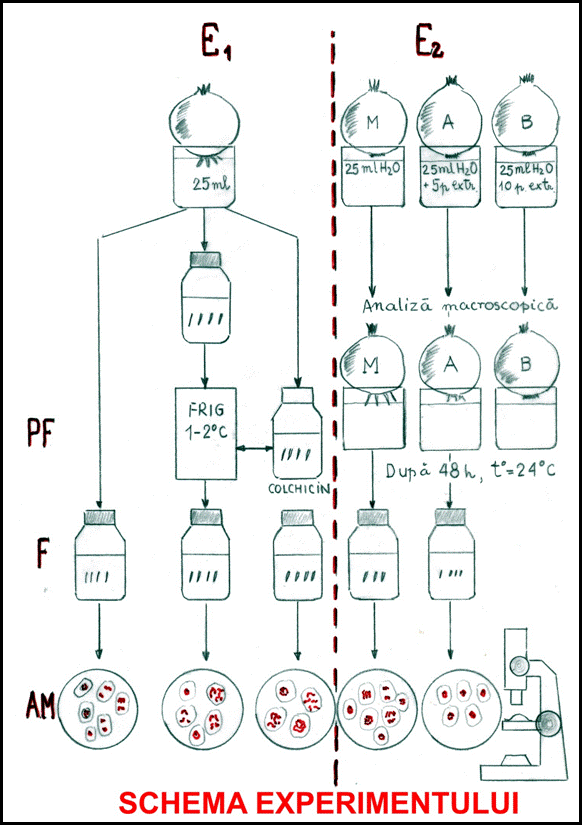
1. Evidentierea diviziunii celulare normale:
Am folosit bulbi de ceapa normali pe care i-am pus in apa (25ml) si au fost lasati 48 ore la incoltit. Dupa doua zile se observa la baza bulbului radicele numeroase de lungime de aproximativ 1-2cm. Dupa ce acestea se recolteaza, se fixeaza intr-o fiola cu fixator Carnoy. Acesta va omori celulele de ceapa, conservand faze ale diviziunii celulare. Apoi se aplica cele doua metode descrise anterior, dupa care urmeaza analiza microscopica a preparatului. Se vor observa celule aflate in toate fazele diviziunii la un preparat bun.
2. Diviziunea celulara influentata de scaderea brusca de temperatura:
Vom folosi un bulb de ceapa care, dupa ce a fost lasat in apa la temperatura camerei, va fi supus unei bruste scaderi de temperatura, punandu-l la frigider. Pentru a stimula si corela efectul distructiv al socului termic ,in apa am introdus o tableta de colchicina. Dupa cca. 10 ore la temperatura de 2 C, radicelele se fixeaza in fixator Carnoy si se analizeaza la microscop dupa preparare. Se va observa distrugerea fusului de diviziune la numeroase celule.
3. Diviziunea celulara influentata de colchicina:
Dupa ce bulbul va fi lasat 2 zile pentru ca radicelele sa ajunga la o lungime optima, acestea se recolteaza si sunt prefixate in colchicina ,2-3 tablete la 25ml apa timp de 10 ore, dupa care sunt fixate in fixator Carnoy. Dupa preparare si analiza microscopica se va observa efectul distrugator al colchicinei asupra fusului de diviziune. Colchicina se foloseste pentru obtinerea speciilor poliploide la plante.
4. Diviziunea celulara influentata de extract alcoolic de Chelidonium majus:
Rostopasca (Chelidonium majus):
|
|
|
Foto 8 |
- Este o planta ierboasa, vivace, in pamant are un rizom bine dezvoltat si ramificat, brun inchis la exterior si galben portocaliu la interior. Infloreste incepand din luna aprilie pana in septembrie - creste pe langa case, printre daramaturi, prin padurile umbroase. Planta contine cea mai mare cantitate de alcaloizi in luna aprilie, la inceputul infloririi. Analizele de laborator dovedesc ca radacinile contin alcaloizi in proportie de pana la 1.4% iar partile aeriene ating cel mult 0.6%, tulpinile avand o cantitate ceva mai ridicata. Planta contine un suc laptos, galben portocaliu cu efect iritant puternic asupra pielii.
- Extragerea principiilor active: se recolteaza tulpinile aeriene cu ramificatii si frunze; se fragmenteaza tulpinile cu ajutorul unui foarfece mare; fragmentele rezultate se pun intr-un borcan de 400ml peste care se toarna alcool 60 pana ce acopera materialul vegetal; se lasa la macerat timp de 12 zile; dupa acest timp lichidul alcoolic incarcat cu principiile active se trage intr-o sticla bruna.
a) Mai intai se testeaza diviziunea celulara influentata de 5 picaturi de extract la 25ml de apa. Dupa doua zile se observa o crestere incetinita comparativ cu cea normala. Dupa fixare si preparare se observa o densitate mult scazuta a celulelor aflate in metafaza, anafaza si telofaza, majoritatea fiind in profaza sau interfaza.
b) Se testeaza acum diviziunea celulara influentata de 10 picaturi de extract la 25ml de apa. Dupa 2 zile se observa o inhibare aproape totala a cresterii radicelelor, acestea fiind absente. Analiza microscopica nu poate fi intreprinsa. Astfel se observa clar efectul inhibitor al acestui extract asupra diviziunii celulare.
5. Rezultate si concluzii
A) Prezentarea rezultatelor si a concluziilor :
In cazul radicelelor obtinute de la bulbii de ceapa germinati pe apa plata fixate in Carnoy, la analiza microscopica realizata, dupa 48 de ore, am observat faze din diviziunea celulara mitotica, ceea ce releva o crestere normala a varfurilor de radacini (vezi E1) si microfotografiile.
Radicelele de ceapa obtinute de la bulbii carora li s-au aplicat socul termic de 1-2 C asociat cu o tableta din medicamentul colchicin, folosit in tratamentul gutei, au suferit rupturi la nivelul fusului de diviziune, fazele diviziunii celulare fiind perturbate.
Radicelele prefixate in emulsie de colchicin (3 tablete la 25ml apa pe 6 ore) au suferit dezorganizarea fusului de diviziune, obtinandu-se cromozomi metafazici bine condensati ce pot permite o analiza morfologica a acestora (E2 si microfotografiile). Acesti cromozomi pot fi prelucrati pentru obtinerea cariotipului, actiune pe care mi-am propus-o in aprofundarea experimentului meu.
Extractul de Chelidonium majus contine alcaloidul papaverina cu actiune mitorepresiva
a. germinarea bulbului de ceapa pe solutia A (5 picaturi extract la 25ml apa) a fost incetinita, rezultand radicele a caror dimensiune a fost redusa la jumatate fata de martorul M, dupa 48 de ore. La analiza microscopica prin metoda carmin acetica, am observat frecventa foarte mare a interfazelor comparativ cu martorul.
b. dublarea cantitatii de extract (10 picaturi la 25ml apa) a dus la o inhibare a procesului germinativ dupa 48 de ore.
Bulbul de ceapa germinat in apa cu 5 picaturi de alcool a dezvoltat radicele normale dupa 48 de ore, comparativ cu martorul M. Aceasta dovedeste influenta minima a celor 5 picaturi de alcool asupra diviziunii celulare normale.
B) Microfotografii
q Microfotografii cu faze normale din diviziunea celulara :
|
|
|
|
Foto 9 (grup) |
|
q Microfotografii cu faze din diviziunea celulara obtinute din radicele tratate cu soc termic corelat cu o tableta de colchicina :
|
|
|
|
|
|
|
Foto 10 (grup) |
|
q Microfotografii cu faze din diviziunea celulara obtinute din radicele tratate cu colchicina (3 tablete la 25ml apa) :
|
|
|
|
|
|
|
Foto 11 (grup) |
q Microfotografii cu faze din diviziunea celulara obtinute din radicele tratate cu extract alcoolic de Chelidonium majus :
|
|
|
|
|
|
|
Foto 12 (grup) |
|
q Microfotografii cu bulbi pusi la germinat in 25ml apa si 5 picaturi alcool :
|
|
|
|
|
Foto 13 (grup) |
C) Angajarea experimentului pe noi coordonate :
Experimentul poate fi aprofundat in directia gasirii altor substante din lumea vegetala cu efecte stimulatoare sau inhibitoare asupra diviziunii celulare.
Cunoscand mecanismele intime ale acestui proces putem testa efectele unor substante si asupra celulei animale .
Importanta cercetarilor in aceasta directie consta in gasirea unor substante care sa stimuleze cresterea plantelor respectiv in gasirea unor inhibitori ai celulelor canceroase
Bibliografie selectiva
Maximilian C., Ioan D. M., Dictionar enciclopedic de genetica, Editura Stiintifica si Enciclopedica, Bucuresti, 1984;
Maximilian C., Genetica medicala, Editura Medicala, 1986, p: 195-201
Fotografiile cu numerele: 1.2.3.4.5.6.7 provin din Biology - Seventh Edition - International Edition - Campbell - Reece
Copyright © 2024 - Toate drepturile rezervate