 | Alimentatie | Asistenta sociala | Frumusete | Medicina | Medicina veterinara | Retete |
Farmacocinetica generala
Medicamentele se administreaza intr-un anume loc bine definit (la nivelul tubului digestiv prin inghitire, subcutanat sau intramuscular prin injectie, etc.) dar sunt destinate sa actioneze, cel mai adesea in cu totul alt loc decat cel in care au fost administrate (ficat, inima, creier, etc.). Este absolut evident ca medicamentele parcurg un anume drum in organism. Farmacocinetica este o parte a farmacologiei care studiaza drumul parcurs de medicamente in organism incepand cu absorbtia, continuand cu distributia, si terminand cu eliminarea lor.
1.Traversarea membranelor biologice.
Organismul poate fi considerat ca fiind format dintr-o serie de compartimente separate intre ele prin membrane biologice. Se pot delimita astfel de compartimente incepand cu aparate si sisteme, continuand cu organe si celule si terminand cu organitele intracelulare. Traversarea membranelor biologice este un proces care sta la baza tuturor proceselor farmacocinetice.
Membranele biologice au proprietati foarte diferite in functie de rolul lor functional. Unele au rol de protectie, cum este pielea, care are in mod evident un rol de bariera, avand o permeabilitate mica pentru substantele venite din exterior. Altele, dimpotriva, au o permeabilitate foarte crescuta, cum este epiteliul tubului digestiv care este specializat pentru absorbtie. Exista si situatii de membrane biologice a caror permeabilitate este controlata, cum este epiteliul tubului colector de la nivelul nefronului a carui permeabilitate pentru apa este controlata de vasopresina. In esenta insa, la baza tuturor membranelor biologice stau membranele celulare. Acestea sunt structuri bimolecular lipidice care separa de regula medii apoase si care sunt traversate de o serie de pori aposi, in general de dimensiuni mici. Medicamentele pot traversa aceste membrane biologice pe mai multe cai, pasiv sau prin mecanisme active, in functie de particularitatile lor biochimice. Pot interveni procese care nu necesita consum de energie, cum sunt filtrarea sau difuziunea pasiva, sau fenomene care necesita consum de energie cum sunt transportul activ, difuziunea facilitata, sau, mai rar, pinocitoza.
Difuziunea pasiva presupune trecerea, fara consum de energie, a medicamentului direct prin masa bimolecular lipidica, in sensul gradientului de concentratie, in principiu pana cand se egaleaza concentratiile de medicament in cele doua compartimente separate de membrana biologica implicata. Difuziunea este cu atat mai intensa cu cat gradientul de concentratie este mai mare si cu cat medicamentul este mai liposolubil. Totusi, in oarecare masura medicamentul trebuie sa fie si liposolubil, altfel medicamentul se dizolva in membrana celulara si ramane cantonat la acest nivel fara sa treaca in celalalt compartiment apos. Difuziunea pasiva este probabil cel mai important mecanism prin care medicamentele traverseaza membranele biologice.
Filtrarea presupune trecerea, fara consum de energie, a medicamentului prin intermediul porilor aposi ai membranelor, in sensul gradientului de concentratie. Filtrarea intereseaza medicamentele hidrosolubile si depinde de gradientul de concentratie precum si de numarul si de dimensiunea porilor aposi. Majoritatea membranelor celulare au pori de dimensiuni mici (cca. 6-8 Å) care permit trecerea numai pentru medicamente de dimensiuni cu masa moleculara foarte mica (sub 100), ceea ce este rar intalnit in domeniul medicamentului. Totusi, la nivelul majoritatii capilarelor exista pori de dimensiuni relativ mari (60-80 Å) care permit trecerea majoritatii medicamentelor, daca nu sunt legate de proteinele plasmatice. Filtrarea poate fi favorizata de existenta unui flux apos prin intermediul acestor pori. In acest sens, existenta unor diferente transmembranare de presiune osmatica poate favoriza sau ingreuna filtrarea in functie de sensul acestor diferente.
Transportul activ, presupune existenta unui transportor specific care se leaga stereospecific cu medicamentul la una din suprafetele membranare formand un complex medicament-transportor. Acesta traverseaza membrana si se desface la celalalt pol eliberand medicamentul si activand transportorul. Trecerea se face cu consum de energie si impotriva gradientului de concentratie. Transportul activ este saturabil, avand o valoare maxima care nu poate fi depasita, in functie de numarul de molecule transportoare disponibile. Transportul activ depinde de asemenea de disponibilul energetic al sistemului.
O forma aparte de transport activ o reprezinta difuziunea facilitata care este in fapt un transport activ realizat in sensul gradientului de concentratie.
O forma rar intalnita de traversare a membranelor biologice o reprezinta pinocitoza care presupune formarea la exteriorul celulelor a unor vezicule care inglobeaza medicamentul si internalizarea acestora cu eliberarea consecutiva a medicamentului.
Cel putin in cazul difuziunii pasive care este cel mai frecvent mecanism implicat in traversarea membranelor biologice, un parametru fizico-chimic de importanta majora il reprezinta solubilitatea medicamentului. Cu cat un medicament este mai nepolar, si prin urmare mai liposolubil, cu atat traverseaza cu mai multa usurinta membranele prin difuziune.
O problema relativ delicata o pun medicamentele capabile sa disocieze in solutie, caz foarte frecvent intalnit in terapeutica. Cu cat un medicament disociaza mai mult, cu atat devine mai hidrosolubil, mai putin liposolubil si, deci, cu sanse mai mici de a traversa membranele biologice prin difuziune. Capacitatea de disociere depinde de coeficientul de disociere al substantei (pKa ) si de pH-ul mediului in care este dizolvata aceasta. Existenta unor compartimente cu pH diferit realizeaza adevarate directionari ale difuziunii medicamentelor.
Pentru o substanta acida care disociaza in solutie apoasa conform reactiei chimice:
AH <=> A- + H+ (1)
unde AH este substanta nedisociata (protonata), iar A- si H+ sunt componentele disociate in solutie, exista ecuatia Henderson-Hasselbalch care arata ca:
[AH]
![]() log = pKa - pH (2)
log = pKa - pH (2)
[A-]
in care [AH] este concentratia formei nedisociate, iar [A-] concentratia formei disociate si care este echivalenta din punct de vedere matematic cu relatia:
[A-]
![]() = 10(pH-pKa) (3)
= 10(pH-pKa) (3)
[AH]
Cu cat pH-ul mediului este mai mic decat pKa-ul substantei, cu atat medicamentul este mai putin disociat, mai nepolar, adica mai liposolubil si deci traverseaza cu mai multa usurinta membranele biologice si invers, cu cat pH-ul mediului este mai mare decat pKa-ul substantei, cu atat medicamentul disociaza, este mai polar adica mai hidrosolubil si deci traverseaza mai greu membranele biologice. Daca luam exemplul acidului acetilsalicilic (AAS), care are pKa =3,5, si ii calculam proportia formei disociate in sucul gastric, la pH=1,5 si in sange la pH=7,4, obtinem urmatoarele valori:
- in sucul gastric: [AAS disociat] / [AAS nedisociat] = 10(1,5-3,5) = 10(-2) = 1/100, deci 99 % din molecule sunt nedisociate, nepolare, putand sa traverseze membranele biologice.
- in sange:[AAS disociat] / [AAS nedisociat] = 10(7,4-3,5) = 10(3, 9) = aprox.10000/1, adica numai 1 molecula din 10000 este nedisociata, capabila sa traverseze membrana celulara, restul fiind polare, neliposolubile.
Aceasta presupune ca acidul acetilsalicilic poate trece cu usurinta prin difuziune din lumenul gastric in sange, dar trece foarte greu invers, din sange catre lumenul gastric.
Astfel de diferente de pH de o parte si de alta a membranelor biologice creaza un sens al miscarii medicamentelor in organism, prin diferentele de presiune de difuziune pe care le realizeaza. pH-ul acid creste gradul de disociere a bazelor slabe si scade ionizarea acizilor slabi, iar pH-ul alcalin creste gradul de disociere al acizilor slabi si scade ionizarea bazelor slabe. Uneori este posibila modificarea in scop terapeutic a pH-ului anumitor compartimente in vederea dirijarii circulatiei medicamentelor.. Este foarte bine cunoscut in toxicologie ca alcalinizarea urinii favorizeaza eliminarea medicamentelor acide, pe cand acidifierea sa, pe a celor alcaline, in ambele cazuri prin cresterea proportiei formei polare, hidrosolubile, si scaderea consecutiva a reabsorbtiei tubulare.
Absorbtia medicamentelor
Absorbtia medicamentelor reprezinta procesul prin care acestea parasesc locul administrarii pentru a patrunde in sange si este un parametru esential pentru alegerea caii de administrare a medicamentelor. Cu exceptia situatiilor in care medicamentele se administreaza direct in torentul sanguin (intravenos sau, mai rar, intraarterial), cand nu putem vorbi despre absorbtie, absorbtia presupune traversarea unor membrane biologice. Medicamentele liposolubile si cele cu dimensiuni mici ale moleculelor, de regula se absorb bine indiferent de calea de administrare, cu conditia sa nu fie inactivate la locul administrarii. Absorbtia este cu atat mai buna cu cat la locul administrarii realizeaza o concentratie mai mare, suprafata de absorbtie este mai mare si vascularizatia este mai bogata.
Cel mai adesea medicamentele se administreaza pe cale orala, considerata cea mai convenabila cale de administrare. Absorbtia dupa administrare orala poate fi influentata de o serie de factori locali. Unele medicamente sunt inactivate de aciditatea gastrica (ex. penicilina G), altele de enzimele sucurilor digestive (polipeptidele si glucidele sunt digerate de pepsina, tripsina si, respectiv, amilaza, catecolaminele sunt distruse de o serie de sulfataze intestinale, etc). Uneori pot fi inactivate chimic de medicamente sau alimente administrate concomitent (tetraciclinele formeaza chelati neabsorbabili cu ionii de calciu, magneziu, aluminiu si fier din medicamente - antiacide, antianemice - sau alimente - produse lactate). Daca sunt nepolare, liposolubile, se absorb in general repede si complet. Daca sunt insa polare, absorbtia lor este cu atat mai mica cu cat polaritatea este mai mare. Cand polaritatea este intermediara absorbtia este partiala, dar daca este suficient de buna poate permite administrarea orala. In aceste din urma cazuri insa absorbtia poate fi influentata de motilitatea tubului digestiv: creste cand tranzitul este incetinit si scade cand este accelerat.
Administrarea prin injectare parenterala este considerata in general cale de administrare alternativa, apelandu-se la ea cand nu este posibila sau nu este avantajoasa administrarea orala: medicamente care nu se absorb (sau nu se absorb suficient) sau sunt distruse in tubul digestiv, bolnavi necooperanti, necesitatea unui efect foarte rapid si intens, contraindicatie pentru administrare orala, etc. Administrarea intravenoasa nu presupune absorbtie si se considera ca intreaga cantitate de medicament injectata ajunge in circulatia sanguina chiar din momentul administrarii. Ea realizeaza concentratii sanguine foarte inalte si rapide fiind considerata in general extrem de eficace in urgente, dar si foarte periculoasa. Pentru a permite medicamentului sa se dizolve in tot sangele, se recomanda de obicei ca administrarea sa se faca lent, in nici un caz in mai putin de 1 minut. Pe aceasta cale se administreaza numai solutii apoase (in cazul solutiilor uleioase exista risc de embolie), deci medicamentul trebuie sa fie hidrosolubil. Administrarea intramusculara si subcutanata presupune absorbtie care poate fi influentata in principal de natura medicamentului si de vascularizatia zonei. In cazul injectarii intramusculare absorbtia este mai rapida decat in cazul administrarii subcutanate, muschiul fiind mult mai bine vascularizat. Scaderea timpului de circulatie in insuficienta cardiaca sau in insuficienta circulatorie acuta poate sa scada absorbtia. Solutiile apoase se absorb mai bine decat suspensiile sau solutiile uleioase, acestea din urma realizand adevarate depozite la locul injectarii, din care medicamentul se absoarbe lent, pe o perioada lunga de timp.
Administrarea prin aplicarea medicamentelor pe mucoase (sublingual-perlingual, intranazal, intrarectal etc) sau tegumente (transdermic) este mai rar utilizata (daca se face abstractie de medicamentele cu actiune locala) si se apeleaza la ea, in general, in cazul unor medicamente care se metabolizeaza foarte mult la prima trecere prin ficat, pentru a sunta circulatia portala (ex. nitroglicerina), sau in cazul unor substante care sunt distruse in tubul digestiv (catecolamine, vasopresina, etc). O absorbtie foarte rapida, daca medicamentul este liposolubil si de dimensiuni mici, o realizeaza administrarea pe cale inhalatorie, cale de administrare de asemenea rar utilizata (in anesteziologie, de exemplu), cu exceptia unor medicamente antiastmatice inhalatorii (a caror destinatie este insa sa ramana la locul administrarii, nu sa se absoarba).
Din punctul de vedere al medicului terapeut, un parametru relativ larg utilizat in legatura cu absorbtia este biodisponibilitatea. Aceasta reprezinta procentul de medicament din cantitatea administrata disponibil pentru actiune (in principiu medicamentul ajuns in circulatia sistemica). Pentru calcularea acestui parametru se porneste de la conventia ca in cazul administrarii intravenoase biodisponibilitatea este 100 % si se calculeaza cat medicament este disponibil pentru actiune in cazul altor administrari, comparativ cu administrarea intravenoasa. Atunci cand biodisponibilitatea este mai mica de 100% intervin pierderi: distrugere ale medicamentului la locul administrarii, absorbtie incompleta (medicamente partial polare), metabolizare a medicamentului la prima trecere prin ficat (fenomen de prim pasaj hepatic) in cazul administrarii orale, etc.
Biodisponibilitatea poate fi influentata de forma farmaceutica. Solutiile au in general o biodisponibilitate mai buna decat comprimatele. In cazul comprimatelor biodisponibilitatea poate sa varieze de la o firma producatoare la alta, cel mai adesea in functie de excipient (material inert din punct de vedere biologic utilizat pentru constituirea formelor farmaceutice) sau de modul de preparare a formei farmaceutice. Formele micronizate asigura in general o absorbtie foarte buna. Uneori pot sa existe diferente chiar de la o sarja de fabricatie la alta in cadrul aceleiasi firme. Exista situatii in care presiunea cu care au fost comprimate pulberile pentru a se obtine comprimatele influenteaza biodisponibilitatea. Cel mai adesea insa aceste diferente de biodisponibilitate nu sunt semnificative clinic. Pentru medicamentele susceptibile sa prezinte diferente semnificative clinic in ceea ce priveste biodisponibilitatea (in general medicamente partial hidrosolubile, mai ales daca sunt importante din punct de vedere terapeutic) autoritatile nationale de reglementare a medicamentului (in Romania Agentia Nationala a Medicamentului) impun firmelor producatoare de medicamente generice sa efectueze studii de bioechivalenta prin care sa demonstreze ca medicamentul propus spre autorizare realizeaza aceeasi concentratie sanguina care persista aceeasi perioada de timp ca si medicamentul original. In general se accepta ca medicamentele bioechivalente sunt interschimbabile. Pentru a evita diferenta de biodisponibilitate intre serii se impune producatorilor sa respecte Regulile de Buna Practica de Fabricatie (Good Manufactory Practice -GMP).
Biodisponibilitatea poate fi influentata si de starea pacientului: poate fi modificata in afectiuni ale tubului digestiv, iar pentru medicamentele care sufera un fenomen de prim pasaj hepatic poate fi crescuta in insuficienta hepatica sau in cazul micsorarii debitului circulator al ficatului (insuficienta cardica, hipertensiune portala etc.).
3. Distributia medicamentelor
Dupa ajungerea lor in sange, medicamentele sunt vehiculate de acesta catre diverse aparate si sisteme distribuindu-le in intreg organismul. Rareori medicamentele se distribuie uniform in organism. Cel mai adesea ele se concentraza preferential in diverse compartimente ale acestuia si nu reusesc sa patrunda in altele. In cazul in care medicamentele se distribuie in mod uniform, organismul poate fi considerat un singur compartiment si se vorbeste depre modelul farmacocinetic monocompartimental. Alteori insa medicamentele se distribuie in doua sau mai multe compartimente, astfel incat se vorbeste despre modele bi- sau tricompartimentale. Intre aceste compartimente medicamentele trec cu o anume viteza intr-un sens si cu alta viteza in celalalt pana cand se instaleaza echilibre dinamice care fac ca medicamentul sa se concentreze preferential in anumite zone realizand uneori adevarate depozite.
Unul din aceste compartimente contine locul de actiune farmacodinamica (receptorii farmacologici asupra carora actioneaza medicamentul) si poarta numele de compartiment central, fiind compartimentul esential din punct de vedere farmacodinamic. Un alt compartiment cu mare implicare clinica este compartimentul care contine sangele. Daca sangele se gaseste in compartimentul central exista un paralelism intre evolutia concentratiei plasmatice si intensitatea efectului farmacodinamic. Daca sangele nu este in compartimentul central nu mai exista un astfel de paralelism, efectul putand sa dureze mai mult sau mai putin decat persistenta medicamentului in sange. Antiinflamatoarele, spre exemplu, persista mai mult in zonele inflamate decat in sange. Exista si situatii in care medicamentele realizeaza depozite in diverse zone ale organismului din care se elibereaza lent ceea ce duce la o persistenta indelungata a efectului. Exista si situatii de modele tricompartimentale. Astfel se comporta, spre exemplu, medicamentele anestezice generale intravenoase. Anestezicele generale intravenoase sunt medicamente foarte liposolubile. Dupa administrarea sa intravenoasa un astfel de medicament va patrunde si se va concentra foarte repede in creier care este foarte bogat in lipide si foarte bine vascularizat. Aceasta va realiza foarte rapid o concentratie foarte inalta a medicamentului in creier responsabila de efectul farmacologic caracteristic (anestezia generala). Ulterior insa, prin intermediul sangelui, medicamentul se va redistribui initial in tesutul muscular si ulterior in tesutul adipos bogate in lipide dar mult mai putin vascularizate. Aceasta redistribuire va scadea concentratia medicamentului in creier ceea ce va face sa inceteze efectul farmacologic (efectul lor este de scurta durata). Este de remarcat insa ca disparitia efectului farmacologic este datorata redistribuirii medicamentului din creier catre tesutul adipos si nu eliminarii sale din organism. Daca se administreaza doze repetate frecvent se ajunge la o saturare a tesutului adipos care va impiedica redistribuirea, ceea ce face ca efectul sa cresca periculos de mult atat in ceea ce priveste intensitatea cat si in ceea ce priveste durata acestuia.
Foarte multe medicamente se leaga de proteinele plasmatice. De regula medicamentele se leaga reversibil de albumine, iar forma legata este inactiva, disponibila pentru actiune fiind numai forma libera, nelegata. Forma libera este cea care patrunde in diverse tesuturi si organe si tot ea este cea care se elimina din organism prin metabolizare sau excretie urinara. Intre forma libera si cea legata se stabileste insa un echilibru dinamic, astfel incat proteinele plasmatice pot fi considerate unul din marile rezervoare de medicament din organism. Cu cat un medicament se leaga mai mult de proteinele plasmatice, cu atat concentratia formei libere va fi mai mica, medicamentul va fi mai putin activ in sange si va trece mai putin spre tesuturi. Hipoalbuminemia (care poate sa apara in sindromul nefrotic, in insuficienta hepatica, etc) poate creste toxicitatea medicamentelor prin cresterea concentratiei formei libere. De asemenea, poate creste concentratia formei libere in cazul administrarii concomitente de medicamente care se leaga in procent mare de aceleasi proteine, una din substante deplasand-o pe cealalta si crescandu-i efectul farmacodinamic. Spre exemplu, antiinflamatoarele nesteroidiene de tipul fenilbutazonei sau indometacinului pot sa creasca intensitatea de actiune a medicamentelor anticoagulante orale de tipul acenocumarolului, crescand riscul de sangerari grave.
Alte depozite se constituie in functie de particularitatile medicamentului. Medicamentele foarte liposolubile se pot depozita in tesutul adipos. Fiind slab vascularizat tesutul adipos realizeaza depozite care se satureaza lent si elibereaza ulterior medicamentul, de asemenea lent, pe o perioada lunga de timp. Medicamentele hidrosolubile se pot acumula in lichidul de edem, atunci cand acesta exista, ceea ce poate face necesar sa se administreze doze relativ mari de medicament la debutul tratamentului, cand bolnavul este edematiat, doze care, eventual, sa devina toxice cand a disparut edemul. Asemenea treceri de la doza eficace la doza toxica nu sunt posibile insa decat in cazul utilizarii unor doze relativ mari de medicamente cu indice terapeutic mic.
4. Eliminarea medicamentelor.
Majoritatea medicamentelor se elimina din organism prin excretie urinara sau metabolizare hepatica. Alte cai de eliminare sunt posibile, dar reprezinta exceptii: metabolizarea sub influenta unor enzime sanguine (pseudocolinesteraza de exemplu metabolizeaza suxametoniul), eliminarea prin fanere (par, unghii, cu importanta toxicologica in cazul arsenicului, sau cu importanta terapeutica in cazul antimicoticelor), eliminarea prin saliva (importanta pentru tratamentul unor afectiuni stomatologice, sau pentru dozarea medicamentului), eliminarea prin laptele matern (cu implicatii pentru sugar in cazul tratarii femeilor care alapteaza), eliminarea prin respiratie (importanta in cazul substantelor volatile sau pentru determinarea indirecta a alcoolemiei) etc.
Eliminarea medicamentelor prin excretie urinara se supune regulilor generale de functionare a rinichiului si poate interesa medicamentul ca atare sau produsii de metabolism ai acestuia. Excretia urinara a medicamentelor se poate face prin filtrare glomerulara sau/si secretie tubulara. Cu cat un medicament se leaga mai putin de proteinele plasmatice cu atat va filtra mai mult glomerular, cel mai adesea medicamentele avand molecule de dimensiuni mici, filtrabile, daca nu sunt legate de proteinele plasmatice.
Daca medicamentul este liposolubil, va suferi procese intense de reabsorbtie tubulara, eliminarea sa urinara fiind limitata, sau invers, daca este hidrosolubil, reabsorbtia tubulara va fi minima, ajungand sa se elimine poate chiar toata cantitatea filtrata glomerular.
In principiu se apreciaza ca excretia urinara este principalul mod de eliminare a medicamentelor hidrosolubile din organism. Acestea, pe de o parte se leaga putin de proteinele plasmatice si filtreaza mult glomerular, pe de alta parte, fiind polare, nu se reabsorb tubular astfel incat toata cantitatea filtrata glomerular se elimina ca atare prin urina. Aceasta face ca in caz de insufucienta renala sa creasca riscul de toxicitate a acestor medicamente necesitand o adaptare a dozelor si a intervalului intre administrari, in functie de gradul insuficientei renale.
Medicamentele liposolubile se elimina putin prin excretie urinara. Pe de o parte se leaga mult de proteinele plasmatice si nu filtreaza glomerular, pe de alta parte, fiind liposolubile, se reabsorb mult tubular astfel incat numai o mica parte din cantitatea filtrata glomerular ajunge sa se elimine prin urina. Medicamentele liposolubile se elimina de obicei prin metabolizare hepatica. Trebuie avut insa in vedere ca nici medicamentele care se elimina prin metabolizare hepatica nu sunt intotdeauna complet lipsite de riscuri in caz de insuficienta renala: daca prin metabolizare rezulta produsi activi biologic, eventual toxici, eliminarea acestora poate fi diminuata ceea ce conduce la cresterea riscului de reactii adverse.
Fig.nr.1. Reprezentare schematica a metabolizarii medicamentelor. Medicamentul liposolubil patrunde in reticulul endoplasmic unde, sub influenta enzimelor microzomiale, sufera procese metabolice de faza 1 rezultand compusi activi chimic care ulterior sunt conjugati in citoplasma (face exceptie glucuronoconjugarea care are loc in reticulul endoplasmic). Compusii conjugati polari se elimina apoi prin excretie urinara.
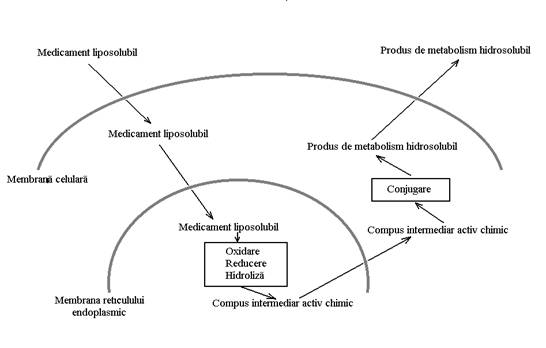
Metabolizarea medicamentelor poate avea loc in
diverse structuri (sange, mucoasa tubului digestiv, etc.) dar in imensa
majoritate a cazurilor metabolizarea are loc in ficat. Sunt eliminate prin
metabolizare de obicei medicamentele liposolubile. Pe de o parte deoarece
acestea nu se pot elimina prin excretie urinara (a se vedea mai sus),
pe de alta parte deoarece, fiind liposolubile, strabat cu
usurinta membranele biologice ajungand astfel in interiorul
reticulului endoplasmic unde se gasesc enzimele capabile sa le
metabolizeze.
Extrem de rar metabolizarea medicamentelor este completa, pana la bioxid de carbon si apa. Cel mai adesea in urma metabolizarii rezulta substante cu polaritate crescuta care se pot elimina mai usor prin excretie urinara.
De obicei, metabolizarea medicamentelor se face in 2 faze. Intr-o prima faza au loc procese de oxidare, reducere sau hidroliza in urma carora rezulta compusi mai activi din punct de vedere chimic. Aceasta faza se desfasoara de obicei in interiorul reticulului endoplasmic sub actiunea asa-numitelor enzime microzomiale (notiune de ordin experimental, microzomii fiind in fapt fragmente de reticul endoplasmic obtinute prin centrifugare). De precizat ca aceasta activare chimica nu presupune si o activare farmacologica, un compus activ din punct de vedere chimic nefiind intotdeauna si activ din punct de vedere farmacologic. Intr-o a doua faza, compusii activi chimic rezultati din prima faza sunt supusi unui proces de sinteza, care consta de regula dintr-un proces de conjugare (sulfoconjugare, glucuronoconjugare, acetilare, etc.). Aceasta a doua faza are loc de obicei in citoplasma, cu exceptia glucuronoconjugarii, uridindifosfat-glucuronil-transferaza fiind o enzima microzomiala. Uneori, daca medicamentul este suficient de activ chimic sufera direct reactiile celei de-a doua faze, fara sa mai fie necesar un proces specific primei faze.
Cel mai adesea, in urma metabolizarii rezulta substante inactive din punct de vedere biologic, deci are loc un proces de inactivare biologica. Exista insa si situatii cand in urma metabolizarii rezulta substante cu aceeasi activitate biologica, dar mai polare, precum exista si situatii in care in urma metabolizarii rezulta substante mai active biologic decat medicamentul initial, avand deci loc un proces de bioactivare. In unele situatii avem de-a face cu substante complet inactive din punct de vedere biologic care devin active in organism prin bioactivare. Aceste substante se numesc de obicei promedicamente sau prodroguri. Astfel este cazul fenacetinei, inactiva ca atare dar care se transforma in paracetamol, un analgetic activ, al prednisonului, inactiv ca atare, care se transforma in prednisolon, activ, etc.
Din multitudinea de enzime implicate in procesele de metabolizare a medicamentelor un loc aparte il ocupa complexul cunoscut sub numele de citocrom P450. Acesta reprezinta un grup foarte numeros de izoenzime care absorb lumina cu lungimea de unda de 450 nm codificate de gene foarte diferite.
Izoenzimele citocromului P450 se noteaza de obicei cu sigla CYP urmata de o cifra, apoi de o majuscula (A,B,C,D, etc.) si ulterior de alte una sau 2 cifre. Prima cifra reprezinta familia de gene care codifica enzima, majuscula reprezinta subfamilia de gene, iar ultima cifra reprezinta gena numerotata in ordinea descoperirii sale. La om au fost descrise peste 50 de izoenzime, nu toate implicate in metabolizarea medicamentelor, dar mult mai multe izoenzime au fost descrise la animale si mai ales la plante. Multe din formele descrise la animale nu exista la om, ceea ce face ca particularitatile de metabolizare a medicamentelor la animale sa nu se regaseasca la om, astfel incat datele obtinute in farmacologia non-clinica sa nu fie intotdeauna superpozabile cu datele de farmacocinetica clinica. Exista si izoforme ale citocromului P450 care exista numai la anumite populatii sau grupe de populatii umane, ceea ce explica unele particularitati farmacocinetice care apar la anumite persoane, iar uneori chiar fenomene de idiosincrazie.
![]()
![]()
Familia de gene Subfamilia de gene Gena
A - T E. Coli 0 gene
Om 55 gene
Plante peste 280 gene
Exemple de izoenzime ale citocromului P450 prezente la om:
CYP2A6, CYP2A7, CYP2A8, CYP2A13, CYP2B6 CYP2B7, CYP2C8,
CYP2C9 CYP2C10, CYP2C17, CYP2C18, CYP2C19 CYP2D6
CYP2D7, CYP2D8, CYP2E1 CYP2F1, CYP2J1
CYP3A3, CYP3A4 CYP3A5 CYP3A7
CYP4A11, CYP4B1, CYP4F2
CYP5A1
CYP7A1
CYP
CYP11A1, CYP11B1, CYP11B2
CYP17A1
CYP
CYP21A1, CYP21A2, CYP21B
CYP
CYP
CYP51P1, CYP51P2
Fig. nr. Denumirea izoenzimelor citocromului P450 si cateva exemple de izoenzime ale citocromului P450 prezente la om. Sunt subliniate izoenzimele citocromului P450 implicate in metabolizarea medicamentelor.
Activitatea citocromului P450 poate fi influentata de anumite substante chimice, medicamente sau de alta natura (toxice, poluanti atmosferici, etc). Unele din aceste substante cresc activitatea respectivelor enzime, ceea ce grabeste metabolizarea propriei molecule sau a altor molecule, de obicei inrudite din punct de vedere chimic. Fenomenul este cunoscut sub numele de inductie enzimatica daca se refera la metabolizarea altor medicamente, sau autoinductie daca se refera la metabolizarea propriei molecule. Alte substante chimice scad activitatea enzimelor ingreunand metabolizarea anumitor medicamente, fenomen cunoscut sub numele de inhibitie enzimatica. Fenomenele de inductie sau inhibitie enzimatica se adreseaza de obicei unei anumite izoenzime si nu citocromului P450 in ansamblul sau.
Tabel 1. Exemple de medicamente substrat ale izoenzimei CYP3A4 a citocromului P450 (care sunt metabolizate de aceasta izoenzima), medicamente inductoare ale acestei izoenzime (care ii cresc activitatea) si medicamente inhibitoare ale respectivei izoenzime (care ii scad activitatea).
Medicamente substrat al izoenzimei |
Medicamente inductoare ale izoenzimei |
Medicamente inhibitoare ale izoenzimei |
|
Alcaloizi din vinca, Alcaloizi ergot, Alfentanil, Alprazolam, Amiodarona, Amitriptilina, Amlodipina, Anastrozol, Astemizol, Atorvastatina, Bepridil, Busulfan, Cannabinoizi, Carbamazepina, Cerivastatina, Chinidina, Chinina, Ciclofosfamida, Ciclosporina, Cimetidina, Cisaprida, Clindamicina, Clonazepam, Clorpromazina, Cocaina, Codeina, Contraceptive orale, Cortisol, Dapsona, Delavirdina, Dexametazona, Dextrometorfan, Diazepam, Diltiazem, Disopiramida, Docetaxel, Donepezil, Doxorubicina, Enalapril, Eritromicina, Estrogeni oral, Etinilestradiol, Etoposida, Etosuximida, Felodipina, Fentanil, Fluconazol, Flutamida, Granisetron, Hidrocodona, Hidrocortison, Ifosfamida, Imipramina, Indinavir, Isotretinoin (retinoizi), Isradipina, Itraconazol, Ketoconazol, Lansoprazol, Lidocaina, Loratadina, Losartan, Lovastatina, Miconazol, Midazolam, Nelfinavir, Nicardipina, Nimodipina, Nisoldpina, Nitrendipina, Ondansetron, Paclitaxel, Paracetamol, Pimozida, Pravastatina, Prednison, Progesteron, Propafenona, Rifabutina, Rifampicina, Ritonavir, Salmeterol, Saquinavir, Sertralina, Sildenafil citrat, Simvastatina, Sufentanil, Tacrolimus, Tamoxifen, Teofilina, Terfenadina, Testosteron, Tiagabina, Tretinoin, Triazolam, Troleandomicina, Verapamil, Vinblastina, Vincristina, Warfarina, Yohimbina, Zileuton |
Carbamazepina Fenilbutazona Fenitoina Fenobarbital Glucocorticoizi Primidona Rifabutina Rifampicina Sulfinpirazona |
Anastrozol Chinidina Cimetidina Claritromicina Clotrimazol Danazol Delavirdina Diltiazem Eritromicina Fluconazol Fluoxetina Fluvoxamina Indinavir Itraconazol Ketoconazol Metronidazol Miconazol Nelfinavir Nevirapina Norfluoxetina Omeprazol Paroxetina Propoxifen Ranitidina Ritonavir Saquinavir Sertindola Troleandomicina Zafirlukast Zileuton |
In esenta se poate aprecia ca medicamentele cu structura polara, hidrosolubile, se elimina dominant prin excretie urinara, iar medicamentele, nepolare, liposolubile, se elimina dominant prin metabolizare hepatica. Capacitatea ficatului de a metaboliza anumite medicamente depinde de bagajul enzimatic al acestui organ si de structura chimica a medicamentului. Pentru anumite medicamente ficatul are capacitatea sa metabolizeze complet medicamentul respectiv la prima trecere a acestuia prin ficat, fenomen cunoscut sub numele de fenomen de prim pasaj hepatic. Medicamentele care sufera un fenomen de prim pasaj hepatic sunt de regula inactive daca se administreaza pe cale orala (prin inghitire), deoarece prin absorbtie trec in vena porta care le transporta la ficat unde sunt complet inactivate. Asemenea medicamente fie se administreaza pe alte cai de administrare, fie, uneori, se administreaza in doze foarte mari care depasesc capacitatea de metabolizare a ficatului. Daca se administreaza pe cai de administrare care presupun o evitare a circulatiei portale (obisnuit se spune ca scurtcircuiteaza sau sunteaza circulatia hepatica), persistenta acestor medicamente in organism este de scurta durata (de ordinul minutelor). In asemenea situatii prelungirea duratei persistentei medicamentului in organism este posibila numai printr-un sistem de administrare continua - sisteme care asigura o absorbtie continua controlata de la locul administrarii, perfuzie intravenoasa, etc. - si in general durata efectului este aproximativ egala cu durata absorbtiei sau administrarii in cazul perfuziei.
5. Parametrii farmacocinetici
Procesele farmacocinetice pot fi urmarite in organism cu ajutorul unor parametrii masurabili direct (parametrii farmacocinetici primari) sau calculabili pe baza masuratorilor biologice (parametrii farmacocinetici secundari). Probabil ca, din punctul de vedere al clinicianului, cei mai importanti parametrii farmacocinetici sunt concentratia plasmatica, volumul aparent de distributie, clearance-ul si timpul de injumatatire al medicamentului.
5.1. Concentratia plasmatica
Concentratia plasmatica (Cp) a medicamentului este principalul parametru farmacocinetic primar, ea obtinandu-se in urma masurarii directe, prin diverse metode (chimice, imunologice, radiochimice, etc), a concentratiei realizata de medicament in plasma.

Fig. nr. 3. Evolutia in timp a concentratiei plasmatice a unui medicament dupa administrarea
intravenoasa (i.v.) si dupa administrarea pe o cale de administrare care presupune absorbtie (orala, i.m., s.c., etc.). Se constata ca dupa administrarea pe o cale de administrare care presupune absorbtie varful concentratiei plasmatice se atinge mai tarziu dar eliminarea se face dupa aceeasi cinetica.
Concentratia plasmatica a unui medicament variaza in timp. Dupa administrarea intravenoasa a unei doze unice Cp creste brusc, apoi scade treptat tinzand catre 0 dupa un model exponential. Dupa o administrare care presupune absorbtie (oral, subcutanat, intramuscular, etc), Cp creste pe masura ce medicamentul se absoarbe de la locul administrarii, atinge un maxim si apoi scade progesiv ca in cazul administrarii intravenoase. Datorita acestor variatii temporale, Cp se masoara in dinamica. Pentru comparatii intre bolnavi, intre medicamente sau intre diferite cai de administrare pentru acelasi medicament se utilizeaza parametrii sintetici ai Cp cum ar fi varful concentratiei plasmatice sau aria de sub curba variatiei in timp a concentratiei plasmatice (ASC in limba romana sau AUC in limba engleza). In general ASC a unui medicament este considerata o masura a expunerii unei perdoane la medicamentul respectiv.
Daca medicamentul se distribuie dupa un model farmacocinetic monocompartimental sau daca receptorii si sangele sunt in acelasi compartiment in cazul modelelor farmacocinetice bi- si tricompartimentale, concentratia plasmatica a medicamentului evolueaza paralel cu intensitatea efectului terapeutic sau toxic, putand fi un instrument de lucru util indeosebi in cazul medicamentelor cu indice terapeutic mic. Concentratia plasmatica permite de asemenea calcularea a o serie de alti parametrii farmacocinetici secundari cum ar fi volumul aparent de distributie, biodisponibilitatea, clearance-ul, etc.
5. Volumul aparent de distributie
Cunoscandu-se concentratia plasmatica si doza administrata intravenos se poate calcula volumul aparent de distributie Vd al unui medicament dupa formula:
![]() Vd
= (4)
Vd
= (4)
Cp
unde Vd = volumul aparent de distributie, D = doza administrata iar Cp = concentratia plasmatica realizata in urma administrarii dozei D.
Acest parametru ofera date informative privind distribuirea medicamentului in organism. Daca se obtin valori egale cu ale anumitor compartimente bine cunoscute ale organismului se poate aprecia ca medicamentul se distribuie in principal in acele compartimente. Spre exemplu, pentru un barbat de 70 kg, volumul plasmei este de aproximativ 3 l, volumul sangelui total de 5,5 l, volumul apei extracelulare de 12 l, iar volumul intregii ape din organism de 42 l. Daca se obtin valori mult mai mari decat volumul intregii ape din organism (de pilda in jur de 700 l in cazul digoxinei) se poate aprecia ca medicamentul realizeaza depozite in organism, fara sa se poata preciza unde sunt situate acele depozite.
Volumul aparent de distributie calculat pe baza concentratiei plasmatice realizata in urma administrarii intravenoase a unui medicament este o constanta pentru medicamentul si bolnavul respectiv. Daca dupa administrarea medicamentului pe alta cale decat cea intravenoasa se obtin volume de distributie mai mari, rezulta ca medicamentul inregistreaza pierderi in procesul de absorbtie, ceea ce permite calcularea biodisponibilitatii medicamentului si adaptarea dozelor pentru fiecare cale de administrare.
5.3. Biodisponibilitatea
Dupa cum se arata mai sus, biodisponibilitatea reprezinta procentul, din cantitatea de medicament administrata, disponibil pentru actiune. Daca se cunoaste concentratia plasmatica (Cp) si volumul aparent de distributie (Vd) se poate calcula cantitatea totala de medicament din organism (Q):
Q = Vd x Cp (5)
Pentru calcularea biodisponibilitatii se porneste de la premisa ca in cazul administrarii intravenoase toata cantitatea de medicament administrata este disponibila pentru actiune, deci biodisponibilitatea in acest caz este 100%. In acest context, pentru oricare alta cale de administrare, care presupune in general procese de absorbtie, biodisponibilitatea procentuala (Bd%) va fi:
Qx Vd x Cpx Cpx
![]()
![]()
![]() Bd%
= x 100 = x 100 = x 100 (6)
Bd%
= x 100 = x 100 = x 100 (6)
Qiv Vd x Cpiv Cpiv
unde Qx si Cpx reprezinta cantitatea si, respectiv, concentratia plasmatica a medicamentului pentru calea de administrare luata in consideratie (oral, intramuscular, etc.) iar Qiv si Cpiv , pentru calea de administrare intravenoasa.
Foarte importrant este momentul determinarii concentratiei plasmatice si de aceea, fie se apeleaza la varful concentratiei plasmatice, fie, cel mai bine, se face apel la aria de sub curba de variatie in timp a concentratiei plasmatice (ASC). In acest ultim caz formula biodisponibilitatii devine:
ASCx
![]() Bd%
= x 100 (7)
Bd%
= x 100 (7)
ASCiv
Valori mici ale biodisponibilitatii presupun de regula pierderi de medicament, fie in procesul de absorbtie, din considerente care tin de substanta activa, de forma farmaceutica sau de particularitatile bolnavului, fie pe parcursul drumului strabatut de medicament de la locul administrarii pana in sange (de pilda, metabolizare la primul pasaj hepatic in cazul administrarii orale).
5.4. Clearance-ul medicamentului
Clearance-ul unui medicament este probabil cel mai important parametru farmacocinetic. In clinica se lucreaza in mod obisnuit cu clearance-ul plasmatic al medicamentului care reprezinta volumul de plasma epurat complet de medicament in unitatea de timp si se calculeaza pe baza variatiei concentratiei plasmatice a medicamentului in timp dupa o administrare unica, conform formulei:
![]() Cl
=
Cl
=
ASC
unde Cl este clearance-ul plasmatic al medicamentului, D este doza administrata, iar ASC este aria de sub curba de variatie in timp a concentratiei plasmatice.
Clearance-ul plasmatic al unui medicament permite stabilirea dozelor necesare mentinerii constante a unei anumite concentratii plasmatice de medicament. Presupunand ca dorim sa mentinem constanta concentratia plasmatica de c mg/ml, rezulta ca in fiecare minut se elimina din organism (c x Cl) mg, care vor trebui substituite. Presupunand o absorbtie de 100%, doza necesara mentinerii constante a unei concentratii c, pentru un medicament al carui clearance plasmatic este Cl, va fi:
D = c x Cl x t (9)
unde t este intervalul intre administrari masurat in minute.
Asa cum a fost prezentat mai sus clearance-ul plasmatic al unui medicament nu tine seama de modul in care se elimina medicamentul din organism - prin metabolizare, prin excretie urinara,etc. - si de aceea se mai numeste si clearance total. Clearance-ul total este format din suma clearance-urilor diferitelor organe, prin clearance de organ intelegand volumul de plasma epurat complet de medicament in unitatea de timp de catre organul respectiv. Se apreciaza ca diferitele clearance-uri de organ sunt aditive, astfel incat se poate scrie:
Cltotal = Clrenal + Clhepatic + Clalte organe
Clearance-ul de organ depinde de capacitatea intrinseca a organului de a epura un medicament, numita in general clearance intrinsec (Clint) si de debitul sanguin al organului respectiv (Qs), conform ecuatiei:
Clint
Q + Clint
Aceasta arata ca un organ epureaza cu atat mai mult un medicament cu cat capacitatea sa de epurare este mai mare si cu cat este mai bine irigat. Cand clearance-ul intrinsec este foarte mic raportat la debitul sanguin al organului respectiv, practic epurarea medicamentetului prin organul respectiv nu este influentata de debitul sanguin. Daca insa capacitatea intrinseca de epurare a unui medicament prin organul respectiv este foarte mare, epurarea medicamentului prin acel organ poate fi influentata de modificarea debitului sanguin. Astfel se explica faptul ca metabolizarea hepatica a medicamentelor care sufera un fenomen de prim pasaj hepatic poate fi scazuta in anumite situatii patologice care scad debitul sanguin hepatic, cum este, spre exemplu, insuficienta cardiaca sau administrarea de medicamente care deprima contractilitatea cordului cum ar fi blocantele b adrenergice.
Intrucat parametrii functionali ai activitatii renale sunt mult mai usor de investigat decat parametrii functionali ai altor organe, obisnuit caracterul aditiv al clearance-urilor de organ se exprima prin ecuatia:
Cltotal = Clrenal + Clnerenal
Aceasta permite apreciarea contributiei rinichilui la eliminarea unui anumit medicament din organism. Spre exemplu, pentru digoxina, care are un clearance plasmatic de 130 ml/min si se elimina 60% prin excretie urinara, clearance-ul renal este:
130 x 60/100 = 78 ml/min (13)
iar clearance-ul nerenal va fi:
130 - 78 = 52 ml/min (14)
deci influentat mult de starea functionala a rinichiului.
Comparand clearance-ul renal al unui medicament cu clearance-ul creatininei, se poate aprecia modul in care se elimina medicamentul prin excretie urinara. Daca cele doua valori sunt egale, medicamentul se comporta la fel cu creatinina - filtreaza glomerular, dar nu se secreta si nici nu se reabsoarbe tubular, daca clearance-ul medicamentului este mai mare decat clearance-ul creatininei intervin si fenomene de secretie tubulara, iar daca este mai mic, medicamentul se reabsoarbe tubular.
Presupunand ca reabsorbtia tubulara se face in proportie fixa din cantitatea de medicament filtrata glomerular, putem aprecia clearance-ul medicamentului la un anume bolnav, in functie de valoarea clearance-ului creatininei endogene la bolnavul respectiv. In exemplul de mai sus, clearance-ul renal al digoxinei in functie de valoarea clearance-ului creatininei endogene va fi:
Clren.dig.b ClCr.b
![]()
![]() = =>
= =>
Clren.dig.n ClCr.n
ClCr.b x Clren.dig.n Clren.dig.n
![]()
![]() => Clren.dig.b = = ClCr.b (15)
=> Clren.dig.b = = ClCr.b (15)
ClCr.n ClCr.n.
unde ClCr.b. este clearance-ul creatininei la bolnavul luat in consideratie, ClCr.n. este clearance-ul normal al creatininei, Clren.dig.n este clearance-ul renal al digoxinei la normal, iar Clren.dig.b. este clearance-ul renal al digoxinei la bolnavul respectiv.
Asemenea calcule permit pana la urma calcularea unor doze adaptate de medicament in functie de particularitatile functionale ale organelor de epurare ale bolnavului.
5.5. Cinetica eliminarii medicamentelor
Viteza eliminarii medicamentelor din organism (V) poate fi definita ca variatia cantitatii de medicament (Q) in unitatea de timp (t):
Q2 - Q1 DQ dQ
![]()
![]()
![]() V = = =
V = = =
t2 - t1 Dt dt
ultima exprimare, sub forma derivata, referindu-se la viteza instantanee. Prin masuratori experimentale s-a constatat ca aceasta viteza poate fi exprimata prin formula:
dQ
![]() V
= = k x Cn (17)
V
= = k x Cn (17)
dt
unde k este o constanta, C este concentratia medicamentului, iar n, puterea lui C, poarta numele de ordin al ecuatiei, iar prin extrapolare, ordin al reactiei sau ordin al cineticii.
Daca n=0 se vorbeste despre o cinetica de ordinul 0, in care:
dQ
![]() V
= = k
x C0 = k (18)
V
= = k
x C0 = k (18)
dt
Conform acestei ecuatii, cantitatea de medicament eliminata in unitatea de timp este constanta, indiferent cat medicament exista in organism. Eliminarea unui astfel de medicament (de exemplu etanolul) dureaza cu atat mai mult timp cu cat exista o cantitate mai mare de medicament in organism.
Daca n=1, vorbim despre o cinetica de ordinul I sau 1 in care:
dQ
![]() V
= = k x C (19)
V
= = k x C (19)
dt
Daca tinem seama ca C=Q/Vd, in care Vd este volumul aparent de distributie, si facem inlocuirea, obtinem:
dQ Q
![]()
![]() = k x
= k x
dt Vd
ecuatie echivalenta din punct de vedere matematic cu:
![]() dQ
dQ
Q k
![]()
![]() = constant (atat k cat si Vd sunt constante) (21)
= constant (atat k cat si Vd sunt constante) (21)
dt Vd
Conform acestei ecuatii raportul dQ/Q, adica raportul intre cantitatea de medicament eliminata si cantitatea totala de medicament din organism, este constant in timp. Acest raport se exprima procentual si poarta numele de proportie de epurare. Majoritatea medicamentelor se elimina dupa o astfel de cinetica de ordinul I.
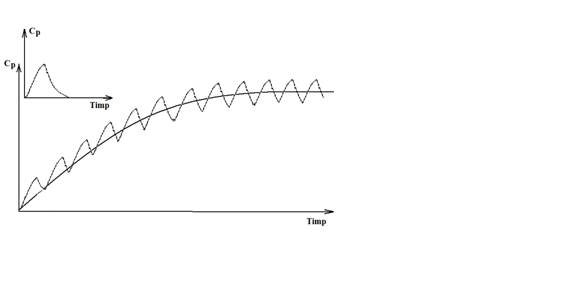
Fig. nr. 4. Reprezentarea evolutiei concentratiei plasmatice in timp a unui medicament care se elimina dupa o cinetica de ordinul 1, dupa o doza unica si dupa administrari repetate. In cazul administrarilor repetate, daca administrarea se face la intervale de timp mai mici decat de patru ori timpul de injumatatire, medicamentul se acumuleaza in organism pana cand atinge o concentratie care ulterior se mentine constanta, in platou
Faptul ca in unitatea de timp medicamentul se elimina intr-o proportie constanta din cantitatea totala de medicament din organism, face ca timpul necesar epurarii complete a medicamentului sa nu depinda de cantitatea acestuia in organism. Timpul necesar epurarii complete a medicamentului din organism tinde exponential catre 0 si este relativ dificil de determinat experimental. Mult mai comod de determinat este insa timpul de injumatatire plasmatica (T1/2), definit ca timpul necesar pentru a se reduce la jumatate concentratia plasmatica. In cinetica de ordinul I acest parametru are o valoare constanta pentru aceeasi substanta, indiferent de cantitatea totala de medicament din organism.
In principiu, daca dupa fiecare T1/2 concentratia plasmatica ajunge la jumatate, teoretic aceasta nu atinge niciodata valoarea 0, ci tinde catre aceasta valoare. Dupa un timp de 4 ori mai mare dcat T1/2 concentratia plasmatica ajunge insa la 1/16 din valoarea initiala, valoare considerata in general neglijabila si de aceea se apreciaza ca un medicament se elimina complet din organism dupa un timp de patru ori mai lung decat timpul de injumatatire
Daca medicamentul se administreaza la intervale de timp mai mici decat 4 x T1/2, de fiecare data noua administrare se aplica peste o cantitate de medicament restanta, ceea ce face ca medicamentul sa se acumuleze in organism. In aceste conditii, cantitatea totala de medicament din organism creste progresiv si, odata cu ea, creste de asemenea cantitatea de medicament eliminata in unitatea de timp, deoarece proportia de epurare nu se modifica. Aceasta crestere este continua pana cand cantitatea de medicament din organism atinge o valoare atat de mare incat proportia de epurare aplicata acestei valori este egala cu doza administrata. Din acel moment, doza administrata este egala cu cantitatea epurata intre administrari, iar cantitatea totala de medicament din organism se mentine constanta, in platou. Pentru digitoxina, spre exemplu, care are o proportie de epurare de cca. 10% in 24 de ore, daca se administreaza zilnic 0,1 mg de medicament, cantitatea totala din organism creste pana cand atinge valoarea de 1 mg; din acel moment ea se mentine in platou, deoarece zilnic se administreaza 0,1 mg si zilnic se elimina 10% din 1 mg, adica 1 mg x 10/100 = 0,1 mg. Se apreciaza ca timpul necesar atingerii platoului este de 4 ori mai mare decat T1/
In mod evident concentratia in platou depinde de doza administrata, intervalul intre administrari si proportia de epurare in intervalul de timp intre administrari considerat ca unitate de timp. In mod obisnuit insa, nu se lucreaza cu proportia de epurare ci cu valoarea clearance-ului plasmatic, astfel incat, concentratia in platou se calculeaza dupa formula:
D
![]() Cpl
= (22)
Cpl
= (22)
Cl x i
unde prin Cpl s-a notat concentratia in platou, D este doza administrata, i este intervalul intre administrari, iar Cl este clearance-ul plasmatic al medicamentului.
Timpul de injumatatire depinde de volumul de distributie si de clearance-ul plasmatic al medicamentului, putand fi calculat dupa formula:
Vd Vd
![]()
![]() T1/2 = (ln(2))x = 0,696 x (23)
T1/2 = (ln(2))x = 0,696 x (23)
Cl Cl
unde T1/2 este timpul de injumatatire, Vd este volumul aparent de distributie, iar Cl este clearance-ul plasmatic al medicamentului.
Copyright © 2024 - Toate drepturile rezervate