 | Aeronautica | Comunicatii | Constructii | Electronica | Navigatie | Pompieri |
| Tehnica mecanica |
PRIMUL PRINCIPIU AL TERMODINAMICII (PT 1)
Studiul termodinamicii se bazeaza pe doua legi foarte generale ale naturii, numite principii. Aceste legi nu se pot demonstra pe cale matematica, ci reprezinta rezultatul experientei acumulate in studiul proceselor din natura.
Primul principiu al termodinamicii este legea generala a conservarii si transformarii energiei, aplicate in cazul sistemelor termodinamice. Pentru a putea da enunturile si expresiile matematice ale PT1 este necesara introducerea notiunilor de energie interna, lucru mecanic, caldura si entalpie.
Notatii: d - pentru cantitate infinit mica;
d - pentru variatii infinit mici;
D - pentru variatii finite.
1 Energia interna U [J]
Energia interna este o marime de stare care reprezinta energia termica a unui corp, intr-o stare termodinamica oarecare.
Este o marime de stare, adica depinde doar de starea sistemului la momentul respectiv si nu depinde de drumul parcurs de sistem pentru a ajunge in starea respectiva.
Este o marime de stare extensiva, deci se poate defini si energia interna specifica:
![]() , unde m - masa corpului.
, unde m - masa corpului.
In calculele termotehnicii nu intereseaza valoarea absoluta a energiei interne, ci numai variatia sa atunci cand sistemul trece dintr-o stare in alta stare:
![]() unde: U2 - energia interna a
sistemului in starea finala:
unde: U2 - energia interna a
sistemului in starea finala:
U1 - energia interna a sistemului in starea initiala.
2 Lucrul mecanic [J]
2a Lucrul mecanic exterior (sau al transformarii) L [J]
Energia interna a unui sistem termodinamic se poate modifica datorita prezentei unor interactiuni intre sistem si mediul exterior. De exemplu, in cazul unei interactiuni mecanice intre un sistem inchis (si adiabatic) si mediul exterior se poate modifica energia interna a gazului prin comprimare sau prin destindere.
|
Comprimare Destindere Figura 1 |
Lucrul mecanic efectuat de piston asupra gazului se numeste lucru mecanic exterior sau al transformarii.
Lucrul mecanic se noteaza cu L si se exprima prin produsul intre forta F si distanta x pe care are loc deplasarea punctului de aplicatie al fortei, pe directia fortei:
![]()
Pentru o deplasare elementara dx, sistemul va schimba cu mediul exterior un lucru mecanic exterior elementar:
![]() (1)
(1)
S-a notat dL si nu dL deoarece lucrul mecanic elementar dL nu reprezinta variatia infinit mica a marimii L, adica lucrul mecanic exterior nu este o marime de stare care sa sufere variatii la trecerea sistemului dintr-o stare termodinamica in alta. Deci, dL nu reprezinta o variatie infinit mica a lucrului mecanic, ci o cantitate infinit mica. Matematic acest fapt inseamna ca expresia dL nu este o diferentiala totala exacta. Deci, notatia corecta este:
 si nu
si nu 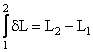
pentru ca nu are sens notiunea de lucru mecanic exterior in starea 1, respectiv in starea 2, ci doar lucrul mecanic al transformarii 1-
Daca: F = p A unde p = presiunea gazului, A - aria sectiunii transversale a cilindrului, rezulta:
dL = p A dx
dL = p dV (2)
Pentru 1 kg de gaz ![]() , dl = lucrul mecanic exterior specific elementar.
, dl = lucrul mecanic exterior specific elementar.
Lucrul mecanic exterior corespunzator transformarii de stare de la 1 la 2 este:
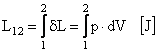
sau lucrul mecanic exterior specific:
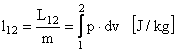
Lucrul mecanic exista doar cand exista o transformare si din aceasta cauza se mai numeste si lucrul mecanic al transformarii.
Deoarece diagrama p - V permite reprezentarea grafica a lucrului mecanic, ea se numeste diagrama mecanica.
|
Figura 2 |
Deci, lucrul mecanic exterior nu este o marime de stare, ci depinde de drumul parcurs. De exemplu, daca transformarea 1-2 e pe drumul punctat, lucrul mecanic exterior este mai mare. Aceasta concluzie sta la baza functionarii masinilor termice la care se reproduc periodic anumite stari. Prin revenirea la starea initiala, variatia tuturor marimilor de stare este zero, dar lucrul mecanic are o valoare diferita de zero. |
Conventia de semn: L > 0, daca este cedat de sistem
L < 0, daca este primit de sistem
2b Lucrul mecanic de deplasare sau dislocare Ld [J]
In cazul sistemelor deschise, pe langa interactiunea mecanica de tipul corp mobil-gaz, mai apare o interactiune de tipul gaz-gaz.
Lucrul mecanic de deplasare sau dislocare reprezinta lucrul mecanic necesar pentru deplasarea unui volum de fluid intr-o conducta, dintr-o pozitie data pana in alta pozitie, in conditii de presiune constanta.
Se considera o conducta prin care se deplaseaza un fluid sub presiune constanta p.
|
Figura 3 |
Lucrul mecanic necesar pentru a deplasa cantitatea m de fluid care ocupa volumul V din pozitia I in pozitia II este:
![]()
Pentru 1 kg: ![]()
Lucrul mecanic de deplasare este egal cu produsul a doua marimi de stare p si V, produs care este acelasi cand valoarea factorilor respectivi sunt aceeasi. Rezulta ca lucrul mecanic de deplasare este o marime de stare spre deosebire de lucrul mecanic exterior care este o marime ce depinde de drumul pe care se realizeaza transformarea dintr-o stare in alta.
Daca in procesul curgerii, gazul sufera si o transformare
a parametrilor de stare rezulta variatia elementara a lucrului mecanic de
deplasare: ![]()
![]()
Variatia finita a Ld cand fluidul trece din
starea 1 in starea 2 este: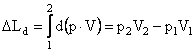
Exemplu: admisia la un motor cu piston cu mecanism biela-manivela (motor actionat de gaze sub presiune).
|
|
Figura 4
In cursul deplasarii pistonului de la 1' la 1 are loc admisia gazului la presiune constanta p1. Sistemul efectueaza lucru mecanic la arborele masinii chiar daca gazul nu a suferit o transformare dintr-o stare in alta. Deci, mediul exterior a cedat sistemului un lucru mecanic necesar introducerii gazului in cilindru, lucru mecanic pe care sistemul il cedeaza inapoi mediului prin intermediul pistonului.
![]()
|
Figura 5 |
In diagrama mecanica, Ld se poate reprezenta grafic printr-un dreptunghi de laturi p1 si V1. |
2c Lucrul mecanic tehnic Lt [J]
Se considera o masina termica motoare. Masina termica este un sistem deschis prin care trece, intr-un interval de timp, masa de agent termic sau agent de lucru m. Aceasta masa de gaz are la intrarea in masina presiunea p1, volumul V1 si temperatura T1. Dupa admisia in masina, agentul de lucru sufera o transformare in urma careia ajunge din starea 1 in starea La evacuarea din masina, masa m de agent de lucru are parametrii p2, V2, T
|
Figura 6 |
Exemplu: motorul cu piston prezentat anterior:
In
timpul deplasarii pistonului din pozitia 1' in 1 are loc admisia gazului la
presiune constanta si motorul efectueaza lucru mecanic: ![]()
|
Figura 7 |
In pozitia 1 se inchid ambele supape si cantitatea de gaz avand parametrii de stare p1V1T1 sufera o transformare (destindere) de la starea 1 la starea 2, caracterizata de parametrii p2V2T Deci, este corect sa spunem transformare pentru ca am avut o cantitate fixa de gaz. In acest caz lucrul mecanic cedat in exterior este lucrul mecanic al transformarii sau lucrul mecanic exterior.
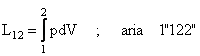
Din pozitia 2, se deschide supapa de evacuare si are loc evacuarea gazului la presiune constanta p Similar cu admisia, acest lucru mecanic de deplasare este:
![]()
Semnul (-) apare datorita faptului ca, pentru evacuarea gazului, masina are nevoie din exterior de lucru mecanic.
Deci, lucrul mecanic tehnic:
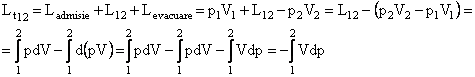
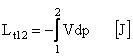
Pentru 1kg: 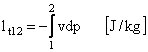
In diagrama pV:
![]()
2d Lucrul mecanic de frecare Lf [J]
In fenomenele reale orice miscare este insotita de frecare. Pentru invingerea acestor forte de frecare este necesar sa se consume un lucru mecanic de frecare Lf.
Pentru sistemele care cedeaza lucru mecanic (ex. motoare cu ardere interna), lucrul mecanic de frecare, in valoare absoluta, se scade din lucrul mecanic produs de motor in conditii ideale. Deci, din cauza frecarilor, un motor va produce un lucru mecanic mai mic decat lucrul mecanic ideal, in lipsa frecarilor. Invers, pentru sistemele care primesc lucru mecanic (ex. compresoare, pompe), lucrul mecanic de frecare, in valoare absoluta, se aduna la valoarea absoluta a lucrului mecanic primit de sistem in conditii ideale, fara frecari. Deci, in conditii reale, un compresor va consuma mai mult lucru mecanic decat in conditii ideale.
3 Caldura [J]
Intre un sistem termodinamic si mediul exterior se poate realiza, independent de interactiunile de natura mecanica, un schimb de energie pus in evidenta prin modificarea temperaturii sistemului. Schimbul energetic inceteaza daca temperatura mediului si a sistemului devin egale. Energia transmisa in acest mod se numeste caldura.
Deci, la fel ca lucrul mecanic exterior, nici caldura nu este o nu este o marime de stare ci este o forma de transfer de energie. Deci caldura apare doar cand are loc un transfer de energie. Dupa ce transferul a incetat, nu se mai poate vorbi de caldura ci doar de modificarea energiei interne a sistemului. Deci, nu este corect sa se spuna ca un sistem are inglobat in el energie sub forma de caldura.
Experimental s-a constatat ca energia schimbata pe aceasta cale este proportionala cu masa sistemului si cu variatia temperaturii sale.
Pentru o transformare elementara, cantitatea elementara de caldura este:
![]()
m - masa sistemului [kg];
dT - variatia elementara a temperaturii [K];
c - marime care depinde de natura sistemului si de starea sa termodinamica si se numeste caldura specifica sau capacitate calorica masica [J/kgK];
Caldura Q12 primita sau cedata de un sistem intr-o transformare termodinamica 1-2 este:
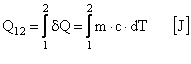
Conventia de semne:
Caldura primita de un sistem in cursul unei transformari este pozitiva deoarece conduce la cresterea temperaturii sistemului, dT > 0, iar caldura cedata este negativa.
4 Entalpia I [J]
Entalpia este o marime de stare ce caracterizeaza, ca si energia interna, nivelul energetic al unui sistem termodinamic.
Se noteaza cu I si se defineste prin relatia:
![]()
adica reprezinta suma dintre energia interna U si lucrul mecanic de deplasare pV.
Pentru 1 kg, entalpia masica: ![]() .
.
5 Formularile primului principiu al termodinamicii
Primul principiu al termodinamicii, care exprima legea generala a conservarii energiei si transformarii energiei in procesele termice, are urmatoarele formulari:
a) Energia unui sistem termic izolat se mentine constanta.
b) Nu se poate realiza o masina termica cu functionare continua care sa produca lucru mecanic fara a consuma o cantitate echivalenta de caldura.
O astfel de masina care ar produce lucrul mecanic continuu fara sa consume caldura in cantitate echivalenta se numeste perpetuum mobile de speta I.
c) Perpetuum mobile de speta I este imposibil.
d) O formulare mai restransa a echivalentei intre caldura si lucrul mecanic ca forme de transfer de energie este urmatoarea: Caldura poate fi produsa din lucrul mecanic si se poate transforma in lucru mecanic, intotdeauna in baza aceluiasi raport de echivalenta: 1 Kcal = 4185,5 J
Aceasta formulare este specifica sistemului tehnic de unitati de masura. In S.I. ambele marimi se exprima in J.
6 Exprimarea matematica a PT 1 pentru sisteme inchise
Ansamblul format de un sistem termodinamic inchis si mediul exterior formeaza in sistem izolat. Conform PT 1, energia acestui ansamblu se mentine constanta. Deci, energia schimbata de un sistem inchis cu mediu sub forma de caldura si lucru mecanic trebuie sa se regaseasca in variatia energiei interne a sistemului.
Tinand cont de conventia de semne, pentru o transformare dintr-o stare 1 in starea 2:
U2 - U1 = Q12 - L12 unde L12 = lucru mecanic exterior, pentru ca sistemul este inchis
Pt. 1 kg: u2 - u1 = q12 - l12
Pentru o transformare elementara:
du = dq - dl = dq - p dv
dq = du + p dv (3)
Din definitia entalpiei i = u + pv si relatia (3) rezulta:
dq = du + p dv = d(i - pv) + p dv = di - d(pv) + p dv = di - p dv - v dp + p dv =
= di - v dp adica
dq = di - v dp (4)
Relatiile (3) si (4) reprezinta expresiile matematice ale PT 1 cele mai utilizate, scrise sub forma diferentiala.
7 Exprimarea matematica a PT 1 pentru sisteme deschise
Se considera un sistem deschis, de exemplu o masina termica prin care circula in permanenta un agent de lucru si care schimba cu mediul exterior energie sub forma de caldura si lucru mecanic tehnic (lucrul mecanic la arborele unei masini termice este lucrul mecanic tehnic).
|
Figura 8 |
Conform legii generale a conservarii energiei:
E2 - E1 = ES (5)
unde: E1, E2 = energia totala a agentului la intrarea, respectiv iesirea din sistem iar Es = suma energiilor schimbate cu mediul exterior.
Energia agentului de lucru la intrarea sau iesirea din sistem este formata din suma energiilor pe care le poseda:
- energia interna U = m u
- energia cinetica Ec = m w2 / 2
- energia potentiala Ep = m g h
- lucrul mecanic de deplasare a masei de fluid din sectiunea respectiva
Ld = p V = m p v
Observatie: Ld este o marime de stare care caracterizeaza nivelul energetic al agentului de lucru intr-o stare si nu este o marime de transformare a energiei.
deci: 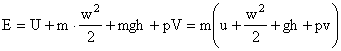
iar ![]()
Din relatia (5) rezulta:
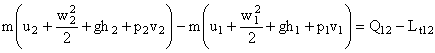
dar ![]()
Pentru 1 kg de agent de lucru:
![]() (6)
(6)
Relatia (6) reprezinta expresia matematica a PT 1 pentru sisteme deschise.
Daca frecarea nu poate fi neglijata:
![]()
8 Procese stationare in sisteme deschise
Cele mai multe masini si aparate termice, de exemplu turbinele, compresoarele, schimbatoarele de caldura, conductele, reprezinta din punct de vedere termodinamic sisteme deschise. In tratarea acestor sisteme se presupune ca procesul din sistem este un proces stationar.
Un proces stationar se caracterizeaza prin faptul ca marimile de stare ale fluidului nu variaza in timp intr-un anumit punct al sistemului.
Daca la sistemele inchise starea initiala si finala se succed in timp, la sistemele deschise toate starile fluidului exista concomitent , insa in diferite puncte ale spatiului.
Procesele stationare ale sistemelor termodinamice deschise pot fi impartite in doua categorii:
1) Procese de curgere = procese in care nu se schimba energie sub forma de lucru mecanic cu mediul.
Aceste sisteme nu poseda instalatii pentru producerea sau consumul de lucru mecanic tehnic (schimbatoare de caldura, conducte) (lt12 = 0).
2) Procese de lucru = procese in care se schimba cu mediul energie sub forma de lucru mecanic tehnic (masinile termice).
Expresia matematica a PT 1 pentru sisteme deschise se va simplifica in functie de procesul stationar considerat. Astfel, neglijand variatia energiei potentiale, mai ales in cazul in care agentul de lucru este gaz, relatia (6) devine:
1a) procese de curgere cu schimb de caldura (schimbatoare de caldura):
![]()
1b) procese de curgere adiabate (conducte izolate termic) (q12 = 0):
![]()
2) procese de lucru adiabate q12 = 0, lt12 ¹
![]() sau
sau ![]()
9 Ecuatii calorice de stare
Din relatiile anterioare (3) si (4) rezulta:
du = dq - p dv (7)
di = dq + v dp (8)
Din (7) si (8) rezulta ca variatia energiei interne si a entalpiei se poate produce prin schimb de caldura cu mediul exterior. Din aceasta cauza energia interna si entalpia se numesc marimi calorice de stare.
De asemenea, fiind marimi de stare, ele pot fi determinate sub forma unor ecuatii de parametri de stare p, V, T. Dar, tinand cont de dependenta parametrilor de stare, exprimata prin ecuatia termica de stare F(p,v,T) = 0, energia interna si entalpia se pot determina numai in functie de 2 parametri.
Tinand cont de relatiile (7) si (8) si de faptul ca variatia caldurii este proportionala cu variatia temperaturii, rezulta ca variatia energiei interne este in functie de variatia temperaturii si a volumului, iar variatia entalpiei functie de variatia temperaturii si a presiunii.
Rezulta ca ecuatiile pentru determinarea energiei interne si entalpiei, adica ecuatiile calorice de stare, vor fi de forma:
u = u(v,T)
i = i(p,T) (9)
u si i sunt marimi de stare, deci admit diferentiale totale. Diferentiind relatiile (9), se obtine:
![]() (10)
(10)
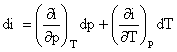 (11)
(11)
sau
![]() (12)
(12)
![]() (13)
(13)
Relatiile (12) si (13) reprezinta ecuatiile calorice de stare scrise sub forma diferentiala.
In aceste relatii s-a notat: ![]() si
si ![]()
Caldurile specifice cv si cp
Din relatiile (7) si (12) rezulta:
![]()
Pentru o transformare la volum constant (dv = 0)
![]() (14)
(14)
Similar, din relatiile (8) si (13), rezulta:
![]()
Pentru o transformare la presiunea constanta (dp = 0)
![]() (15)
(15)
Din relatiile (14) si (15) rezulta:
![]() caldura specifica la volum constant
caldura specifica la volum constant
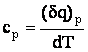 caldura specifica la presiune constanta
caldura specifica la presiune constanta
Deci, se poate defini cv si cp ca fiind energia schimbata sub forma de caldura de unitatea de masa din sistemul considerat intr-o transformare la volum, respectiv la presiune constanta, astfel incat sistemul sa-si modifice temperatura cu unitatea de grad in cuprinsul aceleasi stari de agregare.
Aceasta definitie sta la baza determinarii pe cale experimentala a caldurilor specifice pentru diferite substante.
Fiindca lichidele si solidele sunt practic incompresibile (deci nu-si modifica volumul la marirea presiunii) cv si cp au aceeasi valoare.
In acest caz se considera o singura caldura specifica notata c.
![]()
Copyright © 2024 - Toate drepturile rezervate