 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Diminuarea impactului produs de apele reziduale asupra resurselor de apa naturale; Asigurarea calitatii apei destinata consumului uman
Atentia tot mai crescuta manifestata pentru protectia mediului, se traduce prin adoptarea unor reglementari din ce in ce mai severe privind concentratiile maxime admise (CMA) ale poluantilor din ape (efluenti industriali, ape naturale, ape potabile). Data fiind capacitatea redusa a proceselor conventionale de tratare a apelor naturale si cele de epurare a apelor reziduale in eliminarea unor poluanti organici persistenti (POP), s-a impus necesitatea dezvoltarii unor procese cat mai performante de tratare/epurare a apelor.
Pricipalele categorii de procese capabile sa asigure o eliminare eficienta a POP sunt: filtrarea pe membrane, adsobtia pe carbune activ si procese de oxidare avansata. Dintre acestea, cea din urma este singura prin care se realizeaza o degradare a poluantilor si nu transferul acestora intr-o alta faza.
In procesele de oxidare a poluantilor din ape se folosesc drept agenti oxidanti o serie de reactivi gazosi si lichizi: clor, dioxid de clor, hipoclorit, cloramine, fluor, permanganat de potasiu, oxigen (din aer, sau pur), peroxid de hidrogen si nu in ultimul rand ozon. Potentialele redox ale acestora sunt prezentate in tabelul 1:
Clorul este reactivul cel mai utilizat, in special pentru dezinfectarea apei. El nu se foloseste direct in faza gazoasa, ci este mai intai dizolvat in apa dand nastere acidului hipocloros conform reactiei:
![]() Cl2 + H2O HClO + HCl
Cl2 + H2O HClO + HCl
Care este insotita de reactia de disociere:
![]() HClO ClO- + H+
HClO ClO- + H+
Tabelul 1. Potentialele redox ale principalilor agenti oxidanti
utilizati in tratarea si epurarea apelor (Plant si Jeff, 1994)
Agent oxidant |
potential redox (V) |
|
Fluor | |
|
Radical hidroxil* | |
|
Ozon | |
|
Apa oxigenata | |
|
Permanganat de potasiu | |
|
Acid hipocloros | |
|
Dioxid de clor | |
|
Clor | |
|
Oxigen |
* - generati in procesele de oxidare avansata
In figura 1 este reprezentat acest ultim echilibru in functie de pH. Daca valoarea pH-ul este mai mica de 2, tot clorul se afla sub forma moleculara. La pH 5, clorul molecular dispare in totalitate pentru a forma HClO, iar pentru un pH care depaseste valoarea de 10, tot clorul se gaseste sub forma de ioni hipoclorit (ClO-).
Efectul oxidant al clorului este maxim atunci cand se gaseste sub forma de HClO, deci intr-un domeniu de pH cuprins intre 5 si 10. Din graficul prezentat in figura 2 se poate calcula, pentru o doza data de clor liber, cantitatea de clor prezenta sub forma de HClO, denumita si clor liber activ.
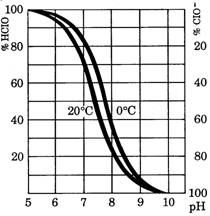
Figura 1. Disocierea HClO in apa
Dioxidul de clor este un agent oxidant cu o putere de oxidare relativ ridicata (tabelul 1). Este produs in situ prin reactia dintre cloritul de sodiu, fie cu clorul, fie cu acidul clorhidric.
Dioxidul de clor reactioneaza lent cu apa:
![]() 2 ClO2 + H2O ClO2- + ClO3- + 2 H+
2 ClO2 + H2O ClO2- + ClO3- + 2 H+
si este sensibil la actiunea radiatiei luminoase, descompunandu-se conform reactiei:
2 ClO2 + hn + H2O ClO3- + Cl- + 2 H+ + O2
Functie de concentratia sa in apa dioxidul de clor poate conduce la reactii de oxidare (exces de ClO2), sau la reactii de clorurare (slab exces de ClO2).
ClO2 este utilizat pentru oxidarea anumitor poluanti organici, dar cel mai frecvent, datorita puterii sale remanente, pentru dezinfectarea apelor potabile, in finalul fluxului de tratare.
Dupa introducerea in apa a hipocloritului de sodiu, NaClO, se produce disocierea acestuia cu formarea ionului hipoclorit si a ionului de sodiu:
![]() NaClO ClO- + Na+
NaClO ClO- + Na+
mentinandu-se astfel un pH optim pentru actiunea oxidanta si bactericida a acestui agent oxidant.
Cloraminele sunt obtinute prin actiunea clorului asupra amoniacului conform reactiilor de mai jos:
![]() Cl2 + H2O HClO + HCl
Cl2 + H2O HClO + HCl
HOCl + NH3 NH2Cl + H2O monocloramina
NH2Cl + HOCl NHCl2 + H2O dicloramina
NHCl2 + HOCl NCl3 + H2O tricloramina
Cloraminele au o putere oxidanta si bactericida mult mai scazuta decat celelalte produse clorigene, dar sunt mult mai stabile avand astfel un efect remanent de lunga durata, aspect interesant pentru retelele care distribuie apa la temperaturi ridicate.
Compusii clorului sunt utilizati pe scara larga in tratarea si epurarea apelor datorita pretului lor scazut, dar prezinta totusi unele dezavantaje si anume:
trebuie adaugati in cantitati apreciabile pentru atingerea unui grad de oxidare avansat al poluantilor;
prezinta riscul formarii unor compusi organici clorurati (de substitutie sau de aditie) unii dintre acestia caracter cancerigen dovedit;
cantitatile remanente confera apei potabile gust si miros neplacut.
Caracterul oxidant cel mai ridicat dintre toti reactivii utilizati il are florul, dar el este putin intrebuintat datorita costului de productie foarte ridicat si a deosebitei sale toxicitati (sub forma de gaz). Aplicatiile sale sunt numai in domeniul dezinfectiei apei potabile. Statele Unite ale Americii aplica un astfel de procedeu, in special din ratiuni medicale, deoarece s-a constatat ca continutul de floruri din apa tratata contribuie la mentinerea unei dentitii si osaturi sanatoase a populatiei.
Permanganatul de potasiu este un agent oxidant puternic (1,7 V) dar costisitor, ale carui performante sunt apreciabile doar intr-un domeniu ingust de pH (pH acid).
Barbotarea de aer in apa are ca efect, datorita oxigenului absorbit oxidarea unor compusi, de exemplu Fe II si ca efect secundar eliminarea unor gaze dizolvate (H2S, CO2 in exces). Aceasta tehnica este de obicei utilizata in tratarea apelor de suprafata si subterane.
Cand consumul de oxigen este mai ridicat, cazul apelor reziduale, se prefera in locul unei aerari o barbotare de oxigen pur pentru eliminarea compusilor usor oxidabili sau pentru asigurarea necesarului de oxigen tratamentului biologic.
Pentru oxidarea unor poluanti refractari (fenoli, pesticide
organoclorurate sau triazinice, etc.) utilizarea oxigenului, care este un agent
oxidant slab, necesita investitii mari datorita conditiilor de operare
(temperatura si presiune ridicata), mai ales daca procesul este necatalitic.
Costurile de operare nefiind insa prea ridicate acesta isi gaseste
aplicabilitate in unele procedee. Acestea poarta denumirea de procese de oxidare
umeda si se relizeaza la temperaturi si presiuni inalte (130-
Peroxidul de hidrogen (sau apa oxigenata) este un oxidant puternic (tabelul 1) care este utilizat intr-o serie de procese de tratare si epurare a apei. In apa disociaza conform reactiei:
![]() H2O2 + H2O HO2- + H3O+
H2O2 + H2O HO2- + H3O+
Peroxidul de hidrogen poate fi folosit si in combinatie cu alti agenti oxidanti, cum ar fi ozonul. Reactia dintre ozon si peroxidul de hidrogen este lenta:
2 O3 + H2O2 2 HO· + 3 O2
si conduce la formarea de radicali hidroxil, care au in inalt potential de oxidare.
De asemenea, pentru marirea eficientei procesului, peroxidul de hidrogen este utilizat si alaturi de radiatie UV si/sau diversi catalizatori.
Abilitatea ozonului de a dezinfecta apele uzate a fost recunoscuta inca din 1886-(Metrius), pentru ca peste cativa ani firma Siemens & Halske sa treaca la aplicarea procedeului. Primul generator de ozon industrial bazat pe efectul Corona a fost creat de catre Von Siemens in 1857.
Chimistul francez Maris Paul Otto care a
efectuat cercetari despre ozon in cadrul Universitatii Sorbona incepand cu anul
Tarile care aplica la scara larga tratarea apelor cu ozon sunt Franta, Olanda, Germania, USA. Dintre tarile Europei Centrale si de Est, Rusia, Polonia si Cehia detin suprematia. In Romania aceasta tehnologie a inceput sa se aplice, desi la scara redusa, de aproximativ 8-9 ani.
Ozonul se utilizeaza cu preponderenta in tratarea apelor, dar in ultima vreme castiga teren si in procesele de epurare a apelor reziduale.
Ozonizarea in tratarea apelor in scopul potabilizarii poate atinge mai multe obiective:
Dezinfectia si controlul dezvoltarii algelor;
Oxidarea compusi anorganici (deferizare, demanganizare);
Oxidarea microplouantilor organici, si anume:
- derivati fenolici,
- pesticide;
- distrugerea trihalometanilor potential formati la tratrea cu Cl2;
Oxidarea macropoluantilor organici (nespecifici):
- cei care confera gust si miros (imbunatatirea propriatatilor organoleptice),
- decolorare,
- cresterea biodegradabilitatii,
Imbunatatirea procesului de coagulare.
Utilizarea ozonului in tratarea apelor de consum si chiar a celor reziduale este tot mai frecventa. Inconvenientele folosirii acestui oxidant, cum ar fi: consum energetic ridicat pentru producerea sa si caracterul toxic la concentratii relativ scazute in atmosfera, pot fi neglijate tinand cont de numeroasele avantajele:
ozonul se produce la locul unde se consuma, deci nu necesita transport si spatii de depozitare;
este un oxidant foarte puternic avand cel mai ridiat potential redox (cu exceptia fluorului care este utilizat doar sporadic);
se utilizeaza cu rezultate bune intr-un domeniu larg de pH (3-12);
este de 13 ori mai solubil in apa decat oxigenul;
risc redus de formarea a compusilor organici halogenati;
nu introduce impurificatori in mediu (ceilalti agenti oxidanti, cu exceptia oxigenului, putand contine impurificatori).
Actiunea ozonului in apa este rezultatul a doua fenomene sucesive: solubilizarea in apa (transferul gaz apa) si actiunea ozonului asupra poluantilor. Numeroase studii au aratat ca actiunea ozonului asupra impurificatorilor din ape este una dubla. El poate reactiona direct, ca ozon molecular (reactie selectiva), sau prin intermediul unor specii secundare, cum sunt radicalii hidroxil, formate prin descompunerea moleculei de ozon in apa.
Ca si peroxidul de hidrogen, ozonul este utilizat si in cupluri de tipul: O3/H2O2; O3/UV; O3/catalizator; etc.
OZONIZAREA - ACTIUNEA OZONULUI ASUPRA SUBSTANTELOR ORGANICE DIN APA
Utilizat la inceput doar pentru dezinfectia apei, ozonul cunoaste astazi o utilizare diversificata, putand fi folosit in oxidarea diversilor micropoluanti specifici din apa (Cocheci, 1993).
Tinand seama ca in apele brute au fost puse in evidenta intre 700 si 1000 substante organice examinarea amanuntita a efectului ozonizarii asupra acestora este extrem de dificila. In ultimul timp au fost publicate numeroase lucrari in acest domeniu, care conduc la concluzia ca pentru fiecare substanta in parte este recomandabil sa se studieze reactiile de oxidare posibile, produsii de reactie, produsii partiali de oxidare si interactiunea lor, in functie de continutul de poluant, de doza de ozon si de durata ozonizarii (Kainuleinen si colab., 1995).
In urma reactiei cu ozonul, compusii organici formeaza produsi partiali sau totali de oxidare. Unii produsi de degradare sunt inofensivi si pot ramane in apa tratata, altii sunt mai biodegradabili decat compusii initiali si pot fi indepartati prin procedee biologice. Pentru marirea eficientei ozonizarii in eliminarea materiilor organice, ea poate fi completata cu o coagulare, filtrare pe nisip sau carbune activ, sau cu un tratament biologic.
Compusii cei mai reactivi fata de ozon sunt cei care contin legaturi C=C si moleculele nucleofile. Cel mai putin afectate sunt legaturile C-H.
In solutiile apoase, o parte din ozon reactioneaza direct cu substantele dizolvate in apa, reactia fiind selectiva si lenta, iar o alta parte se transforma in radicalii HO.. Transformarea in radicalii HO· este initiata de ionii HO- si decurge cu atat mai rapid cu cat pH-ul este mai ridicat. Procesul de oxidare cu ozon reprezinta o suprapunere a celor doua tipuri de reactii: "oxidarea directa" si reactiile radicalice cu HO..
Radicalii HO. sunt oxidanti puternici, neselectivi, care pot:
a) sa formeze cu substantele dizolvate in apa radicali secundari (R·), care functioneaza ca promotori ai reactiilor in lant.
b) sa fie captati de unii compusi intrerupatori de lant ca de exemplu ionii bicarbonat si carbonat, rezultand specii inactive, inhibitori ai reactiilor in lant.
Reactia ozonului cu un substrat de natura
organica, M, respecta o cinetica de ordinul
-d[M]/dt = k[O3][M]
Cosiderand ambele tipuri de rectii de oxidare care pot avea loc, directa (a) si radicalica (b):
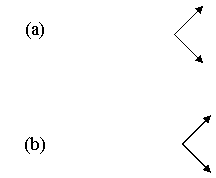 k1
→ produsi
k1
→ produsi
O3 + M
k2 → HO· ± produsi (initiere)
k3 → produsi (intreruperea lantului)
HO· + M
k4 → HO· + produsi (propagare)
ecuatia cinetica devine:
d[M]/dt = (k1 + k2)[O3][M] + (k3 + k4)[ HO·][M]
Principalele categorii de micropoluanti organici prezenti in ape sunt:
hidrocarburi alifatice si derivati halogenati;
alcooli, esteri, adehide si acizi carboxilici;
compusi aromatici simpli (AH) si complecsi (PAH);
derivati fenolici;
amine;
pesticide;
surfactanti;
coloranti.
In cele ce urmeaza vor fi tratate mai amanuntit trei dintre categoriile de micropoluanti organici mai sus mentionate si anume: compusii aromatici (inclusiv substantele humice); derivatii fenolici si pesticidele.
Reactia ozonului cu compusii aromatici
Compusii aromatici constituie o clasa importanta de poluanti ai apelor. Ei pot fi simpli (AH) sau complecsi (PAH), naturali (de ex. substante humice) sau de sinteza.
Ozonizarea compusilor aromatici pote presupune atat un atac asupra catenelor laterale (substituentilor) cat si o deciclizare. O schema generala a rectiei de oxidare cu ozon a substantelor aromatice este prezentata in figura 2 (Legube, 1983).
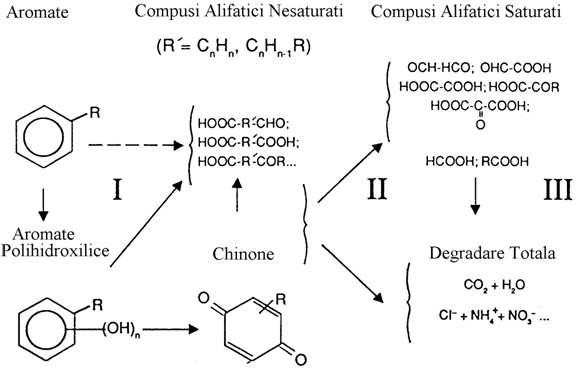
Figura 2. Schema generala a ozonizarii substantelor aromatice simple
Compusii aromatici simpli pot fi clasificati, dupa o regula generala, astfel (Doré si Legube, 1983):
compusi aromatici cu grupari respingatoare de electroni (-OH, -NH2) - acestia reactioneaza rapid cu ozonul;
compusi aromatici cu grupari atragatoare de electroni (-NO2, -Cl) pentru care reactia de ozonizare e mult mai lenta.
Degradarea compusilor aromatici mai putin reactivi necesita aplicarea unor sisteme capabile sa genereze radicali liberi (Procese de Oxidare Avansata - AOP).
Compusii aromatici polinucleari sunt degradati in urma tratarii cu ozon in mod similar cu cei mononucleari, conform schemei generale:

Reactia ozonului cu substantele humice
Datorita concentratiei lor ridicate in apa (30 pana la 50% din carbonul organic dizolvat - Thruman, 1985), substantele humice pot fi considerate reprezentante ale substantelor organice naturale din apa. Fie ca sunt formate in sol (si apoi antrenate in apa) fie direct in apa, substantele humice sunt rezultatul degradarii si polimerizarii materiilor vegetale prin procese microbilogice, chimice si fotochimice. Principalii reprezentanti ai acestei clase de substante sunt huminele, acizii humici si acizii fulvici. Acizii fulvici se gasesc in concentratii mai mari datorita solubilitatii lor mai ridicate, acizii humici fiind prezenti in principal sub forma coloidala.
Datorita structurii lor complexe care e departe de a fi elucidata si prezentei a mai multor grupari functionale, substantele humice prezinta diverse proprietati fizicochimice. Dintre acestea se pot mentiona:
reactivitatea inalta fata de halogeni, ceea ce conduce la un consum ridicat de clor pentru potabilizarea apei si la formarea de compusi organici halogenati, unii cu caracter mutagenic;
adsorbtia puternica pe carbune activ sau alumina, precum si pe coloizi minerali ceea ce poate modifica performantele procesului de coagulare/floculare;
o posibila complexare cu metale aflate in urme - cresterea solubilitatii acestora;
posibilitatea de a se combina cu micropoluanti organici, inclusiv cu pesticide, care de asemenea le poate mari solubilitatea in apa.
Anderson si colab. (1986) au pus in evidenta ca ozonizarea acidului fulvic (in solutie tamponata, pH = 7,2) are loc cu un consum apreciabil de ozon, consum care creste odata cu marirea dozei de ozon aplicata (figura 3). Reckhow (1984) observa si el acelasi fenomen la ozonizarea acidului fulvic si mai mult pune in evidenta dependenta consumului de ozon de prezenta bicarbonatilor in apa. Cresterea consumului de ozon in prezenta ionului bicarbonat poate fi explicata printr-o stabilizare a ozonului in apa (Reckhow si colab., 1986). De asemenea, consumul de ozon este functie de natura substantei humice (Anderson si colab., 1986).
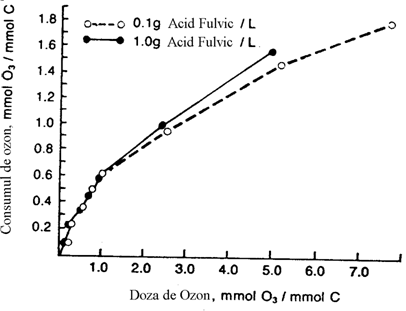
Figura I. 2. Consumul de ozon functie de doza de ozon aplicata la ozonizarea acidului fulvic.
Chiar daca substantele humice (SH) au o structura complexa, se poate considera ca ele reactioneaza cu ozonul in mod similar cu alti compusi organici.
(SH)d + O3 produsi + O2 + H2O2
(SH)i + O3 produsi . HO·
(SH)p + HO· produsi + (O2- HO2·)
(SH)s + HO· produsi
unde: (SH)d - centrii nucleofili
(SH)i - centrii care initiaza formarea de radicali
(SH)p - centrii care realizeaza etapa de propagare
(SH)s - centrii care conduc la intreruperea lantului
Se poate spune ca substantele humice in mediu apos reactioneaza ca o solutie ce contine: diverse concentratii de centrii consumatori de ozon: (SH)i si (SH)d, conducand la formarea de specii radicalice sau neradicalice (reactiile 2 si 1); si diferite concentratii de centri consumatori de radicali hidroxil (HS)p si (HS)s, ce pot conduce la propagarea unui lant radicalic. Pe langa aceste reactii principale, exista de asemenea reactii ale ozonului cu ionii hidroxil si superoxid, (HO- si O-2) ce conduc la formarea de radicali hidroxil si reactia ozonului cu HO·, ce are ca urmare descompunerea ozonului in apa.
Actiunea ozonului asupra substantelor humice din solutie apoasa la pH neutru conduce la:
o abatere nesemnificativa a TOC - ului;
o decolorare puternica si o diminuare a absorbtiei in UV;
o scadere nesemnificativa a ponderii fractiilor de masa moleculara mare si o crestere nesemnificativa a fractiilor cu masa moleculara mica;
o crestere apreciabila a numarului de grupari carboxil;
formarea a numerosi produsi de de oxidare partiala.
Reactia ozonului cu compusii fenolici
Compusii fenolici (fenolul, fenoli substituiti, chinone si polihidroxifenoli) au drept caracteristica prezenta pe nucleu a gruparii respingatoare de electroni, -OH si prin urmare sunt reactivi fata de ozon. Oxidarea lor in solutii apose a fost studiata in special datorita aplicatiilor in procesele de tratare si epurare a apelor.
Datele de literatura prezinta doua tipuri de mecanisme ale ozonizarii fenolilor in mediu apos (Decoret si colab., 1984; Gurol si Vatistat, 1987; Singer si Gurol, 1983; Dorč si Legube, 1983; Einsenhauer 1968, 1971):
In mediu acid sau neutru are loc un atac electrofilic al ozonului asupra carbonului din pozitiile mai reactive (orto si para) (Figura 4);
In mediu neutru sau bazic, procesul se poate desfasoara prin ambele tipuri de mecanisme: (1) atac electrofilic al ozonui asupra ionului fenoxid sau (2) mecanism radicalic generat de radicalii HO· ce poate fi initiat atat de ionii HO- cat si de cei fenoxid.
In urma oxidarii fenolilor rezulta urmatoarele tipuri de intermediari:
produsi rezultati in urma hidroxilarii nucleului aromatic, cum sunt polihidroxibenzenii si chinonele;
produsi rezultati in urma scindarii nucleului aromatic, cum ar fi acidul muconic si derivati ai acestuia;
produsi finali de oxidare: acid glioxilic, oxalic, formic si glioxal
De asemenea, este posibila si formarea unor produsi de condensare (Duguet si colab., 1985).
Un studiu amanuntit asupra ozonizarii 2-clorfenolului in solutii apoase la diferite valori ale pH-ului a fost efectuat de catre Ku si colab. (1996). Acestia au evidentit faptul ca viteza de descompunere a 2-clorfenolului si viteza de mineralizare a intermediarilor organici prin ozonizare creste cu cresterea concentratiei de ozon introdus si cu cresterea pH-ului mediului. Pentru solutii alcaline in care concentratia unor specii captoare de radicali liberi (radical scavengers) ca HCO3- si CO32- este ridicata, mineralizarea intermediarilor organici este nesemnificativa. Pe langa efectul inhibitor asupra reactiilor radicalice, prezenta ionilor carbonat si bicarbonat in solutie conduce si la o crestere semnificativa a consumului specific de ozon. De asemenea, nici in mediu acid nu are loc o mineralizare semnificativa a compusilor organici, datorita probabil formarii de acizi organici cu stabilitate ridicata.
La descompunerea 2-clorfenolului au fost detectati acidul oxalic si glioxilic care contribuie in procent de 70 - 90% la carbonul organic total (TOC) din solutie. Cantitatea de carbon anorganic total (TIC) se mareste in timpul reactiei si odata cu cresterea pH-ului solutiei.
Degradarea 2-clorfenolului poate sa implice declorurari directe si indirecte. In urma declorurarii directe rezulta intermediari fara clor, cum este catechina, iar in urma declorurarii indirecte rezulta intermediari care mai contin clor, cum ar fi clorhidrochinona. Etapa de reactie cea mai rapida este etapa de eliminare a clorului de la nucleul benzenic.
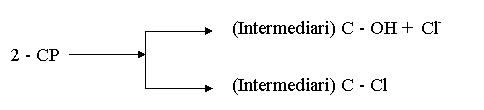
Figura I.4. Reprezentarea schematica a ozonizarii fenolului
Trebuie mentionat insa faptul ca unii dintre produsii primari de degradare rezultati in urma ozonizarii clorfenolilor prezinta caracter toxic (Benoit-Guyot si colab., 1984).
In ceea ce priveste cinetica procesului de ozonizare a fenolilor aceasta este de ordinul unu in raport cu ozonul si cu fenolul (Hoigné si Bader, 1983a, 1983b; Gurol si Nekouinaini, 1984):
-d[fenol]/dt = k[O3][fenol]
Viteza de reactie este dependenta de structura compusului fenolic. Ea este cu atat mai mare cu cat densitatea electronica a nucleului aromatic e mai mare (Gould, 1987). De asemenea, exista o corelatie intre viteza de reactie si valoarea pH-ului, aceasta crescand in mediu bazic datorita disocierii fenolului in ion fenoxid. Hoigné si Bader (1983a, 1983b) au gasit in cazul fenoxidului valori ale constantei de viteza de pana la 6 ordine de marime mai mari fata de cele pentru fenolul nedisociat.
In concluzie, se poate aprecia ca
fenolii sunt oxidati relativ rapid de catre ozon, dar unii din produsii
intermediari pot avea toxicitate mai mare decat fenolii initiali. Din acest motiv este necesar sa se asigure
un timp de contact intre reactanti mai indelungat sau, dupa caz, sa se recurga
Reactia ozonului cu pesticidele
Exista numeroase studii care au avut drept obiect actiunea ozonului asupra pesticidelor. Datorita varietatii acestei categorii de poluanti, este normal ca reactivitatea lor fata de ozon sa fie diferita.
Pesticidele organoclorurate sunt slab reactive si nu sunt degradate complet prin ozonizare simpla (Kroier si colab., 1989). De exemplu, aldrinul este transformat in dieldrin, iar heptaclorul in heptaclorperoxid.
Pesticidele organofosforice sunt mai susceptibile la ozonizarea directa, dand numerosi produsi de degradare (Laplanche si colab., 1984). Principalele reactii care au loc sunt:
oxidarea legaturii P = S cu formarea legaturii P = O;
scindarea moleculei la una din legaturile in care este implicat atomul de fosfor, conducand la obtinerea de esteri simpli si acid fosforic.
Pentru ozonizarea parationului in mediu apos, constanta de viteza de ordinul 1 determinata de Laplanche si colab. (1976) a fost de 70 M-1s-1. Deci, se poate aprecia ca desi in acest caz se poate realiza o oxidare mai avansata, viteza de reactie este scazuta.
Ierbicidele din clasa compusilor fenoxiacetici sunt degradate rapid prin ozonizare (Doré si colab., 1978, 1980; Quentin si colab., 1978). Acesti compusi urmeaza aceleasi etape de reactie ca derivatii fenolici, primii intermediari rezultati fiind produsi de hidroxilare a ciclului aromatic.
Comparativ cu alti compusi heterociclici cu azot, atrazina nu are o reactivitate ridicata. Totusi, ozonul poate exercita un atac asupra nucleului heterociclic. Produsii obtinuti la ozonizarea atrazinei au fost clasificati de S. Nelieu si colab. (1996) in trei grupe, corespunzator substituientului din pozitia a doua a nucleului triazinic: clortriazine, hidroxitriazine si triazine dehalogenate. Legube si colab. (1987) au izolat din mediul de reactie si produsi de oxidare ai atrazinei ce contin grupari oxo.
Ca o concluzie generala, se poate afirma ca marea majoritate a pesticidelor sunt greu degradabile chiar in cazul cand se utilizeaza un agent oxidant puternic cum este ozonul. O eliminare mai eficienta se poate realiza daca se aplica Procedee de Oxidare Avansata (AOP).
Efectul ozonului asupra biodegradabilitatii substantelor organice
In general, la ozonizarea compusilor organici din ape se realizeaza o crestere a bidegradabilitatii (Gilbert si Zinecker, 1980; Brunet, 1981). Exista insa poluanti pentru care, la doze scazute de ozon, s-a pus in evidenta un efect contrar (de scadere a biodegradabilitatii) (Gilbert, 1983).
Un exemplu privind efectul diferit al ozonizarii asupra biodegradabilitatii unor micropolunti organici poate fi gasit in studiul efectuat de Adams si colab. (1997). Acestia au evidentiat ca ozonizarea clorfenolilor si nitrofenolilor conduce la o crestere marcanta a biodegradabilitatii apei astfel tratate, in timp ce la ozonizarea aminofenolilor are loc descrestere semnificativa a biodegradabilitatii (Figura 6).
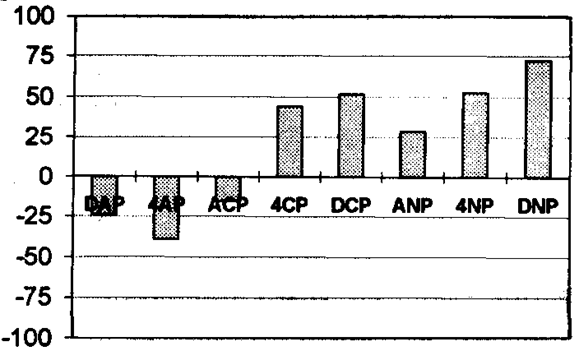
Figura 6. Evolutia biodegradabilitatii compusilor fenolici model in urma ozonizarii
(DAP - 2,4-diaminofenol, 4AP - 4-aminofenol, ACP - 2-amino-4-clorfenol,
4CP - 4-clorfenol, DCP - 2,4-diclorfenol, ANP - 2-amino-4-nitrofenol,
4NP - 4-nitrofenol, DNP - 2,4-dinitrofenol)
Datele de literatura privitoare la efectul ozonizarii asupra biodegradabilitatii unor substante humice nu releva un punct de vedere comun in aceasta privinta. Astfel, functie de metoda de determinare a biodegradabilitatii si probabil functie de parametrii procesului de ozonizare, unii autori au gasit ca biodegradabilitatea substantelor humice este foarte putin marita in urma ozonizarii sau nu este deloc (Larose si colab., 1982; Gilbert, 1983; Somiya 1986), in timp ce altii au obtinut o crestere semnificativa a acesteia ( De Laat, 1988).
Copyright © 2024 - Toate drepturile rezervate