 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
BIOCONCENTRAREA: TEST CU REINNOIRE CONTINUA PE PESTI
METODA
Prezenta metoda de bioconcentrare reproduce directivele OECD TG 305 (1996).
Introducere
Prezenta metoda descrie o procedura de caracterizare a potentialului de bioconcentrare, in cazul pestilor supusi la o reinnoire continua a anumitor substante. Regimurile de testare cu reinnoire continua sunt de departe preferate, dar si cele semistatice sunt acceptate, in masura in care sunt indeplinite criteriile de validitate.
Metoda ofera toate informatiile necesare efectuarii testului, insa lasa libertatea indispensabila de adaptare a conceptului experimental la conditiile specifice fiecarui laborator si nu impune in mod strict caracteristicile substantelor de testat. In special, sunt indicate produsele organice stabile pentru care valorile log Pow sunt cuprinse intre 1,5 si 6,0 (1), insa metoda este aplicabila si substantelor superlipofile (log Pow > 6,0) . Pentru acestea din urma, estimarea prealabila a factorului de bioconcentrare (BCF), denumit uneori KB, va fi probabil superioara valorii factorului de bioconcentrare in starea stationara (BCFSS), la care ne putem astepta in cazul unei experiente de laborator. Evaluarile preliminare ale factorului de bioconcentrare, pentru produsele organice ale caror valori log Pow ajung pana la aproximativ 9,0 se calculeaza cu ajutorul ecuatiei Bintein si col. (2). Potentialul de bioconcentrare se caracterizeaza pentru anumiti parametrii, cum ar fi: constanta de viteza de absorbtie (k1), constanta de viteza de eliminare (k2) si BCFSS.
Substantele de testare marcate radioactiv pot facilita analiza esantioanelor de apa si de pesti; de asemenea, pot servi la definirea degradarii, daca este necesar sa o identificam si sa o cuantificam. Daca se masoara totalul de reziduu radioactiv (de exemplu, prin combustia ori solubilizarea tesuturilor), BCF-ul se bazeaza pe compusul de origine, toti metabolitii retinuti si carbonul asimilat. Factorii BCF care se bazeaza pe reziduurile radioactive totale nu pot fi, asadar comparati direct cu un factor BCF derivat dintr-o analiza chimica particulara exclusiv a compusului de origine.
Se pot utiliza proceduri de epurare, in cadrul studiilor cu markeri radioactivi, pentru determinarea BCF pe baza compusului original, iar principalii metaboliti vor fi determinati daca se considera necesar. De asemenea, exista posibilitatea combinarii unui studiu de metabolism al pestilor cu un studiu de bioconcentrare, prin analiza si identificarea reziduurilor tisulare.
Definitii si unitati
Bioconcentrare/Bioacumulare: cresterea concentratiei substantei de testat la/sau intr-un organism (tesuturile specifice ale acestuia) in raport cu concentratia acestei substante in mediul ambiant.
Factor de bioconcentrare (BCF sau KB): in orice moment din faza de absorbtie a experientei de acumulare, concentratia substantei de testat la/in pesti, sau pe tesuturi determinate ale acestora, [Cf in µg/g (ppm)] raportata la concentratia substantei chimice din mediul ambiant [CW in µg/ml (ppm)].
Factor de bioconcentrare in stare stationara (BCFSS sau KB): nu se modifica prea mult intr-o perioada mare de timp, concentratia substantei de testare din mediul ambiant fiind constanta pentru aceeasi perioada de timp.
Platoul sau starea stationara: in reprezentarea grafica a substantei de testare la pesti (Cf), in functie de timp, se asteapta sa devieze, pentru curba, paralel fata de axa timpului, iar pentru trei analize succesive ale Cf - realizate asupra unor esantioane prelevate la intervale de cel putin doua zile - sa ramana intr-o plaja de 20 % una fata de alta; nu exista diferente semnificative intre cele trei perioade de esantionare. Cand se analizeaza esantioane reunite, se efectueaza minimum patru analize succesive. Daca substantele de testare au caracteristici de absorbtie lente, este preferabil sa se opteze pentru intervale saptamanale.
Factori de bioconcentrare : calculati direct pornind de la constantele cinetice (k1/ k2) se numesc factori de concentrare cinetica, BCFk.
Coeficient de partitie octanol-apa (POW) : raportul de solubilitate a unui produs chimic in n-octanol si in apa, la echilibru (Metoda A.8), de asemenea, desemnat prin KOW. Logaritmul lui POW indica potentialul de bioconcentrare al unui produs chimic in organismele acvatice.
Faza de expunere sau de absorbtie : timpul in care pestii sunt expusi la produsul chimic testat.
Constanta de viteza de absorbtie (k1) : valoare numerica ce defineste viteza de crestere a concentratiei substantei de testat la/in pesti (sau in tesuturile specifice ale acestora), atunci cand sunt expusi la aceasta substanta chimica (k1 este exprimata in zile-1).
Faza de post-expunere sau de eliminare (pierdere): ca urmare a transferarii pestilor dintr-un mediu care contine substanta de testat, intr-un mediu care nu contine aceasta substanta, timp in care este studiata eliminarea (sau pierderea neta) substantei de catre pestii de testare (sau de catre tesuturile specifice).
Constanta de viteza de eliminare (pierdere) (k2) : valoare numerica ce defineste viteza de scadere a concentratiei substantei de testat la/in pesti (sau in tesuturile specifice ale acestora), ca urmare a transferarii lor dintr-un mediu care contine substanta de testat, intr-un mediu care nu contine aceasta substanta (k2 este exprimata in zile-1).
Principiul metodei de testare
Testul se imparte in doua faze: faza de expunere (absorbtie) si de post-expunere (eliminare). In cursul fazei de absorbtie, grupele separate de pesti dintr-o specie, sunt supuse la cel putin doua concentratii ale substantei totale. Apoi, acestia sunt transferati intr-un mediu care nu contine respectiva substanta, pentru faza de eliminare. Aceasta din urma este intotdeauna necesara, in afara de cazul in care absorbtia substantei in timpul fazei de absorbtie a fost nesemnificativa (de exemplu, daca BCF este mai mic de 10). Concentratia substantei de testat la/in pesti (sau in tesuturile specificate ale acestora) este urmarita de-a lungul celor doua faze ale testului. In afara de cele doua concentratii de testare, un grup martor de pesti este mentinut in conditii identice, cu exceptia substantei de testat, care este absenta. Acest lucru este necesar pentru stabilirea eventualelor relatii intre efectele nefaste observate la testul de bioconcentrare si acest grup martor, precum si pentru deducerea concentratiei de baza a substantei de testat.
Faza de absorbtie dureaza 28 de zile, in cazul in care nu se demonstreaza mai devreme ca a fost atins echilibrul. Se poate estima durata fazei de absorbtie si timpul necesar pentru obtinerea starii stationare, cu ajutorul ecuatiilor din anexa 3. Perioada de epurare incepe, asadar, cu transferarea pestilor in alt recipient curat, continand acelasi mediu, cu exceptia substantei de testat. Atunci cand devine posibil, se calculeaza factorul de bioconcentrare, de preferinta sub forma de raport (BCFSS) de concentratie de pesti (Cf) si in apa (CW), in starea de echilibru aparent si in calitate de factor de bioconcentrare cinetica; si BCFk ca si raport al constantelor de viteza de absorbtie (k1) si de epurare (k2), considerand o cinetica de ordinul intai. Daca se constata ca nu a urmat o cinetica de ordinul intai, trebuie utilizate modele mai complexe (anexa 5).
Daca nu se obtine o stare stationara in 28 de zile, faza de absorbtie se va prelungi pana la obtinerea acesteia sau timp de 60 de zile, preferandu-se alternativa cea mai scurta; apoi incepe faza de eliminare.
Constanta de viteza de absorbtie, constanta de viteza de epurare (pierdere) (sau constantele, atunci cand este vorba de modele complexe), factorul de bioconcentrare si, daca este posibil, limitele de incredere pentru fiecare dintre acesti parametrii, sunt calculate pornind de la modelul care descrie cel mai fidel masuratorile de concentratie a substantei de testat, in pesti si in apa.
Factorul BCF se exprima in functie de greutatea totala umeda de peste. Cu toate acestea, pentru anumite studii pot fi utilizate tesuturi sau organe specifice (de exemplu, muschi, ficat), daca pestii sunt suficient de mari sau daca pot fi separati in parti comestibile (fileuri) si necomestibile (viscere). Relatia clara care leaga potentialul de bioconcentrare si lipofilia pentru numeroase substante organice determina si o relatie corespunzatoare intre continutul lipidic la pestii pentru experienta si bioconcentrarile observate pentru aceste substante. Asadar, pentru a elimina aceasta variabila din rezultatele testelor cu substante foarte lipofile (adica avand log POW >3), bioconcentrarea trebuie exprimata in functie de masa corporala totala si de continutul lipidic.
Daca este posibil, continutul lipidic se va stabili folosind acelasi material biologic care a servit la determinarea concentratiei substantei de testat.
Informatii despre substanta de testat
Inainte de a efectua experienta de bioconcentrare, urmatoarele informatii trebuie cunoscute despre substanta de testat :
a) solubilitatea in apa;
b) coeficientul de partitie octanol-apa POW (de asemenea, KOW, determinat printr-o metoda HPLC in A.8);
c) hidroliza;
d) fototransformarea in apa, la radiatia solara sau solara artificiala simulata si in conditiile de radiatii ale testului de bioconcentrare (3);
e) tensiunea superficiala (adica pentru substantele la care log POW nu a putut fi masurat);
f) presiunea de vapori;
g) biodegradabilitatea numita "facila" (daca este cazul).
De asemenea, trebuie cunoscuta toxicitatea relativa pentru specia de pesti utilizata pentru test, de preferinta LC50 asimptotica (adica, independenta de timp). Este indispensabil sa se utilizeze o metoda analitica potrivita, cu exactitatea, precizia si sensibilitatea cunoscute pentru a cuantifica substanta de testat in solutia de testare si in materialul biologic, precum si informatii precise legate de prepararea si pastrarea esantioanelor. De asemenea, trebuie sa fie cunoscuta limita de detectie analitica a substantei de testat, atat in apa cat si in tesuturile pestilor. Daca se utilizeaza o substanta de testat marcata cu 14C, trebuie cunoscut procentajul de radioactivitate asociat impuritatilor.
Conditiile de validitate ale testarii
Pentru ca un test sa fie valabil, trebuie indeplinite urmatoarele conditii:
variatia de temperatura sa fie mai mica de ± 2 °C
concentratia oxigenului dizolvat sa nu coboare sub 60 % din nivelul de saturatie
concentratia substantei de testat in vase sa fie mentinuta la ± 20 % din media valorilor masurate in timpul fazei de absorbtie
mortalitatea si alte efecte sau maladii indezirabile, inregistrate la pestii martor sau la cei supusi testului, sa fie mai mici de 10 %, la sfarsitul testului; atunci cand testul se prelungeste pe mai multe saptamani sau luni, mortalitatea sau alte efecte indezirabile, aparute la cele doua grupe de pesti, trebuie sa fie mai mici de 5 % pe luna si sa nu depaseasca 30 % in total.
Compusi de referinta
Utilizarea compusilor de referinta, avand un potential de bioconcentrare cunoscut, ar putea sprijini controlul asupra procedurii experimentale, daca este necesar. Cu toate acestea, nu se pot inca recomanda substante specifice.
Descrierea metodei de testare
Aparatura
Se vor evita materialele care pot prezenta un efect indezirabil de absorbtie, de dizolvare sau de lixiviere asupra pestilor, si aceasta pentru toate echipamentele folosite. Se vor utiliza bazine standard rectangulare sau cilindrice, din materiale inerte chimic, de capacitate adaptata regimului de umplere. Se va reduce la mimimum folosirea de tevi din plastic flexibil. Este preferabila tubulatura din teflon (R) , otel inoxidabil si/sau sticla. Experienta a demonstrat ca, pentru substantele cu coeficienti mari de absorbtie, cum ar fi piretrinele de sinteza poate fi necesara sticla silanizata. In acest caz, echipamentul se va arunca dupa utilizare.
Apa
In general, se utilizeaza apa naturala, provenita dintr-o sursa nepoluata si de calitate uniforma. Calitatea apei utilizate pentru dilutie trebuie sa permita supravietuirea speciei de pesti aleasa, in perioada de aclimatizare si in cursul testului, fara aparitia vreunui comportament anormal. In cazul ideal, ar trebui sa se demonstreze ca speciile supuse testarii pot supravietui, creste si se pot reproduce in apa de dilutie (de exemplu, prin crestere in laborator sau printr-un studiu de toxicitate asupra unui ciclu biologic). Apa va fi caracterizata cel putin prin pH, duritate, materii solide totale, carbon organic total si, de preferinta, prin continutul de substante amoniacale, nitrati si alcalinitate; pentru speciile marine, apa va fi caracterizata si prin salinitate. Se cunosc perfect principalii parametrii optimi pentru pesti, iar anexa 1 indica concentratiile maxime recomandate unui anumit numar de parametri privind apele de testare, dulci si marine.
Pe toata perioada testarii, apa trebuie sa fie de calitate constanta. pH-ul se aduce la valori cuprinse intre 6,0 si 8,5, insa pentru un test dat, pH-ul trebuie sa ramana in interiorul unei plaje de ± 0,5 unitati de pH. Pentru a avea siguranta ca apa de dilutie nu influenteaza in mod nejustificat rezultatele studiului (de exemplu, prin complexarea substantei de testat) sau ca nu afecteaza negativ performantele stocului de pesti, se vor preleva cu regularitate esantioane pentru analiza. De exemplu, este oportun sa se efectueze aceasta o data la trei luni, interval in care o apa de dilutie isi pastreaza calitatile, relativ constante; se determina metalele grele (de exemplu: Cu, Pb, Zn, Hg, Cd, Ni), anionii si cationii principali (de exemplu : Ca, Mg, Na, K, Cl, SO4), pesticidele (de exemplu : cele organofosforice totale si cele organoclorurate totale), carbonul organic total si solidele aflate in suspensie. Daca se demonstreaza constanta calitatilor apei pe parcursul a cel putin un an, aceste analize se pot rari, iar intervalele dintre ele pot fi marite (de exemplu, la sase luni).
Continutul in particule naturale, precum si in carbon organic total (TOC) din apa de dilutie vor fi cat mai mici posibil, pentru a evita absorbtia substantei de testat in materiile organice, ceea ce i-ar putea reduce biodisponibilitatea (4). Valoarea maxima admisa este de 5 mg/l pentru particulele de materie (materia uscata nu trece printr-un filtru de 0,45 µm) si de 2 mg/l, pentru carbonul organic total (vezi anexa 1). Daca este necesar, apa se va filtra inainte de utilizare. De asemenea, contributia pestilor folositi in experienta (excretii), a reziduurilor alimentare, precum si continutul apei in carbon organic total trebuie sa fie cat mai mici posibil. Pe parcursul testului, concentratia in carbon organic din recipient nu trebuie sa depaseasca cu mai mult de 10 mg/l (± 20 %), concentratia de carbon organic provenit din substanta de testat si, eventual, pe cea a agentului de dizolvare.
Solutii de testat
Se prepara o solutie stoc de substanta de testat, la concentratia dorita. De preferinta, solutia stoc va fi preparata prin simpla amestecare ori agitare a substantei de testat in apa de dilutie. Nu se recomanda utilizarea solventilor sau a dispersantilor (agenti de dizolvare); se poate totusi recurge la acestia, in anumite situatii, pentru producerea solutiei stoc, la concentratia necesara. Solventii susceptibili de a fi utilizati sunt: etanol, metanol, eterul monometilic de etilen glicol, eterul dimetilic de etilen glicol, dimetilformamida si trietilen glicolul. Dispersantii utilizabili sunt : Cremophor RH40, Tween 80, metilceluloza 0,01 % si HCO-40. Se vor lua masuri de precautie in cazul utilizarii agentilor usor biodegradabili, acestia putand provoca probleme de crestere bacteriana in testele cu reinnoire continua. Substanta de testat poate fi marcata radioactiv si trebuie sa aibe cea mai mare puritate posibila (de exemplu, de preferinta, > 98 %).
Pentru testele cu reinnoire continua se va utiliza aparatura care sa antreneze si sa dilueze in permanenta solutia stoc de substanta de testat (cum ar fi : pompe dozatoare, diluator proportional, sistem saturator), pentru a aduce concentratiilor de testare pana la recipiente. Trebuie prevazute minimum cinci volume de inlocuitor pe zi, pentru fiecare incinta de testare. Se opteaza pentru metoda cu reinnoire continua, insa, daca aplicarea acesteia devine imposibila (de exemplu, organismele din cadrul testului sufera efecte nefaste), se poate recurge la o tehnica semistatica, in cazul in care criteriile de validare raman satisfacatoare. Debitul solutiilor stoc si al apei de dilutie va fi controlat cu 48 de ore inainte de test, iar in cursul derularii acestuia, cel putin zilnic. Controlul comporta determinarea debitului in fiecare incinta de testare, avand grija ca acesta sa nu difere cu mai mult de 20 %, pentru fiecare dintre ele.
Selectia speciilor
Printre criteriile importante de selectie a speciilor, figureaza cel al facilitatii de procurare, dimensiunea si posibilitatea intretinerii usoare in laborator. De asemenea, speciile de pesti se aleg in functie de importanta lor in materie de agrement, comert sau ecologie. Speciile de pesti trebuie sa fie de sensibilitate comparabila, care au produs rezultate bune anterior etc.
In anexa 2, se afla o lista de specii recomandate pentru teste. Pot fi utilizate si alte specii, insa atunci procedura de testare ar putea avea nevoie de adaptari, pentru a se determina conditii experimentale adecvate. Intr-un asemenea caz, se expun motivatiile alegerii speciilor si a metodei experimentale folosite.
Pastrarea pestilor
Populatia de pesti trebuie aclimatizata timp de cel putin doua saptamani in apa aflata la temperatura de testare, oferindu-li-se hrana suficienta si de acelasi tip cu cea folosita in cursul testarii.
Dupa o perioada de instalare de 48 de ore, se inregistreaza rata mortalitatii, aplicandu-se urmatoarele criterii :
mortalitate mai mare de 10 % din populatie, in sapte zile: se renunta la intregul lot,
mortalitate cuprinsa intre 5 si 10 % din populatie, in sapte zile: se prelungeste perioada de aclimatizare cu sapte zile,
mortalitate mai mica de 5% din populatie, in sapte zile : se accepta lotul - daca mortalitatea depaseste 5% in urmatoarele sapte zile, se renunta la intregul lot.
Pestii utilizati pentru teste nu trebuie sa prezinte maladii si nici anomalii observabile. Se elimina toti pestii bolnavi. Pestii nu vor fi tratati contra nici unei maladii, cu doua saptamani inaintea testului si nici in cursul acestuia.
Efectuarea testului
Testul preliminar
Se poate dovedi util un test preliminar pentru optimizarea conditiilor de executie ale testului real, in ceea ce priveste, de exemplu, selectia concentratiilor substantei de testat, duratele fazelor de absorbtie si de eliminare.
Conditii de expunere
Durata fazei de absorbtie
Se poate estima durata fazei de absorbtie,cu ajutorul unui test preliminar (de exemplu, plecand de la un studiu anterior sau de la un produs chimic cu proprietati de acumulare) sau pornind de la anumite relatii empirice bazate pe ceea ce se cunoaste despre solubilitatea in apa ori folosind coeficientul de partitie octanol/apa, al substantei de testat (vezi anexa 3).
Faza de absorbtie va dura 28 de zile, exceptand cazul in care se poate demonstra ca a fost atins un echilibru mai devreme. Daca nu se ajunge la o stare stationara in decurs de 28 de zile, faza de echilibru se va prelungi si se vor face alte masuratori, pana la obtinerea starii stationare sau timp de 60 de zile (are intaietate alternativa cea mai scurta).
1.8.2.2. Durata fazei de eliminare
In general, jumatate din durata fazei de absorbtie este suficient pentru a se produce o reducere convenabila (de exemplu, 95 %) a continutului corporal in substanta de testare (vezi explicatiile privind estimarea, in anexa 3). Daca timpul necesar pentru realizarea unei pierderi de 95 % este prea lung, depasind, de exemplu, de doua ori durata fazei de absorbtie (adica mai mare de 56 de zile), se poate opta pentru o perioada mai scurta (respectiv, pana ce concentratia substantei de testat devine mai mica cu 10 % din concentratia starii stationare). Cu toate acestea, pentru substantele avand scheme de absorbtie si eliminare mai complexe decat modelul pestilor in compartiment unic, dupa o cinetica de ordinul intai se utilizeaza faze de epurare mai lungi, pentru determinarea constantelor de viteza de eliminare. Aceasta perioada de timp poate fi totusi controlata prin intermediul perioadei in care concentratia substantei de testat din pesti se situeaza deasupra limitei de detectie analitice.
Numarul de pesti pentru test
Alegerea numarului de pesti pentru concentratiile de testare se face astfel incat sa fie disponibili cel putin patru pesti pentru fiecare esantion, la fiecare esantionare. Daca se doreste o statistica mai performanta, numarul pestilor pentru fiecare esantion va fi marit.
Daca se folosesc pesti adulti, se va indica daca sunt masculi sau femele ori daca ambele sexe servesc testului. In aceasta ultima situatie, inainte de a incepe expunerea, trebuie verificat ca diferentele de continut lipidic sa nu fie semnificative; s‑ar putea dovedi necesara utilizarea de loturi distincte de masculi si femele.
Toate testele se fac utilizand pesti de greutate asemanatoare, in sensul ca cei mai mici nu vor avea o greutate mai mica decat 2/3 din cea a pestilor cei mai mari. Toti vor apartine aceleiasi clase de varsta si vor proveni din aceeasi sursa. Greutatea si varsta unui peste avand aparent efecte notabile asupra valorilor BCF (1), aceste informatii vor fi inregistrate cu precizie. Este indicat ca un subesantion din populatia de pesti, sa fie cantarit cu putin timp inainte de test, pentru estimarea greutatii medii.
1.8.2.4. Incarcarea
Rapoartele apa/pesti se maresc, in scopul de a minimaliza scaderea CW datorita adaugarii pestilor la inceputul testului, dar si pentru a evita diminuarea concentratiei in oxigen dizolvat. Este important ca regimul de incarcare sa fie adaptat speciei utilizate pentru test. Un regim de incarcare de 0,1 - 1,0 g de peste (produs viu) la litru de apa si pe zi, este cel recomandat pentru toate cazurile. Se pot realiza incarcari mai rapide, daca se demonstreaza ca se poate ajusta concentratia necesara de substanta de testat, in limitele de ± 20 % si ca, de asemenea, concentratia de oxigen dizolvat, nu coboara sub 60 % din nivelul de saturatie.
La alegerea regimului de incarcare, se va tine cont de habitatul normal al speciei. De exemplu, pestii bentonici pot necesita un acvariu cu suprafata fundului mai mare, spre deosebire de speciile pelagice, la acelasi volum de apa.
Alimentatia
Pe parcursul perioadelor de alimentare si de testare, pestii vor fi hraniti dupa un regim adecvat, cu un continut cunoscut in lipide si proteine totale, in cantitate suficienta mentinerii pestilor in stare buna de sanatate, astfel incat greutatea lor corporala sa se conserve. Pestii vor fi alimentati zilnic, in perioadele de aclimatizare si de testare, cu ratii de aproximativ 1 pana la 2 % din greutatea lor corporala. Astfel, pentru cea mai mare parte dintre specii, se mentine concentratia lipidica la un nivel relativ constant in timpul testarii. Cantitatea de hrana trebuie recalculata o data pe saptamana, de exemplu, pentru mentinerea greutatii corporale si a continutului lipidic, la un nivel constant. Pentru acest calcul, greutatea pestilor din fiecare incinta de testare se va estima pornind de la greutatea pestilor esantionati cel mai recent, din respectiva incinta. Nu se cantaresc pestii ramasi in incinta.
Hrana neconsumata si excrementele se evacuaeaza zilnic, prin sifonarea incintelor de testare, la putin timp dupa alimentare (30 minute - 1 ora). Incintele vor fi mentinute cat mai curate posibil pe parcursul testarii, astfel incat concentratia de materie organica sa fie cat mai mica, deoarece prezenta carbonului organic poate limita biodisponibilitatea substantei de testat (1).
Numeroase alimente sunt derivate din faina de peste, acestea vor fi analizate pentru determinarea continutului in substanta de testare. De asemenea, trebuie analizat continutul hranei in pesticide si metale grele.
Iluminare si temperatura
In general, fotoperioada este de 12 - 16 ore, la temperatura (± 2 °C) corespunzatoare speciei utilizate (vezi anexa 2). Tipul si caracteristicile iluminarii vor fi clar definite. Se va tine seama de eventualele fototransformari ale substantei de testat, in conditiile de radiatie ale studiului. Iluminarea nu trebuie sa expuna pestii la fotoproduse nenaturale. In anumite cazuri, poate fi esentiala utilizarea de filtre, pentru blocarea radiatiei UV mai mica de 290 nm.
Concentratiile utilizate in timpul testului
Pestii sunt expusi la o reinnoire continua de cel putin doua concentratii apoase ale substantei de testat. In mod normal, concentratia mare (sau cea mai mare) a substantei de testat, stabilita la aproximativ 1 % din LC50 acuta asimptotica si de cel putin 10 ori mai mare decat limita sa de detectie in apa, prin metoda de analiza aleasa.
Cea mai mare concentratie utilizata poate fi stabilita si impartind LC50 la 96 ore, printr-un raport procentual adecvat acut/cronic (rapoartele procentuale adecvate ale anumitor produsi chimici pot varia de la 3 la 100). Daca este posibil, se alege alta concentratie (alte concentratii), astfel incat diferenta fata de cea careia ii este superioara sa atinga un factor zece. Daca este imposibil, din cauza criteriului de 1 % al LC50 si a limitei analitice, poate fi utilizat un factor inferior celui de zece sau se poate accepta interventia unei substante marcate radioactiv cu 14C. Nici una dintre concentratiile utilizate nu va depasi solubilitatea substantei de testare.
Atunci cand se utilizeaza un agent de dizolvare, concentratia acestuia nu trebuie sa depaseasca 0,1 ml/l si trebuie sa fie aceeasi, in toate recipientele pentru test. Contributia sa, adaugata celei a substantei de testat, la continutul global de carbon organic din apa pentru test trebuie sa fie cunoscute. Cu toate acestea, se va face tot posibilul sa nu se recurga la astfel de materiale.
Martori
Apa de dilutie martor sau, daca este necesar, un martor continand agentul de dizolvare, va fi disponibil pentru seria de teste, in masura in care s-a stabilit ca agentul nu are nici un efect asupra pestilor. In caz contrar, se vor folosi doi martori.
Frecventa de masurare a calitatii apei
In timpul testului, oxigenul dizolvat, TOC, pH-ul si temperatura vor fi masurate in toate recipientele. Duritatea totala si, eventual, salinitatea vor fi masurate pe martori si la un recipient cu continutul avand concentratia mare (cea mai mare). Oxigenul dizolvat si, eventual, salinitatea vor fi masurate de cel putin trei ori - la inceputul, mijlocul si sfarsitul perioadei de absorbtie - si o data pe saptamana, in perioada de eliminare. TOC se va masura la inceputul testului (24 si 48 ore inainte de demararea fazei de absorbtie), inainte de adaugarea pestilor si cel putin o data pe saptamana in perioadele de absorbtie si de eliminare. Temperatura se va masura zilnic, pH-ul, la inceputul si la sfarsitul fiecarei perioade, iar duritatea, o data pentru fiecare test. De preferinta, temperatura va fi supravegheata continuu, cel putin intr-un recipient.
Esantionarea si analiza pestilor si a apei
Se va preleva apa din incintele de testare pentru a se determina concentratia substantei de testat inainte de adaugarea pestilor si in cursul fazelor de absorbtie si de epurare. Ca o conditie minima, apa va fi prelevata in acelasi timp cu prelevarea pestilor si inainte de hranirea lor. In timpul fazei de absorbtie, concentratiile de substanta de testat se determina pentru a verifica daca satisfac criteriile de validitate.
In cursul fazei de absorbtie, pestii sunt esantionati de cel putin cinci ori, iar in timpul fazei de epurare, de cel putin patru ori. Uneori este dificil de calculat o valoare estimativa rezonabil de precisa pentru BCF, pe baza acestui numar de esantioane, in special atunci cand nu urmeaza o cinetica simpla de epurare de ordinul intai. In acest caz, se pot realiza esantionarile mai frecvent, pentru cele doua perioade (vezi anexa 4). Esantioanele suplimentare sunt stocate si analizate numai daca rezultatele primei serii de analize se dovedesc insuficiente pentru calculul BCF cu precizia dorita.
In anexa 4 se gaseste un exemplu de calendar acceptabil de esantionare. Altele pot fi determinate cu usurinta pe baza valorilor presupuse ale POW , pentru a calcula timpul de expunere corespunzator unei absorbtii de 95 %.
Se continua esantionarea in cursul fazei de absorbtie, pana la obtinerea unei stari stationare sau timp de 28 de zile, optandu-se pentru varianta cea mai scurta. Daca nu se obtine o stare stationara dupa 28 de zile, esantionare continua pana la obtinerea unei astfel de stari sau timp de 60 de zile, optandu-se pentru alternativa cea mai scurta. Inainte de inceperea fazei de eliminare, pestii se transfera in rezervoare curate.
Esantionarea si prepararea esantioanelor
Se preleveaza esantioane de apa pentru analize, de exemplu prin sifonare cu ajutorul unui tub inert, intr-un punct central al incintei de testare. Intrucat se pare ca fractiile non biodisponibile de substanta de testat nu pot fi separate de cele biodisponibile - nici prin filtrare si nici prin centrifugare - (in particular, pentru cazul produselor chimice superlipofile, adica cele care au log POW > 5) (1) (5), se poate renunta la supunerea esantioanelor la astfel de tratamente.
In schimb, trebuie avut grija ca rezervoarele sa fie cat mai curate posibil, iar continutul in carbon organic va fi supravegheat pe intreaga durata a fazelor de absorbtie si de eliminare.
Pentru fiecare esantionare se preleveaza din fiecare incinta de testare un numar convenabil de pesti (in mod normal, cel putin patru). Pestii prelevati vor fi clatiti rapid cu apa, uscati cu ajutorul hartiei absorbante si sacrificati in mod instantaneu, intr-o maniera cat mai umana posibil, dupa care se cantaresc.
Este preferabil sa se analizeze pestii si apa, imediat dupa esantionare, pentru a se evita orice degradare sau alte pierderi si pentru a calcula cu aproximatie regimurile de absorbtie si de purificare, in timp ce testul continua sa se desfasoare. De asemenea, analiza imediata evita intarzierea constatarii atingerii unui platou.
In lipsa unei analize imediate, esantioanele se vor conserva dupa o metoda convenabila. Inainte de inceperea studiului, se vor aduna toate datele cu privire la metodele de stocare adecvate substantei de testat; de exemplu: congelare, mentinere la 4°C, durata stocarii, extractia etc.
Calitatea metodei analitice
Integralitatea procedurii fiind determinata, in principal, de exactitatea, precizia si sensibilitatea metodei analitice utilizate pentru substanta de testat, trebuie controlat in mod experimental, ca precizia si reproductibilitatea analizei chimice, precum si recuperarea substantei testate - atat din apa cat si din pesti - sa fie pe deplin satisfacatoare, in cazul particular al metodei respective. De asemenea, se are in vedere ca substanta de testat sa nu fie detectabila in apa de dilutie folosita.
Daca este necesar, valorile pentru CW si Cf , derivate din teste vor fi corectate dupa compararea cu valorile furnizate de martori si cu concentratia naturala a substantei de testat. Pe tot parcursul testarii, esantioanele de pesti si de apa sunt astfel manipulate, incat sa se minimizeze contaminarile si pierderile (rezultate, de exemplu, de absorbtia prin materialul de esantionare).
Analiza esantioanelor de pesti
Daca se utilizeaza materiale marcate radioactiv, se poate analiza marcarea radioactiva totala (respectiv, compusii de origine si metabolitii) sau purifica esantioanele, astfel incat compusul de origine sa poata fi analizat separat. In plus, principalii metaboliti pot fi caracterizati fie la starea stationara, fie la sfarsitul fazei de absorbtie, optandu-se pentru varianta cea mai scurta. Daca, in functie de reziduurile marcate radioactiv totale, BCF este ≥ 1 000 %, ar fi indicat (si, pentru anumite categorii de produse chimice, cum ar fi pesticidele, chiar recomandat cu insistenta), sa se identifice si cuantifice produsele de degradare reprezentand ≥ 10 % reziduuri totale in tesuturile pestilor, in starea stationara. Daca aceste produse care reprezinta ≥ 10 % reziduuri totale marcate radioactiv in tesuturile pestilor sunt identificate si cuantificate, se recomanda apoi ca acestea sa fie identificate si cuantificate, de asemenea, in apa pentru test.
In general, concentratia substantei de testat trebuie sa fie determinata pentru fiecare peste cantarit. Daca nu este posibil, se pot pune in comun esantioanele la fiecare esantionare, insa aceasta metoda restrange veridicitatea procedurilor statistice ale rezultatelor. Daca se urmaresc o anumita procedura si o finete statistica specifica, va fi convenabil sa se foloseasca pentru test un numar adecvat de pesti, pentru satisfacerea procedurii de regrupare si precizia statistica dorita (6) (7).
BCF-ul va fi exprimat, atat in functie de greutatea totala de produs viu, cat si pentru substantele puternic lipofile, in functie de continutul lipidic. Continutul lipidic al pestilor se determina, daca este posibil, la fiecare esantionare. Pentru stabilirea continutului lipidic, se vor utiliza metode bine adaptate (ref. 8 si 2 din anexa 3). Se recomanda tehnici de extractie prin cloroform/metanol, ca metode standard (9). Metodele nu ofera rezultate identice (10), motiv pentru care este important sa se precizeze care metoda s-a utilizat. Analiza lipidelor se va face, pe cat posibil, pe aceleasi extracte consacrate si pentru analiza substantei de testat, intrucat, adesea, lipidele trebuie scoase din extras inainte de a-l putea analiza prin cromatografie. Continutul lipidic al pestilor (in mg/kg de produs proaspat), la sfarsitul testului, nu trebuie sa difere fata de cel initial, cu mai mult de ± 25 %. De asemenea, se va indica procentajul de solide din tesuturi, pentru a permite conversia concentratiei lipidice a bazei umede la cea a bazei uscate.
DATE
Prelucrarea rezultatelor
Curba de absorbtie a substantei de testat va rezulta din traseul concentratiei sale in functie de timp, la pesti (sau in tesuturile specifice), in perioada fazei de absorbtie, folosind o scara aritmetica. In cazul in care curba atinge un platou, adica adopta aproximativ un traseu asimptotic la axa timpului, starea stationara BCFSS se va calcula dupa cum urmeaza:
Cf stare stationara (valori medii)___
Cw stare stationara (valori medii)
Atunci cand nu se obtine nici o stare stationara, ramane posibilitatea calcularii unui BCFSS de o precizie suficienta pentru evaluarea riscurilor, pornind de la o "stare stationara" la 80 % (1,6 / k2) sau 95 % (3,0 / k2) echilibru.
In plus, factorul de concentratie (BCFk) va fi definit ca raport k1 / k2 de doua constante cinetice de ordinul intai. Constanta de viteza de eliminare (k2) se determina, in general, plecand de la curba de eliminare (adica de la un traseu al descresterii concentratiei substantei de testat din pesti, in functie de timp). Apoi, constanta de viteza de absorbtie (k1) va fi calculata in functie de k2 si de o valoare a Cf derivata din curba de absorbtie (vezi si anexa 5). Metoda cea mai buna pentru obtinerea BCFk si a constantelor de viteza k1 si k2 este aceea care recurge la metode informatice neliniare de estimare a parametrilor (11). Alternativ, se pot utiliza metode grafice pentru calculul k1 si k2. In cazul in care curba de purificare se dovedeste a nu fi de ordinul intai, trebuie utilizate modele mai complexe (vezi referintele din anexa 3) si sa se ceara opinia unui biostatistician.
Interpretarea rezultatelor
Rezultatele se vor interpreta cu precautie, atunci cand concentratiile masurate de solutie de testare se afla la valori apropiate de limita de detectie a metodei de analiza.
Claritatea cu care sunt definite curbele de absorbtie si de eliminare, dovedeste buna calitate a datelor de bioconcentrare. Variatia constantelor de absorbtie/eliminare intre cele doua concentratii de testare trebuie sa fie mai mica de 20 %. Diferentele considerabile observate la ratele de absorbtie/eliminare, intre cele doua teste de concentratie vor fi inregistrate si explicate, daca este posibil. In general, limita de incredere pentru BCF se apropie de ± 20 %, in studiile bine concepute.
RAPORTARE
Procesul-verbal de testare va cuprinde urmatoarele informatii:
Substanta de testare
natura fizica si, eventual, proprietatile fizico-chimice,
date de identificare chimica (inclusiv continutul in carbon organic, daca este necesar),
in cazul marcarii radioactive, pozitia precisa a atomului sau atomilor marcati si procentul de radioactivitate asociata impuritatilor.
Speciile utilizate
denumire stiintifica, susa, sursa, orice tratament prealabil, eventual, aclimatizare, varsta, gama de dimensiuni etc.
Conditiile de testare
procedura utilizata (de exemplu, reinnoirea continua sau semistatica),
tipul si caracteristicile iluminarii utilizate si fotoperioada sau fotoperioadele,
conceptul testului (de exemplu, numarul si dimensiunea incintelor de testare, regimul de inlocuire al volumelor de apa, numarul de subesantioane si de pesti per subesantion, numar de concentratii testate, durata fazelor de absorbtie si de epurare, frecventa esantionarii pentru pesti si pentru apa),
metoda de preparare a solutiilor mama si frecventa de reinnoire (se vor indica, daca este cazul, agentul de dizolvare, concentratia sa si contributia sa la continutul in carbon organic al apei pentru test),
concentratiile de testare nominale, mediile valorilor masurate si deviatia standard a acestora in recipientele de testare, precum si metoda de obtinere,
sursa de apa de dilutie, descrierea tuturor tratamentelor prealabile, rezultatele tuturor demonstratiilor de aptitudine a pestilor de supravietuire in aceasta apa si caracteristicile apei: pH, duritate, temperatura, concentratia in oxigen dizolvat, nivelul clorului rezidual (daca este masurat), carbonul organic total, solide in suspensie, salinitatea mediului experimental (daca este cazul) si orice alte masuratori facute,
calitatea apei in recipientele de testare, pH, duritate, temperatura si concentratia in oxigen dizolvat,
informatii precise legate de alimentatie (de exemplu, tipul de hrana, sursa, compozitie - cel putin continutul in lipide si proteine daca este posibil, cantitatea data si frecventa),
informatii legate de tratamentul pestilor si al apei esantionate, inclusiv detalii de preparare, stocare, extractie, proceduri (si precizia) de analiza a substantei de testat si continutul in lipide (daca s-a masurat).
Rezultate
rezultatele studiilor preliminare efectuate,
mortalitatea pestilor martor si a pestilor din fiecare incinta de testare, precum si orice comportament anormal observat,
continutul lipidic al pestilor (daca a fost determinat cu ocazia experimentului),
curbele (din toate masuratorile efectuate) exprimand absorbtia si eliminarea produselor chimice experimentale la pesti, timpul de acces la starea stationara,
Cf si CW (cu deviatia standard si, eventual, intervalul) la momentul fiecarui esantionari [Cf se exprima in µg/g de produs viu (ppm), din intreg pestele sau din anumite tesuturi; de exemplu, lipidele si CW se exprima in µg/ml (ppm)]. Valorile CW pentru seria martor (de asemenea, se indica concentratia de baza),
factorul de bioconcentrare in starea stationara (BCFSS) si/sau factorul de concentrare cinetica (BCFk) si, daca este cazul, limitele de incredere la 95 % ale constantelor de viteza de absorbtie si de eliminare (pierdere), toate exprimate in raport cu intregul corp si cu continutul total de lipide, daca acesta este masurat, ale pestelui (ori ale anumitor tesuturi), limitele de incredere si deviatia standard (daca este disponibila), metode de calcul/analiza ale rezultatelor, pentru fiecare concentratie a substantei test utilizate,
atunci cand se folosesc substante marcate radioactiv, poate fi semnalata acumularea tuturor metabolitilor, daca este necesar,
orice situatie neobisnuita legata de test, orice deviere de la aceste proceduri si orice alte informatii pertinente.
Se minimizeaza rezultatele de tipul "nedetectabil la limita de detectie", prin folosirea unei metode experimentale preliminare si elaborarea unui concept de testare, deoarece astfel de rezultate sunt inutile pentru calculul constantelor de viteza.
REFERINTE
Connell D.W. (1988). Bioaccumulation behaviour of persistent chemicals with aquatic organisms. Rev. Environ. Contam. Toxicol. 102, pp. 117-156.
Bintein S., Devillers, J. and Karcher W. (1993). Nonlinear dependence of fish bioconcentration on n-octanol/water partition coefficient. SAR and QSAR in Environmental Research, 1, 29-390.
OECD, Paris (1996). Direct Phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No 3.
Kristensen P. (1991). Bioconcentration in fish : Comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate organic matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
US EPA 822-R-94-002 (1994) Great Lake Water Quality Initiative Technical Support Doc. for the Procedure to Determine Bioaccumulation Factors. July 1994.
US FDA (Food and Drug Administration) Revision. Pesticide analytical manual, 1, 5600 Fisher'' Lane, Rockville, MD 20852, July 1975
US EPA (1974). Section 5, A(1) Analysis of Human or Animal Adipose Tissue, in Analysis of Pesticide Residues in Human and Environmental Samples, Thompson J.F. (ed.) Research Triangle Park, N.C. 27711.
Compaan H. (1980) in 'The determination of the possible effects of chemicals and wastes on the aquatic environment : degradation, toxicity, bioaccumulatio' Ch. 2.3, Part II. Government Publishing Office, Haga, Olanda.
Gardner s. a., (1995) Limn. & Oceanogr. 30, 1099-1105
Randall R.C., Lee H., Ozretich R.J., Lake J.L. and Pruell R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Envir. Toxicol. Chem. 10, pp 1431-1436.
CEC, Bioconcentration of chemical substances in fish : the flow-through method - Ring Test Programme, 1984-1985. Final report March 1987. Authors: P. Kristensen and N. Nyholm.
ASTM E-1022-84 (Reapproved 1988) Standard Practice for conducting Bioconcentration Tests with Fishes and Saltwater Bivalve Molluscs.
ANEXA 1
|
Substanta |
Concentratie limita |
|
|
Particule insolubile |
5 mg/l |
|
|
Carbon organic total |
2 mg/l |
|
|
Amoniac neionizat |
1 μg/l |
|
|
|
Clor rezidual |
10 μg/l |
|
Pesticide organofosforice totale |
50 ng/l |
|
|
Pesticide organoclorurate totale + bifenili policlorurati |
50 ng/l |
|
|
Clor organic total |
25 ng/l |
|
|
Aluminiu |
1 μg/l |
|
|
Arsen |
1 μg/l |
|
|
Crom |
1 μg/l |
|
|
Cobalt |
1 μg/l |
|
|
Cupru |
1 μg/l |
|
|
Fier |
1 μg/l |
|
|
Plumb |
1 μg/l |
|
|
Nichel |
1 μg/l |
|
|
Zinc |
1 μg/l |
|
|
Cadmiu |
100 ng/l |
|
|
Mercur |
100 ng/l |
|
|
Argint |
100 ng/l |
|
Specii recomandate |
Domeniu de temperatura recomandat pentru teste (sC) |
Lungimea totala recomandata pentru animalele utilizate (cm) |
|
|
Danio rerio 1 (Teleostei, Cyprinidae) (Hamilton - Buchanan) Zebra | |||
|
Pimephales promelas (Teleostei, Cyprinidae) (Rafinesque) | |||
|
Cyprinus carpio (Teleostei, Cyprinidae) (Linnaeus) Crap | |||
|
Oryzias lapites (Teleostei, Poeciliidae) (Temminck and Schlegel) Medaka | |||
|
(Teleostei, Poeciliidae) (Peters) Guppy Poecilia reticulata | |||
|
Lepomis macrochirus (Teleostei, Centrarchidae) (Rafinesque) Biban-soare | |||
|
Oncorhynchus mykiss (Teleostei, Salmonidae) (Walbaum) Pastrav curcubeu | |||
|
Gasterosteus aculeatus (Teleostei, Gasterosteidae) (Linnaeus) Ghidrin tepos | |||
|
Meyer A., Orti G. (1993) Proc. Royal Society of London, Series B, Vol. 252, p. 231. |
|||
In anumite tari, au fost utilizate diverse specii marine si de estuar, de exemplu :
|
Leiostomus xanthurus |
|
|
Cyprinodon variegatus |
|
|
Menidia beryllina |
|
|
Cymatogaster aggregata |
|
|
Parophrys vetulus |
|
|
Leptocottus armatus |
|
|
Ghidrin tepos |
Gasterosteus aculeatus |
|
Biban comun |
Dicentracus labrax |
|
Oblet |
Alburnus alburnus |
Pestii de apa dulce, mentionati in tabelul de mai sus, sunt usor de crescut si/sau foarte disponibili, tot timpul anului, fata de speciile marine sau de estuar, a caror disponibilitate este, in anumite tari, limitata. Ei se reproduc si traiesc atat in fermele piscicole cat si in laboratoare, in conditiile in care maladiile si parazitii, se afla sub control; asadar, animalele utilizate vor fi in stare buna de sanatate, cu ascendenta genetica cunoscuta. Pot fi gasiti aproape in intreaga lume.
Prognoza pentru durata fazei de absorbtie
Inainte de executarea testarii, se poate estima k2 si deci un procentaj de timp necesar pentru a ajunge la starea stationara pornind de la relatiile empirice intre k2 si coeficientul de partitie n-octanol / apa (POW) sau intre k2 si solubilitatea in apa (s).
Se estimeaza k2 (zile-1) pornind, de exemplu, de la relatia empirica urmatoare (1):
![]()
![]() (ecuatia 1)
(ecuatia 1)
Pentru alte relatii, vezi referintele (2).
In cazul in care coeficientul de partitie (Pow) nu este cunoscut, se va proceda la o estimare (3), plecand de la solubilitatea in apa (s) a substantei, dupa cum urmeaza:
![]() (ecuatia 2)
(ecuatia 2)
unde s = solubilitatea (mol/l): (n = 36)
Aceste relatii se aplica numai produselor chimice ale caror valori log Pow se situeaza intre 2 si 6,5 (4).
Timpul necesar pentru atingerea unui anumit procentaj din starea stationara va rezulta din ecuatia cinetica generala, indicandu-se absorbtia si eliminarea (cinetica de ordinul I), prin aplicarea estimarii k2:
![]()
unde, daca Cw este constant :
![]() (ecuatia 3)
(ecuatia 3)
Atunci cand ne apropiem de starea stationara (t → ∞ ), ecuatia 3 se reduce (5) (6) la:
![]() sau
sau ![]()
Raportul k1/k2 · CW se apropie astfel, de concentratia substantei din pesti, in "starea stationara" (Cf,s).
Asadar, ecuatia 3 poate fi transcrisa :
![]() sau
sau ![]() (ecuatia 4)
(ecuatia 4)
Timpul necesar pentru atingerea unui anumit procentaj din starea stationara, poate fi prevazut gratie ecuatiei 4, atunci cand k2 a fost in prealabil estimat cu ajutorul ecuatiilor 1 sau 2.
Cu titlu informativ, durata optima statistica a fazei de absorbtie, care permite obtinerea de rezultate statistice acceptabile (BCFk), este perioada necesara pentru ca curba logaritmului concentratiei de substanta de testatadin pesti, trasata in functie de timp in scara lineara, sa ajunga la punctul median, adica la 1,6/k2 sau la 80 % din starea stationara, fara a depasi 3,0/k2 sau 95 % din starea stationara (7).
Timpul pana la atingerea a 80 % din starea stationara, este (ecuatia 4):
![]() unde
unde ![]() (ecuatia
5)
(ecuatia
5)
Similar, pentru 95 % din starea stationara :
![]() (ecuatia
6)
(ecuatia
6)
De exemplu, durata fazei de absorbtie (abs.) a unei substante de testat, avand un log Pow = 4, va fi (folosind ecuatiile 1, 5 si 6):
![]()
![]()
![]() adica 2,45 zile (59 ore)
adica 2,45 zile (59 ore)
sau ![]() adica 4,60 zile (110 ore)
adica 4,60 zile (110 ore)
In acelasi mod, pentru o substanta de testat cu s = 10-5 mol/l [ log (s) = - 5,0 ], durata de absorbtie va fi (folosind ecuatiile 1, 2, 5 si 6 ):
![]()
![]()
![]()
![]() adica 6,5 zile (156 ore)
adica 6,5 zile (156 ore)
sau ![]() adica 12,2 zile (293 ore)
adica 12,2 zile (293 ore)
De asemenea, se poate utiliza expresia alternativa:
![]()
pentru calculul timpului de atingere a starii stationare (4).
Estimarea duratei fazei de eliminare
Se poate estima, de asemenea, timpul necesar pentru ca substanta de testat ajunsa in corpul pestilor sa se reduca la un anumit procentaj din concentratia initiala, gratie ecuatiei generale, ilustrand absorbtia si eliminarea (cinetica de ordinul I) (1) (8).
Pentru faza de eliminare, CW este considerata nula. Ecuatia poate fi redusa la:
![]() sau
sau 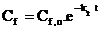
unde Cf,0 este concentratia la inceputul perioadei de eliminare. Se va obtine apoi o eliminare de 50 %, la momentul (t50) :
![]() sau
sau ![]()
In acelasi mod, 95 % din faza de eliminare va fi atinsa la :
![]()
Daca ne plasam la 80 % din faza de absorbtie pentru prima perioada (1,6 / k2) si la 95 % din pierderi pentru faza de eliminare (3,0/k2), atunci faza de eliminare este aproximativ dublul duratei fazei de absorbtie.
Cu toate acestea, este important de mentionat ca aceste estimari se bazeaza pe ipoteza ca schemele de absorbtie si eliminare urmeaza o cinetica de ordinul intai. Daca nu este cazul, se vor folosi modele mai complexe [de exemplu, referinta (1)].
Bibliografie (pentru anexa 3)
Spacie A. and Hamelink J.L. (1982) Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. and Chem. 1, pp. 309-320.
Kristensen P. (1991) Bioconcentration in fish : comparison of BCF's derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Danish Water Quality Institute.
Chiou C.T. and Schmedding D.W. (1982) Partitioning of organic compounds in octanol-water systems. Environ. Sci. Technol. 16 (1), pp 4-10.
Hawker D.W. and Connell D.W. (1988) Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22 (6), pp 701-707.
Branson D.R., Blau G.E., Alexander H.C. and Neely W.B. (1975) Transactions of the Aamerican Fisheries Society, 104 (4), pp 785-792.
Ernst W. (1985) Accumulation in Aquatic organisms. In : Appraisal of tests to predict the environmental behaviour of chemicals. Ed. by Sheehmann P., Korte F., Klein W. and Bourdeau P.H. Part 4.4 pp 243-255. SCOPE, 1985, John Wiley & Sons Ltd. N.Y.
Reilly P.M., Bajramovic R., Blau G.E., Branson D.R. and Sauerhoff M.W. (1977) Guidelines for the optimal design of experiments to estimate parameters in first order kinetic models, Can. J. Chem. Eng. 55, pp 614-622.
Könemann H. and Van Leeuwen K. (1980) Toxicokinetics in fish: Accumulation and Elimination of six Chlorobenzenes by Guppies. Chemosphere, 9, pp 3-19.
Exemple teoretice de grafice de esantionare pentru testele de bioconcentrare ale substantelor cu log Pow = 4
|
Prelevari de pesti |
Calendar de esantionare |
Numar esantioane de apa |
Numar de pesti pe esantion |
|
|
Frecventa minima ceruta (zile) |
Esantionare suplimentara |
|||
|
Faza de absorbtie |
se adauga 45-80 de pesti |
|||
|
I | ||||
|
II | ||||
|
III | ||||
|
IV | ||||
|
V | ||||
|
Faza de epurare |
Pestii se transfera intr-o apa care nu contine produsul de testat |
|||
|
VI | ||||
|
VII | ||||
|
VIII | ||||
|
IX | ||||
|
(*) Se preleveaza apa dupa adaugarea a cel putin 3 volume ale incintelor. Valorile dintre paranteze sunt numere de esantioane (apa, pesti) care trebuie prelevate, daca se procedeaza la o esantionare suplimentara. Nota. Estimarea inaintea testului a lui k2, pentru un log POW = 4,0 este de 0,652 zile-1. Durata totala a testului este fixata la : 3 x abs. = 3 x 4,6 zile , adica 14 zile. Pentru estimarea "abs." se utilizeaza anexa 3. |
||||
ANEXA 5
S-a presupus ca majoritatea rezultatelor de bioconcentrare sunt "rezonabil" de bine descrise, printr-un model simplu cu doua compartimente/doi parametri, respectiv printr-o curba rectilinie ce reprezinta aproximativ punctele de masura ale concentratiilor in pesti, in cursul fazei de eliminare, pe hartie semilogaritmica. (Atunci cand aceste puncte nu se pot reduce la o dreapta, este indicat sa se recurga la modele mai complexe, vezi, de exemplu, Spacie and Hamelink, ref. 1 din bibliografia anexei 3).
Metoda grafica pentru determinarea constantei de viteza de eliminare (pierdere) k2
Se reprezinta, pe hartie semilogaritmica, concentratia substantei de testat determinata in fiecare esantion de pesti, conform graficului de esantionare. Panta acestei drepte este k2.
![]()
![]()
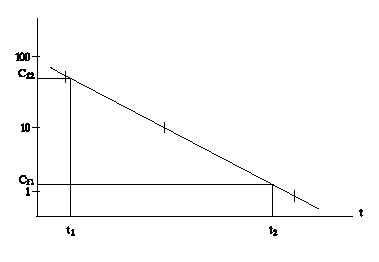
Atentie: abaterile fata de aceasta linie dreapta pot indica o schema de eliminare mai complexa decat cinetica de ordinul intai. O metoda grafica poate rezolva acest tip de eliminare care se abate de la cinetica de ordinul intai.
Metoda grafica pentru determinarea constantei de viteza de absorbtie k1
K2 fiind determinat, se calculeaza k1, dupa cum urmeaza:
![]() (ecuatia
1)
(ecuatia
1)
Se citeste valoarea Cf in punctul median al curbei de absorbtie netezite, aproximata cu o dreapta, atunci cand concentratia logaritmica este trasata in functie de timp (pe o scara aritmetica).
Metoda de calcul informatic a constantelor de viteza de absorbtie si de eliminare (pierdere)
Pentru obtinerea factorului de bioconcentrare si a constantelor de viteza k1 si k2 , se vor utiliza, de preferinta, metode informatice neliniare de estimare parametrica. Aceste programe determina valorile pentru k1 si k2, in functie de ansamblul datelor secventiale ale concentratiei in timp si de model:
![]()
![]() (ecuatia
2)
(ecuatia
2)
![]()
![]() (ecuatia
3)
(ecuatia
3)
unde tc = timpul la sfarsitul fazei de absorbtie.
Aceasta metoda furnizeaza estimari ale deviatiei standard a k1 si k2 .
Intrucat in majoritatea cazurilor se poate estima k2 pornind de la curba de eliminare, si aceasta cu o precizie destul de mare, si intrucat exista o stransa corelare intre cei doi parametri k1 si k2, este de dorit sa se calculeze mai intai k2 pornind numai de la datele de eliminare si dupa aceea sa se calculeze k1 pornind de la datele de absorbtie, cu ajutorul unei regresii neliniare.
Copyright © 2024 - Toate drepturile rezervate