 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
(Activitatile AIV.10., AV.9??, realizate de catre Coordonator)
S-au studiat compusii organici din punct de vedere redox direct, in solutii de diclorometan, tetrahidrofuran si acetonitril, functie de solubilitatea fiecarui compus supus investigarii. Procedura de lucru a procesului de investigare redox a compusilor considerati a fost urmatoarea: fiecare compus organic s-a dizolvat in solventul corespunzator pentru a obtine solutii cu concentratia de 1 mM si s-a introdus intr-o celula de teflon in care s-a fixat macroelectrodul de aur disc (d=6mm), contraelectrodul de platina si ca referinta, un fir de argint. Ca si electrolit inert a fost utilizata o solutie 100 mM de perclorat de tetrabutilamoniu, solubil in solventi organici.
Pregatirea macroelectrodului de aur s-a facut in mai multe etape. Electrozii de aur au fost spalati chimic in solutie « piranha » (98% H2SO4+ 30% H2O2, 3:1) si a urmat curatarea electrochimica a electrodului- prin voltametrie ciclica in H2SO4 0,5M, intre -0,2+1,6 V folosind o referinta de Ag/AgCl (50 cicluri).
De asemenea se poate utiliza si electrod de lucru de platina in situatia in care exista o afinitate ridicata a compusilor pentru suprafata de aur.
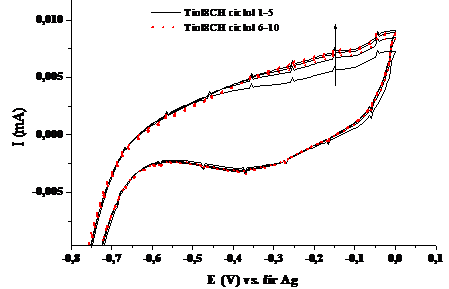
Figura 1.1. Voltamograma ciclica a compusului Tiol8CH in solventul tetrahidrofuran (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
Voltamograma ciclica a compusului Tiol8CH in tetrahidrofuran (Fig.1.1.) prezinta maximele de oxidare si reducere la -0,149 V si -0.378 V. Datorita diferentei mari de 0.224 V dintre aceste picuri se poate aprecia ca procesul este cvasireversibil si suficient de lent pentru a nu se stabiliza dupa zece cicluri de oxidare-reducere. Stabilizarea mai rapida a picului de reducere in raport cu cel de oxidare poate fi considerata ca un efect al fixarii chimice a speciei oxidate pe suprafata electrodului de lucru.
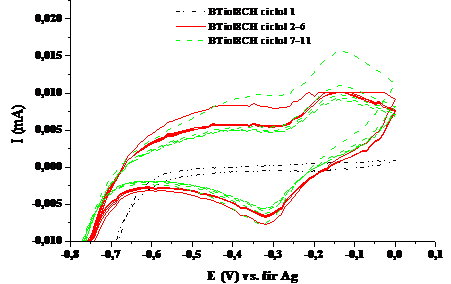
Figura 1.1. Voltamograma ciclica a compusului BTiol8CH in solventul tetrahidrofuran (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
Voltamograma ciclica a compusului BTiol8CH in tetrahidrofuran (Fig.1.2.) prezinta doua maxime de oxidare , unul mai larg la -0,345 V, respectiv unul mai ingust la -0,135 V, si un pic de reducere la -0.317 V. Datorita diferentei mari de 0.210 V dintre picul de oxidare si cel de reducere se poate aprecia ca procesul este cvasireversibil si lent, ajungandu-se la o stabilizare a sistemului dupa zece cicluri de oxidare-reducere.
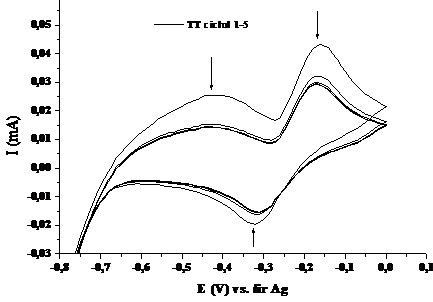
Figura 1.3. Voltamograma ciclica a compusului TT in solventul tetrahidrofuran (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
Voltamograma ciclica a compusului TT in tetrahidrofuran (Fig.1.3.) prezinta doua maxime de oxidare , unul mai larg la -0,419 V, respectiv unul mai ingust la -0,163 V, si un pic de reducere la -0.329 V. Din voltamogramele ciclice se poate aprecia ca procesul este cvasireversibil si relativ lent (ΔE=0.090 V), ajungandu-se la o stabilizare a sistemului dupa trei cicluri de oxidare-reducere. Procesul de reducere se stabilizeaza mai rapid decat cel de oxidare, posibil datorita fixarii speciilor oxidate pe suprafata electrodului de aur.
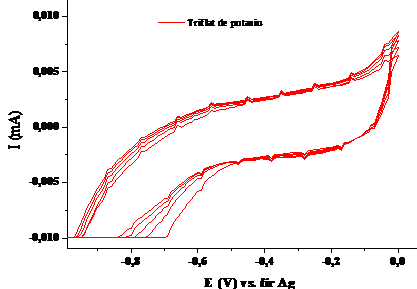
Figura 1.4. Voltamograma ciclica a complexantului TriflF (triflat de potasiu) in solventul acetonitril (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
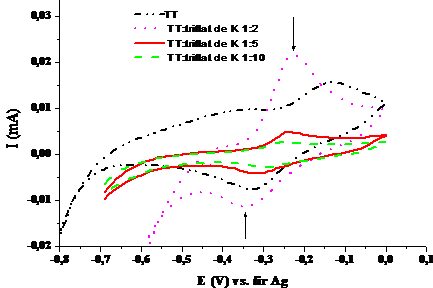
1.5. Voltamograma ciclica a compusului TT in solventul tetrahidrofuran complexat in diferite raporturi molare cu solutie de triflat de potasiul (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
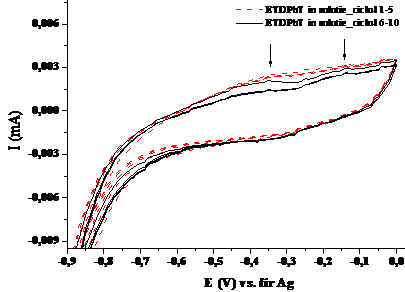
Figura 1.6. Voltamograma ciclica a compusului ETDPhT in solventul tetrahidrofuran (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
Voltamograma ciclica a compusului ETDPhT in tetrahidrofuran (Fig.1.2.) prezinta doua maxime de oxidare , unul mai larg la -0,345 V, respectiv unul mai ingust la -0,135 V, si un pic de reducere foarte mic, la -0.386 V. Datorita diferentei mari de 0.250 V dintre picul de oxidare si cel de reducere se poate aprecia ca procesul este cvasireversibil si lent, ajungandu-se la o stabilizare a sistemului dupa sase cicluri de oxidare-reducere. Se observa o asemanare ca si comportament cu compusul anterior, justificat prin prezenta nucleului tiofenic in ambii compusi.
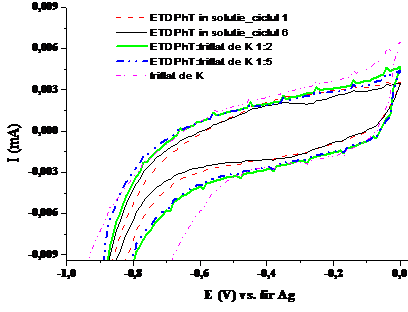
1.7. Voltamograma ciclica a compusului ETDPhT in solventul tetrahidrofuran complexat in diferite raporturi molare cu solutie de triflat de potasiul (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
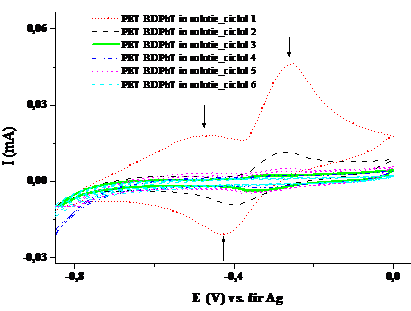
Figura 1.8. Voltamograma ciclica a compusului PET BDPhT in solventul tetrahidrofuran (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
Voltamograma ciclica a compusului PET BDPhT in tetrahidrofuran (Fig.1.2.) prezinta doua maxime de oxidare , unul mai larg la -0,471 V, respectiv unul mai ingust si intens la -0,248 V, si un pic de reducere la -0.428 V. Voltamogramele ciclice inregistrate ciclu dupa ciclu reflecta un proces cvasireversibil si lent, ajungandu-se la o stabilizare a sistemului dupa sase cicluri de oxidare-reducere.
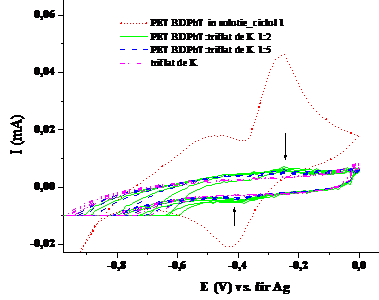
1.9. Voltamograma ciclica a compusului PET BDPhT in solventul tetrahidrofuran complexat in diferite raporturi molare cu solutie de triflat de potasiul (v=100 mV/sec; electrolit: perclorat de tetrabutil amoniu)
COMPLEXARE
S-a inregistrat voltamograma ciclica a unei sari de potasiu-triflatulul de potasiu- si s-a observat ca nu apar semnale de oxidare si de reducere in cazul sau (Fig. 1.4). Prin urmare a fost considerat potivit pentru a fi utilizat ca si complexant.
A fost investigat prin voltametrie ciclica comportamentul compusii organici TT, ETDPhT si
PET BDPhT atunci cand a fost pus in interactiune cu triflat de potasiu drept complexant. Ca
protocol, s-a mentinut constanta concentratia compusului macrociclic si s-a variat concentratia
de complexant, astfel incat s-a ajuns la rapoate de concentratie de 1:2, 1:5 si 1:10.
Voltamogramele ciclice ale complexarilor(Fig. 1.5, Fig. 1.7 si Fig.1.9) indica per ansamblu o diminuare treptata a picului de oxidare, coroborata cu o deplasare a lui spre valori mai pozitive ale potentialului. La stabilizare voltamogramele ciclice indica absenta picurilor de oxidare si reducere caracteristice substantelor supuse complexarii. Pe de alta parte voltamogramele nu se identifica cu voltamograma ciclica a complexantului, eliminand astfel posibilitatea de a regasi in sistemul final doar complexantul si specia participanta la complexare. Cresterea cantitatii de complexant duce la scaderea curentului atribuit procesului de oxidare al compusului macrociclic, evidentiata semnificativ la un raport de 1:10 macrociclu:complexant. Se poate considera ca acest raport este favorabil complexarii in conditiile in care s-a lucrat la o concentratie de 0.5 mM, de doua ori mai mica decat nivelul uzual pentru investigare prin voltametria ciclica. Comportamente similare s-au observat la masuratori de fluorescenta, cand s-a lucrat la concentratii mici de compus macrociclic si concentratii mari de complexant.
Copyright © 2024 - Toate drepturile rezervate