 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Termometrie si principiile termodinamicii
1 Temperatura
Notiunea de temperatura a luat nastere pe baza senzatiei de rece si de cald. Aceasta senzatie este insa relativa si nu poate fi utilizata in mod nemijlocit.
Experienta arata ca daca se pun in contact direct doua corpuri, unul mai cald si celalalt mai rece, starea ambelor corpuri se modifica, acestea ajungand la echilibru.
Corpurile care sunt la echilibru termic produc aceeasi senzatie de caldura. Din aceasta cauza pot fi caracterizate prin acelasi parametru, caracteristic acestei senzatii, numit temperatura empirica.
Experimental s-a mai observat ca, daca dintre cele doua corpuri in echilibru termic unul este in echilibru cu un al treilea corp, atunci si cel de-al doilea corp va fi in echilibru termic cu cel de-al treilea. Deci toate cele trei corpuri pot fi caracterizate cu aceeasi valoare a temperaturii. Aceasta observatie referitoare la tranzitivitatea echilibrului termic poate fi extinsa la un numar arbitrar de corpuri, legea astfel formulata reprezentand principiul zero al termodinamicii. El sta la baza introducerii notiunii de temperatura si masurarii ei.
Masurarea temperaturii se realizeaza folosind instrumentele de masura numite termometre. Acestea folosesc dependenta temperaturii de proprietatile corpurilor (dilatare termica, presiune, rezistenta electrica, etc.) si se bazeaza pe faptul ca doua corpuri cu temperaturi diferite puse in contact, dupa un anumit timp ajung la echilibru, avand aceeasi temperatura.
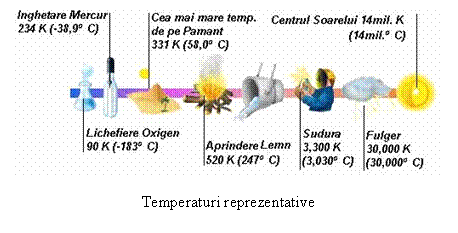
In cazul temperaturii unitatile de masura au la baza patru scari de temperatura:
Scara Celsius, definita (1742) prin punctul de topire la ghetii pure la presiune atmosferica normala, considerat 0oC, si punctul de fierbere la apei la presiune atmosferica normala, considerat 100oC. Gradul Celsius (1oC) reprezinta a suta parte din acest interval de baza; scara Celsius - scara centigrada.
Scara Fahrenheit, definita (1714) prin punctul de topire al amestecului de zapada si amoniac, considerat 0oF, si temperatura normala a corpului uman, considerat 100oF. Punctele fundamentale din scara Celsius au in scara Fahrenheit valorile: 32oF pentru 0oC si 212oF pentru 100oC. Gabriel Fahrenheit este inventatorul termometrului cu mercur
Scara Réaumur, definita (1683) prin aceleasi puncte fundamentale ca si scara Celsius, dar li se prescriu valorile: 0oR pentru 0oC si 80oR pentru 100oC. René Réaumur, naturalist si scriitor francez,.
Legatura dintre temperaturile exprimate in cele trei scari este:
![]() (1)
(1)
Scara Rankine, in care temperatura de topire a ghetii este 492,69 oRa, iar cea de fierbere a apei este 672,69 oRa.
![]()
Scara
Rankine este o scara de temperatura avand un zero absolut, iar ![]() Scarile Fahrenheit
si Rankine sunt inca larg folosite in Anglia, S.U.A. si Canada.
Scarile Fahrenheit
si Rankine sunt inca larg folosite in Anglia, S.U.A. si Canada.
Scara termodinamica, definita pe baza
principiului II al termodinamicii cu ajutorul ciclului Carnot (reversibil),
prescrie punctul triplu al apei, de 0,01oC, la valoarea ![]() . Valoarea prescrisa punctului triplu al apei s-a ales
astfel incat 1 Kelvin (1 K) sa coincida cu 1 grad Celsius (1oC),
adica:
. Valoarea prescrisa punctului triplu al apei s-a ales
astfel incat 1 Kelvin (1 K) sa coincida cu 1 grad Celsius (1oC),
adica: ![]() . Punctului 0oC ii corespunde
. Punctului 0oC ii corespunde ![]() , iar punctului 100oC ii corespunde 373,15 K. Din
scara termodinamica se obtine Scara
Celsius termodinamica prin
relatia:
, iar punctului 100oC ii corespunde 373,15 K. Din
scara termodinamica se obtine Scara
Celsius termodinamica prin
relatia:
![]() (3)
(3)
Scara Celsius internationala (practica), definita cu ajutorul a sase temperaturi primare fixe, bine determinate (puncte fundamentale) si a unor metode standard de determinare a temperaturilor intermediare, astfel incat aceasta scara sa coincida precis cu Scara Celsius termodinamica. Punctele fixe fundamentale ale scarii Celsius internationale sunt:
|
Punctul de fierbere al oxigenului | |
|
Punctul triplu al apei | |
|
Punctul de fierbere al apei | |
|
Punctul de fierbere al sulfului | |
|
Punctul de solidificare al argintului | |
|
Punctul de solidificare al aurului |
In locul punctului de fierbere al sulfului se poate lua punctul de solidificare al zincului 419,505 oC.
In afara de Kelvin - unitate fundamentala in SI pentru masurarea temperaturii - se folosesc curent si gradele de temperatura Celsius (oC), Fahrenheit (oF) si Rankine (oRa), intre care exista relatiile:
![]()
 2 Tipuri de termometre
2 Tipuri de termometre
Principial, termometrele folosite in procesul de masurare a temperaturii functioneaza astfel:
- Termometrul cu gaz; are la baza legea transformarii izocore a gazelor perfecte la care presiunea creste liniar cu temperatura:
![]() (4)
(4)
unde p reprezinta presiunea gazului la
temperatura t, po - presiunea gazului la 0oC, iar ![]() reprezinta coeficientul termic al presiunii.
reprezinta coeficientul termic al presiunii.
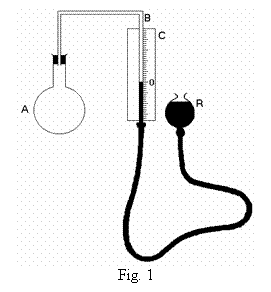
Pentru masurarea temperaturii pe baza acestei relatii este necesar sa se masoare presiunea la 0oC si la temperatura necunoscuta t. In acest scop se foloseste dispozitivul din figura 1 procedand astfel: se aseaza balonul A, care contine hidrogen, in apa cu gheata si se asteapta pana cand se stabilizeaza nivelul mercurului in tubul B, apoi se ridica sau se coboara rezervorul R pana cand in tubul B nivelul coloanei de mercur va fi la indicatia 0. Folosindu-se scala gradata C se afla diferenta dintre nivelul coloanei de mercur din tubul B si cel din rezervorul R. Daca se cunoaste presiunea atmosferica se calculeaza presiunea gazului po din interiorul balonului folosind relatia:
![]() (5)
(5)
unde patm este presiunea atmosferica exprimata in milimetri coloana de mercur, iar h - diferenta de nivel exprimata in milimetri.
Apoi
se plaseaza balonul cu intregul dispozitiv in locul unde trebuie
masurata temperatura t. Dupa ce gazul din balon a preluat
aceasta temperatura nivelul coloanei de mercur din tubul B se
stabileste la o alta pozitie, diferita de cea
corespunzatoare valorii 0oC. Se ridica din nou rezervorul
R pana ce nivelul coloanei de mercur din B ajunge la indicatia 0.
Masurand noua diferenta de nivel si folosind relatia
(5) se calculeaza presiunea gazului p din A. Avand valorile po
si p si cunoscand pe ![]() se calculeaza pe
baza relatiei (4) valoarea temperaturii t exprimata in oC.
se calculeaza pe
baza relatiei (4) valoarea temperaturii t exprimata in oC.
Pentru a asigura determinarilor o precizie cat mai mare, pentru temperaturi sub - 190oC, hidrogenul este inlocuit cu heliu. Sub - 268oC, temperatura se obtine masurand presiunea vaporilor saturanti de heliu in echilibru cu heliu lichid. Astfel se pot masura temperaturi pana la - 272,3oC.
Dupa cum se vede masurarea temperaturii cu termometrul cu gaz este destul de complicata. De aceea termometrul cu gaz se foloseste mai mult numai pentru etalonarea celorlalte termometre.
- Termometrul cu lichid; deoarece volumul multor lichide creste aproximativ liniar cu temperatura, ele pot fi utilizate pentru masurarea temperaturii. Termometrul cu lichid consta dintr-un rezervor de lichid de care este sudat un tub capilar vidat si inchis la partea superioara. Cresterea volumului de lichid se poate observa prin faptul ca lichidul se ridica in tubul capilar. Fiecarei pozitii a coloanei de lichid ii corespunde o temperatura bine determinata, indicata pe scala gradata plasata in spatele capilarului.
Functionarea termometrului cu lichid se bazeaza pe variatia volumului lichidului prin incalzire:
![]()
unde ![]() este volumul
lichidului la
este volumul
lichidului la ![]() , iar
, iar ![]() coeficientul de
dilatare volumica. De aici rezulta:
coeficientul de
dilatare volumica. De aici rezulta:
![]()
Cand
se ia in considerare si dilatarea sticlei termometrului, avand
coeficientul de dilatare ![]() se scrie:
se scrie:
![]()
de unde:
![]()
In ambele situatii, masurarea temperaturii se reduce la masurarea variatiei volumului lichidului.
Termometrele cu lichid se folosesc in intervalul de la -200oC pana la 750oC. La temperaturi joase se foloseste pentanul (-200oC - 0oC), alcoolul, toluenul, iar la temperatura de peste -38,87oC (temperatura de topire a mercurului) se foloseste mercurul. Pentru masurarea temperaturilor mai inalte de 250oC se introduce in tubul capilar si un gaz (de obicei azot) pentru ca punctul de fierbere al mercurului sa fie mai mare din cauza presiunii gazului inert. Deoarece la 600oC in interiorul tubului capilar apare o presiune de 20 atm, iar la 750oC, 70 atm, se folosesc sticle foarte rezistente la constructia tubului capilar.
- Termometrul cu rezistenta; deoarece in cazul metalelor care nu contin impuritati rezistenta electrica creste cu temperatura, dupa legea, in general de forma:
![]() (6)
(6)
temperatura necunoscuta t se poate determina masurand rezistenta electrica, la 0oC si la temperatura t, a unei bobine confectionate dintr-un metal si asezata in interiorul unui cuptor.
Masurarea rezistentei se face practic prin metode variate, dar in general se foloseste puntea electrica Wheatstone. Termometrele cu rezistenta de Pt se folosesc in intervalul -200oC - 1000oC.
Exista anumiti semiconductori, numiti termistori, a caror conductibilitate electrica creste foarte sensibil cu temperatura. Ei pot fi folositi la masurarea temperaturii. Pot fi realizati din oxid de cupru, oxid de zinc, sulfura de argint, oxid de titan, etc.
 - Termometrul cu
termocuplu; la suprafata de contact dintre doua metale diferite
apare o diferenta de potential care depinde de temperatura.
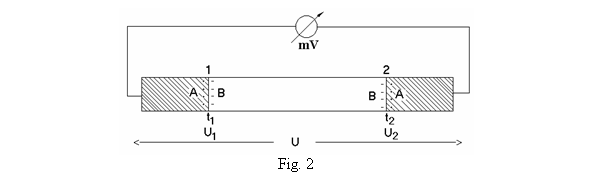
Daca se realizeaza un circuit inchis, alcatuit din doua metale diferite, A si B, numit termocuplu, figura 2, in care apar
doua suprafete de contact, sudurile 1 si 2, se constata
urmatoarele:
- Termometrul cu
termocuplu; la suprafata de contact dintre doua metale diferite
apare o diferenta de potential care depinde de temperatura.
Daca se realizeaza un circuit inchis, alcatuit din doua metale diferite, A si B, numit termocuplu, figura 2, in care apar
doua suprafete de contact, sudurile 1 si 2, se constata
urmatoarele:
a) daca temperatura celor doua suduri este identica, diferentele de potential U1 si U2 sunt egale si de sens contrar, de aceea pe intregul circuit, diferenta de potential totala fiind zero, nu va apare curent electric;
b) daca insa
temperaturile celor doua suduri sunt diferite, cele doua
diferente de potential sunt diferite si, prin urmare,
diferenta de potential totala, ![]() , numita tensiune termoelectromotoare, respectiv
intensitatea curentului electric corespunzator, aflate in relatie cu
diferenta dintre temperaturile sudurilor, sunt diferite de zero. Daca
una din suduri se tine la o temperatura constanta
cunoscuta, iar cealalta sudura se introduce in mediul cu
temperatura necunoscuta t, masurand tensiunea termoelectromotoare se
poate determina temperatura t.
, numita tensiune termoelectromotoare, respectiv
intensitatea curentului electric corespunzator, aflate in relatie cu
diferenta dintre temperaturile sudurilor, sunt diferite de zero. Daca
una din suduri se tine la o temperatura constanta
cunoscuta, iar cealalta sudura se introduce in mediul cu
temperatura necunoscuta t, masurand tensiunea termoelectromotoare se
poate determina temperatura t.
Astfel, din doua bucati de sarma din metale diferite se obtine simplu un termocuplu prin sudare in doua puncte. O sudura se introduce in mediul a carui temperatura trebuie masurata, iar cea de-a doua este la temperatura constanta, eventual temperatura camerei. Tensiunea termoelectromotoare masurata este de ordinul milivoltilor. Daca, de exemplu, unul din metale este platina si punctele de contact sunt la 0oC, respectiv 100oC, pentru diferite metale se obtin urmatoarele tensiuni termoelectromotoare:
|
Bismut |
7,30 mV |
Argint |
0, 72 mV |
|
|
Constantan (55% Co, 45% Ni) |
3,40 mV |
Aur |
0,75 mV |
|
|
Nichel |
1,50 mV |
Cupru |
0,76 mV |
|
|
Paladiu |
0,28 mV |
Wolfram |
0,81 mV |
|
|
Platina |
0 mV |
Molibden |
1, 26 mV |
|
|
Carbune |
+ 0,30 mV |
Fier |
1,80 mV |
|
|
Aluminiu |
+ 0,40 mV |
Cromnichel (90% Ni, 10% Cr) |
2,20 mV |
|
|
Plumb |
+ 0,45 mV |
Stibiu |
4,70 mV |
Termometrele cu termocuplu, si intr-o oarecare masura si termometrele cu rezistenta, au urmatoarele avantaje:
se folosesc intr-un domeniu larg de temperatura (de la - 200oC pana la 1600oC);
punctele de sudura au dimensiuni mici de aceea se poate masura temperatura in domenii foarte mici;
in timpul masurarii temperaturii termocuplul nu consuma energie termica multa;
tensiunea termoelectromotoare poate fi masurata de la distanta.
Termocuplurile cele mai des folosite sunt confectionate din urmatoarele metale: cupru - constantan, argint - constantan, cromnichel - constantan, fier - constantan, platina - reniu cu platina (pentru temperaturi inalte 600 - 1600 oC), platina - rodiu cu platina.
Pentru a le proteja si a le fixa, termometrele cu termocuplu ca si cele cu rezistenta se introduc in tuburi protectoare.
-
Pirometrul optic; functionarea
acestuia se bazeaza pe legea radiatiei termice (legea
Stefan-Boltzmann) care reprezinta proportionalitatea dintre
intensitatea totala a radiatiei electromagnetice emisa de un
corp negru si puterea a patra a temperaturii absolute: ![]() .
.
Pe baza acestei relatii, masurand intensitatea radiatiei, se poate determina temperatura necunoscuta.
Cu ajutorul unei lentile convergente undele luminoase emise de un corp incandescent sunt directionate pe o placuta innegrita, iar temperatura acesteia se masoara cu un termocuplu.
In alte pirometre se folosesc razele luminoase de o anumita culoare.
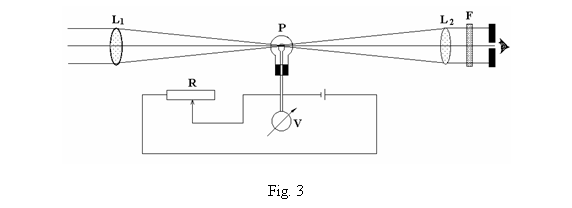 Filamentul incandescent al unui bec P, figura 3, se
aseaza in drumul razelor care vin prin lentila L1 de la
corpul a carui temperatura trebuie determinata, apoi trec prin
lentila L2 si filtrul rosu F, ajungand la ochiul
observatorului.
Filamentul incandescent al unui bec P, figura 3, se
aseaza in drumul razelor care vin prin lentila L1 de la
corpul a carui temperatura trebuie determinata, apoi trec prin
lentila L2 si filtrul rosu F, ajungand la ochiul
observatorului.
Pe un fond luminos creat de lumina emisa de corp se va observa imaginea filamentului incandescent al becului P. Se modifica intensitatea curentului electric prin bec pana cand imaginea filamentului nu se mai vede, adica are aceeasi luminozitate ca si fondul. Deoarece fiecarei luminozitati a fondului ii corespunde o temperatura a corpului incandescent, ce creeaza acest fond, iar acestei luminozitati ii corespunde o pozitie a cursorului reostatului R, care modifica intensitatea curentului prin becul P, se poate etalona acest dispozitiv, cunoscut ca pirometrul cu disparitie de filament, astfel incat, fie din pozitia cursorului R sau din indicatia voltmetrului V, sa se obtina direct valoarea temperaturii corpului incandescent.
- Termometrul cu coloranti; exista anumiti coloranti care isi schimba brusc culoarea la o anumita temperatura. De aceea ei sunt utilizati pentru a indica anumite valori ale temperaturii. Se prepara o pasta din astfel de coloranti si un diluant volatil, de exemplu alcool, care se depune pe corpul a carui temperatura trebuie urmarita. Incalzind acest corp se urmareste culoarea pastei depuse. In momentul cand se schimba culoarea, corpul a atins temperatura colorantului respectiv.
Astfel de coloranti pot fi folositi la confectionarea de creioane colorate cu ajutorul carora se poate afla temperatura anumitor suprafete tragand linii pe aceasta suprafata si observand care dintre culori se schimba si care nu.
3 Energia interna
Particulele unui sistem se afla intr-o continua miscare haotica. Pe de-o parte moleculele efectueaza o miscare de translatie, de rotatie si de vibratie. Pe de alta parte se misca si electronii din interiorul fiecarui atom. Tuturor acestor miscari le corespunde cate o energie cinetica, iar din cauza existentei unor forte de interactiune sistemului ii corespunde o energie potentiala de interactiune. In afara de aceste energii, atat electronii cat si nucleele poseda si energie proprie.
Suma tuturor energiilor corespunzatoare miscarii si starii particulelor sistemului este o marime caracteristica sistemului. Aceasta energie se numeste energie interna. Fiecarei stari a sistemului ii corespunde o valoare bine determinata a energiei respective. Prin urmare, energia interna, notata cu U, este, ca si temperatura, volumul sau presiunea, un parametru de stare, adica o marime fizica care caracterizeaza starea unui sistem termodinamic. Este un parametru macroscopic. Pentru o anumita stare bine definita ii corespunde totdeauna aceeasi valoare a energiei interne.
Daca un sistem trece dintr-o stare in alta, in diferite moduri, modificarea energiei interne este independenta de felul in care s-a realizat trecerea.
4 Caldura
Reprezinta acea parte de energie care trece de la un corp cu temperatura data aflat in contact termic cu un altul aflat la temperatura mai mica. Se noteaza cu Q. Caldura fiind o forma a transferului de energie se masoara in SI tot in joule. In practica se foloseste ca unitate de masura si caloria, respectiv kilocaloria.
Caloria reprezinta caldura necesara pentru incalzirea unui gram de apa pura cu un grad de la 19,5 oC la 20,5 oC la presiune atmosferica normala. Se prescurteaza cal. Valoarea caloriei internationale in SI este: 1 cal = 4,18674 J. Caloria definita in jurul temperaturii de 15 oC are valoarea: 1 cal15 = 4,1855 J. Kilocaloria este de 1000 ori mai mare decat caloria si se prescurteaza kcal.
Caldura necesara pentru a modifica temperatura unui corp cu un grad reprezinta prin definitie capacitatea calorica;
![]() ;
; ![]() (7)
(7)
Caldura necesara pentru a modifica temperatura unitatii de masa a unui corp cu un grad reprezinta prin definitie caldura specifica;
![]() ;
; ![]() (8)
(8)
Caldura necesara pentru a modifica temperatura unui mol de substanta cu un grad reprezinta prin definitie caldura molara;
![]() ;
; ![]() (9)
(9)
Tinand cont de relatiile de definitie ale acestor trei coeficienti calorici, expresia caldurii devine:
![]() (10)
(10)
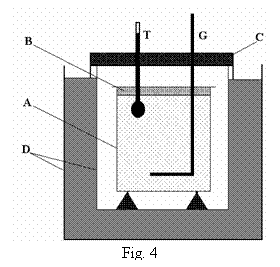 Pentru masurarea caldurii specifice sau a
capacitatii calorice a unui corp se foloseste calorimetrul, figura 4. Vasul metalic
interior A contine de obicei apa intr-o cantitate cunoscuta. El
este acoperit cu capacul B pentru a impiedica evaporarea apei. Vasul A este
asezat intr-un vas D cu pereti dubli intre care se afla un
izolator termic. In locul acestuia din urma se utilizeaza vase Dewar
cu care se asigura o mai buna izolare termica. In interiorul
vasului A se afla termometrul T care masoara temperatura apei
si un agitator G.
Pentru masurarea caldurii specifice sau a
capacitatii calorice a unui corp se foloseste calorimetrul, figura 4. Vasul metalic
interior A contine de obicei apa intr-o cantitate cunoscuta. El
este acoperit cu capacul B pentru a impiedica evaporarea apei. Vasul A este
asezat intr-un vas D cu pereti dubli intre care se afla un
izolator termic. In locul acestuia din urma se utilizeaza vase Dewar
cu care se asigura o mai buna izolare termica. In interiorul
vasului A se afla termometrul T care masoara temperatura apei
si un agitator G.
Introducand diferite substante, solide sau lichide, de mase si temperaturi cunoscute, se poate determina marimea calorica corespunzatoare folosind ecuatia calorimetrica:
![]() (11)
(11)
adica suma tuturor caldurilor schimbate de substantele introduse in calorimetru este egala cu zero.
Lucrul mecanic
Daca un sistem termodinamic de volum V se dilata cu volumul elementar dV, lucrul mecanic efectuat pentru a produce aceasta dilatare, care reprezinta lucrul mecanic elementar in termodinamica are expresia:
![]() (12)
(12)
unde p este presiunea sistemului care produce aceasta dilatare. Daca in urma fenomenului de dilatare, sistemul de la valoarea initiala a volumului V1 ajunge la valoarea finala V2, lucrul mecanic efectuat, care reprezinta lucrul mecanic in termodinamica, are expresia:
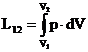 (13)
(13)
6 Principiul I al termodinamicii
Acesta extinde legea conservarii energiei pentru procesele termodinamice. Descoperirea acestui principiu se leaga de incercarile facute timp de mai multe secole in scopul de a construi o masina care sa produca lucru mecanic fara sa consume energie echivalenta corespunzatoare (perpetuum mobile de speta intai). Incercarile nereusite au dus la constatarea ca o astfel de masina nu este realizabila, acceptandu-se urmatoarea concluzie: energia nu poate fi creata din nimic si nici nu poate fi anihilata. Se poate transforma numai o forma de energie in alta.
Energie interna a unui sistem izolat este constanta. Ea se poate modifica daca, de exemplu, sistemul primeste din exterior caldura si el, drept urmare, efectueaza lucru mecanic. Astfel, variatia energiei interne a unui sistem termodinamic se produce pe seama schimbului de energie sub forma de caldura si lucru mecanic dintre sistem si mediul inconjurator - formularea primului principiu al termodinamicii. Matematic, acesta se scrie:
![]() (14)
(14)
sau in forma diferentiala:
![]() (15)
(15)
7 Caldura si lucrul mecanic in transformarile ciclice
Daca un sistem termodinamic
efectueaza o transformare ciclica, atunci: ![]() . Drept urmare, conform principiului I al termodinamicii:
. Drept urmare, conform principiului I al termodinamicii:
![]() (16)
(16)
Aceasta egalitate poate fi satisfacuta in trei cazuri:
a)
![]() , adica sistemul nu schimba cu exteriorul nici caldura si nici lucru
mecanic;
, adica sistemul nu schimba cu exteriorul nici caldura si nici lucru
mecanic;
b)
![]() , sistemul primeste caldura si
efectueaza lucru mecanic. Un asemenea sistem se numeste motor termic;
, sistemul primeste caldura si
efectueaza lucru mecanic. Un asemenea sistem se numeste motor termic;
c)
![]() , sistemul primeste lucru mecanic si
efectueaza caldura. Un asemenea sistem se numeste masina frigorifica.
, sistemul primeste lucru mecanic si
efectueaza caldura. Un asemenea sistem se numeste masina frigorifica.
Aceste sisteme care schimba caldura si lucru mecanic cu exteriorul se numesc masini termice.
Conform principiului I al termodinamicii este posibila transformarea integrala a caldurii in lucru mecanic, cat si a lucrului mecanic in caldura. Trebuie remarcat ca pentru a transforma integral caldura in lucru mecanic, motorul termic ar trebui sa preia caldura de la un corp de temperatura data, fara a mai ceda caldura altui corp, deoarece s-a presupus ca intreaga cantitate de caldura a fost transformata in lucru mecanic.
Experienta arata ca intr-o transformare ciclica nu este posibila transformarea integrala a caldurii in lucru mecanic, cand motorul termic schimba caldura cu o singura sursa de caldura (termostat). In caz contrar ar fi posibila, de exemplu, construirea unui motor termic care sa transforme in lucru mecanic caldura, practic infinita, existenta in apa marilor sau in aerul atmosferic.
Transformarea in care sistemul schimba caldura cu un singur termostat se numeste transformare monoterma. Transformarea izoterma este un exemplu de transformare monoterma.
Imposibilitatea transformarii integrale a caldurii in lucru mecanic este prezentata intr-un nou principiu al termodinamicii: principiul II al termodinamicii.
8 Principiul II al termodinamicii in formularea lui W. Thomson
Se enunta astfel: intr-o transformare ciclica monoterma sistemul nu poate ceda lucru mecanic in exterior. Daca transformarea ciclica monoterma este si ireversibila, atunci sistemul primeste lucru mecanic din exterior.
Deoarece
transformarea este ciclica, conform principiului I al termodinamicii: ![]() . Atunci, conform principiului II al termodinamicii si
avand in vedere si conventiile de semn pentru L si Q,
rezulta ca intr-o transformare ciclica monoterma
. Atunci, conform principiului II al termodinamicii si
avand in vedere si conventiile de semn pentru L si Q,
rezulta ca intr-o transformare ciclica monoterma![]() . Daca transformarea ciclica monoterma este
si ireversibila, atunci
. Daca transformarea ciclica monoterma este
si ireversibila, atunci ![]() , adica sistemul primind lucru mecanic, cedeaza
caldura unicului termostat cu care este in contact termic.
, adica sistemul primind lucru mecanic, cedeaza
caldura unicului termostat cu care este in contact termic.
Principiul
II al termodinamicii exclude posibilitatea ca intr-o transformare ciclica
monoterma sa existe situatia: ![]() . Adica, pentru un astfel de proces, se exclude
posibilitatea transformarii integrale a caldurii primite in lucru
mecanic pe care sa-l cedeze exteriorului.
. Adica, pentru un astfel de proces, se exclude
posibilitatea transformarii integrale a caldurii primite in lucru
mecanic pe care sa-l cedeze exteriorului.
Un sistem care ar evolua intr-o transformare monoterma, folosind integral caldura primita pentru a produce lucru mecanic, ar deveni un perpetuum mobile de speta a doua.
Insa, intr-o transformare monoterma, neciclica, este posibila transformarea integrala a caldurii primite in lucru mecanic. Intr-adevar, considerand o destindere izoterma a unui gaz ideal, deci o transformare monoterma:
![]() (17)
(17)
deoarece volumul final Vf este mai mare decat volumul initial Vi. Inseamna ca sistemul, primind caldura Qrev, o transforma integral in lucrul mecanic Lrev. Transformarea nu este ciclica deoarece volumul final nu coincide cu cel initial.
9 Principiul II al termodinamicii in formularea lui R. Clausius
Experienta arata ca intotdeauna cand doua corpuri sunt in contact termic, caldura schimbata este cedata de corpul mai cald corpului mai rece. Acest schimb se produce de la sine, fara nici o interventie din exterior. In nici o experienta nu s-a constatat trecerea spontana a caldurii de la un corp rece la unul cald.
Generalizand aceste fapte experimentale, R. Clausius a dat o noua formulare a principiului II al termodinamicii: nu este posibila o transformare care sa aiba ca rezultat trecerea de la sine a caldurii de la un corp cu temperatura data la un corp cu temperatura mai ridicata.
Se observa din aceasta formulare ca principiului II nu exclude procesul de trecere a caldurii de la un corp cu temperatura mai scazuta (corpul rece) la unul de temperatura mai ridicata (corpul cald) daca se intervine din exterior cu lucru mecanic.
Se poate arata ca cele doua formulari ale principiului II sunt echivalente, adica postularea unei formulari permite demonstrarea celeilalte.
10 Randamentul unui motor termic
Formularea
Thomson da posibilitatea de a se obtine lucru mecanic de la un sistem
care efectueaza o transformare ciclica in care schimba caldura
cu doua termostate de temperaturi diferite, T1 si T2.
O asemenea transformare in care sistemul schimba caldura cu
doua termostate de temperaturi diferite se numeste transformare biterma. Daca ![]() , atunci sistemul primind caldura
, atunci sistemul primind caldura ![]() de la termostatul de
temperatura mai mare (sursa calda), cedeaza caldura
de la termostatul de
temperatura mai mare (sursa calda), cedeaza caldura ![]() termostatului de
temperatura mai joasa (sursa rece), transformand in lucru mecanic
diferenta dintre valorile absolute ale acestor cantitati de
caldura.
termostatului de
temperatura mai joasa (sursa rece), transformand in lucru mecanic
diferenta dintre valorile absolute ale acestor cantitati de
caldura.
Intr-adevar, caldura totala schimbata de sistem cu exteriorul este:
![]()
Atunci, conform principiului I:
![]()
Dar ![]() , deoarece transformarea este ciclica, prin urmare
lucrul mecanic efectuat de sistem este:
, deoarece transformarea este ciclica, prin urmare
lucrul mecanic efectuat de sistem este:
![]() (18)
(18)
Deci,
intr-o transformare ciclica biterma nu se poate ca intreaga
caldura Q1 primita de sistem de la sursa calda
sa se transforme in lucru mecanic, ci doar diferenta ![]() . De aceea, randamentul unui motor termic care
efectueaza o transformare ciclica biterma este:
. De aceea, randamentul unui motor termic care
efectueaza o transformare ciclica biterma este:
![]() (19)
(19)
deoarece intotdeauna ![]() .
.
11 Entropia
Daca
se considera un sistem termodinamic care este pus in contact termic cu un
termostat cu temperatura T, apropiata de cea a sistemului, atunci
caldura pe care o schimba sistemul cu termostatul, dQrev,
intr-un proces reversibil, catre starea de echilibru de temperatura
T, este arbitrar de mica. Din formularea lui Thomson a principiului II al
termodinamicii se demonstreaza faptul ca raportul ![]() reprezinta
variatia unei marimi, numita entropie, notata cu S. Prin urmare. Entropia este o
marime de stare a carei variatie dS intr-o transformare
reversibila in care sistemul schimba caldura dQrev cu
un termostat de temperatura T este:
reprezinta
variatia unei marimi, numita entropie, notata cu S. Prin urmare. Entropia este o
marime de stare a carei variatie dS intr-o transformare
reversibila in care sistemul schimba caldura dQrev cu
un termostat de temperatura T este:
![]() (20)
(20)
Deci, afirmatia ca entropia este o marime de stare este o consecinta a principiului II al termodinamicii. In mod echivalent, daca se reformuleaza principiul II al termodinamicii, postuland faptul ca entropia este o marime de stare a carei variatie intr-o transformare reversibila este data de relatia (20), atunci se poate demonstra faptul ca formularea Thomson este o consecinta a acestui postulat. Se obtin astfel trei formulari ale principiului II al termodinamicii: formularile lui Thomson si Clausius precum si postulatul entropiei ca marime de stare.
Cu alte cuvinte, principiul I al termodinamicii afirma faptul ca energia interna este o marime de stare, iar principiul II al termodinamicii afirma faptul ca entropia este o marime de stare. Ca si energia interna, entropia este o marime aditiva.
Daca un sistem termodinamic sufera o transformare de stare, variatia dS a entropiei sistemului este aceeasi, independent de caracterul reversibil sau ireversibil al transformarii, in timp ce caldurile schimbate in cele doua transformari, dQrev si dQirev, sunt diferite (caldura nu este o marime de stare; este functie de transformare).
Deoarece ![]() inseamna ca
inseamna ca ![]() . Intr-adevar, se poate demonstra ca in orice
transformare ireversibila, in care sistemul schimba caldura dQirev
cu termostatul de temperatura T, variatia de entropie dS este mai
mare decat
. Intr-adevar, se poate demonstra ca in orice
transformare ireversibila, in care sistemul schimba caldura dQirev
cu termostatul de temperatura T, variatia de entropie dS este mai
mare decat ![]() :
:
![]() (21)
(21)
Daca sistemul sufera o transformare adiabatica, atunci din relatiile (20) si (21) rezulta ca variatia entropiei este zero daca transformarea este reversibila si este mai mare decat zero daca transformarea adiabatica este ireversibila. Rezulta ca in orice transformare adiabatica reversibila entropia sistemului ramane constanta si in orice transformare adiabatica ireversibila entropia creste.
In cazul unui sistem izolat, daca toate transformarile care au loc in interiorul sistemului ar fi reversibile, atunci entropia sistemului izolat ar ramane constanta in tot timpul evolutiei lui catre starea de echilibru. Daca, insa, o singura transformare pe care o efectueaza sistemul izolat este ireversibila, atunci entropia sistemului creste. Cresterea entropiei are loc pana cand sistemul atinge starea de echilibru.
Prin urmare, ca o consecinta importanta a principiului II al termodinamicii, rezulta ca, in decursul evolutiei catre starea de echilibru a unui sistem izolat, exista o marime fizica, numita entropie, a carei valoare nu poate decat sa creasca. Desigur, entropia unor parti ale sistemului izolat poate sa scada, dar cresterea entropiei altor parti este mai mare astfel ca pentru intregul sistem entropia acestuia creste.
Pentru orice sistem, entropia sa este maxima in momentul atingerii starii de echilibru termodinamic. Numai astfel se explica de ce o stare de echilibru nu poate fi starea initiala a unei transformari; entropia numai poate sa creasca, ea fiind deja maxima.
Conform principiului I al termodinamicii, variatia entropiei intre doua stari pentru care valorile parametrilor de stare sunt apropiate, de exemplu (T, V, p) si ( T+dT, V+dV, p+dp), este:
![]() (22)
(22)
12 Principiul III al termodinamicii
Principiului III al termodinamicii, care, prin traditie, se mai numeste si principiul lui Nernst, nu este atat de general ca celelalte doua principii. El este valabil numai pentru sisteme omogene, pure, aflate in echilibru termodinamic si se enunta astfel: atunci cand temperatura absoluta a unui sistem termodinamic tinde catre zero absolut, entropia acestuia tinde catre o valoare constanta, independenta de parametrii sistemului, de starea de agregare sau alte caracteristici ale sistemului termodinamic. Din acest principiu rezulta unele concluzii referitoare la comportarea unor marimi termodinamice la temperaturi foarte joase, in apropierea punctului de 0 K (entropia, caldurile molare, etc.).
Conform acestui principiu:
![]() (23)
(23)
Aceasta
relatie este extrem de importanta pentru aflarea valorii absolute a
entropiei diferitelor substante. Conform acestei relatii entropia
tuturor substantelor pure aflate in echilibru termodinamic este egala
cu zero la temperatura de zero absolut. In plus, folosind si principiul II
al termodinamicii, rezulta o serie de consecinte referitor la
comportarea parametrilor de stare ai substantelor pure la 0 K. De exemplu,
caldura molara tinde catre zero pentru ![]() , indiferent daca ea a fost determinata la volum
constant sau la presiune constanta;
, indiferent daca ea a fost determinata la volum
constant sau la presiune constanta;
![]() (24)
(24)
O consecinta importanta care rezulta din principiul III al termodinamicii este faptul ca temperatura de zero absolut nu poate fi atinsa in natura prin nici un mijloc. Temperatura de zero absolut poate fi considerata doar ca limita inferioara a temperaturii absolute, care poate fi aproximata, in principiu, insa nu poate fi atinsa niciodata.
Rost de dilatare la capatul unui pod
metalic


Copyright © 2024 - Toate drepturile rezervate