 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
PRINCIPIILE TERMODINAMICII
Re REnumerotate
Termodinamica studiaza legile generale ale fenomenelor termice, fara a tine seama de considerente microscopice (structura materiei, miscarile moleculelor, etc.).
Daca teoria cinetico-moleculara a substantei este capabila sa raspunda la intrebari de tipul "de ce?", termodinamica raspunde chestionarilor de forma "cum?".
Metodele termodinamicii sunt metode cu un mare grad de generalitate, ele putand fi aplicate si altor tipuri de fenomene (mecanice, electrice, s. a.).
Termodinamica este o stiinta axiomatica. Ea se construieste pornind de la postulate, principii si notiuni fundamentale.
Cap. 1 Generalitati
§ 1. Notiuni termodinamice de baza
In termodinamica se opereaza cu o serie de concepte definite in cadrul mecanicii, precum notiunile de lucru mecanic, energie, putere, s. a. Pe langa acestea, se mai introduc notiuni specifice domeniului, precum temperatura, energia termica, entropia.
Obiectul de studiu al termodinamicii il constituie studiul starilor si proceselor referitoare la sistemele termodinamice, precum si interactiunile dintre acestea.
Corpurile care nu fac parte din sistemul termodinamic poarta numele de corpuri exterioare sau aceea de mediu exterior.
Sistemul termodinamic care nu interactioneaza (energetic) si nu efectueaza schimb de masa cu mediul exterior, se numeste sistem izolat. Aceasta este o idealizare, un model utilizat in acele situatii in care actiunile exterioare pot fi neglijate.
Sistemul termodinamic ce face schimb de energie, dar nu face schimb de substanta cu exteriorul se numeste sistem inchis.
Sistemul termodinamic ce face atat schimb de energie, cat si de substanta cu exteriorul se numeste sistem deschis.
La un moment dat, un sistem termodinamic are anumite proprietati.
Numim stare a unui sistem termodinamic - totalitatea proprietatilor lui, la un moment dat.
Starea sistemului termodinamic este determinata de un ansamblu de marimi fizice masurabile, marimi care poarta numele de parametri de stare (in limba greaca, parametron inseamna masurabil). Deci: parametrii de stare caracterizeaza proprietatile sistemului termodinamic la un moment dat.
Daca TOTI parametrii de stare sunt constanti in timp, atunci starea sistemului termodinamic se numeste stare de echilibru.
Daca valorile parametrilor de stare se modifica in timp, starea sistemului se numeste stare de neechilibru.
Trecerea unui sistem termodinamic dintr-o stare in alta reprezinta o transformare.
Altfel spus, transformarea unui sistem termodinamic este o succesiune de stari intermediare.
Transformarea se numeste cvasistatica daca parametrii de stare variaza in timp atat de lent incat, la orice moment, sistemul sa poata fi considerat ca fiind echilibru. Acesta este un concept idealizat, un model util studiului. Procesele naturale nu sunt procese cvasistatice.
O transformare in care parametrii initiali de stare coincid cu cei finali se numeste transformare ciclica sau inchisa.
O transformare in care parametrii initiali de stare NU coincid cu cei finali se numeste transformare deschisa.
Un sistem termodinamic poate evolua intre doua stari A si B de la A la B, cat si de la B la A. Transformarea sistemului prin trecerea din starea A in starea B se efectueaza printr-o succesiune de stari intermediare. Daca revenirea sistemului din B in A are loc trecand prin aceleasi stari intermediare prin care a trecut sistemul la trecerea din A in B, atunci spunem ca transformarea este reversibila.
In caz contrar, transformarea se numeste ireversibila.
Transformarile necvasistatice sunt transformari ireversibile.
§ 2. Postulatele termodinamicii
Primul postulat al termodinamicii afirma ca: "daca un sistem termodinamic izolat este scos din starea de echilibru termodinamic, acesta revine, mai devreme sau mai tarziu, intr-o stare de echilibru termodinamic din care nu poate iesi de la sine".
Acest postulat indica sensul de desfasurare a proceselor termodinamice in orice sistem IZOLAT, deci de la stari de neechilibru catre stari de echilibru. Gradul mare de generalitate al acestuia ne indreptateste sa-l numim principiul general al termodinamicii.
Al doilea postulat al termodinamicii (sau principiul tranzitivitatii echilibrului termic) se refera la situatiile in care doua (sau mai multe) sisteme termodinamice aflate in contact termic se afla la echilibru termodinamic.
Sistemele termodinamice aflate in astfel de invelisuri care nu permit schimbul de energie termica se numesc sisteme izolate adiabatic.
Doua sisteme termodinamice se afla in contact termic daca ele pot face schimb de energie termica. Sistemele termodinamice care, desi se afla in contact termic, nu schimba energie termica intre ele, sunt in echilibru termic.
Conform celui de-al doilea postulat al termodinamicii, daca sistemul termodinamic A este in echilibru cu sistemul termodinamic B, iar B este in echilibru termic cu sistemul termodinamic C, atunci sistemele A si C sunt in echilibru termic intre ele.
O alta exprimare a acestui principiu este urmatoarea: "echilibrul termic este tranzitiv".
Larga aplicabilitate a acestui principiu (ex. termometria) face ca acesta sa mai fie numit principiul ZERO al termodinamicii.
Proprietatea de tranzitivitate a echilibrului termic pune in evidenta necesitatea introducerii si definirii unui parametru intern de stare, care sa aiba aceeasi valoare pentru toate sistemele aflate in echilibru termic. Acest parametru intern de stare se numeste temperatura empirica.
Cap. 2 Primul principiu al termodinamicii
Acesta reprezinta, de fapt, aplicarea legii transformarii si conservarii energiei la procesele care intervin la interactiunea sistemelor termodinamice, fapt pentru care acesta mai este cunoscut ca legea transformarii si conservarii energiei in procesele mecanice si termice
Un sistem termodinamic aflat in interactiune cu exteriorul, poate face schimb de energie termica (caldura) si de energie mecanica (lucru mecanic). De cele mai multe ori, in timpul unui astfel de proces are loc si variatia energiei interne.
Expresia matematica a primului principiu al termodinamicii este urmatoarea:
![]() .
.
Exprimarea in cuvinte este:
Energia termica schimbata de un sistem termodinamic cu exteriorul este utilizata atat la modificarea energiei interne cat si la producerea de lucru mecanic
Inainte de a trece la acele aplicatii ale primului principiu al termodinamicii care fac obiectul prezentului material, se impune definirea conventiei de SEMN in termodinamica. Aceasta precizeaza urmatoarele:
Energiei termice schimbate de un sistem termodinamic cu exteriorul i se atribuie SEMNUL PLUS daca aceasta este PRIMITA de catre sistemul studiat si SEMNUL MINUS in caz contrar.
Energiei mecanice schimbate de un sistem termodinamic cu exteriorul i se atribuie SEMNUL MINUS daca aceasta este PRIMITA de catre sistemul studiat si SEMNUL PLUS in caz contrar (fig. 1).
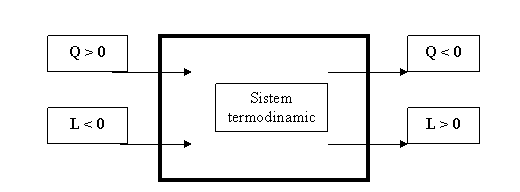
Fig. 1
Cap. 3 Aplicatii ale primului principiu al termodinamicii
Inainte de a detalia diversele cazuri particulare, reamintim proprietatea fundamentala a energiei interne: variatia energiei interne a unui sistem termodinamic care evolueaza intre doua stari, NU depinde de modul in care are loc transformarea.
Alta exprimare: energia interna a unui sistem termodinamic este functie DE STARE, ea nu este FUNCTIE DE PROCES.
Dupa cum se demonstreaza (de exemplu in cadrul teoriei cinetico-moleculare), energia interna a unui gaz ideal este data de expresia:
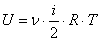 , in care notatiile sunt cele uzuale.
, in care notatiile sunt cele uzuale.
Explicitand pentru doua temperaturi T1 si T2 carora le corespund energiile interne U1 respectiv U2 si efectuand diferenta, se obtine pentru variatia energiei interne:
![]() .
.
Faptul ca in aceasta expresie NU intervine nici un factor care depinde de modul in care se produce trecerea de la o temperatura la alta, justifica afirmatia de mai sus referitoare la proprietatea fundamentala a energiei interne.
§ 3.1 Calduri molare
Daca un corp face schimb de energie termica cu exteriorul, dupa cum se cunoaste, expresia matematica a acesteia are forma:
![]() .
.
Masa corpului studiat se poate exprima in functie de masa unui kilomol si de numarul de kilomoli ca fiind:
![]()
Inlocuind (2) in (1) si utilizand proprietatea de asociativitate a produsului:
![]() in care, daca notam
in care, daca notam
![]() , (in care C se numeste caldura molara), obtinem:
, (in care C se numeste caldura molara), obtinem:
![]() .
.
In cele ce urmeaza, ne propunem sa definim aceasta noua marime fizica. Din ultima relatie gasim relatia de definitie a caldurii molare
![]() .
.
Definitia in cuvinte se obtine utilizand metoda reducerii la unitate. Pentru aceasta impunem conditiile:
Daca: ![]() , prin inlocuire in (6), gasim:
, prin inlocuire in (6), gasim:
![]() , ceea ce, in cuvinte se exprima dupa
cum urmeaza:
, ceea ce, in cuvinte se exprima dupa
cum urmeaza:
Caldura molara este o marime fizica scalara NUMERIC egala cu energia termica necesara unui kilomol de substanta pentru a fi incalzit cu 1 Kelvin.
Pentru a deduce unitatea de masura, pornim TOT de la relatia de definitie in care inlocuim fiecare marime cu unitatea de masura corespunzatoare:
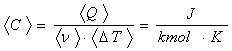 .
.
Nota aceasta unitate de masura NU se defineste, deoarece nu are corespondent real.
Pentru corpurile solide si lichide relatia (6) este suficienta pentru definirea caldurii molare, deoarece modificarea temperaturii intre doua valori date (incalzirea si racirea) nu se pot efectua in mai multe moduri.
In ceea ce priveste gazele, problema este mai complicata deoarece, asa cum vom vedea in cele ce urmeaza, intre doua temperaturi date, un gaz poate fi incalzit (sau racit) in mai multe moduri
Vom studia DOUA astfel de modalitati.
§ 3.1.1 Caldura molara la volum constant
Fie un gaz aflat intr-un cilindru cu piston etans, pistonul fiind BLOCAT (volumul este constant). Energia termica necesara modificarii temperaturii cu ΔT este utilizata, conform primului principiu al termodinamicii la modificarea energiei interne ΔU a gazului si la producerea de lucru mecanic L
Sa le exprimam pe fiecare:
![]() .
.
Deoarece pistonul este blocat, punctul de aplicatie al fortei datorate presiunii exercitate de gaz asupra pistonului este nula:
![]() .
.
Inlocuind aceste doua relatii in expresia (2.1) primului principiu al termodinamicii, gasim:
![]() .
.
Comparand aceasta ultima relatie cu (3.1.5), prin identificare obtinem pentru caldura molara corespunzatoare unui proces IZOCOR:
![]() .
.
§ 3.1.2 Caldura molara la presiune constanta
Fie un gaz aflat intr-un cilindru cu piston etans, pistonul fiind LIBER (presiunea este constanta). Energia termica necesara modificarii temperaturii cu ΔT este utilizata, conform primului principiu al termodinamicii la modificarea energiei interne ΔU a gazului si la producerea de lucru mecanic L
Deoarece variatia energiei interne a unui sistem termodinamic care evolueaza intre doua stari, NU depinde de modul in care are loc transformarea, avem dreptul sa scriem ca:
![]() .
.
In cele ce urmeaza vom calcula lucrul mecanic efectuat de gaz prin incalzire cu acelasi numar de grade.
![]()
![]()
Δh P
![]()
P V2
V1
![]()
![]()
Fig. 1 Fig. 2
In urma absorbirii de energie termica, gazul din incinta se incalzeste (creste temperatura acestuia), dar presiunea ramane CONSTANTA.
Deoarece studiem actiunea gazului asupra pistonului, vom considera numai forta cu care gazul impinge pistonul. Lucrul mecanic efectuat asupra pistonului se exprima ca fiind:
![]() in care:
in care:
![]() .
.
Inlocuind (3) in (2) obtinem:
![]()
si tinand seama ca produsul din paranteza reprezinta variatia volumului gazului prin modificarea temperaturii, deducem una din formele matematice sub care se poate exprima lucrul mecanic intr-un astfel de proces:
![]() .
.
Aceasta relatie se poate transforma dupa cum urmeaza:
![]() in care:
in care:
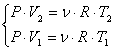 , ceea ce ne permite sa scriem:
, ceea ce ne permite sa scriem:
![]() .
.
Am dedus o alta forma sub care se poate exprima lucrul mecanic:
![]() .
.
Inlocuind expresia variatiei de energie interna (1) si cea a lucrului mecanic (9) in relatia primului principiu al termodinamicii (2.1), gasim succesiv:
![]() sau:
sau:
![]()
Comparand aceasta ultima relatie cu (3.1.5), prin identificare obtinem pentru caldura molara corespunzatoare unui proces IZOBAR:
![]() .
.
Observatii
a) caldura molara la presiune constanta este mai mare decat caldura molara la volum constant. Explicatia consta in aceea ca, daca in ambele procese gazul are nevoie de aceeasi energie termica pentru a-si modifica energia interna, in cazul procesului izobar gazul mai are nevoie de energie pentru deplasarea pistonului (pentru producerea de lucru mecanic), ceea ce nu este cazul in cadrul primului proces.
b)
![]() . Aceasta relatie reprezinta expresia matematica a ceea ce se
cunoaste ca fiind relatia lui Robert Mayer.
. Aceasta relatie reprezinta expresia matematica a ceea ce se
cunoaste ca fiind relatia lui Robert Mayer.
§ 3.2 Procese termodinamice simple
In cele ce urmeaza ne propunem sa stabilim expresiile matematice pentru energia termica schimbata, pentru variatia de energie interna si pentru lucrul mecanic generat, in cadrul unor tipuri simple de procese termodinamice.
§ 3.2.1 Procesul IZOCOR
Deoarece volumul este constant, rezulta ca:
![]() .
.
Pentru variatia de energie interna avem relatia cunoscuta:
![]() .
.
Prin inlocuirea acestor doua relatii in expresia matematica a primului principiu al termodinamicii, gasim:
![]() .
.
Relatia (3.1.1.4) ne permite sa exprimam mai simplu:
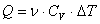 .
.
§ 3.2.2 Procesul IZOBAR
Tinand seama de proprietatea generala a energiei interne, avem:
![]() .
.
Pentru lucrul mecanic efectuat intr-un proces izobar, utilizam relatia (3.1.2.9):
![]() .
.
Primul principiu al termodinamicii ne permite sa determinam expresia matematica pentru energia termica schimbata cu exteriorul (caldura schimbata):
![]() si cu notatia
(3.1.2.12):
si cu notatia
(3.1.2.12):
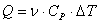 .
.
§ 3.2.3 Procesul IZOTERM
Procesul termodinamic in care temperatura este constanta este caracterizat de variatie NULA de energie interna
![]()
![]() .
.
Calculul lucrului mecanic intr-o transformare izoterma impune utilizarea calculului integral, fapt pentru care in cadrul prezentului paragraf dam numai relatia finala, calculele in detaliu fiind prezentate in Anexa 1
![]() .
.
Acestea, impreuna cu expresia matematica a primului principiu al termodinamicii ne permite sa determinam energia termica schimbata cu exteriorul in cadrul unui proces izoterm:
![]()
Nota Lucrul mecanic efectuat in cadrul unui astfel de proces poate fi exprimat in mai multe feluri. In functie de datele si cerintele unei probleme sa a alteia, se va alege relatia cea mai potrivita dintre cele prezentate in Anexa 2
§ 3.2.4 Procesul ADIABATIC
Conform definitiei procesului adiabatic:
![]() .
.
Variatie energiei interne este data (indiferent de natura procesului studiat) de:
![]() .
.
Acestea doua, inlocuite in expresia matematica a primului principiu al termodinamicii, ne permite sa exprimam lucrul mecanic:
![]() .
.
Nota lucrul mecanic efectuat in cadrul unui proces adiabatic poate fi calculat si in functie de valorile initiale si finale ale presiunii si volumului, pornind de la interpretarea fizica a ariei subgraficului functiei p = p(V), functie particularizata pentru procesul adiabatic.
Calculele in detaliu sunt prezentate in Anexa 3.
Un astfel de calcul ne conduce (vezi Anexa 3) la urmatoarea relatie:
![]() .
.
In cele ce urmeaza ne propunem doua scopuri:
sa prezentam alte forme algebrice pentru expresia lucrului mecanic generat intr-o transformare adiabatica, forme care se vor utiliza in functie de problema studiata (in functie de ce se da si ce se cere in problema);
sa demonstram ca, in urma unor transformari algebrice, relatia (4) devine identica cu (3).
Pentru primul din scopurile enuntate, vom exprima detaliat produsul care apare la numaratorul fractiei din (4). Deoarece:
![]() , vom explicita dupa
cum urmeaza:
, vom explicita dupa
cum urmeaza:
![]() , de unde:
, de unde:
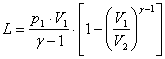 .
.
Dar, conform functiei generale de stare:
![]() si, pentru o
transformare adiabatica, intre parametrii de stare initiali si cei
finali se stabileste relatia:
si, pentru o
transformare adiabatica, intre parametrii de stare initiali si cei
finali se stabileste relatia:
![]() .
.
Aceste ultime doua expresii ne permit sa punem relatia (7) sub una din formele urmatoare:
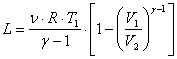 , sau:
, sau:
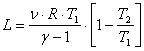 , ceea ce, se mai poate transforma in:
, ceea ce, se mai poate transforma in:
![]() , unde:
, unde:
![]() , deci:
, deci:
![]() .
.
Deoarece, prin definitia exponentului adiabatic:
![]() si deoarece, conform relatiei Robert Mayer:
si deoarece, conform relatiei Robert Mayer:
![]() , deducem:
, deducem:
![]() .
.
Inlocuind (17) in (14), dupa efectuarea unor calcule algebrice elementare, gasim:
![]() , relatie identica cu expresia (3).
, relatie identica cu expresia (3).
Atunci:
![]() .
.
Dar, conform primului principiu al termodinamicii:
![]() .
.
Din (19) si (20), prin tranzitivitate, rezulta:
![]() .
.
Anexa 1
Fie un cilindru cu piston mobil, etans. Gazul din interior sufera o destindere izoterma intre punctul 1 caracterizat de perechea de valori (p1; V1) si punctul 2 cu valorile (p2; V2) - vezi figura A1.1.
![]()
 p
p
![]() (1)
(1)
![]()
![]()
![]() dL
dL
(2)
![]() T = const.
T = const.
![]() V
V
![]()
![]()
![]() V1 V2
V1 V2
dV
Fig. A1.1
Lucrul mecanic efectuat prin destinderea gazului intre cele doua stari este NUMERIC egal cu aria subgraficului cuprinsa intre volumele V1 si V2.
In cele ce urmeaza ne propunem sa calculam aceasta arie.
Unei deplasari elementare (infinit mica - infinitezimala) a pistonului, ii corespunde generarea unui lucru mecanic elementar dL:
![]() .
.
Pentru ca in membrul drept sa existe o singura variabila de integrare (variabila independenta fiind volumul), vom tine seama ca relatia intre parametrii de stare initiali si cei corespunzatori punctului curent de pe curba in cadrul procesul studiat este:
![]() , de unde explicitam:
, de unde explicitam:
![]() .
.
Inlocuind (3) in (1) obtinem, pentru lucrul mecanic elementar:
![]() .
.
Integrand aceasta intre limitele 0 si L in membrul stang si intre limitele V1 si V2 in membrul drept gasim:
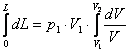 , ceea ce, utilizand formula Leibnitz - Newton ne conduce direct
la expresia cautata:
, ceea ce, utilizand formula Leibnitz - Newton ne conduce direct
la expresia cautata:
![]() .
.
Anexa 2
Dupa cum am demonstrat mai sus, in cazul unui proces izoterm, energia termica si energia mecanica schimbata cu exteriorul (lucrul mecanic) pot fi calculate cu ajutorul relatiei:
![]() .
.
In functie de datele problemei, aceasta expresie mai poate fi pusa sub alte forme.
Conform functiei generale de stare:
![]() , coeficientul logaritmului poate fi exprimat ca fiind:
, coeficientul logaritmului poate fi exprimat ca fiind:
![]() , ceea ce permite exprimarea relatiei (1) sub urmatoarele
forme (echivalente):
, ceea ce permite exprimarea relatiei (1) sub urmatoarele
forme (echivalente):
![]() .
.
Pentru transformarea izoterma studiata, relatia intre parametrii de stare initiali si cei finali este:
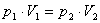 ceea ce ne permite sa
punem raportul care apare ca argument al logaritmului sub forma:
ceea ce ne permite sa
punem raportul care apare ca argument al logaritmului sub forma:
![]() .
.
Cu aceasta, relatiile (4) se scriu:
![]() .
.
In fine, deoarece intre logaritmul natural (in baza e) si logaritmul zecimal fiind relatia:
![]() toate expresiile de
mai sus admit formulari matematice in functie de logaritmul in baza
toate expresiile de
mai sus admit formulari matematice in functie de logaritmul in baza
Anexa 3
In cel ce urmeaza, ne propunem sa calculam direct lucrul mecanic efectuat de un gaz ideal care sufera o transformare adiabatica intre starea 1 caracterizata de parametrii de stare p1, V1, T1 si starea 2 caracterizata de parametrii de stare p2, V2, T2. In cadrul paragrafului 3.2.4 de mai sus, am calculat indirect acest lucru mecanic, prin intermediul variatiei energiei interne.
In considerentele ce urmeaza, vom porni de la interpretarea geometrica a ariei subgraficului reprezentarii presiunii in functie de volum (sistemul de coordonate Clausius - Clapeyron).
![]()
 p Q
= 0
p Q
= 0
![]()
 (1)
(1)
(T1)
![]()
![]()
![]()
![]() dL
dL
![]() (2)
(2)
(T2)
![]() V
V
![]()
![]()
![]() V1 V2
V1 V2
dV
Fig. A2.1
Lucrul mecanic efectuat prin destinderea gazului intre cele doua stari este NUMERIC egal cu aria subgraficului cuprinsa intre volumele V1 si V2.
In cele ce urmeaza ne propunem sa calculam aceasta arie.
Unei deplasari elementare (infinit mica; infinitezimala) a pistonului, ii corespunde generarea unui lucru mecanic elementar dL:
![]() .
.
Pentru ca in membrul drept sa existe o singura variabila de integrare (variabila independenta fiind volumul), vom tine seama ca relatia intre parametrii de stare initiali si cei corespunzatori punctului curent de pe curba in cadrul procesul studiat este:
![]() , in care am notat cu g exponentul adiabatic al gazului studiat. Din
aceasta relatie explicitam presiunea ca functie de volum ca
fiind:
, in care am notat cu g exponentul adiabatic al gazului studiat. Din
aceasta relatie explicitam presiunea ca functie de volum ca
fiind:
![]() .
.
Ultima expresie se inlocuieste in (1) pentru a explicita lucrul mecanic elementar:
![]()
Integrand membrul stang intre limitele 0 si L si membrul drept intre limitele V1 si V2 in gasim succesiv:
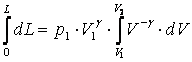 , ceea ce, utilizand formula Leibnitz - Newton ne conduce direct
la expresia cautata:
, ceea ce, utilizand formula Leibnitz - Newton ne conduce direct
la expresia cautata:
![]() .
.
Copyright © 2024 - Toate drepturile rezervate