 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
MODELUL GAZULUI PERFECT
1. Ipotezele gazului perfect
Cel mai simplu model pentru descrierea gazului, este modelul gazului perfect. Acest model porneste de la un numar de cinci conditii restrictive:
Gazul este format dintr-un numar foarte mare de particule identice (molecule).
Dimensiunile moleculelor sunt mici (neglijabile) in comparatie cu distantele dintre ele, astfel ca ele pot fi considerate puncte materiale.
Moleculele se afla intr-o miscare haotica continua; miscarea fiecarei molecule in parte se supune legilor mecanicii clasice.
Fortele intermoleculare se neglijeaza; moleculele se misca liber, traiectoriile lor fiind linii drepte.
Ciocnirile dintre molecule si peretii vasului sunt perfect elastice.
2. Formula fundamentala a teoriei cinetico-moleculare
In timpul miscarii lor, moleculele nu interactioneaza intre ele deci se misca rectiliniu si uniform intre doua ciocniri succesive cu peretii vasului. In momentul in care ele ciocnesc peretele vasului care limiteaza gazul, moleculele actioneaza asupra acestuia cu o forta. Suma fortelor cu care moleculele actioneaza asupra peretelui reprezinta forta totala cu care gazul actioneaza asupra peretelui. Aceasta forta, raportata la suprafata peretelui, reprezinta presiunea pe care o exercita gazul asupra peretelui.
In cele ce urmeaza ne propunem sa determinam expresia acestei presiuni, pornind de la considerente microscopice.
Vom considera gazul ca fiind inchis intr-un vas care are forma unui cub cu latura l.
Nota: faptul ca vom considera un vas de o forma particulara, NU ne va conduce la o forma particulara a expresiei presiunii. Exista demonstratii cu un mare grad de generalizare, care impun doar ca suprafata care limiteaza gazul sa fie inchisa si continua (pentru a nu permite pierderea de gaz). Forma matematica a expresiei finale este aceeasi cu cea la care vom ajunge noi.
Prin definitie, presiunea exercitata de gaz asupra unui perete (care are forma unui patrat cu latura l) este:
![]() ,
,
in care F reprezinta forta totala pe care o exercita moleculele asupra peretelui, iar S este aria suprafetei peretelui: S = l2.
Dar, forta totala exercitata de catre molecule asupra peretelui se exprima ca fiind suma fortelor cu care fiecare molecula actioneaza asupra peretelui:
![]() ,
,
in care am notat cu fj forta
cu care molecula numarul j ![]() actioneaza
asupra peretelui studiat.
actioneaza
asupra peretelui studiat.
Aceasta forta se exprima (conform teoremei variatiei impulsului), ca fiind:
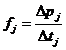 ,
,
unde: Δpj reprezinta variatia impulsului moleculei numarul j, iar Δtj reprezinta timpul in care se produce variatia mentionata a impulsului (timpul de contact cu peretele).
Note
de principiu, aceasta este "coloana vertebrala" a demonstratiei. Daca vom putea estima variatia impulsului unei molecule la ciocnirea cu peretele si timpul corespunzator de contact, vom putea determina forta cu care o singura molecula actioneaza asupra peretelui, conform relatiei (2.3). Sumand aceste forte, conform relatiei (2.2), vom obtine forta F cu care toate moleculele actioneaza asupra peretelui. In fine, pentru a determina expresia presiunii, nu vom mai avea decat sa impartim expresia fortei la aria suprafetei peretelui - relatia (1).
sa remarcam faptul ca relatiile (2.2) si (2.3) reprezinta matematic unele din ipotezele teoriei cinetico-moleculare:
o relatia (2.2) o putem scrie in baza a doua din ipotezele TCM: prima (gazul este format dintr-un numar N foarte mare de molecule) si a treia (in miscarea lor, moleculele se supun legilor mecanicii clasice - ori, teorema variatiei impulsului este tocmai o astfel de relatie).
Vom incepe demonstratia pornind de la ultima relatie (2.3), prin estimarea variatiei impulsului unei molecule in timpul ciocnirii cu un perete. Vom face, din nou, apel la ipotezele TCM. Anume, vom tine seama de ipoteza numarul cinci, conform careia ciocnirile moleculelor cu peretii vasului sunt perfect elastice.
![]()
Pentru molecula numarul j, vom explicita ultima relatie, scalar, sub forma:
![]()
Scriind aceasta relatie, prin faptul ca NU am pus indice la masa molecule ci numai la viteza ei, am respectat (implicit), o ipoteza a TCM si anume, am considerat ca gazul este format dintr-un numar foarte mare de particule identice.
In cele ce urmeaza sa estimam timpul mediu de contact a moleculei numarul j cu peretele.
Pentru aceasta mai avem nevoie de cateva considerente suplimentare. Remarca, in primul rand faptul ca un aparat de masura a presiunii (un manometru) nu determina pentru fiecare molecula in parte actiunea acesteia asupra peretelui. Aparatul de masura determina actiunea medie a ansamblului de molecule asupra peretelui vasului in care este inchis gazul.
Reprezentand grafic actiunea unei molecule asupra peretelui ca functie de timp, vom obtine (calitativ) reprezentarea din figura 2.1.
![]() t
t
![]()
![]() N M
N M
![]() fmed P Q S
fmed P Q S
fj
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() O A B C D
O A B C D
fig. 2.1
Atata timp cat molecula se deplaseaza prin vas, (intervalul de timp de la O la A), forta are valoarea ZERO. Cand molecula loveste peretele (timpul de contact este reprezentat de la A la B pe axa timpului), se produce un puls de forta (nu neaparat dreptunghiular). Efectul acestei forte se masoara prin efectul asupra peretelui, efect care este egal cu efectul actiunii peretelui asupra moleculei.
Acest efect este variatia impulsului moleculei. Dar variatia impulsului, in conformitate cu relatia (2.3), se determina prin produsul dintre forta si timp.
Remarcam, in figura 1 ca, din punct de vedere geometric, acest produs este numeric egal cu aria subgraficului fortei (reprezentata in functie de timp).
Pentru a obtine efectul mediu al efectului moleculei asupra peretelui, vom repartiza uniform aria OABMN in intervalul temporal dintre doua ciocniri succesive ale moleculei cu peretele.
Cu alte cuvinte, dorim sa determinam inaltimea AP = fmed a dreptunghiului APSC a carei arie este egala cu aria ABMN:
![]()
In aceasta interpretare, variatia impulsului nu va trebui impartita la intervalul de timp cat dureaza impactul, ci la intervalul temporal dintre doua ciocniri succesive cu ACELASI perete.
Pentru molecula numarul j, acest interval de timp se calculeaza cu relatia:
![]() .
.
Am determinat marimile care apar in membrul drept al relatiei (2.3). Acestea sunt date de (2.5) si (2.7). Inlocuind si efectuand calculele gasim:
![]() .
.
Pentru a determina forta cu care toate moleculele actioneaza asupra peretelui, vom suma fortele (2.8) dupa indicele j.:
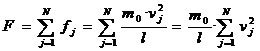 .
.
In cele ce urmeaza vom cauta sa exprimam suma patratelor vitezelor moleculelor. Pentru aceasta, trebuie sa definim o noua notiune: acea de viteza medie patratica. Sa pornim de la cateva considerente legate de notiunea de viteza medie. Aceasta se defineste prin relatia matematica:
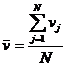 .
.
Efectuand calculele in acest mod, am obtine valoarea ZERO!
Aceasta deoarece unele molecule se misca in sensul pozitiv de masurare, altele in sens negativ al axei. Ca efect, unor viteze li se asociaza semnul plus, altora semnul minus, si suma ALGEBRICA va fi zero.
Pentru a nu mai avea valori pozitive si negative, vom considera un alt mod de efectuare a mediei: media patratelor vitezelor:
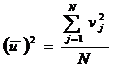 .
.
Nota:
deoarece in membrul drept apar patratele vitezelor, in membrul
stang va fi tot patratul unei viteze numita viteza medie
patratica. Aceasta va fi notata ![]() . si din ultima relatie ii deducem expresia ca
fiind:
. si din ultima relatie ii deducem expresia ca
fiind:
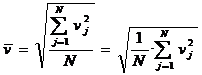 .
.
Din expresia (2.11) deducem pentru suma care apare in (2.9):
![]() , de unde, pentru forta ce se exercita asupra
peretelui:
, de unde, pentru forta ce se exercita asupra
peretelui:
![]() .
.
Pentru simplicitate, in continuare vom nota viteza medie patratica cu u, fara a mai utiliza si bara de deasupra, care reprezinta valoare medie. Ultima expresie se mai scrie:
![]() .
.
Pentru a obtine expresia cautata, cea a presiunii, nu mai avem decat sa impartim forta la suprafata pe care isi exercita efectul. Conform relatiilor (2.1) si (2.15), gasim:
![]() , in care prin inmultire si impartire cu
2, ne apare in mod explicit energia cinetica a unei molecule, energie pe care
o vom nota cu ε:
, in care prin inmultire si impartire cu
2, ne apare in mod explicit energia cinetica a unei molecule, energie pe care
o vom nota cu ε:
![]()
dar primul raport care apare in membrul drept este chiar concentratia moleculelor (marime fizica scalara numeric egala cu numarul de molecule din unitatea de volum):
![]() .
.
Introducand si notatia de care am amintit mai sus, aceea a energiei cinetice medie a unei molecule:
![]() , expresia presiunii se pune sub forma simpla:
, expresia presiunii se pune sub forma simpla:
![]() .
.
Mai ramane ca valorile presiunii calculate cu aceasta expresie sa fie comparate cu datele experimentale.
Daca am inlocui in (2.17) valorile numerice ale numarului total de molecule din vas, masa unei molecule si viteza medie patratica, se constata ca valorile obtinute prin calcul sunt mai mari decat cele obtinute experimental. Concret, valorile teoretice sunt de 3, 5 sau 6 ori mai mari decat cele experimentale.
Va trebui:
sa introducem in (2.17) un factor de corectie notat i care poate lua una din valorile 3, 5 sau 6;
sa explicam provenienta acestui factor de corectie, care ne va permite sa punem expresia presiunii sub forma:
![]() cu
cu ![]() .
.
Factorul de corectie i introdus in relatia (2.21) reprezinta numarul gradelor de libertate ale moleculelor gazului studiat.
Copyright © 2024 - Toate drepturile rezervate