 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Echilibrul termodinamic in sistemele de metale si aliaje reprezinta starea structurala care se realizeaza prin solidificare lenta sau prin incalzire in stare solida urmata de racire lenta. Constitutia fizico - chimica pe care sistemul o adopta in aceste conditii (numarul, natura si proportia fazelor) corespunde energiei libere F minime, energie data de relatia:
F= U - TS
in care:
U - energia interna a sistemului;
S - entropia sistemului;
T - temperatura absoluta.
Pentru ca un sistem metalic sa se gaseasca la o temperatura data T in echilibru, trebuie sa aiba o energie interna U cat mai mica si o entropie S cat mai mare. In acest fel echilibrul este determinat de doua tendinte opuse; starea de echilibru este starea care satisface cel mai bine cele doua tendinte. La temperaturi mici, factorul al doilea din ecuatia de mai sus este mic si ca urmare atomii vor forma o configuratie caracterizata prin cea mai mica energie interna U. La cresterea temperaturii creste atat energia interna (agitatia atomilor) cat si produsul TS, astfel incat entropia devine un factor important in stabilirea echilibrului.
Sistemele fizico - chimice se pot gasi fie in stare de echilibru, fie intr-o stare in afara echilibrului. Conditiile de echilibru ale unui sistem sunt date de legea fazelor care arata dependenta dintre numarul gradelor de libertate ale sistemului, numarul componentilor si numarul fazelor. Prin numarul gradelor de libertate sau varianta se intelege numarul factorilor interni sau externi ca temperatura, presiune, concentratie, care pot fi variati fara a provoca schimbarea numarului de faze. Notand cu n numarul componentilor, cu φ numarul fazelor si cu v variatia sistemului, legea fazelor a lui Gibbs se scrie sub forma:
v = n + 2 - j
In cazul sistemelor metalurgice, presiunea fiind considerata constanta, legea fazelor devine:
v = n + 1 - j
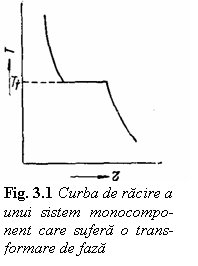 Considerand un sistem monocomponent (n =
1) gradul de libertate minim (v = 0) poate fi obtinut pentru j = 2. In sistemele monocomponente pot exista deci simultan cel mult doua
faze la o anumita temperatura. Ca urmare in cazul metalelor pure
si a compusilor intermetalici procese ca topirea, solidificarea
si transformarea polimorfa se desfasoara la
temperatura constanta. In cazul acestor sisteme o singura
faza poate exista intr-un interval de temperatura deoarece pentru j = 1 avem v = 1. Curba de racire pentru un astfel de sistem are
aspectul prezentat in figura 3.1.
Considerand un sistem monocomponent (n =
1) gradul de libertate minim (v = 0) poate fi obtinut pentru j = 2. In sistemele monocomponente pot exista deci simultan cel mult doua
faze la o anumita temperatura. Ca urmare in cazul metalelor pure
si a compusilor intermetalici procese ca topirea, solidificarea
si transformarea polimorfa se desfasoara la
temperatura constanta. In cazul acestor sisteme o singura
faza poate exista intr-un interval de temperatura deoarece pentru j = 1 avem v = 1. Curba de racire pentru un astfel de sistem are
aspectul prezentat in figura 3.1.
In cazul sistemelor binare starea invariata (v = 0) poate fi obtinuta pentru j = 3. Deci la aceste sisteme pot exista in echilibru simultan cel mult trei faze pentru o anumita temperatura si concentratie. Daca intr-un sistem binar se produc transformari la care participa trei faze, aceste transformari au loc la temperatura constanta, pe curbele de racire obtinandu-se paliere la temperaturile de transformare. Ca exemplu de transformare la care participa trei faze se mentioneaza transformarea eutectica; temperatura la care se produce este temperatura eutectica, concentratia lichidului este numita concentratie eutectica, iar produsul transformarii - eutectic - si reprezinta un amestec de cristale S1 si S2 conform reactiei eutectice:
![]()
O alta transformare invarianta o reprezinta si transformarea eutectoida care are loc in stare solida la transformarea unui solid de concentratie S1 in doua solide S2 si S3 conform reactiei:
![]()
Rezulta astfel ca in sistemele binare transformarile eutectice si eutectoide sunt transformari invariante, pe curbele de racire obtinandu-se la temperaturile de transformare paliere. In sisteme binare se mai pot produce la racire si alte transformari invariante ca:
transformarea peritectica : L + S1 S2
transformarea monotectica : L1 L2+ S
transformarea peritectoida : S1 + S2 S3
Cateva curbe de racire posibile in sistemele binare sunt prezentate in fig. 3.2.
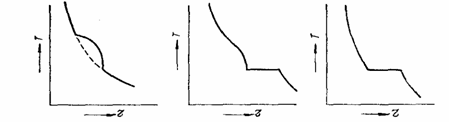
a) b) c)
Fig. 3.2 Curbe de racire ale unor aliaje binare
a) componentii solubili in stare lichida si solida ; b) componentii insolubili in stare solida cu transformare eutectica; c) componentii solubili in stare lichida si insolubili in stare solide de compozitie eutectica
Copyright © 2024 - Toate drepturile rezervate