 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
In forma lor de utilizare metalele si aliajele se afla in contact cu diverse medii chimice cu care interactioneaza (aer, apa, corp uman, etc.), rezultatul acestei interactiuni fiind coroziunea produsului metalic.
Coroziunea reprezinta degradarea si distrugerea metalului sub actiunea chimica sau electrochimica a mediului in care este expus. In cazul metalelor si aliajelor degradarea prin coroziune constituie, impreuna cu uzura mecanica si ruperea prin oboseala, principalele cauze de scoatere din serviciu a produselor metalice.
Fluidul tisular din corpul uman contine apa, oxigen dizolvat, proteine si diferiti ioni (hidroxid si clorid), ca urmare corpul uman reprezinta un mediu foarte agresiv pentru materialele metalice utilizate in fabricarea implanturilor si in consecinta rezistenta la coroziune reprezinta un aspect foarte important de biocompatibilitate.
Efectele cele mai sesizabile ale coroziunii sunt modificarea greutatii, alterarea suprafetei si slabirea proprietatilor mecanice ale produsului metalic. Aceste efecte se manifesta prin unul dintre cele trei tipuri principale de coroziune (fig. 4.37):
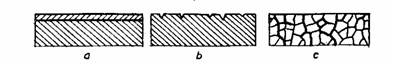 |
coroziunea uniforma (fig. 4.37. a); metalul se corodeaza regulat si uniform, iar rezistenta mecanica scade proportional cu diminuarea grosimii, deci cu pierderea de greutate a produsului metalic. Exemplu: atacul aluminiului in soda caustica;
coroziunea localizata sau de tip "pitting" (fig. 4.37.b); metalul se corodeaza in puncte sau in striuri, suprafata produsului devenind rugoasa ca de exemplu in cazul atacului fierului sau aluminiului in apa de mare;
coroziunea intercristalina (fig. 4.37.c); metalul se corodeaza in profunzime de-a lungul limitelor de graunte, fara a suferi o pierdere de greutate sensibila si uneori fara a i se altera vizibil suprafata. Efectele asupra proprietatilor mecanice sunt insa dezastruoase, produsele de coroziune intergranulara provoaca un fel de "decoeziune" a materialului metalic ceea ce poate conduce la ruperea sub cel mai mic efort.
Ca mecanism, coroziunea se poate produce in trei moduri principale:
coroziunea prin dizolvare;
coroziunea uscata sau oxidarea;
coroziunea electrochimica, care este cea mai pronuntata in cazul biomaterialelor, si care va fi tratata detaliat in continuare.
Ca definitie, coroziunea electrochimica este un proces complex de oxidare si dizolvare a unui metal in contact cu un electrolit (solutie apoasa, fluidul tisular, etc.).
Pentru un metal oarecare procesul de oxidare se exprima prin reactia generala:
![]()
Prin aceasta reactie metalul elibereaza (pierde) electroni, iar ioni sai pozitivi intra in solutie.
Procesul formarii de ioni pozitivi si de electroni creeaza un potential electric (exprimabil in volti) numit potential de electrod a carui valoare depinde de natura metalului si natura solutiei.
Nu toate metalele se oxideaza uniform conform reactiei de mai sus; metalele alcaline si alcalino - pamantoase (grupele IA si IIA din tabelul periodic), care au electroni de valenta slab legati, se oxideaza mai usor decat metalele nobile (grupa IB) sau decat metalele platinice (grupa VIIIB).
De asemenea atomii de la limita de graunte dintr-un metal se oxideaza si trec in solutie ca ioni pozitivi cu mai multa usurinta decat atomii din volumul cristalelor.
In privinta naturii solutiei se constata ca pentru un metal dat reactia de oxidare atinge echilibrul la o valoare a potentialului de electrod mai mare daca ionii metalului care intra in solutie sunt stabili. Potentialul de electrod nu poate fi masurat ca atare ci numai diferenta de potential fata de un electrod de referinta. Acest electrod de referita standard este electrodul de hidrogen pentru care procesul de oxidare este descris de reactia:
![]()
Practic electrodul de referinta de hidrogen este constituit dintr-un tub de platina imersat intr-o solutie acida in care activitatea ionilor de hidrogen este egala cu unitatea si care este saturata cu hidrogen la presiune normala.
Determinarea potentialului standard de electrod pentru orice metal se efectueaza cu un potentiometru, care masoara diferenta de potential ce se stabileste intre cei doi electrozi ai celulei galvanice (fig. 4.38) in care unul din electrozi este electrodul standard de hidrogen, iar celalalt electrod fiind constituit din metalul imersat in solutia apoasa.
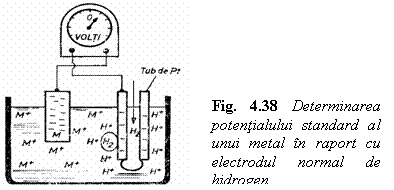
In tabelul 4.13. este prezentata seria potentialelor electrochimice ale metalelor (in raport cu hidrogenul), cifrele din tabel sunt valori de echilibru.
Metalele situate inaintea hidrogenului in seria electrochimica au o tendinta de oxidare (deci de a trece in solutie sub forma de ioni pozitivi) mai mare decat hidrogenul si deci sunt foarte active chimic (potasiul reactioneaza violent cu apa, magneziul cu aburul, fierul cu acizii), in toate cazurile se degaja hidrogen. Metalele situate dupa hidrogen au tendinte de oxidare mai mica decat aceasta si ca urmare nu-i pot deplasa ionii din solutie. In acelasi mod se poate conchide ca un metal poate deplasa din solutie un alt metal daca primul se afla situat inaintea celui de al doilea in seria electrochimica.
Tabelul 4.13 Seria electrochimica in raport cu hidrogenul
|
Elemente |
Reactia de electrod |
Potentialul de electrod (V) |
||
|
Litiu |
Li Li+ + e- | |||
|
Rubidiu |
Rb Rb+ + e- | |||
|
Potasiu |
K K+ + e- | |||
|
Calciu |
Ca Ca2+ + 2e- | |||
|
Sodiu |
Na Na+ + e- | |||
|
Magneziu |
Mg Mg2+ + 2e- | |||
|
Beriliu |
Be Be2+ + 2e- | |||
|
Aluminiu |
Al Al3+ + 3e- | |||
|
Titan |
Ti Ti2+ + 2e- | |||
|
Zinc |
Zn Zn2+ + 2e- | |||
|
Crom |
Cr Cr2+ + 2e- | |||
|
Cr Cr3+ + 3e- |
|
|||
|
Fier |
Fe Fe2+ + 2e- | |||
|
Cadmiu |
Cd Cd2+ + 2e- | |||
|
Nichel |
Ni Ni2+ + 2e- | |||
|
Staniu |
Sn Sn2+ + 2e- | |||
|
Plumb |
Pb Pb2+ + 2e- | |||
|
Fier |
Fe Fe3+ + 3e- | |||
|
Hidrogen |
H2 (g) ½ (H+ + e-) |
referinta |
||
|
Cupru |
Cu Cu2+ + 2e- | |||
|
Oxigen |
O2 + 2H2O + 4e- 4OH- |
metale nobile | ||
|
Cupru |
Cu Cu+ + e- | |||
|
Argint |
Ag Ag+ + e- | |||
|
Mercur |
Hg Hg2+ + 2e- | |||
|
Platina |
Pt Pt2+ + 2e- | |||
|
Oxigen |
O2 + 4H+ + 4e- 2H2O | |||
|
Aur |
Au Au3+ + 3e- | |||
Acestea sunt reactii electrochimice care se produc in electrolit la fiecare din cei doi electrozi ai unei celule galvanice: electrodul la care se produce oxidarea (se degaja electroni) se numeste anod, iar electrodul care primeste electroni reprezinta catodul.
Reactia anodica este intotdeauna o reactie de oxidare a metalului si de dizolvare in electrolit a ionilor pozitivi formati. Rezulta deci ca procesul de coroziune se produce la anod;
Reactia catodica are rol de depolarizare, ea trebuie sa consume electronii eliberati la anod prin reactia de oxidare a metalului;
Reactii in electrolit sunt mai complexe, in functie de natura chimica a electrolitului, de valoarea pH al acestuia, etc. si in care se poate degaja hidrogen, oxigen, etc.
In cazul coroziunii fierului reactiile electrolitice sunt:
- reactii anodice: 2Fe Fe+2 +2e-
3Fe Fe+3 +3e-
- reactii catodice: 2H+ + 2e- H2 Fe+2 + 2(OH)- Fe(OH)2
Fe+3 + 3(OH)- Fe(OH)3
- reactii in electrolit: H2O H+ + OH-
1/2O2 +2e- + H2O 2(OH)-
Hidroxizii de fier formati prin reactiile catodice sunt aproape insolubili in apa si precipita constituind rugina.
Un tip special de reactie catodica il reprezinta depunerea galvanica sau electroplacarea cand ionii metalici din electrolit se reduc la catod, iar metalul redus se depune pe catod:
Me+n +ne- Me
Reactia de mai sus prezinta importanta tehnica deosebita in cadrul proceselor de protectie anticoroziva si in procesele de rafinare electrolitica a metalelor.
Diferenta de potential intr-o celula galvanica in care se produce coroziunea electrochimica poate fi generata de o varietate de cauze care produc eterogenitatea materialului metalic sau a electrolitului; acestea pot fi grupate in trei categorii principale:
diferenta de compozitie chimica dintre anod si catod;
diferenta de stare de tensiuni mecanice (aplicate sau reziduale) din materialul metalic;
diferenta de compozitie a electrolitului.
Conform acestui principiu celulele galvanice pot fi de trei tipuri si anume:
Celule de compozitie care se formeaza atunci cand o solutie apoasa (sau chiar atmosfera umeda ce poate juca rol de electrolit) vine in contact cu doua materiale metalice diferite prin natura lor. Acestea pot fi doua metale sau aliaje diferite sau pot fi doua zone microstructurale ale aceluiasi aliaj, cu compozitie chimica diferita (fie datorita segregatiei, fie datorita prezentei unor faze diferite).
In toate cazurile metalul sau faza negativa mai mare a potentialului de electrod, situat la inceputul seriei electrochimice (tabelul 4.13.) actioneaza ca anod si se corodeaza. Spre exemplu intr-o tabla sau intr-o sarma de otel galvanizat, stratul exterior zincat actioneaza ca anod (zincul fiind mai putin nobil decat otelul). In acest mod chiar daca stratul de zinc nu este intact el protejeaza de coroziune fierul intrucat daca acesta din urma ajunge in contact cu electrolitul el nu se va coroda deoarece are rol de catod.
Este important de accentuat faptul ca intr-o constructie tehnica orice contact intre doua materiale metalice diferite (suruburi de otel in piese de metale neferoase) reprezinta surse potentiale de coroziune electrochimica.
La nivel microstructural un aliaj plurifazic reprezinta o multitudine de celule de compozitie intrucat cristalele vecine din doua faze diferite nu au acelasi potential de electrod, dar diferenta de potential este redusa pentru a nu apare fenomenul de coroziune.
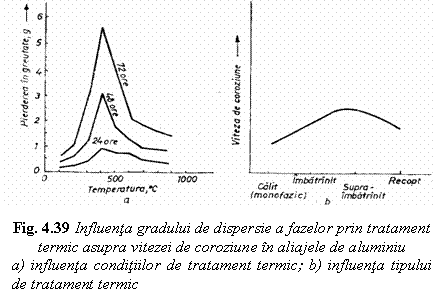 Tratamentele termice ale aliajelor, prin
modificarile care le produc, pot influenta considerabil viteza de
coroziune a materialului metalic. In curbele din figura 4.39 se arata
influenta tratamentului termic de revenire asupra vitezei de coroziune a
aluminiului datorita formarii unui mare numar de microcelule
galvanice intre fazele rezultate. Viteza maxima de coroziune corespunde
unor temperaturi de revenire intermediare, cand amestecul de faze este foarte
fin.
Tratamentele termice ale aliajelor, prin
modificarile care le produc, pot influenta considerabil viteza de
coroziune a materialului metalic. In curbele din figura 4.39 se arata
influenta tratamentului termic de revenire asupra vitezei de coroziune a
aluminiului datorita formarii unui mare numar de microcelule
galvanice intre fazele rezultate. Viteza maxima de coroziune corespunde
unor temperaturi de revenire intermediare, cand amestecul de faze este foarte
fin.
Intr-o celula de compozitie se poate estima care din metalele ce formeaza un cuplu galvanic se va coroda (va functiona ca anod) examinand asezarea lor relativa in seria electrochimica din tabelul 4.13.
In practica majoritatea metalelor si aliajelor sunt acoperite cu un film de oxid, acest fapt tinde sa deplaseze potentialele de electrod spre valori pozitive. Unele metale formeaza filme extrem de aderente la suprafata lor, ceea ce face metalul mult mai nobil decat ar rezulta din seria electrochimica; spre exemplu aluminiul se manifesta frecvent ca fiind mai nobil decat zincul desi in seria electrochimica are o valoare negativa mai mare ca potential de electrod. In tabelul 4.14 o serie de metale si aliaje tehnice sunt asezate in ordinea potentialelor de electrod in raport cu apa de mare, care prezinta un film de oxid mai mult sau mai putin aderent. Aceasta succesiune constituie serie galvanica tehnica, care este mai semnificativa decat seria electrochimica din tabelul 4.13.
Tabel 4.14 Seria galvanica a metalelor si aliajelor in raport cu apa de mare

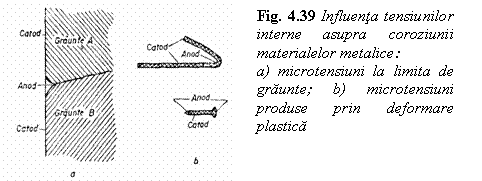
Celule de distorsiune elastica O diferenta de potential se poate stabili chiar si intr-un material metalic monofazic si omogen chimic daca acesta prezinta zone cu distorsiuni elastice ale retelei cristaline (zone cu tensiuni interne). Energia interna din zona distorsionata este mai mare decat in restul materialului si va functiona ca anod, materialul nedistorsionat avand functia de catod. Regiunile de la limita de graunte sau de subgraunte contin microtensiuni si se comporta anodic in raport cu materialul din volumul grauntelui unde reteaua cristalina este mai putin distorsionata (fig. 4.39).
Foarte frecvent se pot crea zone anodice prin introducerea unor macrotensiuni in material ca urmare a deformarii plastice neuniforme, a dilatarilor si contractiilor neuniforme la incalzire si racire rapida.
Astfel de regiuni anodice susceptibile de a se coroda apar intr-un material recopt prin aplicarea unei deformari plastice locale ca refularea capului unui nit, indoirea unei table sau sarme etc. (fig. 4.39).
Celule de concentratie Se pot manifesta intre extremitatile unei bucati de metal (omogen chimic si lipsit de tensiuni) cand acesta vine in contact cu un electrolit cu concentratia diferita de a ionilor metalici. Asemenea diferente in concentratia electrolitului se pot realiza ca rezultat al unor diferente locale ale temperaturii in electrolit, a unei agitari insuficiente a acestuia sau a unei difuzii foarte lente in electrolit a ionilor metalici dizolvati la anod. Coroziunea bazata pe formarea acestui tip de celule galvanice se poate produce in cazul dispozitivelor protetice de tip sarme, ace, suruburi care partial sunt introduse in corpul uman, motiv pentru care sunt admise in acest scop numai materialele cu mare rezistenta la coroziune.
Din punct de vedere termodinamic coroziunea unui material metalic intr-un electrolit se produce cu o variatie negativa a entalpiei libere a sistemului (DG < 0), unde variatia entalpiei libere este data de relatia:
DG = - ZFDE
in care:
Z - valenta ionului metalic;
F - constanta Faraday (96500 coulombi/echivalent gram;
DE - tensiunea electromotoare a celulei galvanice in care se produce coroziunea.
DE = Ece - Eae,
unde:
Ece - potentialul de echilibru al reactiei catodice in electrolit ;
Eae - potential de echilibru al metalului in electrolit.
Din combinarea relatiilor de mai sus rezulta:
- ZF (Ece - Eae) < 0
Eae < Ece
Relatiile de mai sus arata ca din punct de vedere termodinamic, coroziunea unui metal intr-o solutie data este posibila daca potentialul reversibil de electrod al metalului este mai electronegativ decat potentialul reversibil al unui agent depolarizant aflat in solutie.
Potentialul reactiei anodice Eae (reactie de ionizare a metalului in solutia data) se calculeaza cu relatia Nernst:
![]()
in care:
E0 - potentialul metalului in raport cu electrodul normal de hidrogen (tabelul 4.13);
R - constanta generala a gazelor;
T - temperatura absorbita;
a - activitatea ionilor metalului in solutie.
Potentialul reversibil al reactiei catodice de depolarizare se calculeaza in functie de natura agentului de depolarizare:
pentru hidrogen avem:
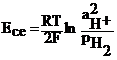
unde:
aH+ - activitatea ionilor de hidrogen din solutie;
pH2 - presiunea partiala a hidrogenului gazos din solutie.
Daca se considera pH2 = 1at, iar T = 293K avem:
Ece = 0,059 lg aH+ = -0,059 pH
unde: pH - logaritmul cu semn schimbat al activitatii (concentratiei) ionilor de hidrogen din solutie.
Rezulta ca probabilitatea termodinamica a coroziunii electrochimice a unui metal depinde de potentialul metalului in seria galvanica si de pH -ul solutiei la depolarizarea cu hidrogen. Depolarizarea se produce si cu oxigen sau cu o substanta oxidanta oarecare.
Reprezentand grafic in coordonatele pH - potentialul E, echilibrul in conditii izoterme intre un metal, ionii sai in solutie si produsii sai de coroziune, se obtin diagramele Pourbaix care permit prevederea coroziunii intr-un mediu dat. Diagrama Pourbaix simplificata pentru sistemul Fe - H2O la 250C este prezentata in figura 4.40 unde suprafata diagramei este divizata de dreptele limita in trei domenii:
domeniul conditiilor de imunitate unde reactia de ionizare a metalului nu este posibila termodinamic;
domeniul conditiilor de pasivitate unde ionizarea metalului este termodinamic posibila, dar nu se produce din cauza formarii pe suprafata metalului a unui film pasivant.
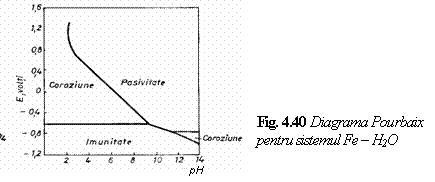
 In anumite cazuri datele privind potentialul
E si pH -ul este posibil sa nu fie suficiente pentru prevederea
coroziunii unui metal intr-un electrolit; asa este cazul cromului a
carui comportare sub forma de aliaje, depinde de prezenta sau
absenta ionilor complecsi aflati in diferitele fluide din corpul
uman (fig. 4.41). In diagrama din fig. 4.41, pe langa cele trei domenii
principale, se observa doua diagonale:
In anumite cazuri datele privind potentialul
E si pH -ul este posibil sa nu fie suficiente pentru prevederea
coroziunii unui metal intr-un electrolit; asa este cazul cromului a
carui comportare sub forma de aliaje, depinde de prezenta sau
absenta ionilor complecsi aflati in diferitele fluide din corpul
uman (fig. 4.41). In diagrama din fig. 4.41, pe langa cele trei domenii
principale, se observa doua diagonale:
2H2O O2 + 4H++ 4e-
In corpul uman aceasta regiune este ocupata de saliva, fluidul intracelular si fluidul interstitial.
Diagonala inferioara (a hidrogenului) reprezinta limita inferioara de stabilitate a apei. Hidrogenul sub forma de gaz molecular se degaja conform ecuatiei:
2H3O++2e- H2 + 2H2O
Coroziunea apoasa este situata in regiunea dintre cele doua linii diagonale ale diagramei Pourbaix. In corpul uman, urina, bila, secretia tubului digestiv inferior si secretiile glandelor endocrine ocupa regiuni apropiate de linia de hidrogen.
Concluzia reprezentarii diagramelor Pourbaix pentru materialele metalice utilizate ca implanturi este ca diferite parti ale corpului uman au diferite valori ale pH si diferite concentratii de oxigen. Ca urmare un metal adecvat pentru o parte a corpului (fiind imun sau pasiv) poate suferi o coroziune inacceptabila intr-o alta parte a corpului. In plus pH - ul se poate schimba dramatic in tesutul vatamat sau infectat. Un fluid tisular are un pH de aproximativ 7,4; dar intr-o rana acesta poate sa scada pana la 3,5; iar intr-o rana infectata pH -ul poate creste pana la 9,0.
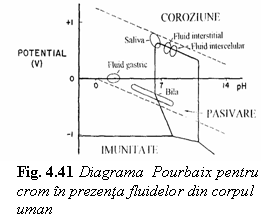
Diagramele Pourbaix, desi sunt
utile in caracterizarea comportarii la coroziune a unui material metalic,
nu descriu suficient de exact rezistenta la coroziune si mai ales
viteza de coroziune. In fig. 4.42 si fig. 4.43 sunt prezentate diagramele
Pourbaix pentru aur si titan.
Viteza unui proces de coroziune electrochimica este determinata de procesele electrochimice care au loc in celula galvanica manifestate prin: transportul agentului coroziv la suprafata de separatie metal - solutie, transferul de sarcina electrica si transportul produsilor de reactie. Fenomenele de polarizare a electrozilor unei celule galvanice constituie cauza de incetinire a procesului de cororziune electrochimica si ele apar ca urmare a unor efecte ireversibile ce se produc in electrolit, in vecinatatea electrozilor. Forta motrice a coroziunii este reprezentata de diferenta potentialelor de electrod masurate in circuit deschis (Ec - Ea). La inchiderea circuitului prin scurtcircuitarea in exterior al celor doi electrozi, incepe sa curga un curent I, se produce coroziunea, dar totodata apar si fenomene ireversibile care tind sa se opuna scurgerii curentului si deci electrozii se polarizeaza (pasiveaza): potentialul anodului devine tot mai catodic, potentialul catodului devine tot mai anodic, iar diferenta dintre ele scade. Deci polarizarea unui electrod reprezinta abaterea potentialului E de la valoarea de echilibru Ee masurata in circuit deschis.
Pe masura trecerii curentului polarizarea celor doi electrozi ai celulei galvanice se accentueaza pana se atinge starea stationara pentru care potentialul celulei galvanice ia o valoare stationara numita potential de coroziune Ecr.
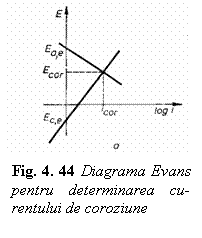 Instalarea starii stationare
si stabilirea potentialului de coroziune corespunde momentului cand
suma tuturor vitezelor reactiilor anodice (de oxidare) devine egala
cu suma tuturor reactiilor catodice (de reducere). Curentul corespunzator
potentialului de coroziune se numeste curent de coroziune Icor
si reprezinta curentul maxim care poate fi dat de o celula de
coroziune in conditii date. Reprezentarea grafica a tensiunii si
curentului de coeziune (fig. 4.44) reprezinta diagrama Evans.
Instalarea starii stationare
si stabilirea potentialului de coroziune corespunde momentului cand
suma tuturor vitezelor reactiilor anodice (de oxidare) devine egala
cu suma tuturor reactiilor catodice (de reducere). Curentul corespunzator
potentialului de coroziune se numeste curent de coroziune Icor
si reprezinta curentul maxim care poate fi dat de o celula de
coroziune in conditii date. Reprezentarea grafica a tensiunii si
curentului de coeziune (fig. 4.44) reprezinta diagrama Evans.
Amploarea coroziunii, conform acestei diagrame, depinde de diferenta potentialelor de electrod in curent deschis (Ece - Eae) si de caracteristicile de polarizare a electrozilor. Cu cat este mai mare polarizarea anodica sau catodica, respectiv cu cat sunt mai abrupte curbele de polarizare din diagrama Evans, cu atat curentul de coroziune va fi mai mic si viteza de coroziune mai redusa.
In anumite conditii atacul electrochimic al unui metal este incetinit si uneori suprimat prin formarea unui film superficial pe suprafata acestuia. In acest mod materialul metalic a trecut in stare pasiva si rezistenta sa la coroziune apare mai buna decat ar rezulta din pozitia metalului respectiv in seria electrochimica, aspect pus in evidenta de compararea seriei electrochimice cu seria anodica (tabelul 4.13) si care constituie fenomenul de pasivare.
Pelicula superficiala raspunzatoare de aparitia pasivarii actioneaza prin izolarea metalului de contactul cu electrolitul, prin diminuarea diferentei de potential in cuplul galvanic de coroziune, deci prin accentuarea polarizarii. Pentru ca pelicula superficiala sa asigure o protectie eficienta trebuie ca ea sa fie insolubila in electrolit, sa fie continua, impermeabila, aderenta si sa nu fie fragila. De asemenea, pelicula sa aiba proprietatea de a se regenera in zona in care a fost distrusa (autoregenerarea).
In prezenta oxigenului sau a unui mediu oxidant se formeaza si se autoregenereaza filmul superficial de pe suprafata metalului, asigurandu-se comportarea pasiva. In absenta oxigenului multe metale si aliaje trec din starea pasiva in stare activa si se corodeaza rapid. Astfel, de exemplu, otelul inoxidabil austenitic, are o buna rezistenta la actiunea acidului sulfuric diluat si aerat, dar o foarte slaba rezistenta la coroziune in acelasi acid neaerat.
Rezistenta la coroziune deosebita a unor metale ca molibdenul, cromul, titanul si a aliajelor speciale anticorozive (seria galvanica - tabelul 4.15) se datoreaza usurintei cu care acestea formeaza filme superficiale protectoare si caracterului autoregenerator al acestor filme, ceea ce asigura pasivizarea metalului in conditii foarte variate de mediu.
|
Ti |
Al |
Cr |
Be |
Mo |
Ni |
Fe |
Mn |
Zn |
Cd |
Sn |
Tabelul 4.15 Seria galvanica in stare pasiva a metalelor (rezistenta la coroziune in apa de mare)
Exista in prezent doua teorii asupra procesului pasivarii:
al doilea proces consta intr-o absorbtie a oxigenului pe suprafata metalului cu formarea unui strat de absorbtie monomolecular de oxigen. Acest strat nu consta dintr-o combinatie chimica si ca atare nu este redus de hidrogen si prezinta o mare stabilitate.
Ca mod de realizare, pasivarea se poate produce chimic sau electrochimic si poate fi naturala sau provocata printr-un tratament prealabil al suprafetei metalului. Pasivarea chimica este un fenomen de oxidare superficiala produsa de oxigen sau un agent oxidant. Pasivarea electrochimica se realizeaza prin aplicarea unui curent exterior care produce polarizarea anodica a metalului supus pasivarii.
In figura 4.45 este prezentata curba de polarizare anodica a titanului, tipica si pentru otelurile inoxidabile.
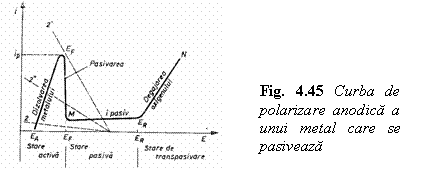
Curba contine mai multe ramuri:
ramura ascendenta EA -EF de crestere rapida a curentului la marirea potentialului; in aceasta zona numita zona de activitate chimica se produce dizolvarea anodica a metalului;
ramura verticala EF - M de micsorare puternica a curentului la o mica crestere a potentialului; corespunde formarii unei pelicule protectoare pe suprafata metalului care opreste coroziunea. Potentialul EF (potentialul Flade) la care incepe formarea peliculei de pasivare depinde de natura metalului si de puterea oxidanta a mediului;
ramura orizontala M-ER, in care curentul de coroziune este neglijabil si independent de potential; zona reprezinta ,,zona de pasivitate";
ramura ascendenta ER-N (ER - potential de ruptura sau transpasivare), in care metalul devine din nou solubil prin dizolvarea peliculei protectoare, fenomenul se produce cu descarcarea catodica a ionilor OH-si trecerea oxidului metalic la valenta superioara.
Evitarea degradarii si scoaterea din uz a produselor metalice datorita coroziunii constituie o problema complexa deoarece rezistenta la coroziune este determinata de un numar mare de factori, care pot fi grupati in urmatoarele categorii:
factori metalurgici referitori la materiale ca: natura aliajului, gradul de puritate, constitutia si structura sa. Acesti factori depind de particularitatile procesului tehnologic de obtinere a produsului metalic finit, (elaborare, puritatea materiei prime, prelucrari mecanice, tratamente termice, etc.).
factori chimici referitori la mediu ca: natura mediului coroziv, concentratia pH-ului, temperatura, presiunea, vascozitatea, continutul de oxigen dizolvat, prezenta microorganismelor, etc.
factori dependenti de conditiile de utilizare: forma piesei, starea suprafetei sale, procedee de asamblare, eforturi mecanice in exploatare, conditii de imersie in mediul coroziv, etc.
Luand in considerare ansamblul acestor factori se ajunge la concluzia ca nu exista metal sau aliaj perfect inalterabil prin coroziune. Un anumit material metalic poate fi considerat rezistent la coroziune numai cu precizarea naturii mediului coroziv si a conditiilor de utilizare, dar si in aceste conditii o serie de factori metalurgici de fabricatie si exploatare pot sa modifice considerabil calitatea anticoroziva a materialului.
In cazul otelurilor inoxidabile cu continut de crom si nichel, se introduce crom intre 12 si 27% si nichel intre 8 si 10%. Cromul asigura pasivarea prin formarea peliculei superficiale de Cr2O3 stabila si rezistenta la coroziune. Nichelul este mai nobil decat fierul, asigura mentinerea unei structuri austenitice la temperatura ambianta. Carbonul este mentinut la valori foarte scazute de concentratie in scopul pastrarii unei structuri monofazice a otelului (austenita) si de evitare a formarii microcelulelor galvanice de compozitie pe seama precipitarii carburilor de fier si crom. Din acest considerent practic, in otelurile inoxidabile austenitice cu aplicatii protetice ,continutul de carbon se limiteaza la valori mai mici de 0,03%.
Intensitatea coroziunii poate fi apreciata pe baza variatiei unor proprietati ale materialului metalic ca de exemplu pierderea de greutate, modificarea starii suprafetei, modificarea caracteristicilor mecanice sau prin masurarea concentratiei in mediul coroziv a unei substante (reactant sau produs) ce intervine in procesul de coroziune.
Din punct de vedere al aptitudinii de utilizare a materialelor metalice intr-un anumit mediu chimic este evident ca modificarile produse de coroziune asupra proprietatilor mecanice constituie indicele cel mai semnificativ in aprecierea rezistentei la coroziune. Datorita insa dificultatilor mari in realizarea acestor determinari, rezistenta la coroziune se apreciaza pe baza unei masuratori mai usor de realizat si anume pierderea in greutate raportata la unitatea din suprafata si la unitatea de timp. Pe baza acestei determinari se deduce un indice de coroziune care exprima micsorarea medie a grosimii materialului metalic in conditii standardizate, in unitatea de timp (mm/an). In tabelul 4.16. indicele de coroziune este corelat cu o scara conventionala de rezistenta la coroziune ce cuprinde 10 grupe de rezistenta. Stabilirea grupei de rezistenta necesara pentru o anumita aplicatie este o problema specifica fiecarei utilizari, depinzand de importanta produsului metalic si de durata de functionare ceruta.
Tabelul 4.16 Indici de coroziune si scara de rezistenta la coroziune a materialelor metalice
Aprecierea aptitudinii unui material metalic de a rezista in anumite conditii practice, la un mod anumit de coroziune, se determina cand este posibil pe un prototip identic cu piesa testata supus la coroziune, in conditii identice cu cele de exploatare.
In principiu efectele coroziunii unui material metalic pot fi mentinute in limite acceptabile actionand prin urmatoarele solutii:
Selectia adecvata a materialului metalic pe principiul omogenitatii chimice si al autoprotectiei prin pasivare. Aplicarea acestor principii se exemplifica prin cele mai importante metale si aliaje utilizate tehnic pentru rezistenta lor la coroziune:
metalele pure utilizate ca materiale anticorozive sunt in numar redus: Au, Pt, Ta, W, Ti, etc. utilizarea acestora este limitata datorita preturilor ridicate. De exemplu titanul, cu potential de electrod - 1,63V, isi datoreaza rezistenta excelenta la coroziune faptului ca este un metal extrem de oxidabil, ceea ce ii asigura o pasivare excelenta si eficace mai ales in medii oxidante;
otelurile inoxidabile isi datoreaza rezistenta la coroziune prin prezenta cromului aflat in solutie solida in fier, care formeaza un strat superficial de oxid compact si aderent, ce asigura o stare pasiva in numeroase medii chimice.
Prezenta nichelului in otelurile inoxidabile conduce la cresterea suplimentara a rezistentei la coroziune in special in medii slab oxidante. O crestere suplimentara a rezistentei la coroziune in medii umede (solutie acida si medii cu clor) se realizeaza prin adaosuri de molibden in aceste oteluri.
aliajele neferoase cu mare rezistenta la coroziune sunt pe baza de Ti, Ni, Cr, Mo, etc. Aceste aliaje ofera pe langa o ridicata rezistenta la coroziune si proprietati mecanice corespunzatoare utilizarii in protetica;
acoperirile metalice utilizeaza metale si aliaje anticorosive sub forma unui strat (fin) foarte subtire pe suprafata pieselor confectionate din aliajele ieftine.
Proiectarea si realizarea corecta a tehnologiei de fabricatie a produsului metalic Un material metalic poate prezenta o buna rezistenta la coroziune ca piesa individuala utilizata in medii corozive, dar isi poate pierde aceasta calitate la incorporarea sa intr-un ansamblu de piese, datorita posibilitatii de aparitie a unor celule galvanice de distorsiune elastica si a unor celule de compozitie.
Izolarea produsului metalic de mediul coroziv se poate obtine prin aplicarea pe suprafata metalului a unui strat de acoperire nemetalica prin procedee ca: fosfatarea, oxidarea anodica, oxidare chimica, acoperiri ceramice, etc.
Copyright © 2024 - Toate drepturile rezervate