 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
COMPORTAREA TERMODINAMICA A SISTEMELOR FLUIDE IN STARE PURA SI
Fundamentarea stiintifica a studiilor termodinamice de echilibru intre faze ca baza de evaluare a unor factori de risc in procesele de separare
INTRODUCERE
Industria chimica foloseste in procesele tehnologice diverse materiale cum ar fi : fluide de transfer termic, solventi, agenti de racire si refrigeranti. Aceste produse, dupa utilizare, ajung in mediul inconjurator constituind deseuri chimice, cu potential de risc major.
Multe industrii care folosesc solventi organici cu impact negativ mare in mediu (de ex. 1,1,1-tricloretan) sunt in cautare sustinuta de solventi alternativi care au performante caracteristice similare, dar un impact mai scazut asupra mediului /1/.
Refrigerantii complet halogenati de tipul clorofluorocarbon (folositi pana de curand) au efecte extrem de adverse asupra mediului deoarece epuizeaza ozonul atmosferic; mecanismul acceptat este cel in care radicalii liberi ai clorului catalizeaza conversia ozonului stratosferic la oxigen atomic. Aceasta situatie a stimulat cercetarile pentru descoperirea unor substituenti ai acestor fluide, mai siguri din punct de vedere al mediului. Cativa hidrohalometani si hidrohaloetani (de ex. HCFC124, HFC125, si HFC134a) s-au impus ca potentiali inlocuitori ai clorofluorocarbonilor /2-4/.
Deseurile chimice cu grad de risc pentru mediu contin in general amestecuri complexe, multifazice (de exemplu apa + compusi organici + electoliti). O clasa de contaminanti potentiali o reprezinta compusii organici volatili, intalniti frecvent in apele reziduale, acestia contribuind la poluarea apei si a atmosferei. Reglementari de protectie a mediului indica limite stricte de concentratii ale poluantilor (parti per million sau chiar parti per bilion) in apa si atmosfera. Distributia substantelor chimice eliberate in mediu (aer, sol, apa si organisme vii) este o masura importanta pentru determinarea impactului acestor chimicale asupra mediului.
Manipularea si inlaturarea acestor deseuri in conditii de siguranta si cu costuri reduse, prin noi tehnologii care includ distilarea, extractia, adsorbtia, absorbtia si distrugerea selectiva, necesita cunoasterea precisa si comprehensiva atat a compozitiei chimice, cat si a proprietatilor termofizice si termodinamice ce descriu comportarea fazelor si caracterizeaza interactiile intre componentii amestecurilor.
Datele termodinamice sunt de mare importanta in dezvoltarea, proiectarea, planificarea si operarea proceselor din industria chimica, indeosebi prin disponibilitatea simulatoarelor de proces /5/. Acestea sunt echipate cu o varietate de modele termodinamice si banci de date de parametri care permit calcularea proprietatilor termofizice ale substantelor pure si ale amestecurilor.
Pentru descrierea completa a unui sistem in echilibru trebuie determinate urmatoarele marimi: temperatura, presiunea si compozitia tuturor fazelor sistemului la echilibru. Acestea constituie, pe de o parte, informatiile de baza pentru obtinerea unor marimi termodinamice necesare verificarii teoriilor fluidelor si intelegerii comportarii sistemelor fluide /5/ si pe de alta parte, impreuna cu date de proprietati calorice, de transport si de interfata, fundamenteaza proiectarea proceselor de separare de catre ingineria chimica /5-9/.
Referitor la echilibrul lichid-vapori (ELV), presiunile de vapori ale componentilor puri sunt importante din punct de vedere termodinamic ca stare standard in calculele de echilibru. Presiunile de vapori sunt astfel legate de parametri semnificativi de proiectare, cum ar fi constantele Henry si "factori K" de echilibru lichid-vapori (coeficienti de distributie). In plus, marimi ca flamabilitatea si corozivitatea sunt importante in aprecierea sigurantei operationale a proceselor. Predictia (si minimizarea) emisiilor de vapori ai compusilor chimici volatili in mediu trebuie sa fie parte integranta a analizei factorilor de risc a oricarui produs sau proces de separare.
In pofida unui numar imens de date experimentale disponibile in literatura (pana in prezent mai mult de 16.000 de sisteme au fost studiate la echilibrul lichid-vapori, sisteme prezentate in mai mult de 11.000 de publicatii /10/, inca sunt mari lipsuri in privinta sistemelor de interes atat practic, cat si teoretic. In plus, numeroase date sunt de slaba calitate (in special cele foarte vechi), in special cele obtinute la presiuni inalte.
Scopul principal al proiectului propus este obtinerea de date termodinamice noi, de calitate, care sa constituie un suport de incredere pentru verificarea unor modele teoretice si empirice ale fluidelor si formularea de teorii relevante. Totodata, aceste date constituie o baza importanta pentru proiectarea instalatiilor de separare prin distilare, fractionare, extractie cu solventi si elaborarea studiilor de evaluare stiintifica a factorilor de risc pentru procesele de separare.
Solutionarea acestei probleme presupune o abordare coordonata si sistematica din trei puncte de vedere: experimental (masurare de date), al procesarii lor (corelare) si cumulativ (banci de date).
Obiective specifice :
Obiectivele specifice ale proiectului sunt:
1. Partea experimentala, care include:
(a) Investigarea sistematica a echilibrelor lichid-vapori in familii selectate de sisteme binare (depinzand de nevoile modelelor predictive), in domeniul presiunilor joase si moderate
(b) Masurarea solubilitatii gazelor in lichide greu volatile si determinarea de date noi de echilibru gaz-lichid la presiuni inalte, pentru sisteme cu aplicabilitate practica.
2. Procesarea datelor experimentale, care cuprinde:
(a) Evaluarea contributiilor de grup si a parametrilor de interactie ce caracterizeaza interactiile moleculare nou studiate, in vederea extinderii domeniului de validitate a metodelor predictive DISQUAC sau UNIFAC (bazate pe conceptul contributiilor de grup)
(b) Evaluarea parametrilor de interactie specifici ecuatiilor de stare pentru regulile de amestecare general valabile
(c) Procesarea critica a seturilor de date selectate pentru serii omoloage si evaluarea lor pentru utilizare in metode predictive extensive.
3. Cumularea datelor experimentale proprii si din literatura pe clase de sisteme relevante si analiza lor riguroasa folosind modele adecvate care sa permita extrapolarea pentru domenii de interes practic. Aceasta se va face sub forma de banci de date proprii care pot fi incorporate ulterior in simulatoarele de proces.
METODE EXPERIMENTALE
Cu toate ca pentru domeniul presiunilor joase si normale metodele experimentale sunt deja destul de elaborate /11/, sunt inca necesare cercetari pentru punerea la punct a unor tehnici experimentale pentru conditii speciale. Noile probleme de depoluare si mentinere curata a mediului, de proiectare a proceselor nepoluante si de reciclare a materialelor reprezinta noi preocupari ale termodinamicienilor pentru obtinerea de date specifice. Apare astfel necesitatea unor noi modificari ale echipamentelor experimentale datorita caracteristicilor neobisnuite ale sistemelor de masurat.
Pentru investigarea sistematica a echilibrelor lichid-vapori (in familii selectate de sisteme binare), in domeniul presiunilor joase si moderate se folosesc doua metode existente in cadrul laboratorului de Termodinamica Chimica din Institutul de Chimie Fizica "I. G. Murgulescu"al Academiei Romane /12, 13/. Acestea metode sunt :
- metoda dinamica, pentru date complete la echilibru (presiune, P, temperatura, T, compozitia fazei lichide, x, si a fazei de vapori, y). Aparatul de echilibru este un ebuliometru cu recircularea fazelor in echilibru (lichidul la fierbere si condensatul vaporilor) cu ajutorul caruia este posibila masurarea presiunilor de vapori ale componentilor puri la diverse temperaturi (date P, T) precum si datele aferente izoterme de ELV pentru amestecuri (P, x, y, la T fixat), [12]. Schita ebuliometrului este prezentata in Figura 1, iar schema bloc a instalatiei de masura in Figura 2.
Metoda ebuliometrica este rapida (timpul de stabilire a echilibrului este scurt, de aproximativ 15 minute) si permite prelevarea de probe (1-2 mL) din ambele faze la echilibru, fara sa fie necesara intreruperea functionarii aparatului. Analiza compozitiei fazelor se face la foarte scurt timp dupa atingerea echilibrului, folosind un refractometru Abbe cu termostatare, calibrat in prealabil.
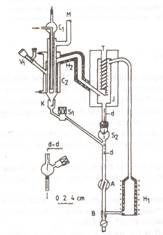
Figura 1
Ebuliometrul tip Rogalski-Malanowski modificat : H1, pompa Cotrell (fierbator) ; A, B, dispozitive de amestecare; K, numarator de picaturi; C1, C2, refrigerenti; E, camera de echilibru; T, locasul termometrului; V1, valva pentru introducerea probelor; M, spre manostat; J, manta vidata; S1, dispozitiv pentru prelevarea probelor din faza de vapori; S2, dispozitiv pentru prelevarea probelor din faza de lichid
Presiunea de vapori a compusilor puri si a amestecurilor se determina la manometrul cu mercur atasat celulei de echilibru (ebuliometru) cu ajutorul unui catetometru si se verifica prin compararea lor cu presiunea de vapori a apei pure bidistilate masurata intr-un ebuliometru Switoslawski cuplat in serie cu cel de masura.
Figura 2
Diagrama schematica a 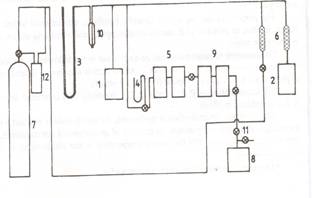 instalatiei ELV: 1, ebuliometru
de masura; 2, ebuliometru Swietoslawski; 3, manometru de masura;
4, manometru de control; 5, rezervoare tampon ; 6, fiola cu silica
-gel; 7, bomba de azot; 8, pompa de vid; 9, rezervoare de vid; 10, fiola de
siguranta; 11, robineti de vid; 12, rezervoare de azot
instalatiei ELV: 1, ebuliometru
de masura; 2, ebuliometru Swietoslawski; 3, manometru de masura;
4, manometru de control; 5, rezervoare tampon ; 6, fiola cu silica
-gel; 7, bomba de azot; 8, pompa de vid; 9, rezervoare de vid; 10, fiola de
siguranta; 11, robineti de vid; 12, rezervoare de azot
Datele complete de echilibru P, T, x, y, colectate sunt corelate cu modele de coeficienti de activitate recomandate pentru domeniul de presiuni joase si normale (Redlich Kister, Wilson, NRTL, UNIQUAC). Pentru corelare este minimizata functia obiectiv data de suma diferentelor marimilor determinate experimental si cele calculate, conform modelului ales care respecta legea lui Raoult si ecuatiile de normalizare ale compozitiei in cele doua faze. Metoda de optimizare este cea a verosimilitatii maxime (ec. 2). Prin analiza rezidualelor obtinute (in speta, in presiune si compozitia fazei de vapori) si tinand cont de precizia estimata a datelor se face analiza consistentei lor termodinamice. Prin corelarea cu un model de coeficienti de activitate, se obtine direct energia libera de exces, GE.
- metoda statica, pentru date incomplete P, T, x.
Aparatul folosit este un izoteniscop pentru masurarea presiunilor de vapori totale / , la temperatura de echilibru, a probelor lichide (componenti puri si amestecuri), degazate direct in celula de masura. Degazarea lichidelor se face prin 6-8 cicluri repetate de inghetare-vidare-topire. Inghetarea probelor se face la temperatura azotului lichid, iar vidarea se realizeaza la presiunea remanenta de 10-3 -10-4 mmHg. Schita izoteniscopului este prezentata in Figura 1, iar diagrama instalatiei de masura a presiunii de vapori in Figura 2.
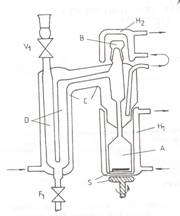
Figura 3
Izoteniscop pentru masurarea presiunii de
vapori. A, celula de echilibru; B, slif de sticla; C,
manta termostatata; D, manometru de nul cu
mercur; H1, H2, mantale termostatate; F1, V1,
robineti de vid; S, agitator magnetic
Presiunea de vapori se citeste la un manometru exterior (Fig. 4) atasat izoteniscopului, cu ajutorul unui catetometru. Amestecurile binare se obtin din componentii puri, prin cantarire intr-o fiola special construita. Dupa masurarea presiunii de vapori, compozitia amestecului este verificata refractometric.
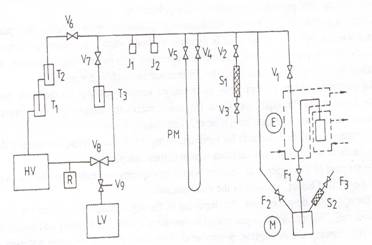
Figura 4
Diagrama schematica a instalatiei de masurare a presiunii prin metoda statica. E, izoteniscop; M, rezervor de mercur; V1-V9 si F1-F3, robineti de vid; PM, manometru de precizie cu mercur; LV, HV, pompe de vid; T1-T3, trape de racire; J1, J2, joje de control vid
Datele experimentale P-T-x fiind incomplete, compozitia fazei de vapori, y, se obtine din calcul, folosind metodologia de corelare prezentata anterior. Aceste date nu necesita verificarea consistentei termodinamice. Corectitudinea lor se poate verifica prin calcularea entalpiei de exces, HE, din variatia lui GE cu temperatura (ec. 3) si compararea cu valori masurate calorimetric.
Masuratorile de ELV prin cele doua metode descrise mai sus se fac de regula la cate 3-4 temperaturi diferite pentru a fi posibila si evaluarea entalpiei de exces, HE la compozitia echimolara a amestecului. Aceasta marime termodinamica serveste apoi in evaluarile parametrilor contributiilor de grup UNIFAC /14/ si DISQUAC /15/.
Pentru domeniul presiunilor inalte se utilizeaza o instalatie de masurare a solubilitatii gazelor in lichide greu volatile (presiuni de vapori neglijabile) /16/, pusa la punct tot in laboratorul de Termodinamica Chimica din Institutul de Chimie Fizica "I. G. Murgulescu" al Academiei Romane.
Metoda de masura este limitata la studiul solubilitatii lichidelor greu volatile cand cantitatea de lichid purtata de gaz in faza de vapori este extrem de mica. Datele de echilibru gaz-lichid sunt importante pentru verificarea si imbunatatirea modelelor pentru presiuni inalte, insuficient dezvoltate (de tipul ecuatiilor de stare) cat si in tehnologiile de extractie supercritica.
Instalatia experimentala de masurare a solubilitatii gazelor in lichide greu volatile, prezentata schematic in Figura 5, este bazata pe metoda izocora, unde cantitatea de gaz, de volum cunoscut, absorbita intr-o cantitate cunoscuta de solvent, este calculata din schimbarea de presiune a gazului, observata in timpul absorbtiei acestuia. Practic, determinarea solubilitatii gazului se face prin bilant de materiale aplicand un algoritm specific de calcul prezentat pe larg in lucrarea /16/.
Pentru procesarea datelor de solubilitati de gaze cu ecuatii de stare se foloseste un pachet de programe de calcul aflat in dotarea noastra.
Tratarea termodinamica a datelor experimentale de echilibru lichid-vapori
Operatia de reducere a seturilor de date experimentale la forma analitica a unor ecuatii empirice sau teoretic fundamentate, prin determinarea valorilor parametrilor folosind metode statistice, corespunde notiunii de corelare in studiul echilibrelor lichid-vapori. Pentru redarea cat mai fidela a datelor experimentale si caracterizarea cat mai completa a sistemelor studiate trebuie avut in vedere ca modelul de coeficienti de activitate ales pentru reprezentarea echilibrului lichid-vapori trebuie sa fie flexibil din punct de vedere matematic si sa contina un numar mic de parametri care sa aiba semnificatie fizica.
In calculele noastre am utilizat pentru corelarea datelor ELV doua metode :
(a) metoda iterativa Barker /17/ pentru corelarea variatiei presiunilor totale de vapori in functie de compozitia amestecului lichid si a carei functie obiectiv este de forma :
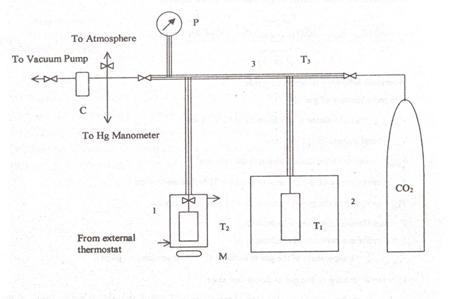
Figura 5
Instalatia de masurare a solubilitatii gazelor in lichide greu volatile. (1) Sectiunea celulei de echilibru; (2) sectiunea rezervorului de gaz; (3) sectiunea liniei de presiune; C: trapa de condensare; M: agitator magnetic; P: manometru cu membrana pentru masurarea presiunii; T1: temperatura rezervorului de gaz; T2: temperatura celulei de echilibru; T3: temperatura liniei de presiune
(b) metoda verosimilitatii maxime /18-20/ care ia in considerare erorile tuturor marimilor masurate (T, P, x, y) si a carei functie obiectiv are forma :
Exista o legatura stransa intre operatia de corelare a datelor experimentale si de verificare a consistentei termodinamice. Astfel, in operatia de corelare trebuie luate in considerare numai datele consistente termodinamic. Totodata, rezultatul verificarii consistentei termodinamice a datelor experimentale are semnificatie numai daca diferenta dintre valorile determinate experimental si cele calculate cu ajutorul ecuatiilor termodinamice nu depaseste cu mult abaterile experimentale. Consistenta termodinamica poate fi evaluata numai in cazul analizei datelor ELV complete (P-T-x-y) prin deviatiile in presiune si compozitia fazei de vapori.
PROCESAREA DATELOR EXPERIMENTALE
Aceasta etapa cuprinde evaluarea contributiilor de grup si a parametrilor de interactie ce caracterizeaza interactiile moleculare studiate, prin aplicarea metodelor predictive UNIFAC (Universal Functional Activity Coefficients) /14/ sau DISQUAC (Dispersive Quasichemical) /15/ (bazate pe conceptul contributiilor de grup), precum si evaluarea parametrilor de interactie specifici ecuatiilor de stare pentru regulile de amestecare general valabile. Detalii privind metodele contributiilor de grup sunt prezentate in cateva lucrari de sinteza /14, 15, 21-23/.
Modelul DISQUAC este un model al contributiilor de grup cvasichimic pseudo-retelar extins /15/ si a fost aplicat cu success in evaluarea proprietatilor termodinamice ale amestecurilor din diferite clase de compusi organici din serii omoloage /24-29/.
Termenii de interactie ce decurg din proprietatile termodinamice de exces GE si HE contin un termen dispersiv (dis) si un termen cvasichimic (quac), care sunt calculati independent si apoi insumati.
![]() (4)
(4)
![]()
Ecuatiile folosite pentru calcularea lui GE si HE si dependenta de temperatura a parametrilor de interactie sunt descrise in lucrarile /15, 24-29/.
Evaluarea parametrilor de interactie specifici ecuatiilor de stare, pentru regulile de amestecare general valabile, se refera la aplicarea ecuatiei de stare Soave-Redlich Kwong (SRK) /30/ in modelarea termodinamica a datelor de echilibre de faze la presiuni inalte. Cand parametrii critici (temperatura, Tc, presiunea, Pc si factorul acentric, w) ai compusilor puri si parametrii de interactie pentru amestecurile binare sunt cunoscuti, ecuatia poate fi folosita cu succes in simulatoarele de proces din industrie in predictia proprietatilor termodinamice ale sistemelor multicomponente de diverse complexitati. Simplitatea ecuatiei confera avatajul economiei de timp pentru estimarea acestor proprietati.
In cadrul proiectului propus s-a folosit ecuatia de stare SRK impreuna cu regula de amestecare cvadratica de ordinul doi, modificata de Huron-Vidal (MHV2), combinata cu modele modificate UNIFAC sau UNIQUAC /31/, pentru modelarea datelor de echilibre de faze la presiuni inalte. Au fost studiate astfel doua categorii de sisteme binare si ternare:
a) sisteme continand refrigeranti alternativi cu lubrifianti (hidrofluorocarboni - HFC) + uleiuri lubrifiante (glicoli polialchilenici - PAG si esteri poliolici - POE), de importanta pentru gasirea sistemelor compatibile din industria frigului, pentru motoarele pompelor de incalzire si ale sistemelor de aer conditionat /31/
b) sisteme de interes pentru tehnologiile de extractie cu fluide supercritice (continand N2, CO2, metanol si dimetil eter), de importanta pentru obtinerea combustibililor alternativi nepoluanti /32/.
a) Pornind de la masuratori de presiuni de vapori in intervalul de temperatura 298.15 K-318.15 K si indici de refractie la 298.15 K pentru sisteme binare de cetone liniare + cloroalcani (2-propanona, 2-butanona + 1-clorpentan, + 1,3-diclorpropan, + 1,4-diclorobutan, + 1,1,1-tricloroetan, + 1,1,2,2-tetracloroetan, si 3-pentanona + 1,2-dicloroetan, + 1,3-diclorpropan, + 1,4-diclorbutan, + triclormetan, + 1,1,1-tricloretan, + 1,1,2,2-tetracloretan) au fost determinate proprietatile termodinamice de exces GE, HE. Aceste marimi au permis evaluarea capacitatii modelelor DISQUAC si UNIQUAC de a caracteriza echilibrele de faze lichid-vapori si termodinamica interactiilor moleculare in astfel de sisteme /33-35/.
b) S-a extins banca de date pentru dioxid de carbon + alcooli normali (C1-C20) si s-au modelat datele cu ecuatia de stare Soave-Redlich-Kwong, cu regula de amestecare cvadratica in vederea generalizarii lor, pentru simulatoare de proces. S-au modelat si interpretat termodinamic date de densitati si volume de exces pentru sisteme de interes practic ce prezinta interactii fizice semnificative in sistemele diglicol amina/apa, trietilenglicol/apa, metanol, etanol si 1-propanol /36-39/.
BIBLIOGRAFIE
1. D. Hairston, Solvent alternatives, Chemical Engineering (February), 55-58 (1997)
2. B. Sukornick, Potentially acceptable substitutes for chlorofluorocarbons: properties and performance features of HFC-134a, HFC-123 and HCFC-141b, Int. J. Thermophys., 10, 553 (1989)
3. E. K. L. Achenie, M. Sinha, Environmentally benign synthesis of refrigerants and solvents, Process design tools for the environmental (Ed. K. S. Sikdar and M. El-Halwagi), Miami Florida, USA, 1999
4. D. W. van Leeuven, J. L. M. Hermens, Risk assesment of chemicals: An introduction, Kluwer Academic Publishers, 1995
5. J. M. Prausnitz, R. N. Lichtenthaler, E. G. De Azevedo, Molecular Thermodynamics of Fluid-Phase Equilibria, 3rd Ed. Prentice Hall, PTR, New Jersey, 1998
6. S. Zeck, D. Wolf, Requirements of thermodynamic data in the chemical industry, Fluid Phase Equilibria, 82, 27-38 (1993)
7. R. Dohrn, O. Pfohl, Thermophysical properties - Industrial directions, Fluid Phase Equilibria, 194-197, 15-29 (2002)
8. S. Bandyopadhyay, Effect of feed on optimal thermodynamic performance of a distillation column, Chem. Eng. J., 88, 175-186 (2002)
9. J. Nikmo, J. Kukkonen, K. Riikonen., A model for evaluating physico-chemical substance properties required by consequence analysis models, Journal of Hazardous Materials, A91, 43-61, (2002)
10. I. Wichterle, J. Linek, Z.Wagner, H. V. Kehiaian, Vapor-liquid equilibrium bibliographic data base, ELDATA, Paris (1993), Suppl. 1 (1994), Suppl. 2 (1995)
11. K. Aim, E. Hala, Measurement of
vapor-liquid equilibria at low and normal pressures, in Thermodynamics of
fluids: Measurement and correlation (Eds. S. Malanowski and A. Anderko ), World
15. H. V. Kehiaian, J. P. E. Grolier, G. C. Benson, Thermodynamics of organic mixtures. A generalized quasichemical theory in terms of group surface interactions, J. Chim. Phys. - Chim. Biol., 75, 1031-1048 (1978)
17. J. A. Barker, Austral. J. Chem., 6, 207- 216 (1953)
18. R.G. Rubio, J. A .R. Renuncio, M. Diaz Peña, Fluid Phase Equilib., 12, 217-34 (1983)
19. S. Kemeny, J. Manczinger, S. Jorgensen, K. Tott, AI ChE J., 28, 20-30 (1982)
21. H.V. Kehiaian, Group contribution methods for liquid mixtures. A critical review, Fluid Phase Equilib., 13, 243-252 (1983)
22. J. Gmehling, Group contribution methods in the prediction of activity coefficients, Fluid Phase Equilib., 30, 119-134 (1986)
24. H. V. Kehiaian, J. P. E. Grolier, M. R. Kechavarz, G. C. Benson, O. Kiohara, Y. P. Handa, Thermodynamics properties of binary mixtures containing ketone. VII. Analyssis of the properties of n-alkanone+n-alkane, and n-alkanone+n-alkanone mixtures in terms of a quasichemical group contribution model, Fluid Phase Equilib., 7, 95-120 (1981)
25. H. V. Kehiaian, B. Marongiu, A comparative study of thermodynamic properties and molecular interactions in mono - and polychloroalkane+n-alkane or + cycloalkane mixtures, Fluid Phase Equilib., 40, 23-78 (1988)
29. D. Dragoescu, A. Barhala, DISQUAC predictions of phase equilibria, molar and standard partial molar excess quantities for 2-propanone + chloroalkanes mixtures, Rev. Roum. Chim., 46, 847 (2001)
D. Dragoescu, M. Teodorescu, A. Barhala, I. Wichterle, Disquac characterization of the carbonyl-chlorine interactions in binary mixtures of linear ketone with chloroalkane, Collect. Czech. Chem. Commun., 68, 1175 (2003)
D. Dragoescu, A. Barhala, R. Vilcu, Thermodynamic modelling of vapour-liquid equilibria data of linear ketones + chloroalkanes selected mixtures, Annals of West University of Timisoara, Chemistry, vol. 12, 343 (2003)
D. Dragoescu, A. Barhala, Thermodynamic behaviour of strongly nonideal alkanones + chloroalkanes binary mixtures, Proceedings of the 13th Romanian International Conference on Chemistry and Chemical Engineering, RICCCE 13, Bucuresti, 16-20 Septembrie, vol. 2, 1 (2003)
M. Teodorescu, L. Lugo, J. Fernández, Modeling of gas solubility data for HFCs - Lubricant oil binary systems by means of the SRK equation of state, International Journal of Thermophysics, 24, 1043-1060 (2003)
Copyright © 2024 - Toate drepturile rezervate