 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Desi numarul reactiilor din chimia analitica care au loc cu formare de precipitate este foarte mare, numarul metodelor volumetrice care au la baza aceste reactii este mic, datorita dificultatilor care apar la punerea in evidenta a sfarsitului titrarii.
Reactiile de precipitare, pentru a putea fi utilizate in dozari prin titrare trebuie sa indeplineasca mai multe conditii:
Ø precipitatul sa fie practic insolubil;
Ø precipitarea sa decurga cu viteza mare, incat determinarea sa fie rapida;
Ø rezultatele sa nu fie denaturate, datorita efectelor de coprecipitare;
Ø precipitatul sa aiba o compozitie definita exact;
Ø sa existe posibilitatea determinarii precipitatului, a punctului de echivalenta.
Subtanta cu cele mai largi intrebuintari in volumetria de precipitare este AgNO3. Metodele care se bazeaza pe folosirea AgNO3 sunt grupate sub denumirea argentometrie.
Consideram cazul general al titrarii unui cation cu un anion, conform reactiei:
![]()
Pana la punctul de echivalenta, concentratia de cation se calculeaza cu ajutorul cantitatii de agent de precipitare folosit.
Foarte aproape de punctul de echivalenta se considera urmatoarea relatie:
![]()
b x
Pentru a calcula pe x se pleaca de la expresia produsului de solubilitate:
![]()
si cum:
![]()
rezulta:
![]()
ecuatie de ordinul (m+n) care se rezolva prin aproximatii succesive, adica luand diferite valori pentru x pana la satisfacerea egalitatii:
![]() si
si ![]()
La punctul de echivalenta este valabila relatia:
![]() respectiv
respectiv ![]()
adica:
![]() si
si ![]()
Foarte aproape dupa punctul de echivalenta
![]()
Deci putem scrie:
![]()
y
Dar, in solutie:
![]()
a y
Deci:
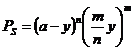
ecuatie de ordinul (m+n) care se rezolva, de asemenea, prin aproximatii succesive. Rezulta deci ca:
![]() si
si ![]()
Departe de punctul de echivalenta, [Bn+] se poate calcula prin produsul de solubilitate.
Cu cat solutia ce se titreaza este mai concentrata si cu cat solubilitatea precipitatului care se formeaza este mai scazuta, cu atat titrarea va fi mai exacta.
În mod similar, se trateaza si cazul titrarii anionilor cu cationi.
Metodele
clasice de titrimetrie, utilizandu-se reactii de precipitare sunt
Mohr, Volhard si Fajans. Acestea folosesc pentru detectarea punctului
final indicatori de culoare. În general, aceste trei metode implica
titrarea unei halogenuri sau a unei pseudohalogenuri cu ioni de Ag. Reactivii chimici folositi ca
indicatori pentru aceste trei reactii nu se pot utiliza si pentru
alte titrari de precipitare (Na2CrO4 ![]() Ag2CrO4
rosu; ionul feric serveste drept indicator pentru titrarea cu SCN - - la un exces de SCN - folosit pentru titrarea
Ag+ se formeaza Fe(SCN)2+
rosu intens; fluoresceina pentru AgCl-Cl cu Ag+ - se absoarbe pe suprafata precipitatului
si la trecerea de punctul de echivalenta se coloreaza
in roz-rosu).
Ag2CrO4
rosu; ionul feric serveste drept indicator pentru titrarea cu SCN - - la un exces de SCN - folosit pentru titrarea
Ag+ se formeaza Fe(SCN)2+
rosu intens; fluoresceina pentru AgCl-Cl cu Ag+ - se absoarbe pe suprafata precipitatului
si la trecerea de punctul de echivalenta se coloreaza
in roz-rosu).
Totusi, principiile folosite in cadrul acestor metode pentru detectarea punctului final si anume: formarea unui precipitat colorat si aparitia unei culori omogene sau numai la suprafata pot fi extinse si pentru alte metode.
Copyright © 2024 - Toate drepturile rezervate