 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Metodele volumetrice complexonometrice folosesc doua tipuri de combinatii complexe:
a) combinatii complexe in trepte;
b) combinatii complexe chelatice (raportul metal:ligand este 1:1).
Teoria si metodele primei grupe formeaza
complexonometria veche, clasica. În prezent, metodele din prima
categorie se folosesc destul de putin, majoritatea fiind combinatiile
complexe ale argintului sau mercurului: ![]() .
.
Complexonii, utilizati in combinatiile complexe chelatice conform definitiei lui Schwarzenback sunt acizi aminopolicarboxilici.
În ultimii 40 de ani au fost sintetizati un numar foarte mare de complexoni, dar in laboratoarele de chimie analitica au utilitate curenta un numar redus si anume:
Acidul nitrilotriacetic care se mai numeste si complexon I si are urmatoarea structura:
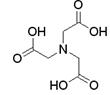
Acidul ca atare nu este solubil in apa, din care cauza se lucreaza cu sarea sa monosodica prin adaugarea de NaOH la suspensia acidului, pana la un pH = 2,2.
Între cationii bivalenti si anionul care provine de la sarea monosodica a acidului nitrilotriacetic se stabileste echilibrul:
![]() D
D ![]()
iar complexonatul MX - are structura:
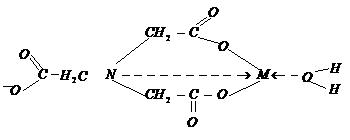
in care se formeaza cicluri de 5 atomi lipsite de tensiune si deci stabile.
Cu metalele trivalente, formeaza complexonati conform reactiei:
![]() D
D ![]()
si care are structura:
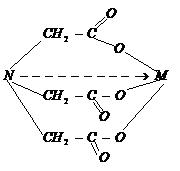
Acidul etilen-diaminotetraacetic notat prescurtat H4Y. Se mai numeste si complexon II - (EDTA).
Structura acestui acid este:
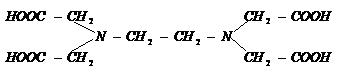 D
D
D 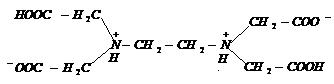
forma betainica
Nici acest acid nu este solubil in apa, de aceea se obtine sarea disodica a acestui acid Na2H2Y prin adaugarea de NaOH la suspensia de H4Y pana la un pH= 4,5. Aceasta sare se mai numeste si complexon III. Complexonul III are cea mai extinsa gama de aplicatii in chimia analitica.
În literatura, mai este intalnit si ca trilon B, chelaton, idranal, versen, versenat de Na etc.
Cu matalele bivalente formeaza complexonati conform reactiei:
![]() D
D ![]()
Cu metodele trivalente formeaza complexonati conform reactiei:
H Y +M3+ D MY- + 2H+
Deoarece in acesti complexonati se formeaza mai multe cicluri de 5 atomi, au o stabilitate foarte mare.
Consideram echilibrul de formare a complexonului MZ:
În general, pentru simplificare, ionul metalic se noteaza cu M, iar ionul complexonului cu Z (facandu-se abstractie de sarcina electrica).
Complexul format este caracterizat de constanta de stabilitate:
![]()
Pana la punctul de echivalenta, concentratia ionului M se calculeaza in functie de cantitatea de complexon adaugata.
În apropierea punctului de echivalenta trebuie considerata si concentratia ionului M din complex. Astfel, concentratia totala a lui M va fi:
![]()
Deci ![]() .
.
Daca dorim sa aflam valoarea x din concentratii si constanta de stabilitate, inlocuim in relatia constantei de stabilitate si vom avea:
![]()
sau
![]()
de unde:
![]()
La punctul de echivalenta:
[M] = [Z]
si din expresia K de stabilitate:
![]()
rezulta:
![]()
Imediat dupa punctul de echivalenta, pe langa Z in exces, nu vom putea neglija Z din complex. Deci, concentratia totala a lui Z dupa echivalenta este:
![]()
b y
În acest caz: ![]()
Sau:
![]()
Deci,
![]()
Dupa adaugarea unui exces mai mare de complexon si tinand cont de expresia constantei de formare (stabilitate) a complexonului, concentratia metalului va fi data de relatia:
![]()
Influenta [H+] asupra stabilitatii complexonului
Aceasta se manifesta in cazul in care ionul de complexonul intra intr-o reactie de forma:
![]() D
D ![]()
Deci, in solutie apoasa exista nu numai ioni Z ci si HZ, H2Z . HnZ.
Din acest motiv, in expresia concentratiei de formare a complexonatului, in loc de [Z , va trebui considerata suma:
![]()
astfel incat constanta de formare, intr-o solutie in care exista ioni H+, va fi:
![]()
si depinde deci de [H+], precum si de constanta de formare a complecsilor protonici HiZ ai complexului respectiv.
Alegerea indicatorului in titrarea complexometrica se face dupa aceleasi criterii ca la titrarea de neutralizare.
Acest tip de determinare are o larga aplicabilitate pentru dozarea: Mg, Ca, Pb, Fe, Ni, Co, Cu, Al, Cr, Ba, Hg si chiar Na, K.
Copyright © 2024 - Toate drepturile rezervate