 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Schimbarea starilor de agregare
Exista trei stari de agregare:
Solida
Lichida
Gazoasa
A patra stare de agregare este plasma.
Aceste proprietati sunt datorate interactiunilor dintre moleculele corpurilor.
La presiune normala, schimbarea starii de agregare a unui corp are loc prin schimb de caldura intre corp si mediul inconjurator. Moleculele unui corp aflat la o anumita temperatura efectueaza o miscare de oscilatie in jurul unor pozitii de echilibru, pozitii determinate de interactiunile dintre molecule. Prin absorbtie de caldura din exterior se modifica atat energia cinetica medie cat si energia lor potentiala. Atat timp cat corpul ramane in stare solida, modificarea energiei potentiale este mult mai mica decat modificarea energiei cinetice. Acest fapt are ca urmare cresterea temperaturii corpului, caldura absorbita fiind data relatia:
Q=mcsolid(tfinal - tinitial)
Dupa absorbtia intregii calduri necesare starii de agregare solidul se transforma in lichid.
Topirea si solidificarea
Procesul de trecere a unui corp din faza solida in faza lichida se numeste topire. Procesul invers se numeste solidificare.
Din punct de vedere a structurii lor, corpurile se impart in doua categorii: amorfe si cristaline. Topirea corpurilor amorfe (sticla, ceara, smoala)nu are loc la o temperatura constanta, ci pe un interval de temperatura. Mai intai corpul se inmoaie si apoi devine o pasta vascoasa, ca mai apoi, la o temperatura mai mare, sa devina lichid cu vascozitate mica.
La topirea corpurilor cristaline se constata ca temperatura ramane constanta, daca presiunea nu se modifica (Figura 6).
Variatia temperaturii de topire cu presiunea este data de aceeasi ecuatie Clapeyron-Clausius (8), care aplicata la procesul de topire-solidificare, pentru 1 kmol, devine
![]() , (18)
, (18)
unde Lmt reprezinta caldura latenta kilomolara de topire, iar Vml si Vms sunt volumele kilomolare ale lichidului, respectiv solidului.

Figura 6 Figura 7 Figura 8
Sublimarea si desublimarea
Trecerea substantei solide direct in vapori se numeste sublimare, iar procesul invers, desublimare. De exemplu, naftalina, camforul, iodul, sulful, bromul, la temperaturi si presiuni obisnuite se vaporizeaza fara a se topi. In principiu, orice substanta poate sublima, doar ca la unele presiunea de vapori este mica. Daca vaporii proveniti din procesul de sublimare sunt in echilibru dinamic cu solidul din care au provenit, ei se numesc vapori saturanti.
Ecuatia Clapeyron-Clausius (8) pentru procesul de sublimare este
![]() , (20)
, (20)
care devine, ca si in cazul vaporizarii, de forma
![]()
Vaporizarea si condensarea
Trecerea unei substante din faza lichida in faza de vapori se numeste vaporizare. Exista mai multe modalitati de vaporizare a unui lichid in functie de conditiile in care se face experimentul: vaporizare in vid, in atmosfera gazoasa, la suprafata lichidului si vaporizarea in toata masa lichidului.
Cantitatea de caldura necesara pentru a vaporiza la temperatura constanta o unitate de masa dintr-un lichid se numeste caldura latenta specifica de vaporizare
![]() .
.
Vaporizarea in vid
Introducind pe rand mici cant
itati dintr-un lichid (de exemplu eter) in camera barometrica (Figura 1) se constata ca vaporizarea in vid se face instantaneu si presiunea creste (inaltimea coloanei de mercur scade) pana cand apar vaporii saturanti, adica lichidul ramane deasupra mercurului fara sa se mai evapore, presiunea atingind o valoare maxima si constanta, pentru temperatura experimentului, numita presiunea vaporilor saturanti.
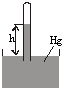
Figura 1
Experimentele au aratat ca proprietatile vaporilor saturanti sunt:
Presiunea vaporilor saturanti la o temperatura data reprezinta presiunea de echilibru (dinamic) care se exercita asupra suprafetei unui lichid in contact cu vaporii sai.
Presiunea vaporilor saturanti este mai mare decat presiunea vaporilor nesaturanti la o temperatura data. De aceea, ea mai este numita presiune maxima, pm.
Presiunea vaporilor saturanti nu depinde nici de cantitatea fazei lichide, nici de cantitatea de vapori, creste cu temperatura si depinde de natura lichidului (a vaporilor).
Copyright © 2024 - Toate drepturile rezervate