 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
![]() Universitatea
"Transilvania"
Universitatea
"Transilvania"
Catedra de Chimie
STUDIUL TERMODINAMIC AL REACTIEI
DE OXIDARE A MONOXIDULUI DE CARBON
Raport Stiintific
1. Introducere
Chimia fizica este ramura chimiei care stabileste si dezvolta legile ce explica si interpreteaza fenomenele descoperite in celelalte domenii ale chimiei. Domeniul de cercetare in cadrul chimiei fizice cuprinde studierea mecanismelor si a proceselor chimice, dependenta acestora de factorii externi, stabilirea mecanismelor si proceselor fizico-chimice de imobilizare, oxidare catalitica, oxidare cu compusi chimici, proceselor termodinamice si termochimice de descompunere si de formare a compusilor chimici, stabilirea chimiei suprafetei a proprietatilor corpurilor solide etc.
Termodinamica studiaza din punct de vedere energetic proprietatile generale ale substantelor si legile care guverneaza miscarea termica, fara a se tine seama de natura miscarilor si interactiilor moleculare.
Termodinamica chimica este o ramura a Chimiei Fizice, care se ocupa cu caracterizarea, din punct de vedere energetic, a proceselor fizico-chimice a sistemelor, cu determinarea probabilitatii de reactie a substantelor, a constantelor de material si stabileste metodele de determinare a caracteristicilor termice ale substantelor.
In acest raport stiintific urmarim scopul deducerii posibilitatilor de formare a unui anumit compus prin determinarea unor marimi energetice, potentiale termodinamice si constante de echilibru.
Ecuatia de reactie propusa pentru realizarea studiului termodinamic in aceasta lucrare este reactia de oxidare a monoxidului de carbon cu formare de dioxid de carbon:
CO(g) +![]() O2(g) ↔ CO2(g)
O2(g) ↔ CO2(g) ![]()
2CO(g) +O2(g) ↔ 2CO2(g)
2. Date termodinamice necesare studiului
Tabelul 1.
Date termodinamice pentru CO, O2, CO2 [1]
|
Nr. crt. |
Substanta |
∆H |
S |
C |
||
|
cal/mol∙K |
||||||
|
kcal/mol |
cal/mol∙K |
a |
b∙10 |
c∙10 |
||
|
CO |
-26,41 |
47,18 | ||||
|
2. |
O2 |
49,00 |
0,81 | |||
|
3. |
CO2 |
-94,05 |
51,06 |
2,16 | ||
3. Transformarea temperaturilor de tranzitie de faza (de topire, de
fierbere) ale substantelor principale din procesul studiat in toate
scarile termodinamice
La transformarea temperaturilor ne vom folosi de urmatoarea relatie :
10C = 1K = ![]() 0Re =
0Re = ![]() 0F =
0F = ![]() 0R.
0R.
Tinand cont de translatia de axe, putem scrie:
T(K) = T(0C) + 273,15 (1)
T(0Re)
= ![]() T(0C) (2)
T(0C) (2)
T(0F)
= ![]() T(0C) + 32 (3)
T(0C) + 32 (3)
T(0R)
= ![]() T(0C) + 491,67 (4)
T(0C) + 491,67 (4)
Unde: T(K), T(0C), T(0Re), T(0F), T(0R) - tempraturile in scarile
termodinamice: Kelvin, Celsius, Reaumur, Farenheit, Rankin.
Tabelul 2.
Transformarea temperaturilor de tranzitie de faza ale
|
Nr. Crt. |
Subst. |
Temperatura |
Scari termodinamice de temperatura |
||||
|
0C |
0Re |
0F |
0R |
K |
|||
|
1. |
CO |
ttopire |
-199 |
74,15 |
|||
|
tfierbere | |||||||
|
2. |
O2 |
ttopire |
-218,4 |
-174,72 |
54,75 |
||
|
tfierbere |
-182,96 |
-146,36 |
162,34 |
90,19 |
|||
|
3. |
CO2 |
ttopire |
-56,6 |
389,79 | |||
|
tfierbere |
-78,5 |
350,37 | |||||
substantelor procesului studiat din 0C in celelalte scari termodinamice
4. Aprecieri asupra stabilitatii compusilor principali in comparatie cu alti compusi ai aceluiasi element
Indicatii asupra
stabilitatii compusilor chimici deducem in urma evaluarii
valorii entalpiei de formare. O substanta este stabila daca
aceasta s-a format printr-un proces exoterm - ∆H![]() < 0 - si este instabila in cazul in care
substanta s-a format printr-un proces endoterm - ∆H
< 0 - si este instabila in cazul in care
substanta s-a format printr-un proces endoterm - ∆H![]() > 0.
> 0.
Observam astfel urmatoarele cazuri :
∆H![]() > 0
> 0 ![]() sistem instabil
termodinamic;
sistem instabil
termodinamic;
∆H![]() < 0
< 0 ![]() sistem stabil
termodinamic.
sistem stabil
termodinamic.
Daca
realizam o scala a stabilitatii atunci substantele
cele mai stabile vor avea valoarea lui ∆H![]() cat mai departata de zero pe scala negativa.
cat mai departata de zero pe scala negativa.
Tabelul 3.
Entalpiile de formare standard a unor compusi ai C [1]
|
Nr. crt. | |||
|
Substanta |
CO(g) |
CO2(g) |
CS2(g) |
|
∆H | |||
|
kcal/mol |
Asadar,
in urma compararii valorilor din Tabelul 3., concluzionam ca cel
mai stabil compus este CO2 , deoarece
are valoarea lui ∆H![]() cea
mai departata de zero, pe scala negativa, comparativ cu valorile
∆H
cea
mai departata de zero, pe scala negativa, comparativ cu valorile
∆H![]() ale celorlalti compusi.
ale celorlalti compusi.
5. Calcularea entalpiei standard de reactie
Entalpia de formare reprezinta cantitatea de caldura cedata, sau acceptata, la formarea unui mol de substanta din elemente in stare standard. Prin conventie entalpia de formare a elementelor in stare standard se considera zero.
Entalpiile de formare sau caldurile de formare in stare standard ajuta la determinarea caldurii de reactie in stare standard :
∆H![]() =
= ![]() produsi -
produsi - ![]() reactanti
reactanti
in care:
∆H![]() - entalpia de reactie in conditii standard,
[kcal];
- entalpia de reactie in conditii standard,
[kcal];
![]() produsi -
entalpia de formare standard a produsilor, [kcal/mol];
produsi -
entalpia de formare standard a produsilor, [kcal/mol];
![]() reactanti - entalpia de
formare standard a reactantilor, [kcal/mol];
reactanti - entalpia de
formare standard a reactantilor, [kcal/mol];
![]() ,
, ![]() -
coeficienti stoechiometrici.
-
coeficienti stoechiometrici.
H![]() =
= ![]() CO
CO![]() - (
- ( ![]() CO(g) +
CO(g) +![]() O
O![]() ) = - 94,05 - (-26,41) = -67,64 kcal
) = - 94,05 - (-26,41) = -67,64 kcal
6. Calcularea entropiei standard de reactie
Entropia este o marime energetica cu scopul de a caracteriza evolutia proceselor din natura.
Entropiile de formare sunt variatii de entropii care insotesc reactia de formare a unui mol de substanta din elementele in stare standard.
In cazul unei reactii chimice , variatia standard de entropie este data de relatia:
∆S![]() =
= ![]() ,produsi -
,produsi - ![]() ,reactanti
,reactanti
∆S![]() - entropia
de reactie [cal/mol∙K];
- entropia
de reactie [cal/mol∙K];
![]() ,produsi -
entropiile standard de formare a produsilor [cal/mol∙K
,produsi -
entropiile standard de formare a produsilor [cal/mol∙K
![]() ,reactanti -
entropiile standard de formare a reactantilor [cal/mol∙K
,reactanti -
entropiile standard de formare a reactantilor [cal/mol∙K
![]() ,
, ![]() -
coeficienti stoechiometrici.
-
coeficienti stoechiometrici.
∆S![]() =
= ![]() CO
CO![]() - (
- (![]() CO +
CO + ![]() O
O![]() ) = 51,06 - ( 47,18 + 49 ) = - 45,12 cal/K
) = 51,06 - ( 47,18 + 49 ) = - 45,12 cal/K
Aprecieri calitative asupra variatiei entropiei de reactie in conditii standard
Entropia are o anumita semnificatie fizica, si anume ca variatia ei este data de starea de dezordine a particulelor.
Starea de dezordine este diferita in functie de starea fizica a sistemului respectiv:
Ssolid << Slichid < Sgaz
Orice sistem se transforma in sensul in care ii asiguram un ∆S maxim.
In functie de valoarea entropiei, ne confruntam cu cazurile :
∆S > 0 ![]() conditie
termodinamica de spontaneitate a unui proces
conditie
termodinamica de spontaneitate a unui proces
fizico-chimic in sistem izolat;
∆S < 0 ![]() proces imposibil din
punct de vedere termodinamic in sisteme
proces imposibil din
punct de vedere termodinamic in sisteme
izolate;
∆S = 0 ![]() proces de echilibru.
proces de echilibru.
Astfel, pentru reactia de
oxidare a monoxidului de carbon cu ∆S![]() = - 45,12 cal/K este valabila conditia
termodinamica de spontaneitate a transformarii.
= - 45,12 cal/K este valabila conditia
termodinamica de spontaneitate a transformarii.
8. Calcularea energiei libere Gibbs in conditii standard
Energia libera Gibbs face parte din potentialele termodinamice prin analogie cu energia potentiala din mecanica. Acestea sunt functii de minim, adica sistemul se afla in echilibru atunci cand valoarea potentialului este nula. Procesele se desfasoara spontan in sensul diminuarii potentialelor termodinamice.
Energia libera Gibbs se utilizeaza pentru caracterizarea proceselor izobare, atunci cand presiunea este constanta.
Se poate calcula in functie de entalpia si entropia de reactie in stare standard:
∆G![]() = ∆H
= ∆H![]() T∆S
T∆S![]()
∆G![]() - energia libera Gibbs de reactie;
- energia libera Gibbs de reactie;
∆H![]() - entalpia
de reactie in conditii standard
- entalpia
de reactie in conditii standard
∆S![]() - entropia
de reactie in conditii standard.
- entropia
de reactie in conditii standard.
∆G![]() ∙10-3 = - 54,19 kcal
∙10-3 = - 54,19 kcal
9. Aprecieri asupra spontaneitatii reactiei in sistem izolat/neizolat
Dintre principiile Termodinamicii, cel de-al doilea stabileste sensul de desfasurare
spontana al unei transformari, in sistem izolat. Sensul transformarii spontane decurge
intotdeauna de la entropie mica la entropie mare.
O variatie de entropie negativa caracterizeaza un proces imposibil, din punct de vedere
termodinamic, in sisteme izolate; pentru ca procesul fizic sa fie spontan, variatia de
entropie trebuie sa fie pozitiva.
Deoarece valoarea lui ∆S![]() , corespunzatoare
reactiei in studiu, este una pozitiva putem
, corespunzatoare
reactiei in studiu, este una pozitiva putem
concluziona ca reactia de formare a dioxidului de carbon este una posibila in sistem
izolat.
In sistemele neizolate se tine seama de valoarea potentialelor termodinamice in timpul transformarii, mai precis de variatia energiei libere Gibbss:
![]() <0
<0 ![]() procesul decurge
spontan;
procesul decurge
spontan;
![]() >0
>0 ![]() process imposibil;
process imposibil;
![]() =0
=0 ![]() procesul atinge starea
de echilibru termodinamic.
procesul atinge starea
de echilibru termodinamic.
Relatia (7), a energiei libere Gibbs, ne ajuta la determinarea domeniului de temperatura in care procesul este spontan in functie de valorile gasite pentru entalpie si entropie, avand astfel combinatiile:
∆H
>0, ∆S
>0 ![]() procesul este spontan
la temperatura ridicata;
procesul este spontan
la temperatura ridicata;
∆H >0, ∆S<0 ![]() proces imposibil;
proces imposibil;
∆H <0, ∆S >0 ![]() proces spontan pentru orice temperatura;
proces spontan pentru orice temperatura;
∆H <0, ∆S <0 ![]() process spontan pentru temperatura scazuta.
process spontan pentru temperatura scazuta.
In cazul de fata ∆H <0, iar ∆S >0 ceea ce semnifica ca reactia de oxidare a carbonului
decurge spontan pentru orice temperatura in sistem neizolat.
10. Calculul afinitatii de reactie in conditii standard
Prin definitie, afinitatea este egala cu variatia energiei libere Gibbs cu semn schimbat.
Afinitatea s-a introdus pentru a nu se lucra cu valori negative.
A![]() = - ∆G
= - ∆G![]() (8)
(8)
A![]() = - (- 54,19) = 54,19 kcal
= - (- 54,19) = 54,19 kcal
11. Determinarea entalpiei de reactie in functie de temperatura
Pentru a determina dependentele de temperatura a marimilor energetice si a potentialelor
termodinamice va trebui sa determinam, mai intai, capacitatea calorica molara.
Capacitatea calorica molara reprezinta cantitatea de caldura necesara unui mol de
substanta pentru a-si creste temperatura cu un centigrad.
Pentru substante anorganice, capacitatea calorica molara, sau caldura specifica, se
calculeaza astfel:
c![]() = a + bT +
= a + bT + ![]() (9)
(9)
Relatia (9) se inlocuieste in relatia:
∆H![]() =
= ![]() dT (10)
dT (10)
∆H![]() =
= ![]() =
= ![]() + IH (11)
+ IH (11)
unde IH -
![]() =
= ![]() - (
- (![]() +
+ ![]() ) = 10,55 - ( 6,79 + 7,52 ) = - 3,76
) = 10,55 - ( 6,79 + 7,52 ) = - 3,76
![]() =
= ![]() - (
- (![]() +
+ ![]() ) = 2,16 ∙ 10-3 - ( 0,11 + 0,81 ) ∙ 10-3 = 1,24 ∙ 10-3
) = 2,16 ∙ 10-3 - ( 0,11 + 0,81 ) ∙ 10-3 = 1,24 ∙ 10-3
![]() =
= ![]() - (
- (![]() +
+ ![]() ) = -2,04 ∙ 105 - ( - 0,11 - 0,90 ) ∙
105 = - 1,03 ∙ 105
) = -2,04 ∙ 105 - ( - 0,11 - 0,90 ) ∙
105 = - 1,03 ∙ 105
Pentru determinarea constantei de
integrare ![]() se calculeaza
relatia (11) in conditii standard: 1 atm si 298 K.
se calculeaza
relatia (11) in conditii standard: 1 atm si 298 K.
∆H![]() =
= ![]() + IH
+ IH
IH = ∆H![]() -
-![]() =
=
= -67,64 ∙103
+ 3,76 ∙298 - 1,24 ∙ 10-3
∙![]() - 1,03 ∙ 105 ∙
- 1,03 ∙ 105 ∙![]() = - 66920,22 cal
= - 66920,22 cal
IH = - 66,92 kcal
Entalpia de reactie in functie de temperatura corespunzatoare oxidarii monoxidului de carbon este :
∆H![]() =
= ![]() - 66,92
- 66,92
12.Determinarea dependentei entropiei de reactie in functie de temperatura
Pentru o reactie, entropia la o anumita temperatura este data de ecuatia:
∆S![]() =
= ![]() + IS (12)
+ IS (12)
Impunem conditiile standard - 1 atm,
298 K - ecuatiei (12) si determinam ![]() :
:
∆S![]() =
= ![]() + IS
+ IS
IS = ∆S![]() -
-![]() =
=
= -45,12 + 3,76∙5,69 - 1,25∙10-3∙298 - 1,03∙105∙![]() = -24,67 cal
= -24,67 cal
Entalpia de reactie in functie de temperatura corespunzatoare oxidarii carbonului este :
∆S![]() =
= ![]() - 24,67
- 24,67
13. Determinarea dependentei energiei libere Gibbs in functie de temperatura.
Pentru a determina dependenta de temperatura a energiei libere Gibbs, trebuie sa calculam:
![]()
![]() = −
= − ![]() (
( ![]() + IH ) =
+ IH ) = ![]() −
−![]()
∆G![]() =
= ![]() + IH +IG
∙T (14)
+ IH +IG
∙T (14)
Impunem conditiile
standard - 1 atm si 298 K - si determinam ![]() :
:
∆G![]()
![]() + IH +IG ∙298
+ IH +IG ∙298
IG
= ![]()
![]()
![]()
= ![]()
![]()
![]()
![]()
![]() ∙103 = - 69,3 cal
∙103 = - 69,3 cal
Dependenta energiei libere Gibbs in functie de temperatura corespunzatoare reactiei noastre este:
∆G = ![]() - 66,92 ∙103 - ∙T
- 66,92 ∙103 - ∙T
14. Particularizarea si trasarea graficelor dependentelor functiilor termodinamice pentru temperaturi de 300, 400, 800, si 1500 K
Pentru 300K
∆H![]()
![]() + IH =
+ IH =
![]()
![]() − 66,92∙103 = - 67648,87 cal
− 66,92∙103 = - 67648,87 cal
∆H![]() = − 67,65 kcal
= − 67,65 kcal
S![]()
![]() + IS =
+ IS =
![]() - 24,67
- 24,67
∆S![]() = - 45,16 cal/K
= - 45,16 cal/K
∆G![]() =
= ![]() + IH +IG
∙300 =
+ IH +IG
∙300 =
= ![]() -66,92∙103 -69,3 ∙300 = − 81164,53 cal
-66,92∙103 -69,3 ∙300 = − 81164,53 cal
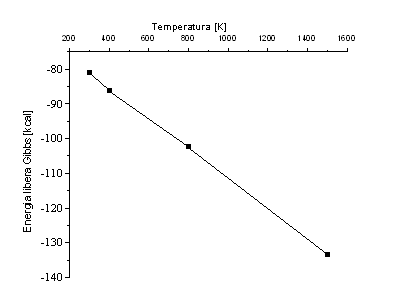
∆G![]() = − 81,16 kcal
= − 81,16 kcal
Pentru 400K
∆H![]()
![]() + IH =
+ IH =
![]()
![]() − 66,92∙103 = −68067,3
cal
− 66,92∙103 = −68067,3
cal
∆H![]() = −68,07 kcal
= −68,07 kcal
∆S![]()
![]() + IS =
+ IS =
![]()
∆S![]() = - 46,37 cal/K
= - 46,37 cal/K
∆G![]()
![]() + IH +IG ∙400 =
+ IH +IG ∙400 =
![]() -66,92∙103 -69,3 ∙400 = −85601,49 cal
-66,92∙103 -69,3 ∙400 = −85601,49 cal
∆G![]() = −85,60 kcal
= −85,60 kcal
Pentru 800K
∆H![]()
![]() + IH =
+ IH =
![]()
![]() − 66,92∙103 = −69659,95
cal
− 66,92∙103 = −69659,95
cal
∆H![]() = −69,66 kcal
= −69,66 kcal
S![]()
![]() + IS =
+ IS =
![]()
∆S![]() = - 48,97 cal/K
= - 48,97 cal/K
∆G![]() =
= ![]() + IH +IG
∙800 =
+ IH +IG
∙800 =
= ![]() -66,92∙103 -69,3 ∙800 = − 102598,985 cal
-66,92∙103 -69,3 ∙800 = − 102598,985 cal
∆G![]() = − 102,60 kcal
= − 102,60 kcal
Pentru 1500K
∆H![]()
![]() + IH =
+ IH =
![]()
![]() − 66,92∙103 = −71096,33
cal
− 66,92∙103 = −71096,33
cal
∆H![]() = −71,1 kcal
= −71,1 kcal
S![]()
![]() + IS =
+ IS =
![]()
∆S![]() = −50,27 cal/K
= −50,27 cal/K
∆G![]() =
= ![]() + IH +IG
∙1500 =
+ IH +IG
∙1500 =
=![]() −66,92∙103 −69,3 ∙1500 =−131002,26 cal
−66,92∙103 −69,3 ∙1500 =−131002,26 cal
∆G![]() = −131 kcal
= −131 kcal
Dependentele de temperatura a potentialelor termodinamice au fost calculate pentru 1 mol de substanta. In continuare acestea se vor determina pentru 200 kg de substanta principala, motiv pentru care calculam, pentru inceput, numarul de moli corespunzator, urmand ca apoi sa determinam dependentele de temperatura a potentialelor termodinamice specifice cantitatii cerute.
Formula necesara aflarii numarului de moli este urmatoarea:
![]() (15)
(15)
in care ![]() - numarul de moli [kmoli] ;
- numarul de moli [kmoli] ;
![]() - cantitatea de
sunstanta [kg] ;
- cantitatea de
sunstanta [kg] ;
![]() - masa
moleculara.
- masa
moleculara.
Substanta principala in acest caz este dioxidul de carbon; deoarece masa moleculara
![]() = 88,02 , atunci numarul de moli este
= 88,02 , atunci numarul de moli este ![]() = 2,27
kmoli .
= 2,27
kmoli .
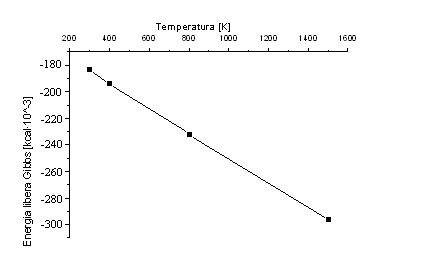
Tabelul 4.
Dependenta de temperatura a entalpiei, entropiei si a energiei libere Gibbs
|
Temp. [K] |
∆H [kcal] |
∆S [cal/K] |
∆G [kcal] |
|||
|
1 mol |
200 kg |
1 mol |
200 kg |
1 mol |
200 kg |
|
Pentru 1 mol
Dependenta entalpiei in functie de temperatura

Dependenta entropiei in functie de temperatura
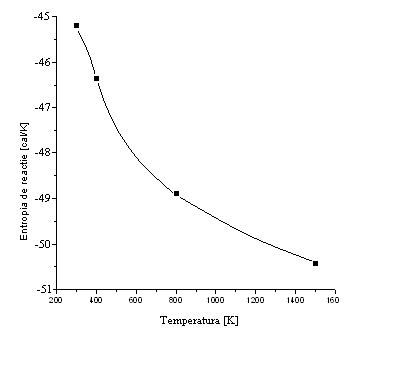
Dependenta energiei libere Gibbs in functie de temperatura
Pentru 200kg
Dependenta entalpiei in functie de temperatura

Dependenta entropiei in functie de temperatura
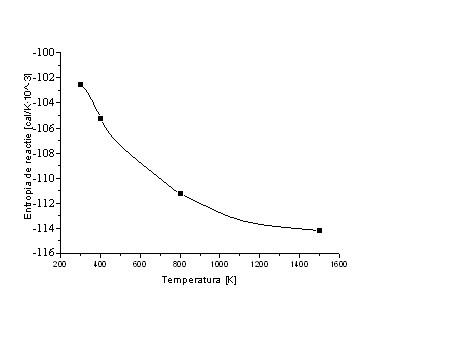
Dependenta energiei libere Gibbs in functie de temperatura
15.Determinarea constantelor de echilibru in conditii standard : Kx, Kc, Kp
Starea de echilibru chimic poate fi definita ca o stare de aparenta netransformare a sistemului in care parametrii macroscopici raman constanti, adica compozitia sistemului, temperatura si presiunea.
In mod real, echilibrul chimic este o stare dinamica in care se produce transformarea in sensul direct de reactie, si in sens invers cu viteze egale.
Echilibrul chimic este caracterizat din punct de vedere cantitativ prin constanta de echilibru, care este definita ca raportul dintre produsul concentratiilor produsilor si produsul concentratiilor reactantiilor, fiecare ridicat la o putere egala cu coeficientul stoechiometric.
In functie de parametrii termodinamici, constantele de echilibru se pot obtine din relatia:
∆G![]() = −R∙T∙lnkp (16)
= −R∙T∙lnkp (16)
kp = ![]()
kc = ![]()
kx = ![]()
unde : ∆n - variatia numarului de moli in timpul reactiei;
R - constanta universala a gazelor;
T - temperatura;
p - presiunea.
∆n = 1-1-1 = -1
kp
= ![]()
![]()
kp = 1,32
kc =
![]()
kx = 1,32
16.Concluzii
Studiul termodinamic al reactiei de oxidare a monoxidului de carbon ne dezvaluie: o stabilitate buna a compusului principal, faptul ca reactia decurge spontan la orice temperatura, avand loc atat in sistem izolat, cat si neizolat.
Constantele de echilibru au scos in evidenta randamentul reactiei, deoarece cu cat valoarea acestora este mai mare, cu atat concentratiile produsilor de reactie in sistem sunt mai mari, astfel randamentul de reactie este mai mare.
17. Bibliografie
1. Gavril Niac : Formule, Tabele si Probleme de Chimie Fizica, Editura Dacia Cluj- Napoca, 1984, pag.119-122;
2. Silvia Patachia: Curs de chimie fizica, Reprografia Universitatii "Transilvania" Brasov, 1994.
3. Silvia Patachia - Ghid pentru realizarea si prezentarea unui raport stiintific in chimie, Editura Lux Libris Brasov, 1999;
Copyright © 2024 - Toate drepturile rezervate