 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
REACTII CU TRANSFER DE PROTONI
1. Notiuni introductive
2. Teoria protolitica a acizilor si bazelor
3. Exponent de aciditate (pKa) si exponent de bazicitate (pKb)
4. Amfoliti acido-bazici
5. pH-ul solutiilor apoase
6. Reactia de neutralizare. Tittrari acido-bazice
7. Solutii tampon in sistemele biologoce
1. INTRODUCERE
acid < lat. acidus = acru
baze = alcalii < arab. al kalium = cenusa de plante
Acizii si bazele reprezinta doua clase de compusi cu importanta deosebita in viata cotidiana, in procesele biologice si in industrie.
Acizii si bazele sunt implicate in numeroase reactii chimice. De exemplu, echilibrul acido-bazic in plante si animale reprezinta un factor critic pentru sanatatea si existenta acestora. Unele plante pot creste in soluri alcaline (bazice), in timp ce altele necesita soluri acide.
De asemenea, acizii si bazele sunt foarte importante in industrie: anual sunt consumate cantitati foarte mari de H2SO4, HCl, NaOH, NH3 etc., intr-o mare varietate de sinteze chimice. De exemplu, produsele utilizate pentru curatenie (sapunuri, detergenti, dezinfectanti lichizi si prafuri de curatat, spray-uri s.a.) contin sau sunt obtinute din acizi si baze.
ACIZII
sunt substante compuse care contin atomi de H si un radical acid
au gust acru
sunt solubili in apa (cei anorganici)
conduc curentul electric in solutie apoasa (sunt electroliti), deoarece disociaza in solutie apoasa
inrosesc turnesolul si nu modifica culoarea fenolftaleinei
reactioneaza cu metale active (Na, K, Ca, Mg) formand saruri, cu degajare de H2
se neutralizeaza cu baze/oxizi bazici formand saruri
se pot clasifica in:
© hidracizi: HCl (acid clorhidric), HF (acid fluorhidric), HBr (acid bromhidric), HI (acid iodhidric), H2S (acid sulfhidric), HCN (acid cianhidric) etc.
© oxiacizi: H2SO4 (acid sulfuric), H2SO3 (acid sulfuros), HNO3 (acid azotic), HNO2 (acid azotos), H3PO4 (acid fosforic), H3PO3 (acid fosforos), H2CO3 (acid carbonic), HClO4 (acid percloric) etc.
¢ acizi tari: HCl, HClO4, HNO3
¢ acizi slabi: HCN, H2CO3, H2S
¤ acizi anorganici: HCl, HF, HBr, HI, H2S, HCN, H2SO4, H2SO3, HNO3, HNO2, H3PO4, H3PO3, H2CO3, HClO4 etc.
¤ acizi organici: acidul acetic (in otet), acidul formic (in formol), acidul citric, acidul acetilsalicilic (aspirina), acidul benzoic, acidul maleic, acidul malic etc.
® acizi monoprotici: HF, HCl, HBr, HI, HCN, HNO3, HNO2 etc.
® acizi diprotici: H2S, H2SO4, H2SO3, H2CO3 etc.
® acizi triprotici: H3PO4, H3PO3 etc.
BAZELE (hidroxizi sau alcalii)
sunt compusi care contin metal si grupe hidroxid (OH)
sunt caustice (ex. NaOH, KOH)
conduc curentul electric in solutie apoasa (sunt electroliti), deoarece disociaza in solutie apoasa
albastresc turnesolul si inrosesc fenolftaleinase neutralizeaza cu acizi/oxizi acizi formand saruri
scot bazele mai slabe din sarurile lor
se pot clasifica astfel:
© solubile in apa: NaOH (hidroxid de sodiu), KOH (hidroxid de potasiu), Mg(OH)2 (hidroxid de magneziu) etc.
© insolubile in apa: Al(OH)3 (hidroxid de aluminiu), Fe(OH)3 (hidroxid de fier III), Zn(OH)2 (hidroxid de zinc) etc
¢ baze tari: NaOH, KOH, Mg(OH)2
¢ baze slabe: NH3 (amoniac), Al(OH)3
¤ anorganice: NaOH, KOH, Mg(OH)2, Al(OH)3, Fe(OH)3, Zn(OH)2, NH3
¤ organice: CH3 - NH2 (metilamina), C6H5 - NH2 (fenilamina sau anilina), (CH3 - CH2)2NH2 (dietilamina), (CH3)3N (trimetilamina)
TEORII ASUPRA ACIZILOR SI BAZELOR
Se cunosc trei teorii care incearca sa precizeze continutul notiunilor chimice "acid" si "baza".
Ø Teoria disociatiei electrolitice (Svante Arrhenius, 1887)
Acizii sunt substante care elibereaza prin
disociere in solutie apoasa ioni H+: HA ![]() A- + H+.
A- + H+.
Bazele sunt substante care elibereaza in solutie apoasa ioni HO-:
BOH ![]() B+ + HO-.
B+ + HO-.
Aceasta teorie este aplicabila numai solutiilor apoase si limiteaza notiunea de baza la substante care contin in molecula lor grupa OH. Conform acestei teorii, nu se poate explica, de exemplu, caracterul bazic al amoniacului.
Ø Teoria protolitica (J. N. Brönsted si Lowry, 1923)
Acizii sunt specii chimice (molecule sau ioni) capabile sa cedeze protoni (H+), iar bazele sunt specii chimice capabile sa accepte protoni:
HA ![]() A- + H+ B
+ H+
A- + H+ B
+ H+ ![]() BH+
BH+
acid baza
Protonul nu poate exista ca atare si de aceea un acid cedeaza protoni numai in prezenta unei baze care sa il accepte. Drept urmare, o reactie cu schimb de protoni presupune un sistem dublu conjugat:
HA
+ B ![]() A- + BH+
A- + BH+
a1 b2 b1 a2
Ø Teoria electronica (G.N. Lewis, 1923)
Acizii
sunt substante capabile sa accepte o pereche de electroni, iar bazele sunt
substante capabile sa ofere o pereche de electroni. De exemplu, in reactia AlCl3
+ Cl2 ![]() [AlCl4]-Cl+,
AlCl3 este un acid, iar Cl- este o
baza.
[AlCl4]-Cl+,
AlCl3 este un acid, iar Cl- este o
baza.
Conform acestei teorii, multe reactii din chimia organica si din chimia combinatiilor complexe pot fi considerate ca reactii intre acizi si baze.
2. TEORIA PROTOLITICA A ACIZILOR SI BAZELOR
A fost elaborata de chimistul danez Johannes Bronsted si de chimistul englez Thomas Lowry, in 1923, definitiile bazandu-se pe transferul de protoni.
ACIZII - sunt specii chimice (ioni sau molecule) capabile sa cedeze protoni (H+) in solutie apoasa.
In molecula unui acid, atomul de H este legat de un atom de nemetal printr-o legatura covalenta polara. In general, taria unui acid HA este influentata de polaritatea si taria legaturii hidrogen - nemetal si de stabilitatea anionului A-: cu cat legatura hidrogen - nemetal este mai polara si mai slaba si cu cat anionul A- este mai stabil, cu atat acidul HA este mai tare.
Acizii foarte tari cedeaza usor protoni si ionizarea lor la dizolvarea in apa este, practic, totala:
HA + H2O → A- + H3O+
Acizii slabi cedeaza greu protoni si ionizeaza putin in solutie apoasa, reactia fiind reversibila:
HA + H2O
![]() A- + H3O+
A- + H3O+
Dupa numarul protonilor transferati, acizii pot fi:
Ø acizi monoprotici (monobazici)
Ø acizi poliprotici (polibazici)
Acizii poliprotici cedeaza protonii in trepte, de exemplu:
H2CO3
+ H2O ![]() HCO3-
+ H3O+
HCO3-
+ H3O+
acid carbonic apa hidrogenocarbonat ion hidroniu
HCO3- + H2O ![]() CO32-
+ H3O+
CO32-
+ H3O+
carbonat
BAZELE - sunt specii chimice (ioni sau molecule) capabile sa accepte protoni (H+) in solutie apoasa.
O baza prezinta la unul dintre atomii sai o pereche de electroni neparticipanti la legatura, pe care se poate fixa un proton (H+) printr-o legatura covalenta coordinativa.
Bazele tari (de exemplu hidroxizii metalelor alcaline) accepta usor protoni si disociaza total in solutie apoasa:
NaOH → Na+ + HO- (ion hidroxil)
Bazele slabe accepta greu si ionizeaza putin in solutie apoasa, reactia fiind reversibila:
B + H2O
![]() BH+ + HO-
BH+ + HO-
Bzele se pot clasifica, dupa numarul protonilor acceptati (dupa numarul gruparilor HO-), in
Ø baze monoacide
Ø acizi poliacide.
Acizi conjugati si baze conjugate
Orice acid, prin cedare de protoni, se transforma intr-o specie chimica cu caracter bazic - baza conjugata acidului. Deci unui acid ii corespunde o baza conjugata:
Acid ![]() Baza conjugata + H+
Baza conjugata + H+
Cl- este baza conjugata acidului HCl
NH3 este baza conjugata acidului NH4+
HSO4- este baza conjugata acidului H2SO4
Orice baza, prin acceptare de protoni, se transforma intr-o specie chimica cu caracter acid. Deci fiecarei baze ii corespunde un acid conjugat:
Baza + H+![]() Acid conjugat
Acid conjugat
HCl este acidul conjugat bazei Cl-
Na+ este acidul conjugat bazei NaOH
NH4+ este acidul conjugat bazei NH3
HSO4- este acidul conjugat bazei SO42-
Observatii:
Unui acid tare ii corespunde o baza conjugata slaba, iar unui acid slab ii corespunde o baza conjugata slaba.
Unei baze tari ii corespunde un acid conjugat slab, iar unei baze slabe ii corespunde un acid conjugat tare.
3. EXPONENT DE ACIDITATE (pKa) SI EXPONENT DE BAZICITATE (pKb)
Echilibrul de ionizare a unui acid este caracterizat de constanta de aciditate, care se poate calcula astfel:
HA + H2O ![]() A- + H3O+
A- + H3O+ ![]()
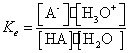 , dar [H2O] = constant =>
, dar [H2O] = constant => 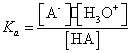
Ke -
Constanta de aciditate este o marime specifica fiecarui acid si se defineste ca fiind raportul dintre produsul concentratiilor speciilor A- si H3O+ si concentratia acidului HA. Acizii tari au Ka>1. Deci un acid este cu atat mai tare cu cat valoarea constantei de aciditate este mai mare.
Aciditatea unei solutii poate fi exprimata si cu ajutorul exponentului de aciditate, pKa, calculat cu relatia:
pKa = - lgKa
Acizii tari au pKa negativ, iar acizii slabi au pKa pozitiv.
Acizii poliprotici ionizeaza in mai multe trepte, fiecare treapta de ionizare fiind caracterizata de o constanta de aciditate.
Exemplu:
H2CO3
+ H2O ![]() HCO3-
+ H3O+ , Ka1 = 4,3·10-7 mol/L, pKa
= 6,37
HCO3-
+ H3O+ , Ka1 = 4,3·10-7 mol/L, pKa
= 6,37
HCO3-
+ H2O ![]() CO32- +
H3O+, Ka2 = 4,8·10-11 mol/L, pKa
= 10,31.
CO32- +
H3O+, Ka2 = 4,8·10-11 mol/L, pKa
= 10,31.
Echilibrul de ionizare a
unei baze este caracterizat prin
B +
H2O ![]() BH+ + HO-
BH+ + HO-
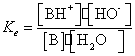 , dar [H2O] = constant =>
, dar [H2O] = constant =>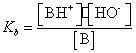 .
.
Bazicitatea unei solutii poate fi exprimata si pri exponentul de bazicitate, pKb:
pKb = - lgKb.
O baza este cu atat mai tare
cu cat
4. AMFOLITI ACIDO - BAZICI. AUTOPROTOLIZA APEI
Unii compusi anorganici sau organici prezinta aspecte structurale care le permit sa se comporte atat ca acizi cat si ca baze: existenta unui atom de H legat covalent polar si existenta unei perechi de electroni neparticipanti la legatura, la unul dintre atomi.
Exemplu:
NH3 + H2O ![]() NH4 + HO- HCl + H2O → Cl- + H3O+
NH4 + HO- HCl + H2O → Cl- + H3O+
Baza Acid Acid Baza Acid Baza Baza Acid
Apa are rol de acid in reactie cu amoniacul (o baza) si de baza in reactia cu acidul clorhidric (un acid).
Substantele care se comporta ca acizi in reactiile cu baze si ca baze in reactiile cu acizii se numesc substante amfotere sau substante amfiprotice sau amfoliti.
Prezinta caracter amfoter: apa, anionii rezultati la ionizarea in prima treapta a unor acizi diprotici, amfionii aminoacizilor, oxizii si hidroxizii unor metale.
a) HS-
+ H2O ![]() S2- + H3O+ b) HOOC - COO- + H3O+
S2- + H3O+ b) HOOC - COO- + H3O+
![]() HOOC - COOH + H2O
HOOC - COOH + H2O
HS- + H3O+
![]() H2S + H2O HOOC - COO- + HO-
H2S + H2O HOOC - COO- + HO-
![]() -OOC - COO-
+ -OOC - COO- + H2O
-OOC - COO-
+ -OOC - COO- + H2O
c) H2SO4 + H2O → HSO4- + H3O+
HSO4- + H2O ![]() SO4- + H3O+
SO4- + H3O+
d) H3N+
- CH2 - COO- + H3O+ ![]() H3N+
- CH2 - COOH + H2O
H3N+
- CH2 - COOH + H2O
H3N+ - CH2
- COO- + HO- ![]() H2N - CH2
- COO- + H2O
H2N - CH2
- COO- + H2O
e) Al2O3 + 6HCl → 2AlCl3 + 3 H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
f) Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
Apa este un amfolit acido-bazic; ea cedeaza protoni in mediu bazic si accepta protoni in mediu acid. Schimbul de protoni poate avea loc si intre moleculele de apa, dar in proportie foarte mica, in cadrul de ionizare a apei (autoprotoliza apei):
H2O + H2O ![]() H3O+
+ HO- sau H2O
H3O+
+ HO- sau H2O![]() H+ + HO-
H+ + HO-
In cazul apei pure ![]() =
=![]() , relatie care arata un mediu neutru din punc de vedere
acido-bazic. Echilibrul de ionizare a apei este caracterizat de
, relatie care arata un mediu neutru din punc de vedere
acido-bazic. Echilibrul de ionizare a apei este caracterizat de
Ke =![]() , dar la echilibru:
, dar la echilibru: ![]() = constant
= constant
Astfel: Ke·![]() 2 =
2 = ![]() => Kw =
=> Kw =![]() , produsul ionic al
apei.
, produsul ionic al
apei.
La 25°C, produsul ionic al apei are valoarea Kw=10-14 mol2/L2.
In functie de concentratia ionilor hidroniu si hidroxil, solutiile pot fi:
- solutii acide: ![]() > 10-7 mol/L si
> 10-7 mol/L si ![]() < 10-7 mol/L
< 10-7 mol/L
- solutii neutre: ![]() =
=![]() =10-7 mol/L
=10-7 mol/L
- solutii bazice: ![]() < 10-7 mol/L si
< 10-7 mol/L si ![]() > 10-7 mol/L.
> 10-7 mol/L.
5. pH-ul SOLUTIILOR APOASE
Aciditatea si bazicitatea unei solutii poate fi exprimata cu ajutorul marimilor pH si pOH:
pH = - lg![]() si pOH = - lg
si pOH = - lg ![]() = pKw - pH
= pKw - pH
pH-ul unei solutii apoase poate fi determinat experimental folosind
hartia de pH
pH-metrul.
Determinarea pH-ului solutiilor de acizi si baze slabe
Acizii tari ionizeaza total in solutie apoasa, iar concentratia ionilor hidroniu este egala cu concentratia initiala a acidului, cHA:
![]() = cHA=> pH = - lg cHA.
= cHA=> pH = - lg cHA.
Bazele tari ionizeaza total in solutie apaosa si concentratia ionilor hidroxil este egala cu concentratia initiala a bazei, cB:
![]() = cB=> pOH = - lg cB, deci pH = pKw
- pOH (pKw = -lgKw).
= cB=> pOH = - lg cB, deci pH = pKw
- pOH (pKw = -lgKw).
Acizii slabi ionizeaza mai greu in solutie apoasa:
HA + H2O ![]() A- + H3O+,
A- + H3O+,
Ka =![]() , dar la echilibru:
, dar la echilibru: ![]() =
= ![]() si
si ![]() =cHA -
=cHA - ![]() , iar Ka devine
, iar Ka devine
Ka = ![]() sau [H3O+]2
+ Ka[H3O+] - KacHA = 0.
sau [H3O+]2
+ Ka[H3O+] - KacHA = 0.
Din ultima ecuatie se poate determina concentratia concentratia ionilor hidroniu:
![]()
Pentru acizii foarte slabi
(Ka<10-5), se neglijeaza termenii ![]() si
si ![]() si concentratia ionilor hidroniu este data de relatia
si concentratia ionilor hidroniu este data de relatia ![]() =
=![]() .
.
Atunci pH = -lg![]() = -lg
= -lg![]() sau pH =
sau pH =![]() .
.
Bazele slabe ionizeaza putin in solutie apoasa:
B + H2O ![]() BH+ + HO-
BH+ + HO-
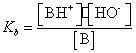 , dar la echilibru:
, dar la echilibru: ![]() =
= ![]() si
si ![]() =cB -
=cB - ![]() , iar Kb devine
, iar Kb devine
Ka = ![]() sau [HO-]2
+ Kb[HO-] - KbcB = 0. Prin urmare
sau [HO-]2
+ Kb[HO-] - KbcB = 0. Prin urmare![]() .
.
Pentru bazele foarte slabe
(Kb<10-5), termenii ![]() si
si![]() se neglijeaza si concentratia ionilor hidroxil devine
se neglijeaza si concentratia ionilor hidroxil devine ![]() =
=![]() .
.
Atunci pOH = -lg![]() = -lg
= -lg![]() , iar pH = pkw - pOH.
, iar pH = pkw - pOH.
Pe de alta parte: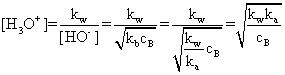 , unde ka este constanta de aciditate a acidului
conjugat bazei B, BH+. Rezulta astfel ca:
, unde ka este constanta de aciditate a acidului
conjugat bazei B, BH+. Rezulta astfel ca:
pH = -lg 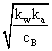 =
=![]() .
.
In functie de valoarea concentratiei ionilor hidroniu, respectiv valoarea pH-ului, solutiile se pot clasifica in:
Ø solutii acide, [H3O+] > 10-7 mol/L si pH < 7
Ø solutii neutre, [H3O+] = [HO-] = 10-7 mol/L si pH = 7
Ø solutii bazice, [H3O+]< 10-7 mol/L si pH > 7
6. REACTIA DE NEUTRALIZARE. TITRARI ACIDO-BAZICE
Una dintre cele mai importante reactii cu transfer de protoni este reactia de neutralizare.
Reactia de neutralizare reprezinta reactia cu schimb de protoni dintre un acid si o baza, cand se formeaza sare si apa.
Exemple:
HCl + NaOH → NaCl + H2O
CH3 - COOH + KOH → CH3 - COOK + H2O
HCl + NH3 → NH4Cl
De obicei se lucreaza cu solutii apoase de acizi si baze. Studiind reactia dintre acidul clorhidric si hidroxidul de sodiu, HCl + NaOH → NaCl + H2O:
in solutia de HCl se afla ionii H3O+ si Cl- rezultati la ionizarea acidului clorhidric la dizolvarea in apa:
HCl + H2O → Cl- + H3O+
in solutia de NaOH se afla ionii Na+ si HO- rezultati din disocierea NaOH la dizolvare in apa:
NaOH
![]() Na+ + HO-.
Na+ + HO-.
Clorura de sodiu, NaCl, rezultata din reactie ramane in solutie sub forma ionilor Na+ si Cl-. Avand in vedere speciile chimice din solutie, ecuatia reactiei de neutralizare este:
H3O+ + Cl- + Na+ + HO- → Na+ + Cl- + 2H2O.
Deoarece ionii Na+ si Cl- nu participa la reactie, fiind "ioni spectatori", ecuatia reactiei este:
H3O++ HO- → 2H2O.
Concluzie: Reactia de neutralizare in solutie apoasa, dintre un acid tare si o baza tare consta in schimbul de protoni dintre ionii hidroniu (H3O+) si ionii hidroxil (HO-) din solutie, cu formare de molecule de apa.
Cantitatea de acid sau de baza dintr-o proba se poate afla determinand experimental cantitatea dintr-o baza, respectiv acid, numite titrant, care neutralizeaza acidul sau baza din proba. Acest demers practic poarta numele de titrare acido-bazica.
Pentru ca o titrare acido-bazica sa conduca la un rezultat cat mai exact, trebuie sa se observe cat mai bine punctul de echivalenta, adica momentul in care toata cantitatea de acid sau de baza din proba a fost neutralizata.
Punctul de echivalenta se determina masurand pH-ul solutiei in timpul titrarii, cu ajutorul pH-metrului. Titrarea se opreste in momentul in care valoarea pH-ului este 7.
In practica obisnuita de laborator, pentru sesizarea punctului de echivalenta se utilizeaza solutia unui indicator acido-bazic: fenolftaleina, turnesol, metiloranj etc. Acesti indicatori acido-bazici sunt compusi organici, cu caracter slab acid sau slab bazic, care prezinta proprietatea de asi schimba culorea odata cu modificarea valorii pH-ului. Schimbarea culorii la indicatorii acido-bazici se datoreaza modificarii structurii moleculelor lor, in functie de caracterul acid sau bazic al solutiei.
Spre exemplu: daca indicatorul folosit la o titrare acido-bazica este un acid slab (HInd), acesta ionizeaza in solutie apoasa astfel:
HInd + H2O ![]() Ind- + H3O+
Ind- + H3O+
a1 b2 b1 a2
culoare X culoare Y
La cresterea concentratiiei ionilor H3O+ in solutie, echilibrul se va deplasa spre stanga (v.Principiul lui le Chateliere), crescand concentratia speciei HInd, deci se intensifica culoarea X. Daca se micsoreaza cantitatea de ioni hidroniu din solutie, echilibrul se va deplasa spre dreapta si creste concentratia ionilor Ind- si se intensifica astfel culoarea Y. Deci, ]n func'ie de valoarea pH-ului, culoarea indicatorului vireaza de la culoarea a la culoarea B si invers. Schimbarea culorii indicatorului nu are loc brusc, ci pe un interval de pH, numit domeniu sau interval de pH.
|
Indicator |
Domeniu de viraj |
Culoarea indicatorului |
|
|
Mediu acid |
Mediu bazic |
||
|
Metiloranj |
Rosu |
Galben |
|
|
Rosu de metil |
Rosu |
Galben |
|
|
Turnesol |
Rosu |
Albastru |
|
|
Albastru de bromtimol |
Galben |
Albastru |
|
|
Fenolftaleina |
Incolor |
Rosu |
|
Pentru a putea fi utilizat, un indicator acido-bazic trebuie sa indeplineasca urmatoarele conditii:
Ø sa prezinte culori diferite, functie de caracterul acido-bazic al elementelor
Ø sa isi schimbe cat mai brusc culoarea, pe un interval cat mai mic de pH
Ø sa fie solubil in mediul de reactie utilizat
Ø sa fie stabil in conditiile de lucru.
Observatie: In titrarile acido-bazice, alegerea indicatorului este foarte importanta, pentru ca punctul de echivalenta sa fie reperat cat mai bine.
7. SOLUTII TAMPON IN SISTEMELE BIOLOGICE
Pentru buna desfasurare a proceselor biochimice este important ca valoarea pH-ului mediului de reactie sa fie mentinut intre anumite valori limita, chiar la adaugarea de mici cantitati de acid sau baza. Pastrarea constanta a valorii pH-ului se realizeaza cu ajutorul solutiilor tampon.
O solutie tampon contine specii chimice chimice cu caracter acido-bazic total opus (antagonist), care nu reactioneaza intre ele, solutie care are capacitatea de a mentine valoarea pH-ului aproape constanta atunci cand se adauga mici cantitati de acid sau baza.
In compozitia unei solutii tampon se gasesc:
![]() un acid slab si baza sa conjugata (HA si
A- de exemplu: H2CO3 si HCO3-);
un acid slab si baza sa conjugata (HA si
A- de exemplu: H2CO3 si HCO3-);
![]() o baza slaba si acidul sau conjugat (B
si BH+, de exemplu: NH3 si NH4+).
o baza slaba si acidul sau conjugat (B
si BH+, de exemplu: NH3 si NH4+).
O solutie tampon poate fi formata din:
![]() un acid slab si sarea sa cu o baza tare,
de exemplu: CH3COOH si CH3COONa
un acid slab si sarea sa cu o baza tare,
de exemplu: CH3COOH si CH3COONa
![]() o baza slaba si sarea sa cu un acid
tare, de exemplu: NH3 si NH4Cl.
o baza slaba si sarea sa cu un acid
tare, de exemplu: NH3 si NH4Cl.
Acidul acetic este un acid slab si ionizeaza conform ecuatiei:
CH3COOH + H2O ![]() CH3COO-
+ H3O+
CH3COO-
+ H3O+
Acetatul de sodiu este un compus ionic, iar la dizolvare in apa disociaza:
CH3COONa ![]() CH3COO- + Na+
CH3COO- + Na+
Drept urmare, in solutie se afla acidul acetic si baza lui conjugata, ionul acetat.
Daca in solutia tampon se adauga o baza tare (de exemplu NaOH) care elibereaza in solutie ioni HO- (hidroxil), moleculele de acid acetic cedeaza protoni (H+) ionilor hidroxil si trec in ioni acetat, neutralizand astfel adaosul de baza:
CH3COOH + HO- ![]() CH3COO-
+ H2O.
CH3COO-
+ H2O.
Daca in solutia tampon se adauga un acid tare (de exemplu HCl), care elibereaza ioni hidroniu (H3O+), ionii acetat accepta protonii de la ionii hidroniu si trec in molecule de acid acetic, neutralizand astfel adaosul de acid.
CH3COO- + H3O+ ![]() CH3COOH
+ H2O
CH3COOH
+ H2O
Astfel, concentratia ionilor hidroniu nu se modifica semnificativ si valoarea pH-ului ramane practic constanta.
Amoniacul este o baza slaba si ionizeaza putin in solutie apoasa:
NH3+ H2O ![]() NH4+
+ HO-
NH4+
+ HO-
Clorura de amoniu este o substanta ionica si la dizolvare in apa disociaza astfel:
NH4Cl ![]() NH4+
+ Cl-
NH4+
+ Cl-
In solutie se afla amoniacul si acidul sau conjugat, ionul amoniu (NH4+).
Daca in solutie se adauga o baza tare, ionii amoniu cedeaza protoni ionilor hidroxil, eliberati in solutie de baza tare si trec in molecule de amoniac, neutralizand adaosul de baza:
NH4+ + HO-![]() NH3+ H2O
NH3+ H2O
Daca in solutia tampon se adauga un acid tare, moleculele de amoniac accepta protoni de la ionii hidroniu, eliberati in solutie de acidul tare si trec in ionii amoniu, neutralizand adaosul de acid:
NH3 + H3O+![]() NH4+ + H2O
NH4+ + H2O
Valoarea pH-ului unei solutii tampon depinde de raportul dintre concentratia acidului si concentratia bazei conjugate, numit raport de tamponare.
Solutiile tampon sunt deosebit de importante in procesele biochimice. Pentru ca multe dintre reactiile biochimice sunt foarte sensibile la pH-ul mediului de reactie, organismele vii si-au creat sisteme de mentinere in anumite limite a valorii pH-ului. De exemplu, sangele uman - fluid cu rol de transport - este usor bazic, valorile normale ale pH-ului sangelui fiind cuprinse intre 7,35 si 7,45. Orice modificare a valorii pH-ului sangelui in afara acestor limite poate avea consecinte foarte grave. Astfel, la pH de peste 7,45 se instaleaza o stare numita "alcaloza", iar la pH sub 7,35 apare starea de "acidoza". Daca valoarea pH-ului sanguin scade sub 6,8 sau creste peste 7,8 poate surveni moartea.
pH-ul sangelui este mentinut in limite normale cu ajutorul mai multor sisteme tampon, care sunt corelate cu mecanisme fiziologice realizate de organele de eliminare.
|
Sisteme tampon |
Cantitate (%) |
|
HCO3- /H2CO3 | |
|
Hb / HbO2 (Hb - Hemoglobina) | |
|
Sisteme tampon formate din proteine | |
|
HPO42- / H2PO4- |
Actiunea sistemului tampon format din acid carbonic (H2CO3) - carbonat acid (HCO3-), cel mai important sistem tampon din sange, se bazeaza pe urmatorul echilibru:
H+ (aq) + HCO3-
(aq) ![]() H2CO3
(aq)
H2CO3
(aq) ![]() H2O (l)
+ CO2 (g)
H2O (l)
+ CO2 (g)
Daca in sange apar substante cu caracter acid, ionii carbonat acid fixeaza protonii eliberati de substantele cu caracter acid, trecand in molecule de acid carbonic care se descompun in apa si dioxid de carbon:
HCO3- (aq) + H3O+ (aq)
![]() H2CO3
(aq) + H2O (l)
H2CO3
(aq) + H2O (l)
In acelasi timp, prin accelerarea respiratiei scade presiunea partiala a CO2 din aerul pulmonar, scade cantitatea de H2CO3 si echilibrul este deplasat spre dreapta. In felul acesta, sunt consumati ionii hidroniu existenti in exces si pH-ul sangelui ramane in limite normale.
Daca in sange apar substante cu caracter bazic, moleculele de acid carbonic cedeaza protonii ionilor hidroxil eliberati de baze si trec in ionii carbonat acid:
H2CO3 (aq)
+ HO- (aq) ![]() HCO3- (aq) + H2O (l)
HCO3- (aq) + H2O (l)
Prin scaderea frecventei respiratorii creste presiunea partiala a CO2 din aerul pulmonar, creste cantitatea de H2CO3 si echilibrul este deplasat spre dreapta. In felul acesta, sunt consumati ionii hidroxil existenti in exces si pH-ul sangelui ramane in limite normale.
Daca mecanismele respiratorii nu pot compensa perturbarile echilibrului acido-bazic, intervine rinichiul care poate elimina fie excesul de acizi, fie excesul de baze
Hemoglobina intra in constitutia a doua sisteme tampon: hemoglobina acida (HbH) - hemoglobinat de potasiu (Hb-K+) si oxihemoglobina (HbHO2) - oxihemoglobinat de potasiu (HbO2-K+), care sunt cele mai importante sisteme tampon cu componente proteice din sange.
Actiune de tamponare au si aminoacizii si unele proteine. Amfionul unui aminoacid poate reactiona atat cu acizii cat si cu bazele.
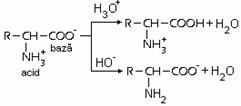
Exemplu:
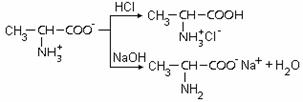
Solutiile tampon au multiple utilizari in chimia analitica, biochimie, industria farmaceutica, agricultura etc.
Copyright © 2024 - Toate drepturile rezervate