 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Potentialele chimice in solutii reale
La solutii neideale nu se verifica legile simple ale solutiilor ideale:
![]() in care mi variaza liniar cu lnxi
in care mi variaza liniar cu lnxi
![]()
![]()
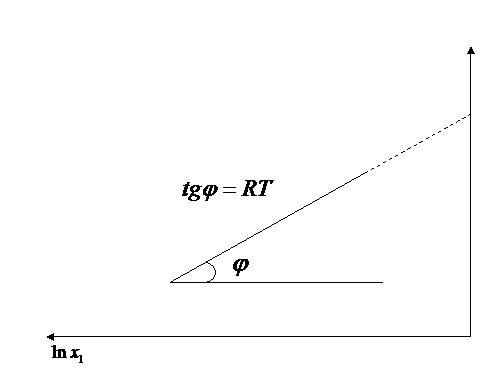
Variatia liniara a potentialului chimic (mi) cu lnxi la solutii ideale.
Abaterile de la idealitate sunt corectate utilizand activitatile termodinamice prin adaugarea unui termen suplimentar incluzand factori de activitate diferiti in functie de modul de exprimare al compozitiei.
a) Potentialul chimic al unui component dintr-un sistem real cu xi corectat este:
![]()
![]() activitatea
termodinamica rationala
activitatea
termodinamica rationala
![]() coeficient
corectiv, factor de activitate rationala
coeficient
corectiv, factor de activitate rationala
![]()
b) In solutii diluate in locul fractiilor molare ale compusului dizolvat se pot folosi concentratiile exprimate in molalitati:
![]()
![]() = potentialul chimic standard care se
refera la o solutie ipotetica ideala diluata (mi 0) cu
= potentialul chimic standard care se
refera la o solutie ipotetica ideala diluata (mi 0) cu ![]() care tinde catre unu (
care tinde catre unu (![]()
c) La dilutii extreme se manifesta proportionalitatea dintre xi si concentratia molara Ci.
Observatii:
Proprietatile potentialului chimic pot fi sintetizate astfel:
![]() 1) In conditii izoterm-izobare, mi este o marime intensiva, independenta de masa totala
a sistemului dar depinde de natura compusului prin si
compozitia exprimata prin fractii molare.
1) In conditii izoterm-izobare, mi este o marime intensiva, independenta de masa totala
a sistemului dar depinde de natura compusului prin si
compozitia exprimata prin fractii molare.
![]()
2) Cea mai generala conditie de idealitate a solutiilor consta in verificarea de catre toti componentii a ecuatiei precedente.
3) In asociatie cu marimile fundamentale U, H, F si G, mi ofera criteriul unic pentru evolutia spontana si starea de echilibru in sisteme polifazice mono- sau policomponente
4) Toate ecuatiile termodinamice ale functiei G se verifica si la mi cu conditia substituirii tuturor marimilor integrale cu marimi molare partiale.
mi se determina numai din calcule, nu se masoara direct experimental
6) Ecuatia simpla de la solutii ideale poate fi extinsa la sisteme neideale prin introducerea activitatilor termodinamice in locul fractiei molare.
Copyright © 2024 - Toate drepturile rezervate