 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
UNIVERSITATEA "BABES-BOLYAI "
FACULTATEA DE CHIMIE SI INGINERIE CHIMICA
LUCRARE DE LICENTA
Acilarea selectiva a amestecului racemic al
etil 3-(furan-3-il)-3-hidroxi propanoat cu
Novozyme 435
Partea I a
1. Obiectivele proiectului. Prezentarea generala a produsului.
1.1.Tema de proiectare
Sa se proiecteze o instalație tehnologica pentru obținerea a 10kg/sarja a 2-(etoxi carbonil)-1-(furan-3-il)-etil butirat si etil 3-( furan-3-il)-3hidroxi-propionatului optic active prin acilarea selectiva a amestecului racemic al etil 3-(furan-3-il)-3-hidroxi propanoat cu CaL-B.
1.2 Prezentarea generala a produsului
Formula structurala
Formula bruta: C9H10O4
Masa moleculara: 182,17707 g/mol
Compozitia elementala:
![]() Carbon:
12,01113/182,17907=59.337%
Carbon:
12,01113/182,17907=59.337%
![]() Hidrogen:
1,007914/182,17907=5,5325%
Hidrogen:
1,007914/182,17907=5,5325%
![]() Oxigen:
15,99944/182,17907=35.129%
Oxigen:
15,99944/182,17907=35.129%
Denumire IUPAC: etil 3-(furan-3-il)-3-hidroxi propanoat
Solubilitate: etanol, acetat de etil, acetona.
Utilizare: substanta de baza in produsele medicamentoase si agrochimicale
2. Prezentarea procesului. Studiu de literatura.
2.1 Izomeri optici
Copmusii organici care rotesc planul luminii polarizate in orice stare fizica (gazoasa, lichida, solida sau in sloutie) si isi datoresc deci activitatea optica insasi structurii moleculare, reprezinta substante optic active, care se pot prezenta sub forma mai multor izomeri optici. Numai acele perechi de izomeri optici care rotesc planul luminii polarizate cu acelasi numar de grade, unul spre dreapta si celalt spre stanga, sunt enantiomeri sau antipozi optici, si prezentandu-se din punct de vedere structural (spatial) ca si obiectul si imaginea sa in oglinda. Amestecul echimolecular al celor doi antipozi optici formeaza un racemic care nu roeste planul luminii polarizate, deoarece rotatiile lor opuse se anuleaza reciproc. Prin anumite mijloace racemicii pot fi scindati in antipozii optici respectivi.
Aparitia activitatii optice la substante organice este legata de anumite conditii structurale, spatiale pe care trebuie sa le indeplineasca moleculele respective. Studiul substantelor optic active a stabilit initial ca si conditie a aparitiei activitatii optice asimetria moleculei. Ulterior insa a avut loc o importanta schimbare de conceptie (si de terminologie), legandu-se fenomenul de activitate optica nu in mod obligatoriu cu notiunea de asimetrie, ci cu cea de chiralitate definita ca proprietatea de neidentitate a unui obiect (structuri) cu imaginea sa de oglindire.
Chiralitatea centrala reprezinta tipul de chiralitate determinat de existenta unor diferentieri tridimesionale fata de un centru, numit centru de chiralitate. Marea majoritate a compusilor organici caracterizati prin acest tip de chiralitate contin un atom de carbon asimetric Cabcd de care sunt legati patru atomi sau grupe de atomi diferite.
In cazul furan-3-hidroxi-propionatului de etil, carbonul chiral este reprezentat in urmatoarea configuratie:

Diferentierea enantiomerilor prin specificarea centrului de chiralitate, se realizeaza prin utilizarea prefixelor R (rectus) si S (sinister) conform conventiei universale a lui Cahn, Ingold si Prelog pentru specificarea chiralitatii.
Stabilirea configuratiilor R si S se poate realiza destul de simplu utilizand proiectiile Fischer in locul formulelor perspectivice sau a modelelor. Daca in formula Fisher atomul cu cea mai joasa prioritate ( H in cazul de fata ) nu este plasat in partea de jos a moleculei, se schimba pozitia lui cu a atomului din partea de jos a moleculei si se tine cont de faptul ca orice modificare a doua grupari intre ele aduce cu sine inversia configuratiei absolute.
Enantiomerii au aceleasi puncte de topire, de fierbere, aceleasi densitati, indici de refractie egali si in general aceleasi proprietati fizice. Ei se deosebesc numai prin activitatea optica si anume in conditii identice ei rotesc planul luminii polarizate cu acelasi numar de grade, unul spre dreapta, celalalt spre stanga. Amestecurile racemice au in general proprietati fizice sensibil diferite de ale enantiomerilor respectivi. Activitatea optica se masoara cu aparate numite polarimetre.
2.2 Formarea și separarea amestecului racemic
Formarea racemicilor se explica prin sintezele de substanțe organice cu molecula chirala, care pornesc de la compuși optic activi și nu utilizeaza catalizatori sau solvenți chirali și nici agenți fizici chirali, ce duc in mod inevitabil la formarea in amestecul de reacție a unor cantitați echimoleculare din cei 2 antipozi optici.
Separarea enantiomerilor dintr-un amesctec racemic prezinta o deosebita insemnatate avand in vedere pe de o parte faptul ca in sinteza chimica organica obișnuita(ce nu utilizeaza produși solvenți sau agenți chirali) se obțin intotdeauna numai produși racemici, iar pe de alta parte faptul ca o serie de produși organici, cu acțiune fiziologica sunt enantiomeri puri.
Metode uzuale de separare a enantiomerilor, ce sunt aplicate pentru a-i izola, sunt scindarea, dedublarea sau rezolvarea.
Scindarea β-hidroxiesterilor racemici se poate realiza și prin formarea de alcooli, prin esterificare cu anhidride, respectiv pot fi separați prin formarea de esteri diastereoizomeri cu acizi optic activi ce sunt apoi separați prin distilare fracționata, pe coloane de mare eficacitate, aceasta ultima metoda fiind de dedublare a racemicilor cu largi aplicații industriale .
S-au realizat separari a racemicilor prin metode chimice cromatografice :
Separari cromatografice pe coloana cu umplutura(adsorbant) optic activa cand racemicul formeaza cu adsorbantul, adsorbanți diastereoizomeri ;
Separari cromatografice cu ajutorul cromatografiei gazoase, utilizand faza staționara chirala.
Izolarea unui enantiomer dintr-un amestec racemic se poate realiza și pe cale biochimica, prina acțiunea unor mucegaiuri, bacterii sau drojdii, care, crescute intr-un mediu de cultura conținand in soluție un racemic, distruge prin metabolizare un singur enantiomer, celalalt ramanand in soluție de unde se poate izola.
2.3 Biocataliza
Biocataliza este ramura importanta a biotehnologiei in care pentru realizarea scopului urmarit se utilizeaza enzime sau preparate enzimatice, respectiv celule producatoare ale acestor enzime ca atare.
Milioane de ani de evoluție au creat mii de microorganisme ce conțin enzime, cunoscute ca si catalizatori pentru aproape orice reacție chimica. Azi cercetatotii reușesc nu numai sa identifice organismele și enzimele lor, dar și sa accelereze procese evoluționare normale și sa aplice ingineria pentru a imbunatati performanța biocatalizatorilor.
Catalizatorii maresc viteza de reacție a unei reacții fara sa produca o schimbare in structura lor. Dezvoltarea conceptului de cataliza in secolul XIX, a mers mana in mana cu descoperirea catalizatorilor din surse biologice. Acestea au fost numite enzime, și mai tarziu s-a descoperit ca erau de natura proteica.
Organismele vii conțin un numar mare de enzime ce mediaza direct toate reacțiile ce au loc in organismul viu. Enzimele sunt catalizatori eficienți, adesea mult mai superiori catalizatorilor convenționali, motiv pentru care sunt folosiți din ce in ce mai mult in societatea de astazi de inalta tehnologie, și au un rol important in expansiunea biotehnologica. Utilizarea lor a dat naștere la afaceri cu o diversitate mare de procese industriale, noi aplicații ale enzimelor fiind descoperite in mod constant. In natura enzimele pot fi gasite foarte rar in afara celulelor, majoritatea exercitandu-și activitatea in interiorul celulei, in interiorul organismelor celulare. Unele enzime iși pierd complet activitatea catalitica cand sunt separate din mediul lor ambiant, astfel nu pot fi folosite in alt mediu, un exemplu ar fi proteinele membranare care sunt inactive in absența componenților membranelor.
Enzimele au un numar de avantaje fața de catalizatorii convenționali. Dintre aceste avantaje cele mai importante sunt specificitatea si selectivitatea, nu doar pentru reacții particulare, ci și pentru distingerea intre parți similare dintr-o molecula (regioselectivitate), sau dintre izomeri optici (enantioselectivitate, stereoselectivitate). Enzimele catalizeaza reacții ale unui numar restans de reactanți (substraturi) care pot fi un numar mic de clase de compuși asemanatori (exemplu: tripsina catalizeaza hidroliza unor peptide și esteri, in mare majoritate proteine) de asemenea pot cataliza o singura clasa de compuși (exemplu: hexokinaza care catalizeaza transferul unei grupari fosfat de pe ATP pe unele hexoze), sau pot cataliza un singur compus (exemplu: glocozoxidaza care oxideaza doar glucoza dintr-un numar mare de glucide). Acest lucru inseamna ca reacția aleasa poate fi catalizata prin excluderea reațiilor secundare, eliminand produșii nedoriți. Astfel se poate obține o productivitate mare reducand costurile materiale. Un alt avantaj este ca generarea produsului se face intr-o stare necontaminata și astfel se reduc costurile de purificare și poluarea mediului. Reacțiile catalizate de enzime nu pot fi doar o alternativa reala la binecunoscutele metode chimice, dar de asemenea permit realizarea unor reacții care sunt mai dificile sau imposibil de realizat prin tehnici chimice pure. Enzimele lucreaza in general in condiții de procesare blande (temperatura camerei, pH neutru). Acest lucru scade energia necesara reducandu-se costurile unui proces industrial, de asemenea este foarte important pentru produși care au tendința de a polimeriza sau sunt instabili. Enzimele accelereaza viteza de reacție prin scaderea energiei de activare, intr-o reacție enzimatica cea mai importanta sursa de energie de activare fiind modificarea conformaționala a enzimei. Acest lucru este in contrast cu reacțiile catalizate de catalizatorii clasici, in care energia de activare este suplimentata de energia termica a mediului. Enzimele sunt capabile sa catalizeze eficient un numar mare de reacții, reacțiile catalizate de enzime pot fi de pina la 1016 ori mai rapide decat aceleași reacții in condiții identice, dar necatalizate de enzime. Unele enzime au capacitatea de a introduce grupari funcționale in poziții care altfel sunt inactive cu reactivi organici comuni.
Funcționalitatea, activitatea și selectivitatea enzimei poate fi influențata de diferiți factori, concentrația de substrat și de produs, pH, temperatura și de alte molecule prezente in sistem. Aceste efecte pot fi exploatate fiind direcționate spre catalizarea procesului enzimatic.
Utilizarea enzimelor in scopuri sintetice are și unele dezavantaje care nu pot fi ignorate. Costul mare al izolarii și purificarii enzimelor descurajaza inca folosirea lor mai ales in domeniile in care exista o procedura bine stabilita. Acest dezavantaj poate fi evitat utilizand extracte crude, sau chiar celule intacte, avand grija ca procesul sa nu fie contaminat cu alți produși. In general, datorita originii naturale, unele enzime devin inactive cand sunt extrase din mediul lor natural. Datorita originii lor naturale, enzimele de obicei lucreaza in mediu apos. Acest lucru poate cauza dificultați cand substratul sau produsul sunt insolubile sau sensibile la apa. Exista totuși unele tehnici care caștiga teren: folosirea solvenților organici, a fluidelor supercritice, sisteme micelare sau emulsii bazate pe cristale lichide. In obținerea compușilor optic activi, enzimele contaminate pot cataliza aceeași transformare, dar cu diferite viteze și stereoselectivitate diferita. Astfel este important sa determini gradul de puritate al enzimei pentru garantarea puritații produsului.
2.4. Utilizarea lipazelor in biotehnologie
2.4.1. Prezentarea generala a lipazelor
Lipazele sunt enzime produse de plante, animale, bacterii și mucegaiuri. Lipazele provenind din plante nu se utilizeaza in scop comercial, in schimb cele provenind de la animale, bacterii și mucegaiuri sunt utilizate pe scara larga. Cele mai importante sunt lipazele provenind de la vite, oi, porci, de exemplu, lipaza din pancreasul porcin este cel mai des utilizata. Dintre lipazele microbiene sunt de menționat cele din clasa Candida, iar dintre lipazele provenite din mucegaiuri, mai utilizate sunt cele din clasa Aspergillus.
Substraturile tipice pentru lipaze sunt: uleiul vegetal, grasimile animale, uleiul de pește, uleiul de maasline, laptele gras și triacilglicerolii sintetici. Aceste substraturi sunt insolubile in apa, ceea ce creaza anumite probleme deoarece trebuie sa se lucreze cu lipaze sub forma de emulsii, iar enzimele iși desfașoara aactivitatea catalitica la interfața ulei-apa. Substratul este in echilibru intre faza uleioasa și emulsie, dar este intr-o continua schimbare. Viteza de reacție depinde de compoziția substratului, de raportul dintre cantitatea de emulsie și cantitatea de ulei, dar compoziția emulsiei depinde la randul sau de concentrația uleiului in substrat. O problema particulara a acestui tip de enzima este ca substratul poate conține sau reacția poate duce la formarea de materiale cu suprafața activa, cum ar fi: sapunuri sau acizi grași liberi, care tind sa se acumuleze la interfața ceea ce reduce suparafața respectiva.
Lipazele necesita activare, iar cele mai multe tipuri de activare sunt cunoscute ca facand substratul mult mai disponibil pentru emulsificare utilizand ca agenți activi detergenții. Alt activator binecunoscut sunt ionii de calciu și ei activeaza prin formarea cu acizii grași liberi a unor saruri insolubile de calciu sau sapunuri.
Cele mai multe lipaze au un pH alcalin cuprins intre 8 și 9. Exista cateva lipaze microbiene care prefera mai mulți ioni de hidrogen, avand pH optim de 5-6. Temperatura optima este de 30-40ºC, dar exista și lipaze care iși inceteaza activitatea catalitica la -10ºC deoarece substraturile lichide devin solide la aceasta temperatura. Lipazele sunt serin hidrolaze, ele prezinta o activitate enzimatica slaba in mediu apos conținand substrat dizolvat. In eucariote lipazele sunt implicate in diferitele etape ale metabolismului lipidic, inclusiv digestia, absorbția grasimilor și metabolismul lipoproteinelor. In plante, lipazele se gasesc in țesuturile depozitare de energie.
Structura lipazei Candida Antartica a fost studiata prin difracție de raze X. Au fost izolate și caracterizate doua lipaze CaLA și CaLB. Cele doua lipaze au fost clonate și secvențiate fiind obținute cristalele pentru caracterizare structurala. Intre cele doua enzime nu s-a gasit nici o secvența omoloaga. Lipaza B s-a dovetit extrem de utila in sinteza organica prin paleta larga a transformarilor stereospecifice și selective pe care le poate cataliza in medii organice. CaLB are 317 aminoacizi, conține doua foi β, 9 catene β, 17 zone α helicoidale și 3 punți disulfurice.
In industria medico-farmaceutica enzimele sunt foarte mult utilizate. Pepsina, enzima izolata din peretele stomacal și din sucul gastric, in stare de inalta puritate, este utilizata in tratarea unor maladii gastrice, iar un amestec de proteinaze, amilaza, lipaza, celulaza intra in compoziția unor medicamente indicate in depresii.
Bioconversia sau transformarea biologica are la baza utilizarea sporilor microbieni, vegetativi, celule animale sau vegetale, care cresc sau sunt imobilizate și prin utilizarea enzimelor separate din celule, care sunt cultivate de mult, sau prin utilizarea preparatelor enzimatice.
3.Analiza desfașurarii procesului
3.1 Chimismul procesului de baza
Reacțiile de acilare catalizate de lipaze au fost intens studiate, fapt ce se explica prin varietatea enzimelor disponibile la ora actuala, stereoselectivitatea inalta pe care o prezinta acestea și mai ales, comportamentul lipazelor la diverse condiții experimentale, in special la solvenți organici.
A fost determinata structura tridimensionala a catorva triacilglicerol lipaze. Toate structurile au relevat prezența unei triade catalitice( Ser-His-Asp/Glu) in situsul activ neexpus la solvent. Un strat amfifilic acopera situsul activ și pentru a permite legarea substratului la situsul activ este necesara o schimbare conformaționala a enzimei. In general structura secundara a lipazelor este similara structurilor α/β a hidrolazelor. Principala caracteristica a acestui tip de "pliere" este o foaie α/β cu 8 șiruri centrale β legate prin α-helixuri, o triada catalitica cu o topologie și o secvența unica.
Studiile chimice care demonstreaza natura situsurilor active ale enzimelor adesea se bazeaza pe reactivii de afinitate-blocare, substanțe ale caror structura este asemanatoare cu cea a substraturilor naturale dar, reacționeaza ireversibil cu enzima.
Reacția are loc in doua etape principale. In prima etapa se realizeaza o legatura covalenta intre atomul de carbon C1 al legaturii peptidice ce urmeaza a fi hidrolizata si serina din situsul catalitic. Formarea intermediarului acilenzima are loc printr-o stare de tranziție incarcata negativ la atomul de oxigen atașat la C1. Formarea acestei stari de tranziție este facilitata de rolul de baza generala a histidinei. Acest rol este potențat de restul de acid aspartic care stabilizeaza sarcina parțiala pozitiva care apare la nucelul imidazolic al histidinei. Oxigenul Ser devine puternic nucelofil astfel incat poate genea o stare de tranziție tetraedrica la C1. Aceasta stare de tranziție este stabilizata prin legaturi de hidrogen care fixeaza oxianionul de la C1. Aceste legaturi de hidrogen sunt realizate in buzunarul oxoanionic. Ruperea legaturii poate duce la formarea acil-enzimei. In cea de a doua etapa, sub influența aceleiași baze generale, dar in prezența metanolului va avea loc un atac nucleofil la același C1. Și in cea de a doua stare de tranziție ionul oxianionic este stabilizat prin existența unor legaturi de hidrogen in buzunarul oxianionic. Prin ruperea legaturii esterice dintre serina și fragmentul peptidic N-terminal enzima se regenereaza.
Eficiența acțiunii catalitice depinde de stabilizarea delor doua stari de tranziție prin legaturile de hidrogen care fixeaza oxianionul de la C1.
Fig.1: Mecanismul serin-hidrolazelor
R = Substrat
3.2.Modelarea procesului
3.2.1 Modele de bilanț de masa
Bilanțul de materiale reprezinta latura cantitativa a transformarilor de natura fizico-mecanica, chimica, biochimica, la care sunt supuse materiile pe parcursul unui proces tehnologic dat. Prin intermediul bilanțului de materiale se stabilesc consumurile specifice, circulațiile produselor prin aparate și instalațiile, stand la baza dimensionarii acestora.
Matematic bilanțul de materiale se scrie sub forma
Unde:
- materiale intrate in sistem
- materiale existente in sistem
- materiale ieșite din sistem
- materiale ramase in sistem
- materiale pierdute in sistem
Termenii din aceasta ecuație se pot exprima astfel:
- pentru procese continue in Kg/s, t/h, t/an etc.
- pentru procese discontinue in Kg/șarja, Kg/zi etc.
- bilanțul de materiale se poate intocmi relativ ușor cunoscand capacitatea de producție, procedeul tehnologic, fluxul tehnologic adoptat și normele de consum.
Se va intocmi bilanțul de materiale pentru o șarja, pe fiecare operație in parte. Calculul randamentului total al procesului de alchilare se efectueaza inmulțind randamentele tuturor operațiilor astfel:
= η reacție * ηcromatografie *ηdistilare
Trebuie sa se obțina 10 kg produs/șarja
|
Compus |
Masa moleculara [g/mol] |
Formula moleculara |
|
Racemic etil3-(furan-3-il) 3 hidroxi propanoat |
C9H10O4 |
|
|
(-) etil3-(furan-3-il) 3 hidroxi propanoat |
C9H10O4 |
|
|
(+)-2-carbonil etoxi-1-furan-3-il) etil butirat |
C11H16O5 |
|
|
Acetat de n-butil |
C6H12O2 |
|
|
Diclormetan |
CH2Cl2 |
|
|
Acetona |
C3H6O |
|
|
Lipaza |
REACȚIA DE ACILARE:
|
INTRARE |
IEȘIRE | |||
|
Compus |
Cantitate [Kg] |
Cantitate [kmoli] |
Compus |
Cantitate [Kg] |
|
Racemic etil3-(furan-3-il) 3 hidroxi propanoat |
(-) etil3-(furan-3-il) 3 hidroxi propanoat | |||
|
(+)-2-carbonil etoxi-1-furan-3-il) etil butirat | ||||
|
Lipaza |
Lipaza | |||
|
Acetat de n-butil |
Acetat de n-butil exces | |||
|
Acetaldehida | ||||
|
Pierderi | ||||
|
Total |
Total | |||
3.2.2 Modelul matematic de bilant termic
Bilanțul termic al unei instalații chimice are ca scop: urmarirea fluxurilor termice, a consumurilor de caldura, determinarea randamentelot termice și dimensionarea aparatelor.
Bilanțul termic al reactoarelor chimice ofera informații necesare pentru determinarea suprafeței de schimb a aparatelor și a materialelor de construcție pentru utilaje și a celor necesare unei izolații eficiente lor, pentru alegerea unui agent termic potrivit pentru condițiile de lucru existente, avantajos ca preț intr-o cantitate corespunzatoare procesului tehnologic in care intervine.
Bilanțul termic al unui reactor chimic, expresie a legii conservarii energiei, poate fi enunțat astfel: unde:
este caldura acumultata de reactor,
∑Qi este caldura intrata in reactor,
∑Qe este caldura ieșita din reactor.
Caldura acumulata in reactor = Caldura intrata in reactor - Caldura ieșita din reactor + Efectul termic al procesului - Caldura cedata in exterior.
Termodinamica permite gasirea condițiilor optime de conducere a procesului chimic, din punct de vedere al necesarului de caldura și energie și calculul unor proprietați dificil sau imposibil de masurat.
Deoarece caldurile de formare ale compușilor ce intervin in reacție nu se gasesc in tabelele corespunzatoare, s-au estimat pe baza bilanțului energetic conform relațiilor de mai jos:
∆Hf = -94,38C-34,1H-0(Br+Cl+N+O)-41,1F-69,3S-∆Hc
unde
C, H, Br, . -reprezinta numarul de atomi de C, H, Br din moleculele substituite
;-34,19, . .caldura de combustie a acestor elemente[Kcal/mol].
Relația se aplica in cazurile in care produsele de ardere ale substituției sunt CO2, Cl2, H2, SO2 in stare gazoasa, N2O și Br in stare lichida.
Estimarea caldurilor de combustie ale compușilor organici, in stare solida se poate realiza prin doua metode:
1.Metoda Karash
2.Metoda bilanțului de oxigen
1.Metoda Karash:
Caldurile de combustie ale compușilor organici in stare lichida se pot determina cu formula lui Karash. Ideea de baza a acestui calcul este aceea ca legaturile dintre atomi se formeaza intotdeauna pe seama a 2 electroni, care devin comuni celor 2 atomi. La arderea unei hidrocarburi are loc deplasearea electronilor atomilor de carbon și hidrogen catre atomul de oxigen. Cantitatea de caldura degajata prin deplasearea unui electron de la atomul de carbon sau hidrogen catre atomul de oxigen este de 26,05 Kcal( regula lui Karash).
Pentru hidrocarburile simple se poate calcula cu relația:
∆Hc = -26,05n
unde: n-numarul de electroni deplasați;
Caldurile de combustie ale compușilor mai complicați, cu legaturi duble sau triple sau ale celor polisubstituiți, nu se pot calcula cu aceasta relație simpla, care trebuie completata cu corecții termice caracteristice diferitelor tipuri de legaturi și substituenți ai atomilor de carbon. Aceasta relație este:
∆HC = -26,05n + ∑ξ∆ [Kcal/mol]
unde: ξ - numarul substituenților de același fel din molecula;
∆ - corecția termica.
Deoarece relația lui Karash se poate aplica doar pentru substanțe lichide, pentru substanțe solide se va introduce corecția urmatoare:
Hf(s )= Hf(l) - qtop
unde: qtop - caldura de topire
qtop = 0,26 * qvap [Kcal/Kg]
qvap = (240 * σ) / M
unde: qvap - caldura de vaporizare;
σ - suma valențelor atomilor din molecula;
M - numarul moleculelor de substanța;
2.Metoda bilanțului de oxigen - se bazeaza pe ideea ca entalpia de combustie a unei substanțe este funcție liniara de numarul de atomi de oxigen implicați in combustia completa a unui mol din compusul respectiv:
∆Hc = ∑ai + x ∑bi
unde: x - numarul de atomi de oxigen necesari arderii compusului;
ai, bi - perechi de coeficienți tabelați pentru gruparile funcționale;
Orice grup funcțional din compusul organic se poate considera ca provine de la o parafina saturata in care s-au operat anumite modificari structurale. De aceea, la calcularea caldurii de combustie, primii coeficienți (ai și bi) care se iau in discuție sunt acei ai parafinei normale pentru care valorile tabelate sunt: ai = +5,7 și bi = +52,08.
Daca apar mai multe grupari de același fel, ai se multiplica cu numarul grupelor funcționale identice, dar bi ramane neschimbat. Valorile coeficienților ai , bi se citesc din tabel in funcție de starea de agregare.
Caldura de combustie este parametrul utilizat in calculul termodinamic din doua motive:
1. Caldura de combustie care poate fi masurata direct, fiind accesibila verificarii experimentale;
Caldurile de formare au valori numerice mai mici, astfel, erorile care apar in calculul lor sunt mai mari.
Cunoscand caldura de combustie a unui compus organic, ∆Hc, caldura sa de formare se poate calcula cu relația:
∆Hf = -94.38C-34.19H-0(Br+Cl+I+N+O)-41.4F-69.3S-∆Hc
unde: C, Br,H, . reprezinta numarul de atomi de C,H, Br din moleculele substituite
94.38, -34.19 . ..caldura de combustie a acestor elemente, in kcal/mol;
Relația se aplica in cazurile in care produsele de ardere ale substituției sunt CO2, Cl2, N2, SO2 in stare gazoasa, H2O și Br2 in stare lichida si HF in soluție apoasa.
Estimarea caldurilor de combustie ale compușior organici pe baza bilanțului de oxigen - caldura de combustie a unei substanțe organice este funcție liniara de numarul de atomi de oxigen implicați in combustia completa a unui mol din compusul respectiv.
Se vor calcula caldurile de combustie prin metoda bilanțului de oxigen utilizand formula lui Roth:
∆Hc = -52.5 x
unde: x - numarul de atomi de oxigen necesari combustiei complete a unui mol de substanța.
Pentru racemic etil3-(furan-3-il) 3 hidroxi propanoat (substrat)
C9H10O4 +14.5 O2 9CO2 + 5H2O
x = 23 moli de oxigen
∆Hc = -52.5* 23 = -1207.5 kcal/mol
∆Hf = -94.38*9-34.19*10-(-1207.5) = -16.18 kcal/mol
Pentru (-) etil 3-(furan-3-il) 3 hidroxi propanoat-produs
C9H10O4 +14.5 O2 9CO2 + 5H2O
x = 23moli de oxigen
∆Hc = -52.5* 23 = -1207.5 kcal/mol
∆Hf = -94.38*7-34.19*10-(-1207.5) = -16.18kcal/mol
Pentru (+)-2-carbonil etoxi-1-furan-3-il etil butirat
C11H16O5 + 19.5O2 11CO2 + 8H2O
x=30 moli de oxigen
∆Hc =-52.5*30 = -1575 kcal/mol
∆Hf =-94.38*11-34.19*10-(-1575) = -2271.28 kcal/mol
Pentru acetat de n-butil
C6H12O2 + 8O2 6CO2 + 6H2O
x= 8 moli de oxigen
∆Hc =-52.5*8 = -420 kcal/mol
∆Hf =-94.38*6-34.19*12-(-420) = -556.56 kcal/mol
Efectul termic al reacției de acilare:
Hf298 = (∆Hf alcool + ∆Hf acetat) - ∆Hf alcool racemic - ∆Hf acetat n-butil
Hf298 =(-1316.26-2271.28)+1316.26+556.56=917.8kcal/mol
Efectul entropiei reacției de alchilare:
Relațiile empirice pentru estimarea entropiei:
Pentru substanțe organice solide:
S0298=4.6* Cp J/mol*K=1.1 Cp cal/mol*K
Pentru substanțe organice lichide:
S0298=5.9*CpJ/mol*K=1.4 Cp cal/mol*K
Pentru determinarea entropiei substanțelor organice este necesara estimarea capacitații calorice a acestora.
Capacitațile calorice ale lichidelor și solidelor pot fi determinate din caldurile atomice utilizand relația lui Kopp:
Cp = ∑Ci * ni, in J/mol*K sau cal/mol*K;
unde: Ci este caldura atomica a elementului i, in J/atomg*K sau cal/atomg*K;
ni reprezinta numarul atomilor de același fel din molecula
|
Caldura atomica |
Unitate de masura |
C |
H |
O |
|
Pentru substanțe Solide |
Cal/atomg*K |
Pentru racemic etil 3 - (furan-3-il) 3 hidroxi propanoat
CP=7*1.8+10*2.3+4*1.6=43cal/mol*K
S0298=1.1*43=47.3 cal/mol*K
Pentru (-) etil3 - (furan-3-il) 3 hidroxi propanoat
CP=7*1.8+10*2.3+4*1.6=43cal/mol*K
S0298=1.1*43=47.3 cal/mol*K
Pentru (+)-2-carbonil etoxi-1-furan-3-il) etil butirat
CP=11*1.8+16*2.3+5*1.6=50.8cal/mol*K
S0298=1.1*50.8=55.88cal/mol*K
Pentru acetat de n-butil
CP=6*1.8+12*2.3+2*1.6=41.6cal/mol*K
S0298=1.1*41.6=98.12 cal/mol*K
Entropia reacției de alchilare:
S0298 = (∆S298alcool +∆S298acetat) -∆S298alcool racemic - ∆S298acetat de vinil
S0298 = (43+50.8)-43-41.6=9.2cal/mol*K=9.2*10-3Kcal/mol*K
Calculul entalpiei libere Gibbs a reacției de alchilare:
∆G0=∆H0-T∆S0
∆G0=315.8-298*(43*10-3)=314.51kcal/mol*K
3.2.3 Modelarea cinetica a procesului
3.2.3.1Notiuni de cinetica enzimatica:
Principiul saturarii enzimei cu substratul este general valabil in cazul cineticii enzimatice. Cinetica enzimatica poate fi folosita ca si cinetica clasica, in elucidarea unor mecanisme de reactie, in calculul timpului de reactie, al conversiilor, al conditiilor economice optime, cand se urmareste productia industriala in bioreactor.
Viteza
reactiei enzimatice creste proportional cu concentratia
substratului pana la o anumita valoare, dupa care oricat de mult am mari concentratia substratului, viteza ramane
Ecuatia vitezei de reactie:
V=k c
unde: k-constanta
c-concentratia
Studiul mecanismului reactiilor enzimatice, a proceselor metabolice si a vitezei de transformare a substratului in produs se face prin metoda cinetica. Aceasta metoda reprezinta singura posibilitate de studiu a proceselor enzimatice, deoarece numarul enzimelor pure separate pana in prezent este relativ redus.
3.2.3.2. Modele cinetice pentru viteza de formare a produsului.
Analizand comportamentul sistemului de reactie s-a constatat ca:
-la concentratii scazute ale substratului, viteza de reactie este proportionala cu concentratia substratului (reactie de ordinul intai);
-la concentratii ridicate ale substratului viteza de reactie este independenta de concentratia substratului, Cs ( reactie de ordinul zero);
-exista o plaja a concentratiei de enzima la care viteza maxima depinde liniar de concentratia enzimei, Ce.
Henry in 1902, pe baza acestor constatari propune un model empiric pentru dependenta vitezei reactiei enimatice de concentratia de substrat:
V=VmaxCs/(Km+Cs)
Brown propune tot in 1902 un mecanism general potrivit caruia initial se formeaza intr-o reactie reversibila, un complex enzima-substrat ES, care se transforma ireversibil in produsul de reactie cu regenerarea enzimei:
E +
Implicarea complexului enzima-substrat in mecanismul reactiei enzimatice a fost facut inainte de cunoasterea naturii chimice a enzimelor precum si inainte de detectia spectrofotometrica a complecsilor enzima-substrat. La baza mecanismului propus de Brown a stat teoria lacat-cheie a interactiunii enzima-substrat prin stereocomplementaritatea statica a zonelor de contact din enzima si substrat. Astazi aceasta teorie este inlocuita cu teoria adaptarii induse care afirma ca interactiunea primara presupune o adaptare reciproca a geometriilor partenerilor de reactie.
Dintre ipotezele suplimentare introduse de Brown amintim:
- concentratia totala
de enzima ramane
- concentratia de enzima este mult mai mica decat cea de substrat, prin urmare formarea complexului nu va modifica semnificativ concentratia substratului;
- concentratia de produs este considerata suficient de mica pentru a nu produce inhibitie.
Michaelis si Menten in 1913 introduc ipoteza conform careia viteza de formare a produsului este mult mai mica decat viteza de asociere - desociere a enzimei si substratului. De aceea, etapa limitanta de viteza este reactia de formare a produsului.
Michaelis si Menten dezvolta modelul cinetic al vitezei de formare a produsului in functie de concentratia substratului si a enzimei. Reactia dintre substrat si enzima se desfasoara in doua etape:
![]()
![]()
Viteza de formare a produsului in procesul enzimatic este descrisa de ecuatiile prezentate anterior:
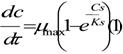
Pentru determinarea concentratiei enzima-substrat, Cc, se foloseste expresia de formare a acestuia, pentru cazul in care Cs>>CE.
In regim stationar, concentratia complexului nu variaza in timp:
![]()
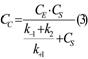
Din ecuatiile (1) si (3) rezulta:
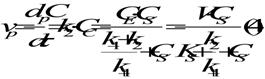
in care: V = k2* CE - viteza maxima de formare a produsului si corespunde stadiului in care intreaga enzima formeaza complexul enzima-substrat.
KS = (k-1)/(k+1)
-
KM =
Daca introducem KM , se obtine:
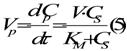
Acesta ecuatie este denumita Michaelis-Menten si descrie viteza de formare a produsului intr-un proces enzimatic, reprezentand modelul ideal pentru viteza proceselor enzimatice in regim stationar, lipsite de procese secundare si de inhibitie.
3.3 Schema de operații
Atașata in Anexe
3.4. Schema fluxului tehnologic
Atașata in Anexe
3.5. Lista cu utilajele și echipamentele necesare
Predimensionarea si evaluarea parametrilor unor aparate este o etapa importanta in proiectarea unor instalatii chimice. Calculul permite obtinerea de informatii de baza chiar daca nu sunt absolut complete si exacte. De exemplu:
marime;
eficienta energiei consumate;
pretul unor piese importante ale instalatiei.
Calculul si proiectarea unor aparate industriale poate fi efectuata in conditii de maxima acuratete stiintifica, tehnica si tehnologica, insa alaturi de verificarea instalatiei, acestora le corespund grade de incertitudine, care cresc odata cu marirea numarului de aparate si utilaje din linia tehnologica respectiva.
Bilantul de materiale si energie sufera o evolutie asemanatoare, raportat la precizia de calcul, aspect, marime, putere consumata, pozitia de functionare, eficienta aparatului sau a liniei tehnologice. Optiunea finala are insa intotdeauna in centrul ei problema costului global. Se poate deci considera ca proiectarea instalatiilor este o problema de optimizare a parametrilor enumerati. In functie de aceasta, tipul utilajelor dintr-o instalatie chimica se poate determina pe baza urmatoarelor criterii:
- necesitatile procesului tehnologic;
- evitarea unor productii de serie sau unitati specializate in fabricarea utilajelor respective;
- nivelul tehnic al utilajului experimentat prin comparatie cu alte utilaje asemanatoare.
In unele cazuri, alegerea utilajului este determinata de disponibilitatea lui, de posibilitatile de achizitionare, etc. Pentru procesele tehnologice discontinue, alegerea utilajelor este simpla si flexibila.
3.6 Schema de masurari in proces și control
Acest capitol se refera la conducerea procesului biochimic de reducere enzimatica, astfel incat cu toata opozitia factorilor extern ai procesului, sa se obtina produsul dorit cu specificatiile de calitate urmarite si cu consum minim de energie.
Creșterea gradului de mecanizare a procceselor tehnologice a dus in mod inevitabil și la marirea complexitații operațiilor de manipulare, comanda și control a surselor de energie și a instalațiilor, aparand astfel dificultați in dezvoltarea tehnicii.
Pentru inlaturarea acestei dificultați s-au creat o serie de sisteme automate care sa preia din ce in ce mai mult, pe de o parte, rolul de intermediar intre sursele de energie artificiala și instalații și pe de alta parte, sa realizeze comanda și conducerea acestora din urma.
Pentru ca procesele de producție sa poata fi comandate automat, o mare parte din instalații sunt echipate cu elemente de automatizare care sa asiste procesele respective și, in funcție de variația unor parametrii, sa comande procesul parțial sau total.
Automatizarea bioreactorului:
Fig1. Model de automatizare al bioreactorului
Reglarea debitului pompelor:
Reglarea debitului pompelor volumetrice - refuland și aspirand un volum constant pot fi utilizate la dozarea precisa a unor fluxuri de materiale. Utilizarea ei este mai mare in cazul in care cursa pompei este ajustabila.
Reglarea debitului pompelor se poate face prin strangularea directa a conductei de refulare. Strangularea nu se va face niciodata pe conducta de aspirație deoarece prin vidul relativ creat se produce un fenomen de cavitație, care distuge rotorul pompei.
4.Proiectarea tehnologica:
4.1. Alegerea si descrirea echipamentelor si utilajelor necesare in proces
4.1.1. Rezervoarele de stocare si vasele de masura
Aceste utilaje de tip recipient cu pereti subtiri care servesc depozitarii temporare a substantelor solide, lichide sau gazoase , care constitue materii prime, produsi intermediari sau finali intr-o instalatie chimica.
Uzual dimensiunile si parametrii caracteristici ai utilajelor de tip recipient sunt tipizate dupa normative generale. Astfel,volumul nominal , presiunea si temperatura de lucru a recipientelor este reglementata prin STAS 4635-90 , iar diametrele nominale interioare prin STAS 7159-90. Avand in vedere necesitatile proceselor tehnologice chimice, materiale utilizate in constructia recipientilor cu pereti subtiri sunt deosebit de diverse.
4.1.2. Recipiente prevazute cu manta
In aceasta categorie se incadreaza bioreactorul si condensatorul.
Ele fac parte din cea mai importanta parte componenta a instalatiilor industriale de sinteza fina, instalatia de distilare si reflux. Partea principala a instalatiei este aparatul de reactie sau reactorul.
El este compus din vasul cu manta, capac cu gura de vizitare, agitator. Pe capacul reactorului sunt fixate mai multe racorduri (stuturi) la traseele de vapori, reflux, incarcari cu materii lichide.
4.1.3. Condensatoarele
Utilajele pentru transfer termic asigura trecerea caldurii de la o substanta la alta substanta prin intermediul unui perete despartitor. Solutiile constructive pentru aceste utilaje sunt de o mare diversitate. In acest caz, transmiterea caldurii este insotita de schimbarea starii de agregare. Cele mai utilizate, in prezent sunt schimbatoarele de caldura de suprafata tubulare cu manta, din cadrul carora se aleg doua schimbatoare cu fascicul tubular rigid si o trecere, in care circulatia agentilor termici este in contracurent .
Gazele necondensabile pot fi evacuate fie impreuna cu condensatul (condensatarele umede) cazul in care amoniacul este evacuat impreuna cu condensatul, fie separat printr-o pompa de vid (condensatoarele uscate).
Aceste aparate sunt construite in principiu dintr-un fascicol de tevi, montate in doua placi tubulare si inchise intr-o manta prevazuta cu capace. In general tevile sunt laminate si destinate special constructiei schimbatoarelor de caldura. Exista o mare varietate de diametre cat mai mici, care asigura un transfer de termic mai intens si constructii mai compacte, dar se vor avea in vedere si aspectele legate de pierderile de presiune si de colmatare.
4.1.4. Filtrul Nutsche
Este format dintr-un cilindric, cu capac , prevazut la o oarecare distanta de fund cu o tabla gaurita (sau fund poros), care sustine mediul de filtrare (panza) si sa permita trecerea filtratului. Dupa intinderea panzei pe placa gaurita (poroasa) se trimite suspensia pe la partea superioara si cea inferioara a stratului filtrant, creata prin presiunea hidrostatica a suspensiei si pentru producerea vidului sub placa poroasa.
4.1.5. Pompele
Pompele utilizate pentru manipularea lichidelor din proces sunt pompe centrifuge.
Acestea se compun din urmatoarele componente:
rotor cu palete (curbate invers sensului acelor de ceasornic);
motor electric cu arbore;
stator sub forma de mot;
carcasa;
Energia hidraulica se obtine indirect ca efect al fortei centrifuge ce actioneaza asupra masei de lichid aflata in interiorul unui rotor , care e pus in miscare de energia mecanica primita de la motorul electric . Paletele rotorului sunt rotite cu turatie mare de un arbore cuplat cu motorul electric. Rotorul este inchis in carcasa, avand axial racordul de aspiratie. Periferia carcasei in forma de melc se largeste continuu catre racordul de refulare , situat tangential la carcasa. Lichidul este aspirat axial, datorita presiunii create in zona centrala, patrunde in rotor fiind antrenat de acesta in miscarea de rotatie. Lichidul strabate canalele formate intre paletele rotorului sub actiunea fortei centrifuge create si este colectat in caracasa si dirijat catre conducta de refulare.
4.2 Dimensionarea tehnologica a unui utilaj cheie
Reactorul are forma cilindrica cu fund si capac elipsoidal, cu manta de incalzire-racire (cu abur respectiv apa), cu agitator cu elice actionat de un motor electric. Capacul este demontabil, asamblat prin flanse prinse cu suruburi, iar fundul este montat de corpul cilindric prin intermediul unui cordon de sudura.
Caracteristici tehnico-functionale ale procesului:
Din procesul tehnologic rezulta ca trebuie impuse anumite conditii de lucru, si anume:
temperatura de lucru de 25 0C;
presiunea de lucru, presiunea atmosferica, P=1,013 MPa;
densitatea masei de reactie ρ=1238.33 kg/m3;
volum de lucru 24.0162m3
volum total 31,5m3 .
Inainte de a incepe calculele de dimensionare ale reactorului este necesar sa cunoastem volumul STAS al reactorului . Acesta se ia din tabele, cunoscand volumul masei de reactie introdus .
Volumul util al reactorului este dat de suma volumelor materiilor prime:
Vu=24+0.016+0.0002
![]() Vu =24.016 m3
Vu =24.016 m3
![]()
![]()
unde: k - coeficient de umplere ;: k =0.7 . 0.85 (alegem k=0,6)
V - volumul reactorului , m3
Astfel:
V = 31.5 m3
VSTAS = 31.5m3 (conform STAS 4645-78)
Raportul dintre inaltimea si diametrul bioreactorului variaza intre 1-3 ( H/D coeficient de zveltete)
![]() Unde: H -inaltimea
partii cilindricea reactorului;
Unde: H -inaltimea
partii cilindricea reactorului;
D -diametrul reactorului.
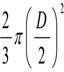 Consideram:
=1,5; H = 1,5D
Consideram:
=1,5; H = 1,5D
![]() Vt=Vcapac + Vfund + Vcilindru
Vt=Vcapac + Vfund + Vcilindru
Vcapac =Vfund =
Hfund
=Vt= Vcilindru +2 Vfund
![]()
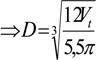
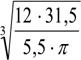
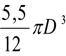 Vt
Vt
D = = 2790 mm;
D ~ 2790 mm =2800 mm ( conform STAS 7159-74)
H = 4200 mm
Bioreactorul va avea diametrul, D = 2800 mm si inaltimea partii cilindrice, H = 4200 mm.
Calculul inaltimii reactorului
Hreactor = H + 2 Hfund [ mm ]
![]() Hfund=
Hfund=
Hfund = m
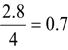 Hreactor
=4.2+1.4
Hreactor
=4.2+1.4
Hreactor =5.6 m =5600 mm(inatimea totala a reactorului).
Caracteristici ale reactorului ales:
diametrul nominal D = 2800 mm;
inaltimea fundului recipientului Hf = 700 mm din care inaltimea partii cilindrice h= 60 mm;
inaltimea capacului recipientului Hc = 700 mm din care inaltimea partii cilindrice h = 60 mm;
diametrul nominal al mantalei Dm = 3000 mm
inaltimea mantalei Hm =4067 mm
inaltimea reactorului Hr =5600 m
Pentru un fund si un capac cu D=2800 si grosimea peretelui de 14 mm se recomanda in literatura o inaltime a partii cilindrice de 60 mm.
5.Aspecte ecologice și de protecția mediului
Deoarece din diversele etape ale procesului de fabricatie rezulta deseuri care nu mai pot fi valorificate sau care trebuie recuperate, tratamentul la care sunt supuse inainte de a fi deversate este foarte important.
Tehnologia propusa in lucrarea de fata nu prezinta un grad inalt de poluare, deoarece materiile prime utilizate prezinta un grad mediu de nocivitate iar apele mume rezultate in proces nu contin substante letale. In acelasi timp amintim ca in cazul in care pot inlocui un proces chimic clasic, procesele biotehnologice sunt preferate si datorita acestor avantaje:
- nu apar intermediari periculosi;
- produsii de reactie sunt, de asemenea, nepericulosi pentru mediu;
- temperaturile la care se lucreaza sunt temperaturile mediului ambiant;
- in general nu se lucreaza la presiuni mari.
Acestea din urma sunt supuse unor recuperari pentru a putea fi purificate si recirculate in sistem, abia apoi sunt deversate in reteaua de canalizare.
Dintre materiile prime utilizate enzima și alcoolul racemic nu sunt periculoase. Cei care ridica probleme sunt: acetatul de n-butil, acetona, diclormetanul.
Acetatul de n-butil
Inflamabil, daunator prin inhalare, irita pielea și ochii;
Factori de risc: R11;
Factori de siguranța: S16-23-29-33
Acetona
Foarte inflamabila, formeaza amestecuri explozive cu aerul; daunatoare prin ingerare, inhalare si absorbție prin piele; poate provoca amețeli, iritanta in contactul cu pielea;
Factori de risc: R 11-36-66-67
Factori de siguranța: S 9-16-26
Diclormetanul
Inflamabil, formeaza amestecuri explozive cu aerul la 100ºC; iritant al ochilor, posibil cancergen.
Factori de risc: R11-26-36/37/38
Factori de siguranța: S 23-24/25-36/37.
Partea a II a
1.Generalitați:
In secolul 21 avem nevoie de subtanțe enantiomeric pure pentru a le folosi in industria farmaceutica. Importanța obținerii acestori compuși a primit o noua dimensiune, in anul 1992, cand Administrația Alimentelor și Medicamentelor din SUA (F.D.A.), a impus producatorilor de medicamente sa sintetizeze, caracterizeze și sa testeze ambii enantiomeri ai oricarei substanțe.
O metoda biochimica de obținere a unui enantiomer dintr-un amestec racemic este rezoluția cinetica care utilizeaza enzimele (biocatalizatori), este vast utilizata la scara de laborator, precum și la scara industriala.
Biocataliza este este ramura importanta a biotehnologiei in care se utilizeaza enzime sau preparate enzimatice, respectiv celule producatoare ale acestor enzime ca atare.
Cuvantul cheie al biocatalizei este selectivitatea. Aceasta se refera la capacitatea enzimelor de a face diferența intre doua sau mai multe substraturi asemanatoare(enantiomeri), ori dintre doua sau mai multe locuri asemenatoare din structura unui substrat. Enzima poate avea capacitatea de a asigura transformarea preponderenta a unui substrat, din doua sau mai multe posibile.
Rezoluția cinetica este un proces unde enantiomerii (selectivitate de substrat) amestecului racemic sunt transformați in produs, cu viteze de reacție diferite.Situsul activ al enzimei este un centru chiral, și atunci unul dintre enantiomeri se potrivește mai bine cu situsul activ decat celalalt enantiomer, și deci este convertit cu o rata de conversie mai mare, rezultand rezoluția cinetica a amestecului racemic. Pentru a avea o rezoluție cinetica eficienta, unul dintre enantiomeri este transformat in produsul dorit cu viteza mult mai mare, iar celalalt este gasit neschimbat. Teoretic conversia maxima a unui enantiomer este de maxim 50%.
In lucrarea de fața, am utilizat rezoluția cinetica pentru subtratul numit furan-3-hidroxi-propionatul de etil:
2.Materiale și metode
Spectrele 1H- si 13C-RMN au fost inregistrate la un spectrometru Brucker ce opereaza la frecvente de 300 MHz respectiv 75 MHz, la 25 C. Probele chimice sunt exprimate in ppm fac_ de valoarea TMS luat_ ca standard intern.
HPLC a fost achiziționat de la firma Agilent, seria 1200, cu pompa cuaternara, detector Uv-Vis, cu injecție manuala. Coloanele chirale folosite pentru separarea enantiomerilor sunt Chiralpak IA și Chiralcel OJ-H, legate in serie, folosind ca eluent hexan:izopropanol 90:10 v/v.
Cromatografia pe strat subtire a fost realizata folosind placute cromatografice de tip Merck silicagel 60F254. Separarile cromatografice preparative au fost realizate folosind coloane cromatografice si silicagel de tip Merck 60 (63-200 Ám). Rotatiile optice au fost determinate cu ajutorul polarimetrului Bellingham Stanley Ltd. ADP 220 si valorile [a]D20 sunt exprimate in unitati de 10-1 deg cm2 g-1, in cloroform.
Reactanti si solventi
Reactantii si solventii folositi sunt produsi ai companiilor Aldrich or Fluka. Toti solventii au fost purificati si uscati prin metode standard.
Biocatalizatori
Lipozyme immob.M, lipozyme TL IM, CalB imobilizata in piatra ponce, si lipaza Ak au fost obținute de la fima Novozyme din Danemarca.
3.Partea experimentala:
S-a realizat obținerea unui a unui β-hidroxi ester optic activ, folosind rezoluția cinetica.
Pentru aceasta s-a realizat urmatoarele etape:
3.1.Sinteza furan-3-hidroxi-propionatului de etil
Reactia Reformatsky:
+ HBr
Mod de lucru:
Intr-un balon cu fund rotund cu 2 gaturi echipat cu palnie de picurare, agitatare și un refrigerent ascendent, se introduce 1,4g (22.22 mmoli) zinc activat in prealabil( Zn este activat cu soluție de HCl, cand o parte din Zn este activat, formandu-se o pulbere foarte fina, și o partese formeaza clorura de Zn. Clorura de zinc se indeparteaza cu apa distilata. Pentru indepartarea apei se spala zincul activat cu acetona care in continuare este indepartat cu ajutorul rotavaporului). Peste zincul activat se adaug 5ml tetrahidrofuran și 1,94g (11.75 mmoli) bromacetatul de etil, si amestecul format se pune la reflux. Reacția fiind exoterma, adaugarea aldehidei in picaturi 2,5g (17.12mmoli) diluata in 10ml tetrahidrofuran, se face fara incalzirea mediului de reacție. Refluxul este susținut de caldura degajata in reacție. Dupa adaugarea aldehidei se incalzește mediul de reacție, pentru ca reacția se desfașoara in reflux. Dupa terminarea reacției tetrahidrofuranul este indepartat cu ajutorul rotavaporului. Amestecul ramas este dizolvat in diclormetan și racit pe baie de gheața și incet, sub amestecare intensa se adauga acidul sulfuric in picaturi pentru descompunerea complexului format (12,5 ml 10%). Amestecul rezultat este format din faza organica și faza apoasa. Faza organica este extrasa și spalata cu acid sulfuric 5% de 2 ori, cu bicarbonat de sodiu si cu apa distilata. Fazele apoase le-am extras cu diclormetan, iar cele organice le-am unit, le-am uscat cu sulfat de sodiu anhidru, le-am filtrat și le-am concentrat la rotavapor. Produsul s-a purificat pe coloana folosind eluent cloroform, apoi diclormetan.
Reacția a fost monitorizata, rezultand urmatoarele spectre IR, HRMN, CRMN:
3.2 Obținerea β-hidroxi esterului optic activ, cu diizopropileter catalizata de
lipaza
In literatura de specialitate s-a gasit o metoda de rezolvare a β-hidroxi-esterilor racemici prin acilare selectiva, iar pentru substratul prezentat in lucrarea de fata :
η = 2-3%
Conversia fiind mica, metoda trebuie optimizata.
Astfel, pentru a optimiza aceasta metoda s-au modificat cateva dintre variabile ale reacției, care sunt in cazul nostru:
a). Timpul
b). Solventul
c). Reactantul
d). Enzima
3.3. Acilarea chimica
Mod de lucru:
Intr-un balon cu fund rotund se dizolva 5g (38.75mmoli) diclorura de crom in 8ml acetonitril (se dizolva parțial), apoi se adauga 2,54g anhidrida (acetica, propionica și butirica) (20mmoli) peste care se adauga foarte incet β hidroxi esterul și se lasa la reflux 8-12 ore. Se indeparteaza acetonitrilul la rotavapor, se adauga diclormetan. Din mediul de reacție diclorura de crom se indeparteaza prin filtrare. Diacetatul format se purifica cu ajutorul cromatografiei pe coloana, folosind ca eluent diclormetanul.
3.4 Modificarea variabilelor reacției
a. Timpul
Timpul optim pentru realizarea reacției este de 65 de ore, randamentul fiind de 49,99%.
b. Solventul
Am incercat urmatorii solvenți, (tabelul 1), timpul de reacție 65 de ore, enzima folosita a fost CalB.
Puritatea enantiomerica a unui compus este exprimat in termenul lui de exces enantiomeric(ee), definit ca:
ees = excesul enantiomeric de substrat = R-S/R+S*100, R>S
unde R, S este concentrația enantiomerului (R) și S concentrația enantiomerului (S);
Astfel pentru un compus racemic valoarea ee-ului este zero, iar pentru un compus enantiomeric pur valoarea de:
ee este 1(sau 100% ee);
eep = exces enantiomeric de produs;
E = raport enantiomeric = ;
c = conversia = eeS/ eeS+eeP;
c. Reactanți de acilare
Am incercat urmatorii reactanți de acilare (tabelul 2), cu enzima CalB, timpul de reacție fiind de 65 de ore.
d. Enzime:
S-a incercat și alte enzime (tabelul 3), folosind timpul de reacție 65 de ore, acetat de vinil, octan pur.
Mod de lucru:
Intr-un balon cu fund rotund se dizolva 5g (38.75mmoli) diclorura de crom in 8ml acetonitril (se dizolva parțial), apoi se adauga 2,54g anhidrida (acetica, propionica și butirica) (20mmoli) peste care se adauga foarte incet β hidroxi esterul și se lasa la reflux 8-12 ore. Se indeparteaza acetonitrilul la rotavapor, se adauga diclormetan. Din mediul de reacție diclorura de crom se indeparteaza prin filtrare. Diacetatul format se purifica cu ajutorul cromatografiei pe coloana, folosind ca eluent diclormetanul.
3.4 Modificarea variabilelor reacției
a. Timpul
Timpul optim pentru realizarea reacției este de 65 de ore, randamentul fiind de 49,99%.
b. Solventul
Am incercat urmatorii solvenți, (tabelul 1), timpul de reacție 65 de ore, enzima folosita a fost CalB.
Puritatea enantiomerica a unui compus este exprimat in termenul lui de exces enantiomeric(ee), definit ca:
ees = excesul enantiomeric de substrat = R-S/R+S*100, R>S
unde R, S este concentrația enantiomerului (R) și S concentrația enantiomerului (S);
Astfel pentru un compus racemic valoarea ee-ului este zero, iar pentru un compus enantiomeric pur valoarea de:
ee este 1(sau 100% ee);
eep = exces enantiomeric de produs;
E = raport enantiomeric = ;
c = conversia = eeS/ eeS+eeP;
c. Reactanți de acilare
Am incercat urmatorii reactanți de acilare (tabelul 2), cu enzima CalB, timpul de reacție fiind de 65 de ore.
d. Enzime:
S-a incercat și alte enzime (tabelul 3), folosind timpul de reacție 65 de ore, acetat de vinil, octan pur.
3.5. Rezoltuția cinetica a furan-3-hidroxi-acetatului de etil mediata enzimatic de lipaza CaL B
Amesctecul racemic (20mg) (0.085mmoli) se dizolva in n-octan, se adauga butanoat de vinil 20 ml, și se adauga biocatalizatorul CaLB (20mg). Amestecul de reacție se menține sub agitare la 300rpm și este lasat 65 de ore la temperatura camerei. Apoi enzima se filtreaza, dupa care se spala cu acetona (2x5ml). Se realizeaza distilarea supernantantului, iar produșii se izoleaza prin cromatografie pe coloana utilizand ca și solvent diclormetanul.
4. Rezultate si discutii
In urma unui studiu al literaturii de specialitate s-a gasit o metoda de rezolvare a β-hidroxi-esterilor racemici prin acilare selectiva pe care am aplicat-o pe substratul: furan-3-hidroxi-acetatului de etil.
Analizele HPLC efectuate au aratat o conversie de 2-3%; din acest motiv s-a recurs la un studiu de optimizare bazat pe modificarea parametrilor reactiei pentru a gasi conditiile cele mai propice. Au fost variati urmatorii parametri: timp de reactie, solvent, reactiv de acilare, enzima.
4.1.Sinteza furan-3-hidroxi-propionatului de etil
(Substratul)
Randament η = 76%;
Analiza RMN
Fig 1. Sprectrul 1 H-RMN al furan-3-hidroxi-propionatului de etil
Fig 2 Spectrul 13C-RMN al furan-3-hidroxi-propionatului de etil
Analiza IR
Fig 3 Spectrul IR al furan-3-hidroxi-propionatului de etil
Obținerea β-hidroxi esterului optic activ, cu diizopropileter catalizata de lipaza
Reacția a fost realizata cu un randament η = 2-3%;
Pentru creșterea randamentului reacției am modificat cateva din variabilele reacției:
a). timp
b).solvent
c).reactant
d).enzima
Ca sa putem monitoriza mersul reacției avem nevoie de o metoda chirala. Aceasta metoda este HPLC:
Fig 4. Cromatograma HPLC (Coloana chirala Chiralpak IA Chiralcel OJ-H) racemat furan-3-hidroxi-propionatul de etil
4.3. Acilarea chimica
Acilarea chimica e realizata cu scopul de a obține amestecul racemic, precum și pentru a putea verifica și controla acilarea selectiva cu ajutorul HPLC:
Astfel, am realizat 3 amestecuri racemice:
Analiza HPLC
Fig 5. Cromatograma HPLC (Coloana chirala Chiralpak IA Chiralcel OJ-H) a butanoat și etil-3-(furan-3-il)-3-hidroxipropanoat
Fig 6. Cromatograma HPLC (Coloana chirala Chiralpak IA Chiralcel OJ-H) a propionat și etil-3-(furan-3-il)-3-hidroxipropanoat
Fig.7 Cromatograma HPLC (Coloana chirala Chiralpak IA Chiralcel OJ-H) a acetat și etil-3-(furan-3-il)-3-hidroxipropanoat
Modificarea variabilelor reacției
Timpul
Cromatograma dupa 30 h
Fig.8 Cromatograma HPLC dupa 30h (Coloana chirala Chiralpak IA Chiralcel OJ-H) etil 3-(furan-3-il)-3-hidroxi propanoat
Cromatograma dupa 65 h
Fig.9 Cromatograma HPLC dupa 65h (Coloana chirala Chiralpak IA Chiralcel OJ-H) etil 3-(furan-3-il)-3-hidroxi propanoat
4.3.2. Solventul
|
Nr. Crt |
Solvent |
Ees |
Eep |
c |
E |
|
Octan:IL 3:1 | |||||
|
Acetatul de vinil:IL 3:1 | |||||
|
IL | |||||
|
Octan |
|
||||
|
Acetatul de vinil | |||||
|
Hexan | |||||
|
Toluen | |||||
|
Ciclohexan | |||||
|
Decalina |
Tabelul1.Solventi utilizati
S-a pastrat timpul de reactie 65 h, reactantul de acilare butanoatul de vinil, enzima CaL- B.
4.3.3. Reactanti de acilare
|
Nr. crt. |
Reactant |
Ees |
Eep |
c |
E |
|
Acetat de vinil | |||||
|
Propionat de vinil | |||||
|
Butanoat de vinil |
Tabel 2 Reactanti de acilare utilizati
S-a folosit enzima CaL- B, timp de reactie 65h, solvent n-octan.
4.3.4. Enzime
|
Nr. Crt. |
Denumire enzima |
Ees |
Eep |
c |
E |
|
Lipozyme immob. M. michei | |||||
|
Lipozyme TL 1M | |||||
|
CalB immob. - acrilic resin | |||||
|
|
Tabel 3 Enzime utilizate
4.5 Rezoltuția cinetica a furan-3-hidroxi-acetatului de etil mediata enzimatic de lipaza CaL B
C=49.99%
ee. = 97% etil-3-(furan-3-il)-3-hidroxipropanoat
e.e. = 97% 2-etoxicarbonil-1-(furan-3-il) etil butirat
]D20 = -24(c0.1, CHCl3)
Analiza HPLC:
Fig 10. Cromatograma HPLC etil-3-(furan-3-il)-3-hidroxipropanoat optic pur
Fig 11. Cromatograma HPLC 2-etoxicarbonil-1-(furan-3-il) etil butirat optic pur
Analiza RMN
Fig 12. Sprectrul 1 H-RMN al 2-etoxicarbonil-1-(furan-3-il) etil butirat
Fig .13 Sprectrul 13 C-RMN al 2-etoxicarbonil-1-(furan-3-il) etil butirat
5.Concluzii
S-a efectuat un studiu de optimizare dupa metoda experimentului factorial pentru o metoda de racemizare a β hidroxi esterilor preluata din literatura;
S-a sintetizat substratul prin reactia Reformatsky;
S-a incercat rezolvarea racemicului prin metoda acilari selective in vederea obtinerii β hidroxi esterului optic activ corespondent substratului folosit dar s-a obtinut un randament foarte scazut;
Pentru optimizarea metodei (obtinerea unui randament mai ridicat) s-a recurs la un studiu de optimizare bazat pe modificarea a 4 factori determinanti pentru reactie;
In urma analizarii rezultatelor s-a demonstrat ca enzima CaLB (Novozyme 435) imobilizata pe piatra ponce este optima pentru a fi folosita in acilarea enzimatica.
Dupa rezultatele obtinute in urma optimizarii, s-a concluzionat ca enzima: lipaza CaLB, solventul: n-octanul, timpul: 65 h , reactiv de acilare: butanoat de vinil sunt variabilele optime pentru substratul discutat.
Prin metoda prezentata in lucrarea de fața s-a obținut enantiomeriul optic activ etil 3-(furan-3-il)-3-hidroxipropanoat, prin acilare enzimatica cu CaL-B.
Partea a III-a
1. Concluzii generale
Prin prezenta lucrare s-a efectuat:
Studiul eficacitații unei metode noi de separare a racematului prin intermediul folosirii HPLC-ului, pe coloane chirale legate in serie IA și OJ-H;
Proiectarea unei instalații la scara industriala de obținere a etil 3-(furan-3-il)-3-hidroxipropanoat;
Prin metoda rezoluției cinetice s-a obținut etil 3-(furan-3-il)-3-hidroxipropanoat optic activ
Analiza spectrala a confirmat structura compușilor organici sintetizați;
2. Lista de simboluri si utilaje
3. Bibliografie
S.Mager, M. Horn, Stereochimia compușilor organici, Ed.
Robert A.Copeland, Enzymes A practical introudction to Structure, Mechanism and Data Analysis, Second edition, Copyright 2000 by Wiley-VCH, Inc.
I.F.Dumitru, D.Iordanescu, Introducere in enzimologie, Editura medicala, București, 1981;
F.D.Irimie, Elemente de biochimie, vol I, Editura Erdelyi Hirado,
Patent Status, Production of an Industrially Useful Fungal Lipase by a
Genetically Altered Strain of
Angewandte. Chemie.Int, Ed. 2005, 44, 3976-3975;
V.Keller, Dynamic Kinetic Resolution: Practical Aplications in Synthesis, 2001;
Uppenberg,
A. Ozun, R.Mișca, Introducere in proiectarea instalațiilor
chimice, Editura Genesis,
C.Cristea, I.Hopartean,
I.A.Silberg, Chimia organica a
produșilor naturali, Editura Risoprint,
C.D.Nenițescu, Chimie organica, vol II, Ed. Didactica și Pedagogica, Buc, 1980;
Gh.Lupușor, E.Merica, G.Gorea, V.B.Gorduza, Ingineria sintezei intermediarilor aromatici, vol I, Editura Tehnica, București.
Ș.Agachi, Automatizarea
proceselor chimice, Casa Carții
de Știința,
I.Lazar, Indrumator de proiectare. Calculul și construcția recipientelor cu amestecare, Cluj-Napoca, 1988;
C.Pavlov, P.Romanov, A.Nascov, Procese și aparate in ingineria chimica. Exerciții și probleme. Editura Tehnica, București, 1981;
Pelsz, G.Klibanov, A.M., Biotechnol.Bioenerg, 1983;
Klibanov, A.M.Siegel, E.H., Enzyme. Microb.Technol., 1982;
I.Baldea, Cinetica chimica și mecanisme de reacție. Bazele teoretice și aplicații, Editura Presa Universitara Clujeana, Cluj-Napoca, 2002;
A.Ozunu, Elemente de hazard și risc in industrii poluante, Editura Accent, 2000:
Aldrich - Catalog
A new Acylation Catalyst, J.Chem.Soc, Chem.Commun, 1987;
Novel (R)-oxynitrilase sources for the synthesis of (R)-cyanohydrin in diisopropyl ether, Tetrahedron: Asymmetry, Vol. 8, No. 8, pp. 1225-1234, 1997;
Molecular recognition of sec-alcohol enantiomers by Candida
25. C.D.Nenițescu, Tratat elementar de chimie organica, vol II, Editura Tehnica, București, 1958;
26. E.Boral, M.Zapan, Chimie organica, Editura Tehnica, București, 1972;
4. Anexe
A.1.Schema de operatii
4.Anexe
A.2.Schema de flux tehnologic
1 - vas de stocare pentru butanoatul de vinil; 15 - vas de masura diclormetan;
2 - pompa centrifuga pentru butanoatul de vinil; 16, 19 - pompe centrifuge pentru fracțiile
3 - vas de masura pentru butanoatul de vinil; rezultate;
4 - bioreactor pentru
reacția de acilare; 17, 18, 20 - vase de stocaj fracții rezultate
5 - filtru Nutsche de vid; de
la coloana cromatografica;
6- vas de stocaj masa de reacție; 21, 23 - concentratoare pentru fracții;
7 - pompa centrifuga pentru masa de reacție; 22, 24 - vase de stocare produși;
8 - vas de masura masa de reacție; 27, 28, 29 - vase de stocare solvenți
9 - pompa centrifuga pentru acetona; rezultați la concentrare;
10 - vas stocaj acetona
11 - evaporator;
12, 25, 26 - condensatoare pentru solvenți;
13 - vas stocaj diclormetan;
14 - coloana cromatografica;
Copyright © 2024 - Toate drepturile rezervate