 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
CHIMIA MEDIULUI
C. Compusii sulfului
Principalii compusi cu sulf prezenti in atmosfera sunt:
dioxidul de sulf (SO2),
trioxidul de sulf (SO3),
hidrogenul sulfurat (H2S),
compusi organici cu sulf: dimetilsulfura ((CH3)2S) si dimetil disulfura ((CH3)2S2).
Dioxidul de sulf (SO2)
Ø SO2 se gaseste in atmosfera in cantitati reduse si variabile, astfel atmosfera oraselor industriale contine urme de SO2, rezultat in principal din procesele de ardere a combustibililor fosili.
Ø SO2 poate ajunge in atmosfera si ca urmare a eruptiilor vulcanice.
Proprietatile fizice ale SO2
Ø SO2 este un gaz incolor, cu miros inecacios de pucioasa arsa;
Ø nu arde si nu intretine arderea;
Ø este foarte solubil in apa (11,3 g in 100 cm3 la 200C), iar solutiile apoase contin ioni de HSO3- si SO32- motiv pentru care sunt bune conductoare de electricitate.
Proprietatile chimice ale SO2
1. Proprietati reducatoare - sunt cele mai importante proprietati ale dioxidului de sulf. Ele sunt responsabile pentru problemele de poluare a mediului sau care intervin in transformarile suferite de acest poluant in atmosfera. Sub actiunea diversilor oxidanti SO2 este transformat in SO3.
a) daca oxidantul este unul metalic se va forma sulfatul metalului respectiv. De exemplu oxidul de plumb reactioneaza energic cu dioxidul de sulf dupa cum urmeaza:
![]()
b) atat NO2 cat si HNO3 reactioneaza cu SO2 conform reactiilor:
![]()
![]()
c) Halogenii (I2 si Br2) reactioneaza cu SO2 in prezenta apei ducand la formarea acidului sulfuric si a acidului halogenat corespunzator:
SO2 + I2 + H2O
![]() H2SO4
+ 2HI
H2SO4
+ 2HI
SO2 + Br2 + H2O
![]() H2SO4
+ 2HBr
H2SO4
+ 2HBr
Consumul de iod sau de brom poate servi la dozarea dioxidului de sulf.
d) Apa oxigenata reactioneaza cu dioxidul de sulf ducand la formarea acidului sulfuric:
SO2 + H2O2
![]() H2SO4
H2SO4
a) Reactia cu tetracloromercuriatul de sodiu:
![]()
Complexul format este mult mai stabil decat solutiile apoase de dioxid de sulf, motiv pentru care reactia serveste la fixarea dioxidului de sulf din atmosfera in vederea determinarii ulterioare.
Barbotarea se face in formaldehida si conduce la formarea acidului hidroximetil sulfonic:
![]()
Acidului hidroximetil sulfonic da cu clorhidratul de p-rozanilina un compus colorat care se decoloreaza in prezenta urmelor de acid clorhidric. Dupa mai multe trepte intermediare se obtine un compus colorat a carui intensitate este proportionala cu concentratia de SO2.
b) Reactia cu nitroprusiatul de sodiu (Na2[Fe(CN)5NO]*2H2O). În reactia de mai jos este prezentat ionul de nitroprusiat in reactie cu ionul de trioxid de sulf si apa:
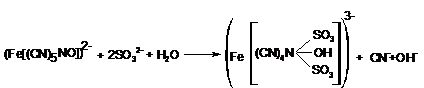
Complexul format, este instabil, si se stabilizeaza ca sare de zinc, solubila in piridina, de culoare rosie. Intensitatea culorii se coreleaza cu concentratia de dioxid de sulf.
3. Reducerea la hidrogen sulfurat se poate realiza trecand dioxidul de sulf peste o retea de platina incalzita la 700-9000C, in prezenta de hidrogen. Are loc reactia:
SO2 + 3H2 ![]() H2S + 2H2O
H2S + 2H2O
Efecte fiziopatologice
Efectul principal al dioxidului de sulf il constituie actiunea sa asupra sistemului olfactiv si a cailor respiratorii superioare, actiune care devine iritanta la concentratii de aproximativ 20 mg/m3. Asupra plantelor se manifesta prin leziuni locale ce variaza dupa gradul atacului, determinand necroza celulelor sau distrugerea tesuturilor.
Trioxidul de sulf (SO3)
Surse de obtinere:
Ø SO3 este produs in timpul arderii combustibililor fosili, dar intr-o masura mult mai mica decat SO2.
Ø Cantitatea de trioxid de sulf formata in timpul proceselor de ardere depinde foarte mult de conditiile de reactie, mai ales de temperatura si variaza intre 1% si 10% din totalul oxizilor de sulf.
Ø Mecanismul simplificat de formare a SO3 poate fi reprezentat prin reactia de mai jos:
![]()
Cantitatea mica de SO3 produs conform reactiei de mai sus este rezultatul a doi factori: viteza de
reactie si concentratia trioxidului de sulf. La temperaturi ridicate, echilibrul se stabileste rapid
datorita vitezei mari. La temperaturi scazute reactia are loc atat de incet incat conditia de echilibru
corespunzand unei concentratii mari de trioxid de sulf nu este niciodata atinsa.
Ø O alta sursa de obtinere a trioxidului de sulf o constituie instalatiile chimice de fabricare a acidului sulfuric. În contact cu vaporii de apa din atmosfera trioxidul de sulf este transformat rapid in aerosoli de H2SO4 procesul fiind insotit de fumegare. Prezenta SO3 liber in atmosfera nu a fost niciodata demonstrata si este de fapt foarte improbabila. Acesta este motivul pentru care analiza SO3 este intreprinsa numai la emisie.
Proprietati fizice. La temperatura obisnuita trioxidul de sulf este un lichid incolor, care fierbe la 44,80C; la 16,80C se solidifica, formand o masa alba cristalina.
Proprietati chimice
a) SO3 reactioneaza energic cu apa, cu degajare de caldura:
SO3 + H2O ![]() H2SO4,
H2SO4, ![]()
Reactia se petrece in atmosfera si conduce la formarea cetii acide.
b) reducerea la hidrogen sulfurat se realizeaza in aceleasi conditii ca si cazul SO2:
![]()
Hidrogenul sulfurat (H2S)
Surse de obtinere
Ø Prezenta H2S in atmosfera se datoreaza in general unor cauze naturale: anumite fermentatii anaerobe cu caracter reducator pot sa transforme in hidrogen sulfurat sulful din materia organica iar dioxidul de carbon (respectiv acidul carbonic) deplaseaza hidrogenul sulfurat.
Ø Anual se degaja de pe uscat circa 80 milioane tone de H2S in timp ce degajarile din oceane ating aprox. 200 mil. tone.
Ø Unele gaze naturale contin cantitati importante de hidrogen sulfurat si este posibil ca o parte din ele sa ajunga in atmosfera. Aici intra acele emisii care provin din arderea combustibililor ce contin sulf atunci cand conditiile de desfasurare a combustiei nu sunt bine reglate (adica cantitate insuficienta de aer sau oxigen).
Ø În titei hidrogenul sulfurat se gaseste ca atare sau ca sulfuri organice. În timpul prelucrarii titeiului compusii cu sulf sunt convertiti in hidrogen sulfurat sau mercaptani.
Ø Deoarece otraveste catalizatorii utilizati la tratarea produselor petroliere sulful trebuie eliminat. Aceasta face ca unitatile de cracare, rafinare catalitica si de recuperare a sulfului sa se degaje hidrogen sulfurat. În acelasi timp din rafinari au loc scapari de gaze care contin si hidrogen sulfurat.
Proprietati fizice
H2S este un gaz incolor, cu miros caracteristic, neplacut, de oua stricate. Este mai greu decat aerul si foarte toxic. Hidrogenul sulfurat este solubil in apa: la 200C solutia saturata contine 3,85 g sau 2,67 l de H2S la litru.
Proprietati chimice
a) Reactii de oxidare
H2S arde in aer formand
apa (vapori) si SO2: 2H2S + 3O2 ![]() 2H2O + 2SO2
2H2O + 2SO2
Cand oxigenul este in cantitate insuficienta, in loc de dioxid de sulf se separa sulf:
2H2S + O2 ![]() 2H2O + 2S
2H2O + 2S
b)
Reactia cu metalele. H2S reactioneaza cu
diferite metale formand sulfuri. Exemplu: o piesa de argint
tinuta intr-o atmosfera de H2S se acopera
cu un strat de sulfura de argint, de culoare neagra. Reactia
este folosita pentru identificarea unor urme de H2S si de
fapt se petrece intre ionii metalici respectivi si ionul de S2-: H2S + 2Ag+ ![]() Ag2S + 2H+
Ag2S + 2H+
c) Formarea albastrului de metilen. H2S reactioneaza cu p-aminodimetilanilina, in prezenta ionului de Fe3+ ca oxidant si formeaza albastru de metilen (e o pulbere verde inchis, iar cand e dizolvat in apa da o culoare albastra. Albastru de metilen este utilizat ca indicator redox in chimia analitica):

albastru de metilen
Reactia este foarte sensibila si este utilizata pentru dozarea hidrogenului sulfurat.
d)
Actiunea iodului asupra hidrogenului
sulfurat are ca rezultat
separarea (precipitarea) sulfului, condorm reactiei: H2S + I2
![]() S
S![]() + 2HI
+ 2HI
Reactia este cantitativa si serveste la dozarea hidrogenului sulfurat din gaze. Pentru aceasta, un volum masurat de aer continand H2S se barboteaza prin solutia de iod apoi se determina iodul neconsumat prin titrare cu tiosulfat de sodiu.
e) Oxigenul din aer oxideaza incet H2S dizolvat in apa astfel ca o solutie de H2S pastrata mult timp in contact cu aerul depune sau separa sulf.
D. Compusii azotului
Cei mai importanti compusi cu azot implicati in poluarea atmosferei sunt oxizii de azot si amoniacul (respectiv sarurile de amoniu).
Se cunosc mai multe variante de oxizi de azot:
N2O - oxid de diazot sau protoxid de azot;
NO - monoxid de azot;
NO2 - dioxid de azot;
N2O3 - trioxid de diazot sau anhidrida azotoasa;
N2O4 - tetraoxid de diazot (forma dimera a dioxidului de azot);
N2O5 - pentaoxid de diazot sau anhidrida azotica;
Desi sunt dovezi si pentru existenta oxizilor NO3 si N2O6, ei nu au fost inca bine definiti.
Dintre toti oxizii mentionati numai NO si NO2 joaca un rol important in problemele de poluare atmosferica. Ansamblul acestor oxizi este reprezentat prin formula NOx.
Monoxidul si dioxidul de azot
Metode de obtinere
Ø NO este emis in cantitati mari de numeroase procese biologice, in particular ca rezultat al activitatii unor bacterii.
Ø Sursele tehnologice emit NO ca urmare a
reactiei directe dintre azotul molecular si oxigenul moelcular atunci
cand aceste doua componente se gasesc impreuna la temperaturi
ridicate: ![]()
Ø NO se combina relativ repede cu oxigenul mlecular pur din aer dand dioxid de azot (hipoazotida).
Ø NO2 se mai formeaza ca produs secundar in procesul de obtinere a acidului azotic, prin oxidarea catalitica a amoniacului.
Proprietati fizice
NO este un gaz incolor, putin solubil in apa si greu de lichefiat. În stare lichida sau solida are culoare albastra, este paramagnetic, iar in stare gazoasa moleculele de NO sunt practic monomeri. În stare lichida se observa o slaba diemrizare, in timp ce in stare solida dimerizarea este mult mai avansata si paramagnetismul dispare.
NO2 este un gaz de culoare brun-roscat, mai greu
decat aerul si cu un miros caracteristic. Hipoazotida si
tetraoxidul de diazot constituie un sistem in echilibru: ![]() deplasarea spre unul dintre cei doi componenti
depinzand de temperatura de peste 1400C exista forma
monomera, NO2, in timp ce la aproximativ -110C
forma de existenta este dimerul.
deplasarea spre unul dintre cei doi componenti
depinzand de temperatura de peste 1400C exista forma
monomera, NO2, in timp ce la aproximativ -110C
forma de existenta este dimerul.
Proprietati chimice
Reactii de oxidare. NO poate fi oxidat de numerosi oxidanti:
a) oxigenul atomic. Reactia este posibila, dar nu joaca practic nici un rol in transformarea NO la NO2 in atmosfera datorita faptului ca reactia nu este reversibila.
NO + O ![]() NO2
NO2
b) oxigen molecular - realizeaza oxidarea relativ lenta a NO in atmosfera:
2NO + O2 ![]() 2NO2, dar
procesul este accelerat in prezenta hidrocarburilor.
2NO2, dar
procesul este accelerat in prezenta hidrocarburilor.
c)
ozonul: NO + O3 ![]() NO2 + O2.
Aceasta reactie poate fi utilizata pentru transformarea NO
in NO2, in vederea dozarii sale ulterioare.
Reactia este extrem de rapida, dar sunt necesare unele precautii
pentru ca, pe de o parte, ramane un rest de ozon in gazele
rezultate si pe de alta parte reactia poate continua cu
transformarea unei parti din NO2 in pentaoxid:
NO2 + O2.
Aceasta reactie poate fi utilizata pentru transformarea NO
in NO2, in vederea dozarii sale ulterioare.
Reactia este extrem de rapida, dar sunt necesare unele precautii
pentru ca, pe de o parte, ramane un rest de ozon in gazele
rezultate si pe de alta parte reactia poate continua cu
transformarea unei parti din NO2 in pentaoxid:
2NO2 + O3 ![]() N2O5
+ O2
N2O5
+ O2
Pentru a inlatura aceste deficiente se recurge la incalzirea gazelor, dupa reactie, la o
temperatura moderata, cand ozonul si pentaoxidul de diazot se distrug, formand oxigen si
dioxid de azot.
d) permanganatul de potasiu - oxideaza in solutie apoasa, NO la NO2
![]()
Aceasta reactie era folosita pentru transformarea NO in NO2, in vederea dozarii ulterioare. Problema este ca se formeaza demonstrat si cantitati neglijente de acid azotic, motiv pentru care reactia nefiind cantitativa nu se recomanda pentru dozare.
e) Reactia cu cromatul de potasiu in mediu de acid sulfuric. În solutie sulfurica cromatii oxideaza la NO si NO2. Se utilizeaza o pasta de cromat de potasiu si acid sulfuric, repartizata pe un suport poros, dar s-a constatat ca umiditatea joaca un rol considerabil astfel incat conditiile prin care se poate obtine transformarea NO la NO2 sunt greu de reprodus. Reactia care are loc este:
![]()
Daca continutul de vapori de apa din aerul de analizat este foarte scazut, reactivul se usuca
si reactia nu are loc. Daca el este prea ridicat, reactivul se dilueaza si reactia de asemenea se
opreste.
În acest caz este indicat ca tubul de reactiv ce contine CrO3 sa fie incalzit la 600C sau sa fie
precedat de un tub cu acid fosforic 85%, care sa fixeze apa din curentul de aer supus
analizei.
Actiunea apei. NO nu reactioneaza cu apa, fata de NO2 care reactioneaza conform reactiei:
2NO2 + H2O ![]() HNO2 + HNO3,
formand acid azotos si acid azotic.
HNO2 + HNO3,
formand acid azotos si acid azotic.
Reactia cu hidroxizi alcalini
a) Cand este singur NO nu reactioneaza cu hidroxizii alcalini
b) NO2 singur - are o comportare asemanatoarea cu cea fata de apa:
2NO2 + 2NaOH ![]() NaNO2 +
NaNO3 + H2O
NaNO2 +
NaNO3 + H2O
c) NO + NO2 . În cazul amestecului celor doi oxizi trebuie luate in considerare mai multe posibilitati:
NO +
NO2 se gasesc in
cantitati stoechiometrice, in aceste conditii amestecul de
NO si NO2 reactioneaza ca si cum ar fi trioxid
de diazot (N2O3): N2O3 + 2NaOH ![]() 2NaNO2 + 2H2O.
Astfel un mol de NO2 formeaza doi moli de azotit
(considerand ca NO nu reactioneaza).
2NaNO2 + 2H2O.
Astfel un mol de NO2 formeaza doi moli de azotit
(considerand ca NO nu reactioneaza).
Daca NO este in cantitate superioara fata de NO2, numai partea din NO echivalenta lui NO2 va reactiona conform schemei de mai sus, ca N2O3, iar restul va trece prin solutia alcalina fara sa reactioneze.
Daca NO2 este in cantitate mai mare decat NO, atunci cantitatea echivalenta NO reactioneaza ca N2O3, iar excesul se comporta ca si cum ar fi singur.
Deoarece NO2 atmosferic este totdeauna insotit de NO, reactia cu hidroxizii alcalini nu poate fi folosita ca atare pentru dozare.
Actiunea aminelor
Atunci cand o proba gazoasa ce contine NO si NO2 se barboteaza prin solutia unei amine aromatice, NO nu reactioneaza, iar NO2 se transforma mai intai in nitrit. Acidul azotos reactioneaza cu amina si formeaza o sare de diazoniu, dupa cum urmeaza:
HNO2 + H2N - Ar + H+
![]() Ar - N+
Ar - N+![]() N + H2O
N + H2O
Sarea de diazoniu rezultata este folosita pentru obtinerea unui colorant azoic, in urma reactiei cu o alta amina. Cantitatea de NO2 se apreciaza prin masurarea intensitatii colorantului format. Practic se foloseste ca amina aromatica diazotata acidul sulfanilic:
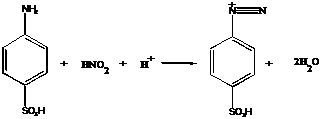
Sarea de diazonium rezultata se cupleaza cu α-naftiletilendiamina (reactivul Saltzman) si astfel se formeaza un colorant azoic de culoare rosie:
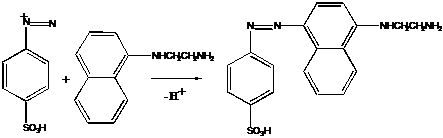
Actiunea ionilor iodura
NO2 reactioneaza cu ionii iodura, in mediul acid, rezultand iodul:
NO2 + 2I- + 2H+ ![]() NO + I2 + H2O
NO + I2 + H2O
Aceasta reactie sta la baza unei metode coulometrice de determinare a NO2.
Efecte ale oxizilor de azot
Amestecul diferitilor oxizi de azot printre care NO2 este cel mai mare agresiv, constituie un gaz iritant cu actiune toxica asupra cailor respiratorii.
Prezenta oxizilor de azot in atmosfera produce vatamarea plantelor.
Este dificil de stabilit cu exactitate care efecte sunt rezultatul direct al oxizilor de azot si care al poluantilor secundari formati prin reactii chimice in care sunt implicati oxizii de azot. Cele mai serioase efecte de poluare determinate de prezenta oxizilor de azot in atmosfera sunt cele care duc la formarea asa numitilor oxizi fotochimici.
Amoniacul (NH3)
Amoniacul este un component natural al atmosferei, fiind prezentat la nivel de urme, ca rezultat al actiunii unor bacterii din sol. Sursele antropogene sunt reprezentate de rupturile din conductele de canalizare si de diverse scapari industriale.
Proprietati fizice
NH3 este un gaz mai usor ca aerul, fara culoare, cu gust arzator si cu miros caracteristic. Solutiile apoase de amoniac au caracter bazic si sunt cunoscute ca hidroxid de amoniu.
Proprietati chimice
Amoniacul este un compus stabil la temperatura obisnuita. Sub actiunea scanteilor electrice sau in prezenta unor catalizatori la incalzire se descompune partial in componente:
2NH3 ![]() N2 + 3H2
N2 + 3H2
NH3 nu arde in aer dar arde
in oxigen formand apa si azot: 4NH3 + 3O2
![]() 6H2O + 2N2
6H2O + 2N2
Amoniacul actioneaza atat in stare de gaz cat si in solutie cu acizii formand saruri de amoniu:
NH3 + HCl ![]() NH4Cl
NH4Cl
NH3 + HNO3 ![]() NH4NO3
NH4NO3
NH3 + H2SO4 ![]() (NH4)2SO4
(NH4)2SO4
Astfel de reactii se petrec in atmosfera, conducand la conversia dioxidului de sulf si a oxizilor de azot la particule de sulfat, respectiv nitrat de amoniu.
Copyright © 2024 - Toate drepturile rezervate