 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Structura apei
1. Structura atomica si electronica a moleculei de apa
Molecula de apa este formata din doi atomi de
hidrogen legati covalent de un atom de oxigen. Deoarece atomii
constituienti prezinta fiecare cate trei izotopi ai hidrogenului ( ![]() ,
, ![]() -deuteriu,
-deuteriu, ![]() -tritiu) si oxigenului (
-tritiu) si oxigenului ( ![]() ,
,![]() ,
,![]() ), teoretic ar putea exista 18 specii moleculare de apa.
Insa, in natura specia cea mai raspandita este apa
obisnuita (H2O) formata din izotopii
), teoretic ar putea exista 18 specii moleculare de apa.
Insa, in natura specia cea mai raspandita este apa
obisnuita (H2O) formata din izotopii ![]() si
si ![]() , celelalte specii
moleculare fiind in proportii foarte mici, de exemplu apa grea (D2O)
reprezinta doar 0,0166%.
, celelalte specii
moleculare fiind in proportii foarte mici, de exemplu apa grea (D2O)
reprezinta doar 0,0166%.
Atomii constituenti ai moleculei de apa se gasesc in acelasi plan, legaturile covalente O - H au o dimensiune de cca. 0,99 Å, iar unghiul dintre ele este de aproximativ 1050 (Fig.).
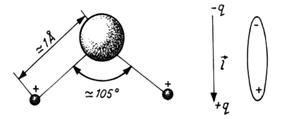
Fig. Schema unei molecule de apa.
Din cauza caracterului mult mai electronegativ al oxigenului comparativ cu al hidrogenului, densitatea de sarcina negativa este maxima in vecinatatea oxigenului, astfel incat pozitia centrului de greutate al sarcinii negative nu coincide cu cea a sarcinii pozitive. Deci, apa este o molecula polara, avand un moment de dipol permanent:
![]() (4.1)
(4.1)
unde q - sarcina dipolului, l - distanta dintre centrele de greutate a sarcinilor dipolului, iar valoarea momentului dipolar este p = 1,858 D (1Debye = 3,33·10-30 cm).
Deoarece moleculele de apa mai pot poseda momente de cuadrupol, octopol etc, au tendinta de a interactiona electrostatic intre ele, cu ionii din mediile intra- si extracelulare, precum si cu gruparile hidrofile ale macromoleculelor. Fiind polare, moleculele de apa se orienteaza in campuri electrice si magnetice.
Din punct de vedere electronic, molecula de apa are 10 electroni a caror distributie spatiala este urmatoarea: 2 electroni se gasesc in permanenta in vecinatatea oxigenului pe orbitalul 1s, iar ceilalti 8 electroni de valenta graviteaza pe 4 orbitali bilobati care au axele de simetrie de-a lungul directiilor ce unesc varfurile unui tetraedru cu centrul acestuia (Fig. 4.2.).
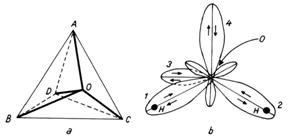
Fig. 4.2. Structura tetraedrica a moleculei de apa.
2. Asociatii moleculare
Molecula de apa poate forma legaturi coordinative cu alte molecule de apa, legaturi cunoscute sub numele de punti de hidrogen (legaturi de hidrogen).
Nucleele celor doi atomi de hidrogen de pe orbitalii bilobati 1si 2 (Fig.4.2.), fiind slab ecranati de catre norul electronic, genereaza un camp electric puternic, determinand fiecare cate o interactiune electrostatica asupra unui atom de oxigen, ce apartine altei molecule de apa. Deci, se formeaza doua punti de hidrogen cu doua molecule de apa. De asemenea, electronii ce se misca pe orbitalii 3 si 4 pot trece partial pe orbitalii atomilor de hidrogen, care apartin altor doua molecule de apa vecine, realizandu-se inca doua legaturi de hidrogen.
In consecinta, o molecula de apa poate realiza patru punti de hidrogen (Fig. 4.3.). Lungimea unei legaturi de hidrogen este de 1,77 Å.
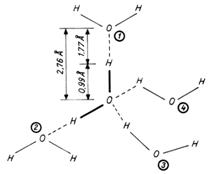
Spatial, cele patru molecule de apa asociate prin punti de hidrogen sunt dispuse in varfurile unui tetraedru, iar molecula tetracoordinativa se afla in centrul tetraedrului.
In stare solida, puntile de hidrogen sunt permanente, in schimb in stare lichida ele se formeaza sau se rup neincetat datorita agitatiei termice. Asocierea moleculara, determina aparitia unor microdomenii ordonate de molecule de apa, dar cu o existenta foarte scurta, deoarece timpul de viata al unei punti de hidrogen in stare lichida este de 10-9 secunde.
Copyright © 2024 - Toate drepturile rezervate