 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
STUDIUL UNEI PILE DE CONCENTRATIE
Notiuni teoretice :
Un electrod metalic introdus in solutie apoasa ce contine ionii sai va participa la o reactie redox de tipul :
![]()
![]() red z e- + ox ,
red z e- + ox ,
unde red - atomul neutru, z - valenta ionului, e - sarcina electronului, ox -ionul cu sarcina +z.
Intrucat electronii raman in metal iar ionii trec in solutie, datorita atractiei electrostatice dintre ei, se formeaza la interfata metal-solutie un strat dublu electric. Diferenta de potential datorita stratului dublu electric se opune trecerii unei noi cantitati de ioni in solutie. Sistemul ajunge la echilibru cand tendinta de trecere a ionilor in solutie datorita diferentei de potential chimic intre formele red si ox este anulata de tendinta trecerii in sens opus datorita diferentei de potential electric.

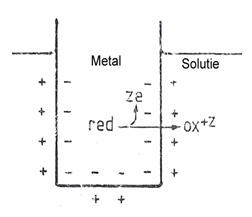
Se poate demonstra (avand in vedere ca potentialul chimic in faza metalica este egal cu potentialul standard) ca potentialul electric al electrodului metalic in raport cu solutia se poate calcula cu formula:
![]() , unde Cox - este concentratia molara a
ionilor in solutie, R - constanta universala a gazelor, T- temperatura
absoluta, z- valenta ionului, F - numarul lui Faraday (96500
C/mol) , E0 - potentialul electric normal al electrodului (potentialul
electric standard daca temperatura este 25○C).
, unde Cox - este concentratia molara a
ionilor in solutie, R - constanta universala a gazelor, T- temperatura
absoluta, z- valenta ionului, F - numarul lui Faraday (96500
C/mol) , E0 - potentialul electric normal al electrodului (potentialul
electric standard daca temperatura este 25○C).
Doi electrozi identici introdusi in solutii de concentratii diferite, C1ox si C2ox, se vor incarca la potentiale diferite, E1 si E2.
E1 = E0 + ![]()
E2 = E0 + ![]()
La punerea in contact electric a celor doua solutii printr-o punte electrolitica (continand o sare ce disociaza in ioni cu mobilitati egale si deci nu produce potential de difuziune) intre cei doi electrozi apare o diferenta de potential electric, E:
E = E2 - E1 = ![]()
Un astfel de dispozitiv se numeste pila de concentratie datorita faptului ca diferenta de potential electric este o consecinta a diferentei de concentratie a ionilor in cele doua solutii.
Cazul discutat mai sus se refera la trecerea in solutie a unor ioni pozitivi. Daca electrodul utilizat se comporta reversibil in raport cu ionii negativi din solutie diferenta de potential se va calcula cu aceeasi formula doar semnul va fi schimbat datorita schimbarii polaritatii stratului dublu electric. In general se va putea scrie:
E = ![]()
Semnul "+" utilizandu-se pentru ionii pozitivi, iar "-" pentru ionii negativi.
Trecandu-se la logaritmi zecimali se obtine forma practica a formulei de mai sus:
E = ![]() , sau
, sau
E = ![]()
In cele ce urmeaza se va studia potentialul electric generat de o pila de concentratie a ionului C1- din solutiile de KCl, dispozitiv ce se apropie de comportamentul ideal.
Electrozii utilizati sunt fire de argint pe care s-a depus electrolitic un strat de AgCl (notati pe scurt electrozi Ag/AgCl) si care sunt reversibili in raport cu Cl-.
Electrodul introdus in solutie mai diluata de KCl va trimite in faza apoasa mai multi ioni Cl-, el incarcandu-se la un potential pozitiv in raport cu cel aflat in solutia mai concentrata. Diferenta de potential, masurata in mV, va fi:
E = - 2302 ![]() sau, dupa
rasturnarea fractiei:
sau, dupa
rasturnarea fractiei:
E = 2302 ![]() (mV).
(mV).
Masurarea diferentelor de potential generate de pilele de concentratie nu poate fi facuta cu instrumente obisnuite datorita faptului ca acestea modifica stratul dublu electric de la suprafata electrozilor prin cantitatea mare de curent ce trebuie sa le strabata. Din acest motiv se folosesc galvanometre sau milivoltmetre electronice care au rezistenta de intrare suficient de mare.
Materiale necesare
Milivoltmetrul cu afisaj digital, 2 electrozi Ag/AgCl montati pe suporti ce se pot deplasa vertical pe stative, 2 pahare Berzelius de 50 ml, fasii de hartie de filtru (ca punti electrolitice), solutie de KCl cu concentratia 1 . 2 moli/litru, cilindru gradat de 50 ml, apa distilata.
Descrierea aparaturii
Dispozitivul experimental este realizat pe doua stative verticale in lungul carora pot fi deplasate suporturile pe care sunt fixati cei doi electrozi si de care pot fi prinse cu cleme paharele Berzelius continand solutiile de lucru. Primul pahar Berzelius va contine solutia de KCl nediluata, de referinta, cu concentratia pe care o vom nota C1 si care ramane nemodificata pe tot cursul experientei. Al doilea pahar Berzelius va contine solutii de concentratie variabila, C2, obtinute prin diluarea progresiva a solutiei de referinta. Prin coborarea suportilor, electrozii El1 si El2 pot fi introdusi in solutiile respective. Puntea electrolitica, P, dintre cele doua solutii este realizata cu o banda de hartie de filtru. Cablurile electrozilor El1 si El2 vor fi cuplate la bornele 'referinta' si respectiv, 'masurare' ale milivoltmetrului sau pH-metrului. In cazul utilizarii unui pH-metru butonul de comutare mV-pH se va pune in pozitia 'mV'.
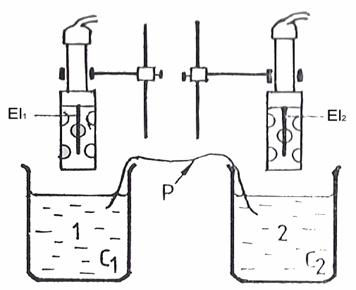
Fig.6.2. Reprezentarea schematica a dispozitivului experimental pentru o pila de concentratie.
Fig.6.3.
Multimetre digitale utilizate pentru inregistrarea diferentei de
potential electric produsa de o pila de concentratie.

Modul de lucru
Se cupleaza milivoltmetrul la retea si se porneste urmarindu-se aprinderea ecranului de afisaj. Nu se va da importanta valorilor indicate de aparat atata timp cat electrozii nu sunt introdusi in solutie iar puntea electrolitica nu este instalata intre cele doua vase cu solutie.
In ambele pahare, dupa ce in prealabil au fost spalate cu apa distilata, se introduce solutie de concentratie C1. Paharul nr1 se va prinde cu o clema pe stativul din stanga, in el va fi introdus electrodul El1 si va fi mentinut astfel pana la sfarsitul determinarilor. In paharul nr.2, prins de stativul din dreapta, va fi introdus electrodul El2 si cu o banda de hartie de filtru se va face legatura cu vasul nr.1. Indicatiile aparatului se vor stabiliza intr-un interval de timp 1-2 minute. Daca intregul sistem functioneaza corect diferenta de potential afisata de aparatul de masura este nula, sau difera cu cel mult 5 mV. Vom nota aceasta valoare E1.
In continuare, se poate scoate electrodul El2 din vasul nr2 si din solutia ce o contine se prepara, prin diluare ˝, 50 ml solutie de concentratie C2 = C1/2 (25 ml solutie intiala + 25 ml apa distilata). Aceasta se reintroduce in vasul nr.2 dupa clatirea lui cu apa. Se repeta masurarea diferentei de potential obtinandu-se valoarea E2.
Se procedeaza ca si mai sus, in mai multe randuri, diluand succesiv solutia din vasul nr.2, astfel incat sa se obtina valorile pentru potentialele E4, E8, E16, E32 corespunzatoare unor solutii din vasul nr.2 de concentratii C1/4, C1/8, C1/16, C1/32, Este foarte important ca la fiecare masuratoare sa se schimbe puntea de hartie de filtru dintre vase. Altfel exista riscul falsificarii rezultatelor prin modificarea concentratiilor din acest vas.
Prezentarea rezultatelor si calcule:
|
C2 C1/1 |
C1/2 C1/4 C1/8 C1/16 C1/32 C1/64 C1/128 |
|
C1/C2 1 | |
|
lg |
0,301 0,602 0,903 1,204 1,505 1,806 2,107 |
|
En(mV) O |
Se va reprezenta grafic dependenta potentialului pilei de concentratie, E, in functie de lg (C1/C2) trasandu-se dreapta care aproximeaza cel mai bine punctele obtinute experimental.
Cu ajutorul graficului se stabilesc valorile pentru panta experimentala a dreptei ke:
ke= ![]()
Ecuatia drepetei experimentale cu valorile astfel gasite se va scrie sub formula:
E = E0 + ke
lg (C1/C2)![]()
Aceasta ecuatie va fi comparata cu cea teoretica:
E = kt . lg (C1/C2)![]() unde kt =
unde kt = ![]() este panta
teoretica pentru masuratori facute in mV.
este panta
teoretica pentru masuratori facute in mV.
Astfel se poate aprecia cat de aproape de comportamentul ideal este pila studiata. Aceasta apropiere este cu atat mai mare cu cat E0 (potentialul datorita asimetriei in functionarea electrozilor) este mai redus si cu cat panta experimentala ke se apropie mai mult de valoarea calculata pentru panta teoretica kt.
Copyright © 2024 - Toate drepturile rezervate