 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
DETERMINAREA VARIATIEI DE ENTALPIE LA DIZOLVARE
In sistemele biologice vii au loc o serie de transformari energetice insotite de producere de caldura. Desigur, rolul principal in producerea caldurii il au procesele de oxidare ale substantelor nutritive, iar o parte mai mica o au si procesele de hidroliza, de dizolvare etc., procese care au loc la presiune constanta (1atmosfera ). Pentru a studia aceste procese s-a introdus o functie de stare numita entalpie (H), care poate fi exprimata cu ajutorul relatiei:
H = U + pV (1) Unde U este energia interna a
sistemului, p este presiunea la care se gaseste sistemul iar V
este volumul lui. Variatia entalpiei ![]() H = H2 - H1 reprezinta cantitatea
de caldura pe care sistemul o schimba cu mediul exterior intr-un
proces izobar,
H = H2 - H1 reprezinta cantitatea
de caldura pe care sistemul o schimba cu mediul exterior intr-un
proces izobar,
![]() H = Q p
, Q p =
H = Q p
, Q p = ![]() U + p
U + p![]() V (2)
V (2)
Procesul de dizolvare a substantelor
este insotit de caldura de dizolvare, care depinde de
interactiunea ionilor sau moleculelor substantei cu moleculele
dizolvantului. La dizolvarea unei substante cristaline in apa au loc
urmatoarele fenomene: a) distrugerea retelei
cristaline de catre moleculele de apa dipolare, care se interpun
intre ionii sarii, energia ce trebuie cheltuita in acest proces se
numeste energie de retea ![]() Hr si b) solvatarea (hidratarea) lor cand are
loc o degajare de caldura datorita interactiunilor
ion-dipol, numita energie de solvatare
Hr si b) solvatarea (hidratarea) lor cand are
loc o degajare de caldura datorita interactiunilor
ion-dipol, numita energie de solvatare ![]() H s.
H s.
Conform legii lui Hess, suma cantitatilor de caldura ce insoteste un proces este constanta.
![]() Hdiz =
Hdiz = ![]() H r +
H r + ![]() H s (3)
H s (3)
Energia de retea ![]() Hr are valoarea de cca 102 cal /mol si este
pozitiva deoarece este absorbita de sistem, iar energia de solvatare
Hr are valoarea de cca 102 cal /mol si este
pozitiva deoarece este absorbita de sistem, iar energia de solvatare ![]() H s are cam aceeasi valoare dar este
negativa, deoarece ea este degajata de catre sistem. Entalpia de
dizolvare (caldura de dizolvare) poate fi pozitiva (dizolvarea endoterma ) sau negativa
H s are cam aceeasi valoare dar este
negativa, deoarece ea este degajata de catre sistem. Entalpia de
dizolvare (caldura de dizolvare) poate fi pozitiva (dizolvarea endoterma ) sau negativa
(dizolvare exoterma ) dupa cum
energia de retea este mai mare sau mai mica decat energia de solvatare. Caldura
degajata sau absorbita se masoara in calorii /mol sau in jouli/mol. Cantitatea
de caldura Q primita sau cedata de un corp de masa m si caldura specifica c depinde de variatia temperaturii
![]() t adica:
t adica:
Q = m
c![]() t (4)
t (4)
Produsul dintre caldura specifica si masa lui se numeste capacitate calorica :
C = m c , Deci:
Q = C
![]() t (5)
t (5)
Pentru determinarea caldurii de
dizolvare se aplica ecuatia calorimetrica conform careia cantitatea de caldura
absorbita de un sistem este egala cu cea degajata de alt sistem,
cu care este in contact. In cazul dizolvarii unor saruri,
caldura primita pentru dizolvare (Qp ) este egala cu cea cedata de
sistemul calorimetric (Qcal ) si de caldura cedata de solvent (Q sol ).
Caldura cedata de calorimetru
este Qcal = C![]() t , iar cea cedata de solvent este Qsol. = m s.c s.
t , iar cea cedata de solvent este Qsol. = m s.c s.![]() t, deci caldura totala este:
t, deci caldura totala este:
![]() H = Q p = Q
sol + Q cal = m sc s
H = Q p = Q
sol + Q cal = m sc s ![]() t + C
t + C![]() t = ( m scs
+ C )
t = ( m scs
+ C )![]() t (6)
t (6)
unde ms este masa solutiei ( masa apei + masa sarii ), c caldura specifica a solutiei care se poate egala cu cea a apei (1 cal/gr.grd.). Constanta calorimetrului C se poate determina din calcul. Entalpia de dizolvare se raporteaza la un mol de substanta.
Modul de lucru:
Se cantaresc urmatoarele: vasul interior al calorimetrului si
agitatorul, masa de apa ce se va introduce in acest vas si sarea pe
care vrem s-o dizolvam, intr-o eprubeta. De exemplu:
utilizati 200 moli apa (1Mapa
= 18 g ) pentru 1mol sare. Se
introduce eprubeta cu sare in apa din calorimetru si se masoara
temperatura din minut in minut, pana ce ea ramane constanta.
Se va folosi termometrul digital. Se varsa continutul eprubetei in
apa, se agita pana la dizolvarea sarii. Se
masoara din nou temperatura, timp de 5 minute, din minut in minut. Pentru a gasi valoarea lui ![]() t se reprezinta grafic temperatura in functie
de timp. Se calculeaza apoi
variatia entalpiei cu relatia (6).
t se reprezinta grafic temperatura in functie
de timp. Se calculeaza apoi
variatia entalpiei cu relatia (6).
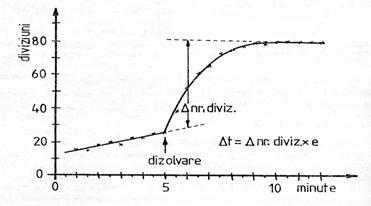 Fig.4.2.Variatia temperaturii in
procesul de dizolvare.
Fig.4.2.Variatia temperaturii in
procesul de dizolvare.
Copyright © 2024 - Toate drepturile rezervate