 | Biologie | Chimie | Didactica | Fizica | Geografie | Informatica |
| Istorie | Literatura | Matematica | Psihologie |
Universitatea București
Facultatea de Biologie
Specializarea Biologie Generala
LUCRARE DE DIPLOMA
Transportori membranari cu structura 3D cunoscuta
INTRODUCERE
Esenta vietii (fenomene biotice) consa in capacitatea structurilor vii de a oxida gradat diferite substante, utilizand mare parte din energia chimica astfel eliberata pentru desfasurarea anumitor reactii chimice ce consuma energie (endergonice). Ansamblul acestor procese de nivel molecular se numeste metabolism și sta la baza vietii, asigurand conditiile energetice pentru fenomenele antientropice de pastrare și dezvoltare a structurilor proprii.
Celula este unitatea fundamentala a materiei vii. La nivel celular se manifesta toate proprietatile generale, fundamentale ale materiei vii: metabolism, excitabilitate, miscare, reproducere, asigurate fiind in mod diferentiat prin specializari ale organitelor celulare.
Componenta principala a membranei celulare este plasmalema, un bistrat fosfolipidic in care se gasesc proteine periferice și integrate, la care se adauga glicocalixul (cu compozitie predominant glicoproteica) la exterior și citoscheletul submembranar și reticul endoplasmic superficial la interior. Citoplasma este compartimentata printr-un sistem de membrane fosfolipidice intracelulare.
Plasmalema delimiteaza celula, asigurand schimburi controlate de substanta și informatie cu mediul extracelular. Ea prezinta structuri specializate pentru diverse aspecte functionale: transferul substantelor hidrofile (pori, canale, transportori), recunoasterea semnalelor biochimice (receptori), legatura cu celulele invecinate (jonctiuni stranse și comunicante), miscarea celulei / lichidului extracelular (cili și flageli).
Permeabilitatea sa selectiva sta la baza diferentelor de compozitie ionica intre mediul intra- și extracelular, ce explica existența potentialului electric membranar de repaus. Variatiile de potential electric membranar au o importanța speciala in semnalizarea la nivel celular.
Transportul transmembranar se realizeaza ca macro- și microtransfer. Dupa sens, macrotransferul poate fi endocitoza și exocitoza. Microtransferul poate fi pasiv sau activ, dupa cum se realizeaza in sensul sau impotriva gradientului electrochimic transmembranar.
Transportul pasiv este de fapt un proces de difuzie prin membrane. In general rata de difuzie printr-o membrana este direct proportionala cu temperatura absoluta, gradientul de concentratie și coeficientul de permeabilitate, determinat la randul sau de coeficientul de partiție intre membrane și mediu. Substantele lipofile difuzeaza usor prin bistratul fosfolipidic, iar cele hidrofile utilizeaza diverse cai hidrofile. In sensul scaderii ratei de transfer și al cresterii selectivitatii, precum și pe baza diferentelor structurale, caile hidrofile pot fi clasificate in pori, canale și transportori. Porii și canalele sunt structuri proteice care delimiteaza cai apoase transmembranare. Canalele prezinta bariere de permeabilitate și de selectivitate, unele din ele operate chimic sau electric. Difuzia transmembranara pe cai preferentiale specifice se numeste facilitate, in opozitie cu difuzia simpla. Difuzia apei prin membrane se numeste osmoza.
In cazul transportorilor, transferul de substanta presupune legarea acesteia de proteina transportoare pe o fața a membranei, o anume modificare conformationala a acesteia (flip - flop, ping - pong, situsuri succesive de legare), și eliberarea substantei transportate pe cealalta fața a membranei. Dupa numarul de specii moleculare transferate pentru un ciclu transportor, exista unitransport și cotransport. Acesta din urma se numeste sinport daca transferul este in acelasi sens și antiport daca sensul transferului este opus. Transportul activ se realizeaza evident numai de catre transportori proteici și poate fi primar sau secundar, dupa cum proteina transportoare prezinta sau nu activitate ATP-azica proprie.
Transportul activ secundar este intotdeauna cotransport, una din substante fiind transportata activ pe baza gradientului pentru o alta. Consumul de energie este indirect, realizandu-se la nivelul unui transportor activ primar ce mentine gradientul mentionat, necesar pentru functionarea celui secundar.
Stimulii fizici din mediu determina la nivel plasmalemal modificari de conductanta ionica, cu variatii consecutive ale potentialului electric transmembranar.
Daca depolarizarea atinge pragul pentru deschiderea unor anume populații de canale ionice voltaj - dependente se declanseaza potentialul de actiune (PA), ce se propaga in toata membrana.
Stimulii chimici sunt reprezentati de diverse substante din spatiul extracelular, cu actiune mai mult sau mai putin specifica. Exista substante bioactive care trec prin membrana și se leaga de proteine receptor din citosol, complexul rezultat actionand ulterior la nivel plasmalemal, asupra fluiditatii membranare. Complexul agonist-receptor realizeaza mai departe transmiterea semnalului pe diverse cai. Unii receptori au in structura lor sau sub controlul direct, canale ionice numite receptor - operate.
Aceasta categorie de canale include si pe cele controlate indirect, prin intermediul proteinelor G sau mesageri secunzi.
Desfasurarea reactiilor anabolice și a altor procese celulare consumatoare de energie necesita disponibilitatea acesteia intr-o forma direct utilizabila, ușor controlabila și in cantitate suficienta. Aceste criterii sunt indeplinite de energia chimica din asa-numitele legaturi fosfat macroergice (esterice fosfat-fosfat sau fosfat-substrat), din diversi compusi cum sunt creatin-fosfatul și nucleotidele, dar cel mai important compus din aceasta clasa este de departe adenozin - trifosfatul (ATP). Reactiile chimice ce se desfașoara cu consum de energie metabolica (sub forma principala de ATP) sunt catalizate direct de enzime cu activitate ATP-azica sau cuplate indirect cu hidroliza ATP, care furnizeaza astfel energia necesara.
Sinteza ATP se realizeaza prin anumite reactii din catabolismul nutrimentelor, cuplate cu fosforilarea ADP, care poate necesita sau nu prezența oxigenului. De aici distinctia aerob/ anaerob sau fosforilare de substrat / oxidative. Cea mai mare parte a productiei de ATP se realizeaza la nivel mitocondrial, dar contributia acestui proces difera in functie de tipul celular (de fapt depinde mai ales de numarul mitocondriilor și incarcarea lor enzimatica), precum și in functie de statusul metabolic și de oxigenare al celulei.
In prezenta lucrare se face referire la anumite clase și tipuri de transportori membranari, avand in vedere structura lor 3D, rolul lor specializat ca liganzi de ATP, necesar metabolismului atat la om cat și la organisme inferioare de tip experimental.
Se va urmari deasemeni și rolul lor la nivel molecular și genetic cu implicatii in studii medicale și aplicatii in diverse alte ramuri experimentale (microbiologie, imunobiologie, biochimie).
CAP.1 SUPRAFAMILIA TRANSPORTORILOR ABC DIN GRUPELE DE LIGANZI AI ATP-ULUI
Transportul specific al moleculelor prin membranele cu bistrat fosfolipidic reprezinta o functie esentiala a tuturor organismelor vii, si un numar variat de transportori specifici au evoluat in vederea indeplinirii acestei functii.
Cea mai mare familie de gene transportoare este cea a suprafamiliei de transportori ABC, specializati in legarea ATP-ului.
Aceste proteine strabat o larga varietate de substraturi, implicate fiind in fluxul de polizaharide, aminoacizi, ioni de metale, peptide si proteine, precum si un numar mare de componente hidrofobe si metaboliti, extra- si intracelular.
Genele ABC sunt esentiale in numeroase procese intracelulare, iar mutatiile ce pot interveni la nivelul lor cauzeaza, sau sunt implicate, in nenumarate anomalii genetice umane incluzand fibroza chistica, boli neurologice, anemie, diverse reactii la administrarea de medicamente.
Secventierea si caracterizarea genomului la eucariote a
permis identificarea completa a tuturor genelor ABC in genomurile de
Proteinele ABC-liganzi ai ATP-ului, folosesc energia in vederea transportului diverselor molecule atat la nivelul membranei plasmatice, cat si la nivelul membranelor intracelulare ale reticulului endoplasmic (RE), peroxizomilor si mitocondriilor.
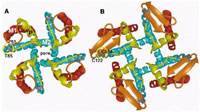
Structura principala de la care se pleaca in diferentierea subclaselor de transpotori ABC este reprezentata de 2 domenii de legatura a ATP-ului, NBF (nucleotide binding folds), domenii de nucleotide cu structuri de legatura, si 2 domenii transmembranare (TM), continand 6 membrane condensate, α - helicate.
![]() TMs
TMs
Fig.1. Structura unui
transportor ABC.
NBD(F)s
https://www.chem.umass.edu
Nucleotidele (NBF) contin 3 domenii de conservare: domeniile Walker A si Walker B, intalnite in toate proteinele - leganzi de ATP, si o semnatura: motivul C, localizat deasupra domeniului Walker B.
Domeniul C este specific transportorilor ABC si ii distinge de alte proteine de legatura a ATP-ului.
Prototipul proteinei ABC contine deci 2 domenii NBF si 2 domenii TM, cu nucleotidele localizate in citoplasma. Componentele hidrofobice sunt scoase din citoplasma dinspre patura interna a membranei catre cea externa sau catre un acceptor de molecule.
Genele ABC sunt profilate, fiind specializate cu functie de transportor deplin cu ambele tipuri de domenii (2 NBF si 2 TM), sau sunt doar cu cate un domeniu din fiecare (1 NBF si 1 TM), functionand doar cu jumatate din componente. Jumatatile de transportori sunt asamblati fie ca homodimeri, fie ca heterodimeri pentru a forma un transportor functional. Genele care codifica transportorii ABC, sunt dispersate in genom si arata un grad ridicat de secvente de aminoacizi identificat la eucariote.
Analize filogenetice au permis ca suprafamilia de gene ABC sa fie impartita in 7 subfamilii, iar 6 dintre ele sunt intalnite atat in genomul mamiferelor cat si al Saccharomyces cerevisae.
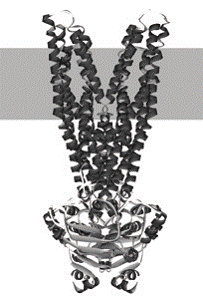
Fig.2 Structura in spațiu a unui transportor ABC
https://www.abctransporters.com/
SUBCLASELE DE GENE ABC - Clasificare si generalitati
1.1.1 SUBCLASA ABCA (ABC1)
Subclasa ABCA este reprezentata de gene "portar" alcatuita din 12 transportori cu functie deplina, separati in 2 subgrupe. Prima subgrupa cuprinde ABCA1-A4, A7, A12, A13, , include 7 gene cu situsuri pe 6 cromozomi, iar a doua subgrupa, genele ABCA5-A6, A8-A10 organizate intr-o retea cap-coada pe cromozomul 17q24.
In ce
priveste expresivitatea pattern- ului cromozomului 17, este reprimata activitatea ABCA5, iar ABCA10 exprimata in
musculatura scheletica, ABCA9 in inima, ABCA8 in ovar, iar ABCA6 in
ficat. Exista ipoteza ca aceste componente ale retelei de gene
de pe cromozomul 17 ar fi de fapt un grup distinct, fiind diferite dupa numarul
intronilor, de 38 pe cromozomul 17 si de 50-51 la restul genelor, dar primele nu se exprima, de
exemplu
Gena ABCA1 este implicata in controlul fluxului de colesterol, in boala numita Tanger, prin membrana (PL - fosfolipidica), catre acceptorii plasmatici specifici, apolipoproteinele.
Expresia ei este indusa de steroli si de receptori nucleari hormonali, receptori oxisteroli si receptori ai acizilor biliari, precum si heterodimer cu receptorii retinoizi. Asigura deasemeni homeostazia in continutul lipidic al membranei cu influente dramatice in plasticitatea si fluiditatea membranei in sine, afectand mobilitatea laterala a proteinelor de membrana precum si asocierea lor cu domenii membranare cu structura lipidica specializata. Gena ABCA4 s-a demonstrat ca fiind exprimata in fotoreceptori si implicata direct in Sindromul Stargardt, un sindrom degenerativ recesiv in copilarie, precum si in distrofii ale celulelor cu con fotoreceptoare, in degenerarea simtului vizual la pacientii in varsta de peste 60 de ani, prin acumularea componentilor cu pigment retinoid, asemanatoare cu boala Stargardt.
Gena ABCA5 este exprimata in pancreas, muschi, si testicule, insa nu se cunoaste inca nici substratul si nici functia propriu-zisa a acestei gene.
Gena ABCA2 este exprimata in oligodendrocite din creier si de asemenea poate functiona ca pompa de eflux pentru medicamentele tumorii ovariene; gena ABCA7 este exprimata in splina si timus. Functionarea acestor gene, precum si a ABCA12 si ABCA13, nu este cunoscuta, desi se presupune ca ar participa in homeostazia lipidelor celulare in diverse medii.
1.1.2 SUBCLASA ABCB (MDR / TAP)
Subfamilia ABCB este alcatuita din 4 transportori cu functie deplina si alti 7 cu jumatate de structura, constituind singura familie cu ambele tipuri de transportori.
Gena ABCB1 (MDR/PGY1) a fost descoperita ca o proteina supraexprimata in linii celulare tumorale rezistente la medicamente. Celulele care prezinta aceasta proteina, arata o reactie de rezistenta la administrarea de medicamente, manifestand rezistenta in transportul unei largi varietati de componente hidrofobe de genul colchicinei, doxorubicinei, adriamicin, vinblastine, digoxin, saquinivir, si paclitaxel.
Gena este exprimata in primul rand in ficat si in bariera sangvina cerebrala, si se presupune ca este implicata in protectia celulelor de agenti toxici.
Secretia colesterolului, fosfolipidelor si a altor componente in bila, este critica pentru functionarea normala a bilei, incluzand si excretia colesterolului si a altor steroli, precum si absorbtia vitaminelor. Proteinele ABCB4 si B11 sunt amandoua localizate in ficat si participa la secretia de fosfatil-colina si saruri biliare. Mutatii la nivelul acestor proteine, respectiv gene, duc la numeroase forme de blocaj intrahepatic, autosomale, caracterizate prin blocaj si mai apoi colaps hepatic, acest fapt reprezentand cauza principala a transplantului de ficat la pacienti copii.
Mutatii ale ABCB4 sunt responsabile si de blocajul la nivel hepatic in cazul sarcinii.
Procesul de recunoastere al antigenului din clasa 1 de histocompatibilitate genica implica digestia celulara a proteinelor straine in peptide scurte, transportate apoi in RE unde formeaza complexe cu clasa I de proteine exprimandu-se pe suprafata membranei celulare.
Genele ABCB2 si ABCB3 (TAP) sunt jumatati de transportori ce formeaza un heterodimer pentru transportul acestor peptide in RE. Familii destul de rare cu mutatii ale acestor gene, prezinta imunitate supresoare, lipsindu-le capacitatea de desfasurare a procesului de recunoastere imunologica.
Jumatatile de transportori ramasi din familia ABCB se exprima in lizozomi (ABCB9), in mitocondrii (ABCB6, B7, B8, si B10). Una dintre aceste gene (ABCB7) este localizata in cromozomul X, iar mutatiile de la nivelul genei sunt responsabile de anemie sideroblastica si ataxie (XLSA/A). Gena de la om ABCB9 poate suplini gena ortoloaga de la drojdie ABCB7, Atm1. Aceasta gena detine rolul de a mentine homeostazia ionilor de metale si a proteinelor citosolice Fe/S in mitocondrii.
1.1.3 SUBCLASA TRANSPORTORILOR ABCC ( CFTR)/(MRP)
CFTR= Cystic Fibrosis TM conductance Regulator (reglator transmembranar implicat in conductanta fibrozei chistice)
MRP= Multidrug Resistance Protein (proteina rezistenta la administrarea medicamentelor)
Subfamilia transportorilor ABCC este reprezentata de 12 transportori completi, ce indeplinesc functie de transport al ionilor, secretiilor toxice si in traducerea semnalului.
Fibroza chistica, supranumita si mucoviscidoza, este o anomalie ereditara caracterizata prin disfunctii la nivelul fiziologiei glandelor cu secretie exocrina, fapt ce coincide cu pierderea functiei transportorului CFTR.
Aceasta proteina este unica, in cadrul clasei de proteine ABC, deoarece contine un canal reglator al fluxului de Cl (AMP). Boala este intalnita la populatiile caucaziene mult mai rar decat in cadrul celorlalte rase umane. Pacientii cu 2 alele CFTR nefunctionale, dezvolta secretii neadecvate de enzime pancreatice ducand la deficiente de ordin nutritional, infectii bacteriene manifestate la nivelul plamanilor si obturarea vaselor deferente provocand sterilitate la barbati. In functie de prezenta sau absenta alelelor CFTR, anomalii pot aparea sau nu, sau intr-un grad variat de infectiozitate.
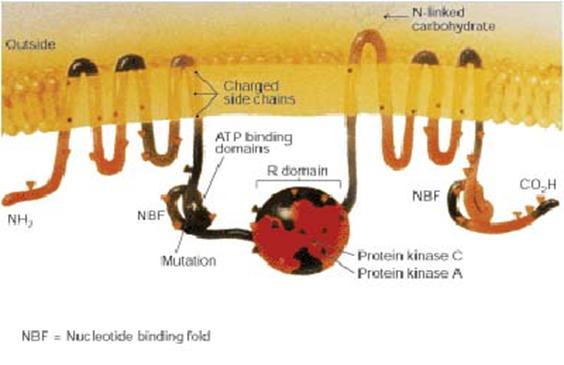
Fig. 3 Alcatuirea proteinei CFTR. https://en.wikipedia.org/wiki/Image:CFTR.jpg
Gena ABCC8 a fost identificata ca fiind locusul specific familiei persistente a hipoglicemiei hiperinsulinice prezenta in stadiul infantil, o anomalie recesiva autosomala caracterizata prin secretia neregulata a insulinei. Cercetari ulterioare au constatat ca gena ABCC8 este un receptor cu afinitate mare pentru medicamentele de gen sulfonylurea.
Acest medicament este folosit pentru cresterea nivelului de secretie a insulinei la pacientii cu diabet nondependenti de insulina injectabila. Medicamentul se leaga de proteina ABCC8 si de cea apropiata ei ABCC9, cu reactia de inhibare a canalului de potasiu KIR6. Un polimorfism al genei ABCC8 a fost asociat cu raspunsul insulinic la pacientii din Mexic, si un raspuns al diabetului de tip II, la pacientii francezi canadieni, dar nu s-a exprimat sub nici o forma la "cohortele" scandinavice.
Celelalte gene ABC sunt 9 gene legate, de rezistenta la administrarea de medicamente.
ABCC1, a fost identificat ca fiind o gena cu rezistenta la medicamente si s-a demonstrat ca transporta conjugate glutationice a unor componente toxice. ABCC2 si C3, deasemeni transportori de conjugate glutationice, precum si a unor anioni organici.
Asemanator cu ABCB1, transportorul ABCC1 confera rezistenta unei intregi varietati de substraturi toxice, dar nu are vreo implicatie in crestere si dezvoltare, desi poate transporta leukotriene C4, un factor chemotactic ce controleaza migratia celulelor dendritice din tesuturile periferice in ganglionii limfatici.
ABCC2 este prezent in hepatocite , implicat in sindromul Dubin - Johnson, mediind transportul de anioni organici.
ABCC6 este implicata in pseudoxanthoma elasticum, mutatii la nivelul acestei gene sunt responsabile pentru disfunctii la nivelul conectivelor tisulare, boala manifestandu-se prin depozitarea Ca in fibrele de elastina, rezultand hemoragii arteriale, sangerari la nivelul tractului gastrointestinal si la nivelul retinei. Gena este exprimata in rinichi si ficat, iar la nivelul acestora se pare ca pseudoxanthoma elasticum nu poate fi localizata, ceea ce ar sugera faptul ca aceasta gena nu are implicatii directe in boala respectiva si nici in transportul sau eliminarea metabolitilor toxici la care au sensibilitate conectivele tisulare.
Proteinele ABCC4, C5, C11, sunt mai mici decat celelalte gene MRP - uri si leaga un domeniu N-terminal, neimplicat in functia de transport.
Genele ABCC4 si C5 confera rezistenta catorva nucleotide incluzand 9-(2-fosfonil-metoxietil), adenina si analogi ai purinei, si poate fi implicata si in secretia de GMP.
1.1.4 SUBCLASA TRANSPORTORILOR ABCD - SUBFAMILIA ADRENOLEUKODISTROFIEI (ALD)
Aceasta subfamilie contine 4 gene ce codifica jumatati de transportori exprimati
exclusiv in peroxizomi.
Una dintre gene, ABCD1, este responsabila pentru forma X-linkata a ALD (adrenoleukodistrofiei), o anomalie caracterizata prin deficiente neurodegenerative si adrenale, tipologie initiata in copilaria tarzie.
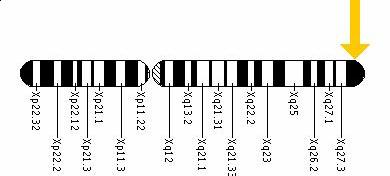
Fig.4. Localizarea citogenetica a genei ABCD1 pe cromozomul Xq28 , pe bratul lung
https://ghr.nlm.nih.gov/gene=abcd1
ALD este prezentata in asociere cu adrenomieloneuropatia, forma infantila a ALD -ului precum si un set de forme adulte. In orice caz se pare ca nu exista o corelatie clara intre fenotipul ALD-ului si genotipul locusului genei ABCD1.
Celulele de la pacientii cu ALD, sunt caracterizate printr-o acumulare de acizi grasi saturati neramificati, iar rolul exact al genei ABCD1 inca nu a fost elucidat in acest proces.
Functiile celorlalte familii de gene ABCD la fel au fost incomplet descoperite, dar similaritatile dintre secventele markate au sugerat implicarea lor in metabolismul acizilor grasi.
Genele ABCD sunt subjugate complexului reglator de la nivel transcriptional, fiind strans legat de celulele lipidice din metabolism, nu este surprinzator faptul ca impart cu subclasele ABCA si ABCG senzitivitatea receptorului de proliferare a peroxizomilor si a familiei receptorilor nucleari, specifica receptorului X retinoid.
1.1.5 SUBCLASA TRANSPORTORILOR ABCE - PROTEINA- LIGAND DE OLIGOADENILAT (OABP) SI ABCF (GCN20 - PROTEINE ABC NEMEMBRANARE)
Subfamiliile transportorilor ABCE si ABCF sunt alcatuite din gene ce prezinta domenii de legare a ATP, strans legate de cele ale celorlalti transportori ABC, dar aceste gene nu codifica domenii transmembranare (TM).
Familia ABCE cuprinde un singur membru, OABP, ABCE1.
Aceasta proteina indeplineste functia de a recunoaste oligoadenilatul produs in urma infectiilor virale.
Genele ABCF au
fiecare cate o pereche de domenii NBF, si cel mai bine caracterizat membru
al acestei familii este gena GCN20 de
1.1.6 SUBCLASA TRANSPORTORILOR ABCG (WHITE) CU STRUCTURA INJUMATATITA
Subfamilia
transportorilor ABCG contine 6 jumatati de transportori ce au un domeniu
NBF la capatul amino-terminal si un singur domeniu TM la capatul
carboxi-terminal: orientare opusa celorlalte gene ABC. La Drosophila,
locusul pentru gena White a fost prima gena cartata. Proteina "white" formeaza
un heterodimer cu alte 2 proteine ABCG inrudite: "brown" si "scarlet",
pentru transportul guaninei si triptofanului in celulele ochiului musculitei.
Aceste molecule sunt precursorii pigmentilor ce dau culoarea ochilor
Surprinzator
exista doar 5 gene ABCG in genomul uman, spre deosebire de cele 15
ABCG1 este exprimata in macrofage si indusa de colesterol.
ABCG4 detine o expresivitate mare in creier. Ar fi interesant de urmarit daca aceste gene interactioneaza sau sunt inrudite cu ceva in functiile indeplinite.
Genele ABCG5 si ABCG8 sunt localizate cap-la-cap pe cromozomul uman 2p15-p16, separate de o grupare de 200 bp. Aceste gene sunt mutate in aceeasi familie cu sitosterolemia, o anomalie caracterizata prin transportul deficient al sterolilor si colesterolului din plante si peste. Pacientii cu sitosterolemie dezvolta deficiente de secretie a sterolilor la nivel intestinal si hepatic. Aceasta dovada genetica indica faptul ca cele doua jumatati de transportori formeaza un heterodimer functional, dovada sustinuta de faptul ca cele doua gene sunt coordonate regulat de colesterol.
 Fig. 5. Identificarea unei gene ABCG5,
implicata in reglarea absorbtiei colesterolului, structura
sterolica si pozitionarea mutatiilor prin punctuatia
neagra si a codonilor stop (cruciulite).
Fig. 5. Identificarea unei gene ABCG5,
implicata in reglarea absorbtiei colesterolului, structura
sterolica si pozitionarea mutatiilor prin punctuatia
neagra si a codonilor stop (cruciulite).
Gena ABCG5 sufera mutatii indeosebi la populatia asiatica, iar cea ABCG8 la caucazieni. Acest lucru sugereaza faptul ca aceste proteine pot forma atat heterodimeri cat si homodimeri pentru a transporta o varietate de steroli (compesterol, stigmasterol, avenosterol, sitosterol, colesterol) intalniti in digestie. Gena de la mamifere ABCG1 este deasemeni indusa de colesterol si implicata in reglarea transportului de colesterol.
Model 2D de structura a genei ABCG2
Gena
ABCG2, un transportor rezistent la actiunea
medicamentelor, poate folosi medicamente de gen anthraciclina in tratamentul
anticancer, la fel si topotecan, mitoxantrone sau doxorubicin ca
substraturi. Aceasta gena este
amplificata sau rearanjata de translocatii cromozomale in
liniile celulare de rezistenta.
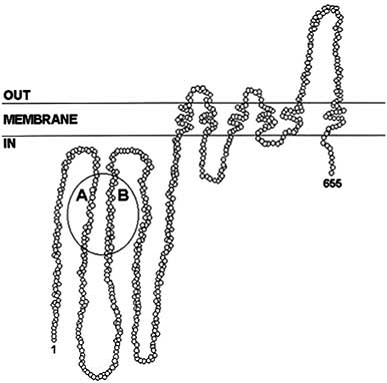
Fig. 6. Structura
2D a unei gene ABCG2 dupa secventierea primara a amino
acizilor si analiza hidropatica
https://www.chem.purdue.edu
Gena are expresivitate mare intr-o subpopulatie de celule stem hematopoietice, in celulele sincitiotrofoblaste, sugerand faptul ca pot fi pompe pentru fluxul de metaboliti toxici de la proviziile sangvine fetale la cele materne.
Gena ABCG3 a fost intalnita in studiu genetic doar la soarece si in alte genomuri de rozatoare. Gena are expresivitate in splina si timus si detine un domeniu de legare a ATP-ului caruia ii lipsesc cateva reziduuri conservate in domeniile Walker A si de Semnal.
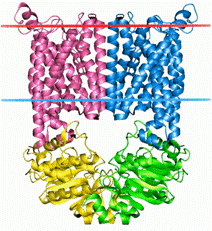
1.2 STRUCTURA TRANSPORTORULUI BtuCD DIN
SUPRAFAMILIA TRANSPORTORILOR ABC, CU APLICATIE
Mult studiata deja bacterie Escherichia coli, Gram-negativa detine 2 membrane de protectie (externa si interna), pe care nutrientii trebuie sa o traverseze pentru a ajunge la citoplasma si pentru a hrani celula. Nutrienti mici sunt difuzati prin membrana externain periplasma prin porii de apa filtranti ai proteinelor numite porine; in acelasi timp, transportorii activi ai membranei externe preiau nutrientii prea mari pentru a se strecura prin porine. Odata aflati in periplasma, transportorii specifici substratului, localizati in membrana interna, muta nutrientii in citoplasma.
O clasa de astfel de transportori ai membranei interne, cunoscuti sub denumirea de transportori periplasmici de legare a proteinelor, apartin casetei ABC de transportori - leganzi ai ATP-ului, suprafamilie ce cupleaza ATP-ul hidrolizat transportului activ.
Acesti transportori- proteina ABC, sunt activi la toate speciile, de la bacterie la om, mediind atat fluxul cat si efluxul diverselor elemente de compozitie celulara.
O paleta
de boli umane, cum ar fi fibroza chistica, au fost detectate ca mutatii
la nivelul genelor codificatoare a transportorilor ABC. Analiza structurala
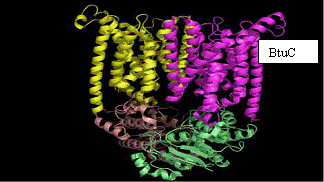
a transportorului BtuCD, de
 Structura
transportorului de vitamina B12 reprezinta o structura dubla, "completa" a unui transportor tipic ABC, constand in 2 domenii ce
traverseaza membrana sau subunitatile BtuC si 2 casete BtuD,
leganzi ai ATP - ului. Cytoplasm
Structura
transportorului de vitamina B12 reprezinta o structura dubla, "completa" a unui transportor tipic ABC, constand in 2 domenii ce
traverseaza membrana sau subunitatile BtuC si 2 casete BtuD,
leganzi ai ATP - ului. Cytoplasm
|

Prima structura completa, descrisa fost cea a MsbA, o proteina implicata in transportul lipidului A prin membrana interna a E. coli de pe partea de sinteza in citoplasma spre destinatia sa finala in membrana externa.
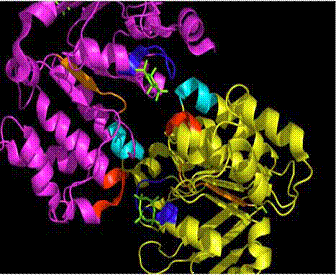
O analiza atenta la nivelul acestor 2 transportori demonstreaza diferente evidente: MsbA contine 6 panglici α-helicate in regiunile transmembranare, in timp ce fiecare subunitate BtuCD contine 10 helice transmembranare ce se impacheteaza intr-un model ce traverseaza prin diferite unghiuri, avand un factor care antreneaza deplierea inainte de a ajunge pe partea opusa a membranei.
Structura BtuCD dezvaluie un canal de transfer pozitionat intre subunitati suficient de larg pentru patrunderea vitaminei B12. Canalul este inchis automat la suprafata citoplasmatica de doua bucle citoplasmatice ce conecteaza α-helicele transmembranare.
Transportorii
ABC ce muta nutrientii cu greutati moleculare mici prin
membrana sunt construiti special cu doar 10 sau 14 helice
transmembranare, 12 reprezentand numarul canonic. Acesta constatare
arata faptul ca cele 20 de helice vazute
Suprafata
de contact dintre caseta si regiunea transmembranara este asemanatoare
Fig. 8. Motivele Walker A (albastru), Walker B
(orange), motivul semnaturi/amprenta (rosu), bucla D (cyan), cyclotetravanadat(verde)
in regiunea de legare a nucleotidelor (scene F5 - nov 28) https://www.chem.umass.edu/
 In prima
subunitate a casetei legand a ATP-ului, numita HisP, o subunitate de
permeaza histidinica de natura bacteriana, cu situsuri de
legare a nucleotidelor, definite prin motivele Walker A si B, rasucite
fata de interfata dimerului HisP.
In prima
subunitate a casetei legand a ATP-ului, numita HisP, o subunitate de
permeaza histidinica de natura bacteriana, cu situsuri de
legare a nucleotidelor, definite prin motivele Walker A si B, rasucite
fata de interfata dimerului HisP.
Ca o consecinta a acestei rasuciri, legatura ATP-ului cu HisP este expusa la suprafata, in contrast cu alte ATP-aze unde ATP-ul este ingropat intr-un buzunar.
Modelul propus de cercetatori,ca amprenta (motiv de semnatura) , Leu - Ser- Gly- Gly- Gln (LSGGQ), specific transportorilor ABC, fiecarei casete si subunitati, este un model opus altor casete de transportori cu legare de ATP.
In ce priveste acest motiv, BtuCD se aseamana structural cu Rad50 implicat in reglajul ADN, si mai putin cu MsbA, iar activarea hidrolizei ATP-ului poate fi asociata cu miscarea acestui motiv LSGGQ ce intra in contact cu fosfatii ATP-lui.
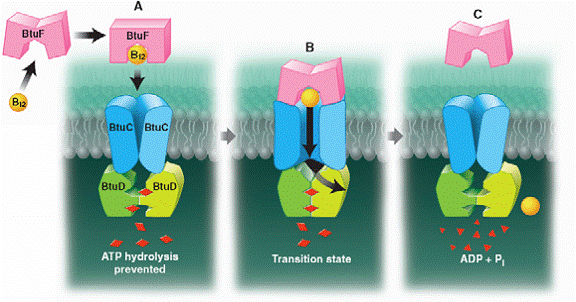
Fig.9. Model ce arata cum hidoliza ATP-ului, in casetele ATP, provoaca schimbari conformationale in domeniile transmembranare asigurand transportul vitaminei B12 in citoplasma. https://www.chem.umass.edu
Sunt eliberati ADP si Pi (fosfat anorganic), in acest proces fiind nevoie de retragerea motivului LSGGQ. Deoarece cele 2 casete de legare a ATP-ului sunt in stransa legatura cu cele 2 subunitati transmembranare, poate fi imaginat faptul ca miscarea celor 2 casete una catre alta, ca raspuns la legarea si hidrolizarea ATP-ului, s-ar putea traduce prin miscari de deschidere a portii dintre cele 2 subunitati transmembranare, permitand astfel vitaminei B12 sa intre in citoplasma prin canalul central.
Ce previne iesirea vit.B12 inapoi in periplasma? S-a demonstrat ca proteina de legatura periplasmica, maltoza, este cuplata pentru transportul acesteia in hidroliza ATP-ului.
A extrage un fragment din sistemul de transport al maltozei, interactiunile stranse de legare in sistemul Btu ce se asteapta sa se dezvolte in timpul hidrolizei ATP-ului (intre proteina-ligand BtuF si subunitatile BtuC, si intre subunitatile BtuD si moleculele ATP de pe interfata dimerului (Fig.9), pot reduce afinitatea de legare a proteinei fata de vitamina B12 la deschiderea portii catre citoplasma.
Aceste schimbari simultane vor permite vit. B12 sa se disocieze si sa intre in citoplasma, exceptand periplasma, care se afla temporar in blocaj datorita prezentei fizice a proteinei BtuF in complexul transportor.
In concluzie, diversitatea structurala a regiunilor transmembranare, demonstrate in analize ale structurii complete a transportorilor ABC, fiecare croit, specializat, pentru indeplinirea unei sarcini bine determinate, subliniaza importanta experimentelor induse la nivelul acestor transportori ABC in vederea obtinerii unei intelegeri depline a antrenarii hidrolizei ATP-ului pentru participarea in diverse procese.
1.3 STRUCTURI MsbA DE Escherichia coli SI Vibro cholera - OMOLOGI AI TRANSPORTORILOR ABC CU
REZISTENTA
Rezistentala medicamente (MDR) este o problema medicala dezbatuta si reprezinta un obstacol major in tratamentul unor boli si in dezvoltarea unor terapii eficiente. In tratamentul cancerului, de exemplu, MDR a restrans eficienta chemoterapiei, rezultand o mai mare rata a mortalitatii in randul pacientilor bolnavi de cancer.
MDR poate creste prin efluxul unor molecule de medicamente la interventia transportorilor localizati in membrana celulara. Unii dintre acestia, cum ar fi P-glicoproteina, poate transporta diverse clase de molecule de medicamente amfipatice si de lipide.
Comparatia
structurala dintre VC-MsbA si MsbA de
Domeniul transmembranar al VC-MsbA este capturat intr-o conformatie inchisa iar structura suporta un model de "atac de forta" al dinamicii transportorului unde NBD-urile opuse se suprapun situsurilor de legare a ATP.
MbsA apartine unei vaste superfamilii de proteine caracterizate printr-o inalta putere de legare a adenozintriphosphatului (ATP), aceea a casetei de transportori ABC.
MsbA transporta lipidul A, un component major al membranei externe bacteriene, fiind singurul transportor ABC esential pentru viabilitatea celulei, transformand-o intr-o tinta cu potential antibiotic.
Studii in-vitro au demonstrat ca MsbA este o ATPaza stimulata specific de catre lipidul A. Mutatii la nivelul transportului au derivat in acumulari letale de lipid A in membrana interna a celulei.
https://www.biophysj.org/
VC-MsbA
detine 68% din identitatea secventelor prezente
In
urma cristalografierii cu raze X, la o rezolutie de 3.8 Ĺ, VC-MsbA are o conformatie
de dimer reprezentat prin fuziunea domeniului transmembranar cu un domeniu NBD,
si la fel ca si
B C A
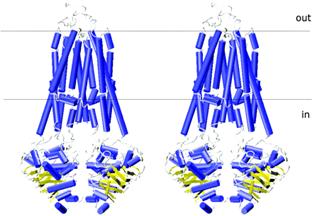
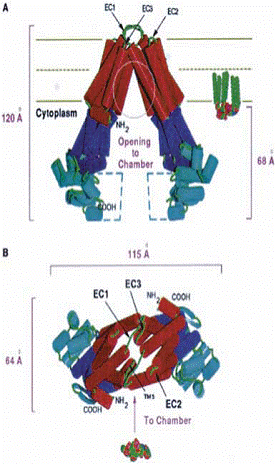 Fig.11.
(A) Vizualizarea camerei de deschidere a
dimerului MsbA, cu toate domeniile, (B) vizualizare din mediul extracelular
membranar, buclele implicate in deplasarea lipidului A (E.coli).(C) imaginea stereo a modelului omolog P-gp generat in baza structurii VC-MsbA.
Fig.11.
(A) Vizualizarea camerei de deschidere a
dimerului MsbA, cu toate domeniile, (B) vizualizare din mediul extracelular
membranar, buclele implicate in deplasarea lipidului A (E.coli).(C) imaginea stereo a modelului omolog P-gp generat in baza structurii VC-MsbA.
|
|||
|
|||
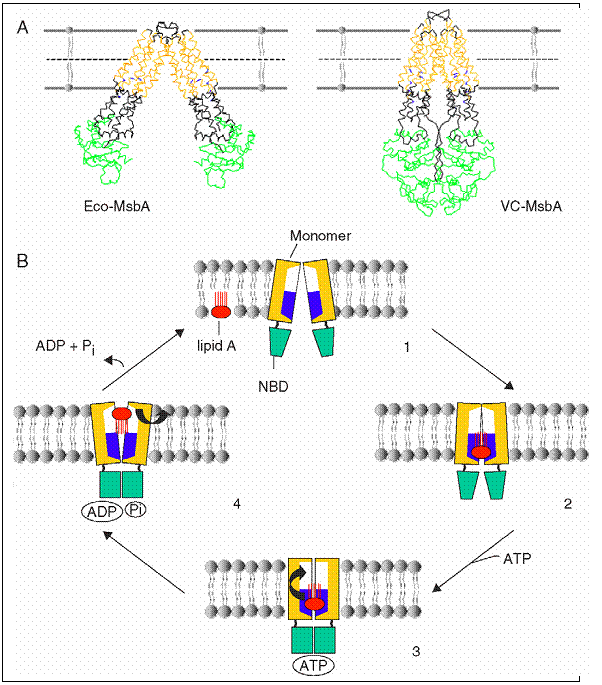
Fig.
Transportorii MDR-ABC sunt unici prin faptul ca extrag lipide sau molecule de medicamente direct din membrana celulara si fie le rasucesc prin flipaza pe celalalt strat, fie le expulzeaza in mediul extracelular.
Pentru indeplinirea acestei functii, MsbA trebuie sa recunoasca in prima faza o molecula de lipid A, urmand extragerea din membrana intr-un micromediu ce favorizeaza mutarea acestuia pe cealalta suprafata. "Camera flipazei " formata la nivelul dimerului Eco-MsbA este regasita inca odata si la nivelul structurii VC-MsbA, ca o confirmare a apartenentei acestui component in arhitectura tipica a MsbA.
In
contrast cu structura de "conformatie deschisa" a Eco-MsbA, NBD-urile de
Un contact analog este observat la importorul vitaminei B12 si poate reprezenta o caracteristica comuna a transportorilor ABC.
Structurile de VC-MsbA si de Eco-MsbA demonstreaza ca NBDurile pot forma un spatiu larg conformational in lipsa nucleotidei, asemanat in studiu cu proteina P-gp umana, arata ca subunitatea TM6, care este practic unita cu NBD, are o miscare de rotire in timpul ciclului catalitic.
Structura VC-MsbA evidentiaza o alta viziune asupra exporterului ABC si mai departe subliniaza ideea ca transportorii MDR-ABC sunt masini moleculare ce scaneaza stratul intern al membranei de substraturi, le accepta lateral intr-o incapere, si le scoate prin flipaza pe suprafata externa a membranei sau pe "mileul" extracelular. Este o noua viziune in starea de inchidere descrisa initial si vine cu o baza structurala pentru mecanismul asociat cu lipid/medicament de "flip-flop".
Impreuna, structurile VC-MsbA si Eco-MsbA pot contribui la elucidarea bazei structural-moleculare a transportului de medicamente de catre transportorii MDR-ABC, ce pot avea un impact foarte important in dezvoltarea unor terapii folosite in tratarea cancerului si a bolilor infectioase.
1.4 STRUCTURA SI MECANISMUL DE TRANSPORT AL GLYCEROL-3-PHOSPHAT-ULUI (Esherichia coli) - GlpT
Superfamilia majora a facilitorilor reprezinta cel mai complex grup de transportori secundari ai membranei celulare. GlpT, prezentat in acest subcapitol, faciliteaza transportul glicerol - 3- fosfatului in citoplasma si a fosfatului anorganic in periplasma.
Jumatatile amino si carboxi-terminale ale proteinei emit o pseudo bisimetrie.
Cele 2 arginine prezente la nivelul porului central aflat in preajma periplasmei, comprima situsul de legare la substrat.
Se presupune ca GlpT opereaza cu un singur situs de legare, alternand mecanismul de acces printr-o rotatie de tip rocker-switch.
Transportul membranar in celula este un proces biologic fundamental mediat de diverse proteine de transport. Un tip foarte important de astfel de proteine sunt transportorii activi de membrana, ce folosesc un gradient solubil pentru conducerea translocatiei in alte substraturi.
Cei 1000 de membri ai suprafamiliei de transportori facilitanti, transporta ioni, zaharide, medicamente, neurotransmitatori, nucleotide, aminoacizi, peptide si alte solutii hidrofile.
Membrii acestei superfamilii sunt prezenti la nivelul celor 3 regnuri de organisme vii, si multi au relevanta medicala sau farmacologica.
La bacterii, aceste proteine functioneaza in principiu pentru preluarea nutrientilor, dar unele se comporta ca pompe de eflux ce confera rezistenta la antibiotice.
La E.coli, G3p serveste ca sursa de energie si de
carbon, si ca precursor al biosintezei de fosfolipide. GlpT este un sistem
antiport de fosfat organic/ fosfat anorganic (Pi ), cu rol in
preluarea de G3p, condus de gradientul Pi . In sisteme reconstituite,
acest transportor poate constitui mediator de schimb Pi /Pi.
GlpT se leaga la substrat in solutii de solvent, iar in urma reconstituirii sub forma de proteolipozomi, mediaza G3P in schimbul de Pi .
Proteina este inrudita cu transportorul hexoza-6-fosfat (UhpT).
Structura analizata in urma cristalografierii cu raze X, la o rezolutie de 3.3 Ǻ, sugereaza un mecanism de translocatie la nivel de subtrat.
Transportorul este alcatuit din 12 α-helice transmembranare cu densitati ce amintesc de cele ale unor lanturi aromatice. Molecula de GlpT are forma unui templu Mayan, cu etaj si parter, ambele rectangulare. Poate fi divizat in 2 domenii asemanatoare astfel incat jumatatea cu capat N-terminal sa fie legata de cea cu capat C-terminal printr-o portiune pseudo bisimetrica perpendiculara pe un plan.
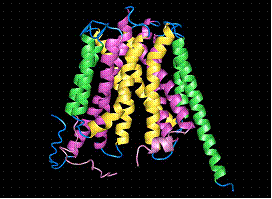
Fig.13. Structura 3D a moleculei de GlpT - transportoare de Glicerol- 3-Fosfat (G3P)/ https://saturn.med.nyu.edu/
O analiza de-a lungul membranei, arata aceasta portiune pseudo bisimetrica extinsa la nivelul tuturor helicelor, H1-H12, si la nivelul celor doua bucle (L1-L2, L11-L12), cu legarea H1-H7, H2-H8 si tot asa.
Interfata domeniului este aproximativ perpendiculara pe axa lunga a moleculei, unde se afla atat resturi proteice polare cat si apolare. Privind din interiorul suprafetei plane a membranei, de-a lungul intefatei domeniului, se poate observa un por inchis pe una din fetele membranei si unul deschis, pe cealalta fata.
In functie de lungimea helicelor este indusa pozitia portiunii pliate; H3, H6, H9, rezultand faptul ca periplasma este plata, dar coboara pe alocuri. In contrast cateva helice transmembranare se extind pe suprafata citoplasmatica a membranei.
In ambele jumatati ale moleculei, helicele formeaza 2 impachetari a cate 3 helice fiecare; H1-H5-H6 si H2-H3-H4 in domeniul cu capatul N-terminal, si H7-H11-H12 si H8-H9-H10 in domeniul capatului C-terminal.
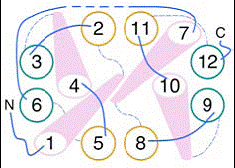
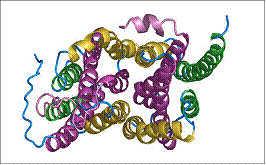
Fig.14 . Jumatati simetrice ale proteinei GlpT transportoare de G3P, model structural 3D https://saturn.med.nyu.edu/
Aceste impachetari sunt inserate in membrana cu orientari opuse.
Fata de porul central, GlpT,emite 8 helice periferice ce formeaza un zid rectangular, cu functie de esafod pentru celelalte 4 helice centrale.
4 dintre helicele centrale, H3 si H6 N-terminale si H9 si H12 in C-terminal, formeaza peretii limitanti, ce contracta zidul, in timp ce peretii deschisi ai zidului ce limiteaza aceasta fortareata, sunt formati din helicele H2 si H11 in fata si H5 si H8 in spate.
Pentru ca ultimele 4 helice au forma curbata, in forma unei "banane", fiecare pereche capata forma incompleta, cu helicele intrand in contact in membrana dar fiind separate una de cealalta in citosol.
Pe partea citosolica a moleculei, cate 2 arginine, reprezentand semnatura proteinelor MFS, definesc cele 2 capete ale buclelor L2-3 si L8-9, bucla citoplasmatica 10-11 contine 2 lizine.
Se presupune ca aceste 2 resturi proteice cu sarcina electrostatica pozitiva, au rol in pozitionarea si orientarea helicelor transmembranare, la insertia proteinei in membrana, fapt observat la proteina Glut.
Mutatii intervenite la nivelul acestei proteine, prin schimbarea Arg de la capatul C-terminal cu o grupare triptofan, produce un sindrom deficitar de Glut.
GlpT purifica in solventi ca un monomer legat la substrat in solutie. Este omolog UhpT de la E.coli, unde s-a demonstrat ca nu doar purifica dar si functioneaza ca un monomer in membrana.
Este posibil ca si GlpT sa functioneze tot ca un monomer la nivel membranar, de aceea calea de translocație prin substrat in respectiva structura este porul central, aflat la interfata domeniilor N-terminal si C-terminal.
Deoarece porul se deschide doar la nivel citosolic, GlpT se afla in conformatie inchisa in absenta substratului. Pe partea cealalta a proteinei se afla o bariera, formata de H1 si H7, spatiul dintre ele fiind umplut cu 9 lanturi aromatice cu rol in inchiderea porului. Nu se mai formeaza cele 2 centuri aromatice de la suprafata membranei, spre deosebire de celelalte proteine reziduale.
Partea interna a porului masoara 10Ǻ cu 8Ǻ, are cateva lanturi laterale de aminoacizi ce patrund in por. Suprafata electrostatica este incarcata pozitiv, indeosebi in capatul cel mai intern.
Suprafata interna a "furnalului", este in mare parte hidrofoba, inafara de extremitatile din exterior, acest lucru sugerand faptul ca ionii si molecululele de apa nu adera la suprafata "furnalului".
Pentru ca legarea la substrat a moleculei GlpT este mediata de gruparea fosfat, are un comportament dibazic la pH fiziologic, legarea la substrat in ce priveste GlpT se presupune ca s-ar realiza datorita potentialului electrostatic pozitiv de suprafata.
Singura arie aflata in centrul porului cu aceasta insusire, se afla la capatul cel mai apropiat porului, in mijlocul membranei.
GlpT opereaza cu un singur situs de legare, pe modelul unui mecanism de acces alternativ.
Fig. 15. Miscarea de tip rocker- switch
specifica GlpT/ https://saturn.med.nyu.edu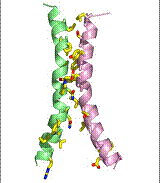
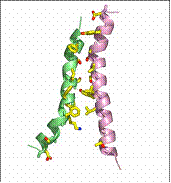
H8 H5 H2 H11
Pentru ca atomii de O ai legaturii fosfatidice a substratului sa formeze legaturi de H la lungimi optime (2.9 Ǻ) in acelasi timp cu gruparile guanidinice si argininice, aceste 2 tipuri de lanturi proteice trebuie sa se miste cam cu 1.4Ǻ mai aproape una de cealalta.
In concluzie, legarea la substrat se presupune ca avand rol de bariera energetica intre fetele interna si externa ale conformatiei proteinei transportoare GlpT, facilitand conversia si permitand gradientului de Pi sa conduca transportul de glicerol-3-fosfat.
Fig.16. Legarea la substrat, harta electrono-densa (2.9Ǻ) https://saturn.med.nyu.edu/
CAP.2. STRUCTURA DE BAZA A POMPEI DE EFLUX AcrB CU MULTIPLE CAPACITATI DE LEGARE A MEDICAMENTELOR.
Pompele de eflux implicate in transportul medicamentelor sunt responsabile de cauzarea diverselor probleme aparute in chemoterapia in cancer si in tratamentul infectiilor bacteriene.
Prin tehnica cristalografierii cu raze X, s-a obtinut o structura trimerica a pompei AcrB de la Esherichia coli, cu 4 leganzi structurali diferiti.
Structurile arata ca 3 molecule de liganzi se leaga simultan la o cavitate centrala de aprox. 5000 Ǻ3 , mai intai prin interactiuni hidrofobice, aromatice si prin interactiuni de tip van der Waals. Fiecare ligand foloseste un set diferit de resturi proteice AcrB pentru legare.
Moleculele de liganzi deseori interactioneaza una cu cealalta, stabilizand legatura.
La bacterii, rezistenta la medicamente este deseori asociata cu transportorii de medicamente, functionand in vederea eliberarii celulei de surplusul de medicamente.
AcrB-ul E.coli, este un transportor energizat de forta proton-motoare, acest lucru arata specificitatea stricta fata de subtrat dovedita in randul celor mai cunoscute pompe de eflux al medicamentelor, recunoscand de la cele mai cunoscute si curent folosite tipuri de antibiotice, pana la simpli solventi.
Proprietatile acestei pompe au fost stabilite prin reconstituire, servind ca prototip al transportorilor bacterieni de medicamente, folosite in studiul mecanismelor de transport cu specific medicamentelor.
Structura trimerica de liber-ligand, a fost determinata prin cristalografiere cu raze X in laboratorul lui Yamaguchi, munca sa deschizand o abordare a detaliilor structurale si de captura a transportorilor.
Fiecare ligand se pare ca leaga in situsuri diferite in cavitatea centrala transmembranara a trimerului, aratand si micile schimbari conformationale in proteina transportor la legarea in substrat.
 Structura
liber-ligandului AcrB arata ca este un homotrimer cu o greutate de
aprox. 11kDa/ unitate.
Structura
liber-ligandului AcrB arata ca este un homotrimer cu o greutate de
aprox. 11kDa/ unitate.
Fig. 17. Structura 3D a trimerului AcrB cu
legarea a 3 dintre substraturi Et, Dq si Cip, vedere din fata, 2
promotori in fata, unul in spate - vestibul./
https://jb.asm.org/cgi/content/full/185/19/5657/F2
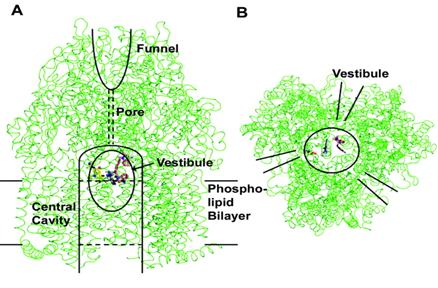
Fiecare subunitate este alcatuita din 12 α-helice transmembranare si 3 domenii largi periplasmice (fiecare de cate 300 de resturi proteice) situate intre helicele α1 si α2, respectiv intre α7 si α8.
Analizele cu raze X au aratat ca cele 3 domenii periplasmice, formeaza in centru o structura de tip "furnal" si un por conector imprejmuit.
Porul este deschis spre periplasma prin 3 vestibuli situati la interfata subunitatilor.
Acesti vestibuli se presupune ca permit accesul direct al medicamentelor prin periplasma, precum si de pe suprafata externa a membranei citoplasmatice.
Cele 3 domenii transmembranare ale promotorilor AcrB, formeaza o cavitate centrala cu un diametru de 30 Ǻ, ce patrunde prin membrana citoplasmatica si se extinde in citoplasma.
In purificarea tipului salbatic de AcrB, acesta a fost supus cristalizarii in prezenta a 4 agenti diferiti structural; rodamina 6G (R6G), ethidium (Et), dequalinium (Dq) si ciproflaxacin (Cip).
La concentratii mai mari de 100 µM, s-a realizat intr-un procent de 50 %, inhibarea reactiei de excludere fosfolipidica, in urma cristalizarii AcrB.
Structura cristalizata arata ca acesti liganzi se leaga in diverse locatii in cavitatea centrala, fiecare folosind un subset diferit de resturi proteice, scazand cu succes rangul de potential al interactiunilor proteina-medicament.
Suprafata interna a partii superioare a cavitatii este inconjurata de resturi hidrofobe, incluzand 12 resturi bine conservate de fenilalanina (Phe386, Phe388, Phe458, Phe459).
Acesti promotori sunt implicati in legarea medicamentelor sugerand ca legarea este determinata de interactiuni atat hidrofobe cat si aromatice π-π.
Un alt lucru important ar fi legarea tuturor liganzilor mai ales in aria care s-ar afla in imediata apropiere a suprafetei externe a substratului lipidic, daca, si asa se pare a fi, aceasta cavitate ar fi de aceeasi origine cu bistratul.
2.1 STRUCTURA COMPLEXULUI R6G
Acest complex contine o bucla intre helicele α3 si α4, si helicele α5 si α6, formand un domeniu de legare in centrul cavitatii centrale cu orientare citoplasmatica.
Cavitatea de legare este extensiva si ocupa cea mai mare parte a jumatatii superioare a regiunii transmembranare. La R6G, situsul de legare al unei singure subunitati se afla la o distanta de 6Ǻ fata de ligand, si contine resturi de Phe386, Ala385, Leu25, Val382, Lys29 si Phe386' de la subunitatea vecina (marcarea numarului prim reprezinta apartenenta restului la subunitatea vecina).
AcrB este un homotrimer, iar fiecare molecula de R6G se leaga la aria ce corespunde granitei dintre cele 2 subunitati vecine, aceste 3 situsuri identice sunt asezate fata in fata in cavitatea centrala.
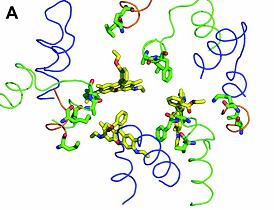
Fig. 18. A.Structura 3D a complexului R6G /legare la substrat.
https://jb.asm.org/cgi/content/
full/185/19/5657/F3
Se asista reciproc si interactioneaza una cu cealalta, formand un buzunar unic, larg pentru legarea a 3 molecule de medicamente.
Lys29 , localizata in vestibulul fiecarei subunitati, pare sa isi indrepte lantul lateral spre grupul estic al fiecarui substrat.
Este de notat faptul ca toate celelalte resturi aflate la distante de 6Ǻ de ligand, sunt aminoacizi hidrofobi, sugerand astfel importanta interactiunilor hidrofobe si, posibil a celor van der Waals in legarea medicamentelor.
Cele 3 molecule de liganzi par sa interactioneze reciproc in stabilizarea configuratiei finale.
2.2. STRUCTURA COMPLEXULUI ET
In complexul AcrB-Et, Et (ethidium), se realizeaza legarea la un situs distinct, dar se pare ca se revarsa peste situsul de legare a R6G.
In comparatie cu legatura R6G, Et se afla legat la 6Ǻ distanta deasupra situsului de legare a R6G, situsul de legare a Et fiind situat mai aproape de vestibul decat cel al R6G.
Resturile de aminoacizi din aria de 6Ǻ ai Et includ Phe386 si Ala385 intr-o subunitate, si Phe386' din subunitatea vecina. Phe388 este usor mai indepartata (7-8Ǻ), Et fiind mai apropiat de Phe386 (~4Ǻ).
Gruparea de fenil a Et este legata deasupra Phe386', interactionand in apropiere cu acest rest. In acest fel, molecula de Et este facuta "sandwich" intre doua subunitati ale transportorului.
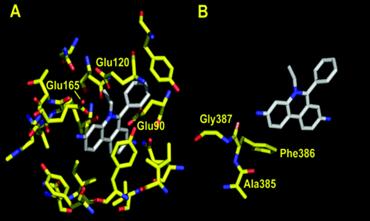
Fig. 18.B (A/B) Structura 3D a legaturii de Et/ https://jb.asm.org/cgi/content/full/185/19/5657/F4
Ca si la R6G, majoritatea acestor legaturi sunt hidrofobe. In buzunarul de legare, carbonilul oxigenului apartinand Phe386 , se afla in apropierea unei grupari amino a Et (la 3,6Ǻ), si poate contribui la neutralizarea incarcaturii formale a substratului. Tripla legatura a moleculelor Et se afla la o distanta de ~3,2Ǻ una fata de cealalta, indicand faptul ca acesti liganzi interactioneaza puternic la nivelul cavitatii centrale.
2.3. STRUCTURA LEGATURII Dq
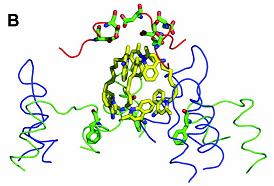
Moleculele cu tripla legare a Dq (dequalinium), ocupa o regiune extinsa a partii superioare a buzunarului de legare. In cei 6Ǻ ai unei molecule Dq se afla 2 resturi de acizi, Asp99 si Asp101 , si un rest de Ile102 , in apropierea zonei superioare a varfului apartinand gruparii quinolinium.
Asp99 este inalt conservat, acest lucru aratand importanta acestui rest in recunoasterea medicamentelor cationice.
 Acest grup de quinolinium
din varf, formeaza un complex strans cu alte grupari de quinolinium si in alte 2 molecule de medicament.
Acest grup de quinolinium
din varf, formeaza un complex strans cu alte grupari de quinolinium si in alte 2 molecule de medicament.
C
Fig.18. C. Structura 3D al complexului Dq, legare la substrat/ https://jb.asm.org/cgi/content/full/185/19/5657/F3
In contrast, partea inferioara a ligandului, cu alte doua grupari de quinolinium, nu se afla la distanta normala de 6Ǻ fata de vreun rest din peretele cavitatii, dar se afla la ~6.3Ǻ departare de cele 2 resturi de Phe (Phe386 si Phe386') ale subunitatilor vecine.
Contactele dintre moleculele Dq sunt dominate, ca si cele din complexele R6G si Et, de interactiuni hidrofobe, exceptand portiunea din varf dominata de prezenta gruparii de quinolinium unde se desfasoara interactiuni cu potential electrostatic puternic.
Deasemeni, interactiunile de tip medicament - medicament, se pare ca sunt foarte straanse in cadrul acestui complex.
2.4. STRUCTURA MOLECULEI CIP
Ca si cu R6g, molecula Cip este legata intre 2 subunitati proteice. Resturile aflate la distanta de 6Ǻ a legaturii ciprofloxacin, includ Phe458 , Phe459 , si Lys29 , Leu25 si Ala385' de la subunitatea vecina. In acest complex, majoritatea interactiunilor de legare sunt hidrofobe. Grupul ciclopropil apartinand moleculei de medicament interactioneaza cu Phe458 si Phe459 . din subunitatea vecina, lanturile laterale de Leu25' si Lys29', se afla in apropierea inelului de nitrogen al grupului de quinolon. Distanta de 5Ǻ dintre grupul ɛ-amino al Lys si inelul de nitrogen sarac in electroni, sugereaza anumite contributii bipolare.
Interactiunile dintre gruparile carbonil-oxigen si resturile proteice ale Cip, interactioneaza cu moleculele de apa ce pot aparea la un moment dat in transport.
D
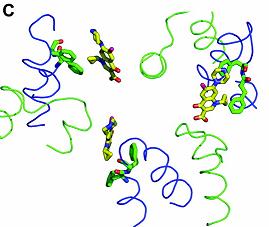
Fig. 18. D. Structura 3D a complexului Cip/ legare la substrat.
https://jb.asm.org/cgi/content/full/185/19/5657/F3
Moleculele de medicamente ce sunt legate la cavitatea centrala a transportorului AcrB, sunt probabil impinse afara prin domeniile periplasmice ale pompei, prin tunelul TolC ( proteina dinafara membranei ce impreuna cu proteina AcrA formeaza complexul AcrB), si apoi in mediul extracelular. Cea mai directa cale de extragere poate fi prin porul central, format de helicele porului din domeniul periplasmic cu resturi de la 102 la 115.
Aceste resturi interactioneaza exact in centrul celor 3 subunitati, iar porul se inchide.
Probabil fluxul de protoni ce urmeaza legarii, produce o schimbare conformationala destul de importanta a AcrB-ului, ce conduce la deschiderea porului si pornirea mecanismului de tip-elevator al expulzarii medicamentelor.
Studii genetice recente, la nivelul domeniilor si al resturilor, apar importante in efluxul la nivelul substratului mediat de pompa AcrB, precum si la nivelul altor astfel de pompe.
Domeniul periplasmic este cel care detine un rol major in determinarea specificitatii de substrat a acestor pompe.
Structurile liganzilor arata ca diverse chimicale au abilitatea de a lega grupari polare complementare si hidrofobe la cavitatea centrala a transportorului de eflux.
CAP.3. STRUCTURI DE TRANSPORTORI
3.1. STRUCTURA DE BAZA A POMPEI DE EFLUX CU ROL IN REZISTENTA LA MEDICAMENTE, EmrE , PREZENT LA Escherichia coli
Transportorii implicati in rezistenta la medicamente, ce asigura efluxul acestora, sunt folositi in tratarea bolilor infectioase, cu rolul de expulzare in mediul extracelular al componentelor citotoxice si a medicamentelor.
Un astfel de transportor este si EmrE, din familia transportorilor de mici dimensiuni, componenti ai acestei familii fiind specializati in rezistenta la medicamente, utilizand gradienti de protoni ca sursa de energie pentru conducerea translocatiei la nivel de substrat.
La o rezolutie de 3.8Ǻ, EmrE, este un tetramer ce conține 2 heterodimeri conformaționali, legați printr-o axa perpendiculara imaginara, de simetrie, la membrana celulara.
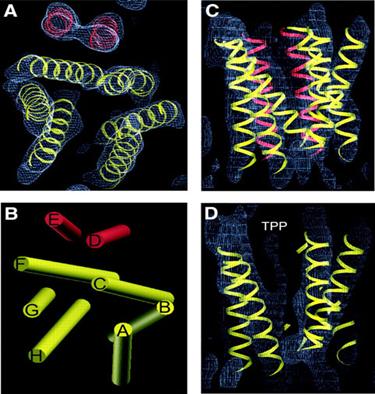
Fig.19. Structura 3D a pompei de eflux
EmrE. A. vedere de sus perpendiculara pe planul membranei. B.
Arhitectura in cilindru a helicelor din plan perpendicular pe planul
membranei. C. vedere in lungul membranei la o densitate de 1.2Ǻ. D.
vedere din lateral in plan membranar. Cele 2 seturi de grupari de
helice, unul galben- buzunarul de legare la substrat, și al doilea,
roșu, separat de buzunarul de legare. / https://www.nature.com/
Pe baza dovezilor structurale și biochimice, este propus un mecanism prin care EmrE realizeaza efluxul medicamentelor prin cuplarea schimbarilor conformaționale intre cei 2 heterodimeri cu gradient de protoni.
Structura este chiar simpla și compacta, de aceea poate servi ca model ideal in intelegerea structurii tipice a unui antiportor proton - medicament, pentru alte sisteme de eflux al medicamentelor.
Superexpresivitatea EmrE, cauzeaza bacteriei E.coli, o rezistenta sporita la contactul cu componente cationice, toxice și hidrofobe de gen bromura de ethidium, metil- viologen, tetraciclina și tetrafenilfofonium, la antiseptice.
EmrE este un antiportor de proton - medicament, dirijand indreptarea gradienților protonici electrochimici, in direcția opusa, avand in jur de 60 de omologi atat la bacterii Gram - pozitive cat și Gram - negative.
Fiind cel mai mic transportor, EmrE, de la E.coli este o molecula mica de 12 kDa, avand 110 resturi de aminoacizi și 4 helice. Este o proteina hidrofoba, cu doar 8 resturi incarcate cu sarcini, incluzand Glu - 8, necesar in activitatea de eflux al medicamentelor.
In urma cristalografierii cu raze X, structura EmrE dezvaluie un tetramer compus din 2 heterodimeri conformaționali legați printr-o axa lunga perpendiculara de simetrie, la suprafața membranei.
Intr-un heterodimer, helicele α1, α2, α3, ale unei subunitați sunt aranjate aproape invers fața de cele ale celuilalt monomer, formand o impachetare de 6 helice cu miez hidrofob.
Poziția helicei α4 aparținand unei subunitați este aproape paralela cu suprafața membranei, iar o alta parte patrunde in planul membranei. Aceasta poziționare a α4 pe lateral, de-a lungul suprafeței membranare, a fost observat și la nivelul altor membranei altor proteine, cum ar fi E si M de la flavivirusuri.
Cea mai interesanta parte a structurii, este reprezentata de orientarea inversata a polipeptidelor ce intra in alcatuirea conformației heterodimerilor.
Deși un fapt inca nedovedid, aranjamentul conformațional este datorat unor posibile fuzionarii de gene, evenimente ce dau și alți transportori, de exemplu exportori de medicamente - metaboliți din cadrul acestei familii de transportori, ale caror subunitați omoloage se crede ca s-ar inversa la nivelul substratului.
Aceasta fuziune este susținuta de structuri precum canalele de clor, aquaporine și vitamina transportata de BtuCD din familia transportorilor ABC-MDR, ce prezinta subdomenii transmembranare inversate, codificate de o singura polipeptida.
In cazul EmrE, exista un potențial ce unește capatul C-terminal al α4, aparținand unui monomer, cu capatul N-terminal a helicei α4, aparținand celuilalt monomer, intr-un dimer asimetric.
Acest lucru poate explica cum subunitațile transmembranare sunt formate la transportorii evoluați.
Tetramerul este alcatuit din contacte ale α1 de la ambii heterodimeri, formand un unghi de 90̊.
Aria ingropata este de aprox. 550Ǻ, conține molecula relativ mica a EmrE, și poate reflecta starea conformației prinsa de forma acestui cristal.
La acest nivel, o grupare de Glu14s de importanța funcționala și o serie de resturi proteice, implicate impreuna in legarea protonilor.
Gruparea de glutamat se pare ca are rol decisiv in activarea mecanismului prin care protonii sunt folosiți pentru indepartarea medicamentelor cationic- hidrofobe.
Forma in X a aranjamentului din α1s, și poziția restului glutaminic, realizeaza consistența punctului pivot, studii ce au aratat ca Glu -14 este singurul rest din α1 ce poate fi legat la HgCl2 la inlocuirea cu cisteina, arata calea de translocație a medicamentelor, interfața dovedita in urma studiilor biochimice.
3.2 STRUCTURA CRISTALULUI FORMAT DE TRANSPORTORUL CorA CE FACILITEAZA TRANSPORTUL DE Mg2+
Ionul de magneziu, Mg2+ , este esențial in nenumarate procese biochimice și ramane singurul ion major de mare importanța biologica, ale carui mecanisme de transport raman neelucidate.
Familia CorA a transportorilor de magneziu este primul sistem de preluare a Mg2+ la majoritatea procariotelor și funcționeaza ca omolog al transportorului mitocondrial de magneziu prezent la eucariote.
In studiul structurii cristalografiate a transportorului, s-a folosit intreaga familie a CorA de la Thermotoga maritima.
Transportorul are forma unui "furnal", format dintr-un homopentamer cu cate 2 helice transmembranare per monomer. Canalul este format de un grup de 5 helice interne avand ca "portari" resturi hidrofobe. Domeniul citoplasmatic vast, formeaza "furnalul", a carui gura larg deschisa asigura conducția spre interiorul celulei, și ai caror pereți sunt formați din cele 5 helice, care sunt de fapt prelungiri ale celor 2 helice transmembranare.
Gatul citoplasmatic al porului este inconjurat, inafara "furnalului", de un inel format de resturi cu sarcini inalt conservate.
2 helice incarcate negativ, din domeniul citoplasmatic, se extind inspre spate orientate spre membrana, inafara "furnalului" și pe deasupra inelului incarcat pozitiv.
Transportorul homopentameric, la nivelul porului central, poate fi divizat in 3 zone.
Un domeniu transmembranar C-terminal, cuprinzand cate 2 helice transmembranare de unitate monomerica, ce prezinta porul central cu o deschidere de aprox. 5Ǻ la intrare și 20Ǻ la gura de ieșire, se formeaza in lungul extinderii α-helixului intern transmembranar.
Domeniul extern citoplasmatic al CorA, este un β-pliat, format de 7 unitați pliate paralel/ antiparalel, facut "sandwich" de 2 seturi α - helice; α1, α2, α3 și α4, α5, α6.
Cele 5 helice transmembranare ce alcatuiesc porul, formeaza 7 bucle proteice extracelulare scurte, intorcandu-se in citoplasma capatul C-terminal incarcat cu un motiv KKKKWL.
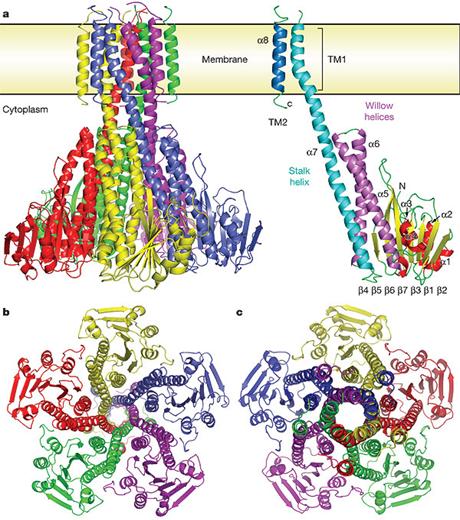
Fig.21. Structura 3D canalului de CorA de Mg2+ . A. diagrama complexului pentameric CorA, in dreapta, o singura unitate a canalului CorA. B. vedere din regiunea intracelulara. C. vedere dinspre periplasma. / https://www.nature.com
Un ion de Mg2+ , intrand in celula prin CorA, trebuie sa traverseze o distanța de 40Ǻ, extinzandu-se prin filtrul selectiv periplasmic, prin domeniul transmembranar și prin o parte a domeniului citoplasmatic.
Diametrul caii variaza considerabil in lungime, producand 2 cavitați mici cu diametre de 6Ǻ și 5.6Ǻ; formand 3 constricții interspațiale; prima, formata de lanțurile laterale Asn314, a doua, formata de Thr305 și Met302, și a treia, formata de 2 resturi de Leu294 și Met291.
Canalele de potasiu au o singura cavitate larga, localizata in centrul bistratului, care ajuta la stabilizarea ionului13. Cele 2 cavitați, posibil, au un rol analog pentru CorA.
Sfincterul bazal se afla la același nivel in proteina, cu ultima constricție hidrofoba.
Acest lucru sugereaza ideea ca incarcatura de concentrație pozitiva ar juca un rol important in controlul diametrului porului la acest nivel transmembranar.
Datorita variabilitatii diametrului porului, se pare ca transportorul se afla in conformație inchisa.
Deși CorA are cateva teme structurale comune cu canalele ionice, transportul ionilor se face mult mai incet. Problema ar fi la nivelul ionului de Mg2+ , prefera sa fie hexacoordonat și probabil ramane așa pe tot parcursul procesului de conducere a transportului.
La intrarea ionilor hidratați de Mg2+ prin calea de conducere, numarul situsurilor de coordonare disponibile nu se vor potrivi simetriei pentamerice a filtrului selectiv al CorA.
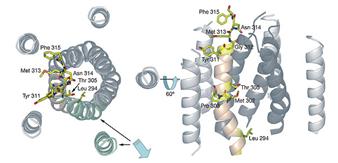 La nivelul porului de
conducere ionica al CorA, ionul de Mg2+ se deshidrateaza, acest lucru
reprezentand o cheie de baza in selectivitate.
La nivelul porului de
conducere ionica al CorA, ionul de Mg2+ se deshidrateaza, acest lucru
reprezentand o cheie de baza in selectivitate.
Fig.22. Analiza porului CorA
Inițial, CorA, poate transporta și Co2+ și Ni2+ , 2 ioni asemanatori atomic cu ionul de Mg2+, dar nu și cu ionul de Mn2+ , a carui raza atomica este semnificativ mai mare decat a ionului de Mg2+ .
Gruparile polare de la nivelul porului servesc la compensarea costului de energie consumata in procesul deshidratarii.
CorA poseda un mecanism de reglare a deschiderii porului ca raspuns al schimbarilor de concentrație ionica intracelulara.
3.3. STRUCTURA ANTIPORTORULUI NhaA IN TRANSPORTUL Na+/ H+
Controlul in transportul de Na+/ H+ in pastrarea concentrației normale in ioni, precum și in pastrarea volumului celulei, este esențial pentru viabilitatea tuturor celulelor.
Adaptarea la o salinitate ridicata și/sau la un pH extrem la plante și bacterii sau in mușchii inimii la om, presupune activitatea antiportorului de Na+/H+, activitate strans coordonata de nivelul pH-ului.
 Principalul antiportor
al E.coli, precum și a altor
enterobacterii, este cristalul de NhaA, transportor cu rol de echilibrare a
concentrației pH-ului.
Principalul antiportor
al E.coli, precum și a altor
enterobacterii, este cristalul de NhaA, transportor cu rol de echilibrare a
concentrației pH-ului.
Fig.23. Arhitectura structurii 3D a cristalului de NhaA. / https://www.nature.com
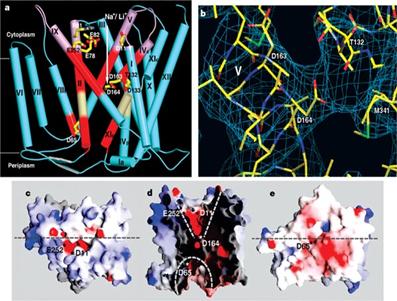
Un "furnal" ionic, incarcat negativ, se deschide la nivelul citoplasmei și se termina la mijlocul membranei, la nivelul situsului de legare ionica.
Aici, un ansamblu unic de 2 perechi de helice scurte incrucișate, impreuna cu extinderile lor, creaza un mediu electrostatic stabilizant.
Legarea la situsurile substratului cu incarcatura, cauzeazi un dezechilibru electric, inducand mișcari, ce permit un mecanism de acces alternativ rapid. Aceasta mașinarie de schimb ionic este reglata de o schimbare conformaționala, indusa de un semnal de pH, inițiat la intrarea in "furnalul citoplasmatic".
NhaA folosește gradientul electrochimic de protoni pe care il menține pe toata lungimea membranei bacteriene, expulzand Na+ in schimbul unui flux de protoni, la nivel celular.
Cristalizat, in spațiu, NhaA, prezinta 2 monomeri ce alcatuiesc un dimer asimetric, aflați intr-o orientare non-fiziologica, opusa.
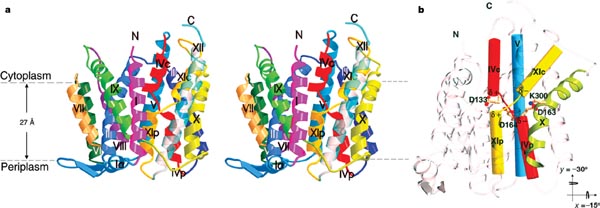
NhaA conține 388 de resturi de aminoacizi, cu capetele N-terminal și C-terminal, expuse in citoplasma. Modelul structural cuprinde de la 9 la 384 resturi aranjate in 12 segmente transmembranare, molecula avand o dimensiune de 40Ǻ cu 45Ǻ și cu o inalțime de 50Ǻ.
Complexul NhaA este format din 2 domenii; A și B. 2 pachete cuprinzand 3 TMs-uri (III, IV, V, si X, XI, XII) formeaza domeniul A, pachetele fiind inrudite structural.
Domeniul B este format dintr-o impachetare lineara a 6 helixuri (II, VII, VIII, IX, in centru, și I și VI atașate periferic pe laterale opuse.
Helicele TMs IV și XI sunt așezate in poziție opusa in membrana, notate "p" și "c" datorita inserției primei in periplasma, respectiv citoplasma, sunt orientate antiparalel cu partea N-terminala incarcata pozitiv, stand fața in fața la mijlocul membranei.
Cele 2 domenii se afla in coordonare deplina cu pachetele helicate observate in structura 3D a NhaA prin tehnica de microscopie crio-electronica a cristalelor in vedere 2D, obținute la randul lor la pH acid.
In centrul interfaței domeniului, se deschide un "furnal", format de helicele II și IX din domeniul B, din helixul Ivc și lanțul sau extins, și helixul V al domeniul A.
Potențialul electrostatic de suprafața, vazut dinspre citoplasma, este incarcat cu sarcini negative, restul membranei citoplasmatice este incarcat negativ, la fel și la nivel periplasmatic.
"Furnalele" citoplasmatic și periplasmatic sunt indreptate unul catre celalalt, dar nu formeaza un por continuu. "Furnalul" NhaA este inalt specializat in atragerea cationilor și in creșterea concentrației locale, fața de cea a anionilor.
3.3.1. MECANISMUL DE REGLARE AL pH-ULUI, PRIN SCHIMBUL DE DE Na+/H+
Principalul rol fiziologic al NhaA este menținerea echilibrului citoplasmatic al pH-ului, și a conținutului in Na+ (Li+).
Pentru menținerea unui pH intracelular constant, surplusul de Na+ (Li+), toxic pentru celula, este expulzat in schimbul cu protoni.
Activitatea sa alterneaza pe 3 nivele de magnitudine, intre pH7 și pH8, și este pe deplin reglat in scadere pana la un pH6.5.
Modelul general acceptat, explica schimbul de Na+/H+ și alte procese secundare de transport, este mecanismul de acces alternativ. Acest model presupune ca transportorul sa dețina 2 conformații alternative majore la nivelul situsurilor de legare la substrat, orientate fie inspre sau dinspre substratul respectiv.
Fig. 24. Pasajul substratului și
bariera periplasmica/ a. alinierea pasajului periplasmic și citoplasmic, b. situs catalitic al
NhaA, c. vedere citoplasmatica de-a lungul membranei, d. secțiunea
incrucișata prin antiportor, e. vedere periplasmica de-a lungul
membranei. / https://www.nature.com
Interconversia celor 2 conformații intr-un antiportor este posibila doar printr-o legatura la substrat formata de o proteina.
Pentru NhaA, acest lucru inseamna ca legatura este susținuta fie de o grupare Na+/Li+, fie de 2 H+
Cele 2 grupari Asp ale situsului de legare sunt situate la nivelul helixului V, nu deține structuri specifice pentru eventualele schimbari conformaționale.
La pH acid, doar o parte a situsului de legare cationica este expusa caii de trecere a cationilor, in timp ce pasajul periplasmic este blocat de o bariera ionica formata parțial de helixul XIp, la pH alcalin, conformația helixului XIp și orientarea acestuia se schimba impreuna cu cea a helixului Vc.
Legarea propriu-zisa a Na+/Li+ la situsul activ, intervine in urma dezechilibrarii incarcaturii ce ar determina mișcarea helicelor XIp și Ivc, precum și a lanțurilor lor extinse.
Situsul de legare al cationilor este astfel expus periplasmic și separat și inchis in citoplasma. In eliberarea Na+/H+, ambele grupari de Asp devin protonate, determinand astfel o schimbare conformaționala, expunand și deschiderea citoplasmica, deprotonizarea inchizand ciclul.
Deși multe aspecte ale mecanismului de translocație ionica și de reglare a pH-ului, sunt dezvaluite de structura NhaA, determinari la rezoluții ridicate ale legaturilor Li+ sau Na+, fiind necesare in ințelegerea legarii proteinelor și a mecanismului de translocație la nivel atomic. Conformația indusa la pH alcalin, este esențiala in ințelegerea controlului pH-ului și a accesului de protoni la situsul de legare.
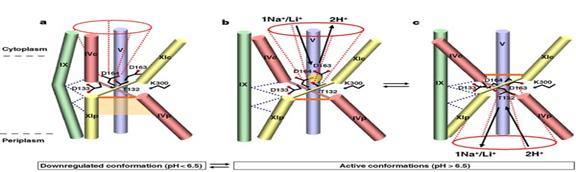
Fig.25. Mecanism de transport a reglarii pH-ului și translocația NhaA. A. conformația in mediu cu pH acid. B. Activarea schimbarii conformaționale indusa de pH-ul alcalin.C. Rezultatul legarii Na+(Li+) la deschiderea "furnalului"periplasmic.
3.3.2 STRUCTURA TRANSPORTORULUI DEPENDENT DE Na+/Cl- IMPLICAT IN TRANSPORTORUL DE NEUROTRANSMIȚATORI.
Transportorii dependenți de Na+/Cl-, mediaza transmiterea sinaptica folosind gradienții electrochimici in conducerea fluxului de neurotransmițatori, incluzand amine biogenice, de la sinapsa la citoplasma neuronilor și a celulelor gliale.
Acești transportori sunt țintele componentelor terapeutice, iar disfuncții la nivelul lor sunt implicate in boli ale sistemului nervos. Structura de cristal studiata la Aquifex aeolicus, arata un complex ce cuprinde și legarea la substrat a leucinei, și a 2 ioni de sodiu.
Miezul proteinei cuprinde un set de 10 din 12 segmente transmembranare, cu segmentele 1-5 legate cu 6-10 printr-o axa perpendiculara de simetrie in plan membranar.
Leucina și ionii de sodiu sunt legați la miezul proteic, la jumatatea distanței bistratului membranar, intr-o ocluzie datorata apei. Ca situs de legare al leucinei LeuTAa a proteolopozomilor stimulata de valinomicina, aceasta funcționeaza și ca ligand al celor 2 ioni de sodiu , numiți Na1 și Na2, legarea se face la nivelul regiunilor TM1 și TM6.
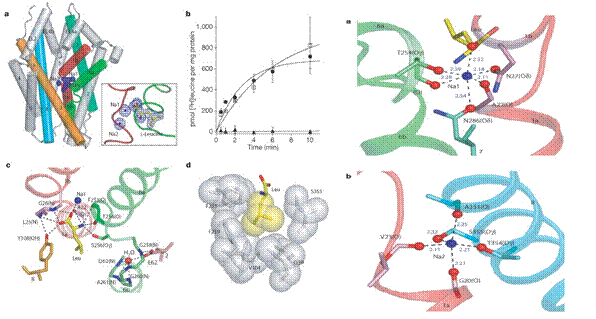
Fig.26. Situsuri de legare ale LeuTAa respectiv a ionilor de sodiu./
Situsurile de legare ale leucinei și a ionilor de sodiu sunt datorate decondensarii parțiale a helicelor transmembranare, cu atomi din lanțurile principale și cu dipoli helicați, indeplinind roluri cheie in legarea ionilor la substrat.
Comunicarea dintre neuroni, este esențiala pentru transmiterea impulsului nervos prin sinapse chimice, joncțiuni la nivelul carora semnalele electrice sunt eliberate de un neuron spre cel din imediata apropiere, pe calea clasica a neurotransmiterii mediatorilor de tip serotonina, norepinefrina, dopamina, glicina și GABA (acid γ-aminobutiric).
Sosirea unui potențial de acțiune la capatul terminal presinaptic, determina eliberarea acestor proteine mici, ce pot activa cu o rapiditate de milisecunde deschiderea canalelor ionice, sau pot avea o acțiune mai lenta data de receptorii cuplați ai proteinei G.
Dupa activarea receptorilor, acești neurotransmițatori sunt eliberați in sinapsa, inițial specific, prin inalta afinitate a transportorilor membranari, localizați la capatul terminal presinaptic, inconjurand mai apoi și celulele gliale.
Acest flux energetic are rol in reglajul electrochimic al concentrației ionice normale, dar și in inlocuirea depozitelor veziculare presinaptice de neurotransmițatori, printr-o clasa separata de purtatori veziculari.
Simportorii dependenți de Na+/ Cl-, folosesc gradientul electrochimic de sodiu și clor in cataliza supraincarcarii ce determina mișcarea termodinamica pe o arie larga a substratului, folosind și aminele biogenice (serotonina, dopamina, norepinefrina), aminoacizi (GABA, glicina, prolina, taurina) și produși ai osmozei (betaina, creatina).
Disfuncții la nivelul acestui simportor, sunt implicate in depresii, boala Parkinson, intoleranța ortostatica și epilepsie. De reținut ar fi faptul ca sunt ținta substanțelor ce creaza dependența: cocaina, amfetamina, precum și a unor agenți terapeutici de genul anticonvulsivi și a unor inhibitori de preluare selectiva a serotoninei.
3.4 STRUCTURA TRANSPORTORULUI GLUTAMAT OMOLOG LA Pyrococcus horikoshii
Transportorii glutamați sunt proteine integrate de membrana, ce intervin in preluarea și transportul concentrației de glutamat, din sinapse inspre spațiul intracelular, prin inlocuirea gradienților ionici preexistenți.
In centrul sistemului nervos, transportorii glutamați sunt esențiali pentru dezvoltarea și funcționarea in condiții optime, fiind implicați in atacul cerebral, epilepsie și in alte boli neurodegenerative.
Trimerul transportorului are forma unui bol, cu un camp bazal incarcat cu solvenți, extins de-a lungul bistratului membranar.
Pe suprafața bazala sunt localizate 3 situsuri de legare independente, fiecare dintre acestea susținut de 2 agrafe helicale, HP1 și HP2, intrate prin parțile laterale ale membranei.
Transportul glutamatului este facilitat de mișcarea acestor 2 agrafe, ce permit accesul alternativ prin bistratul membranei.
Sinapsa chimica este punctul central al comunicarii dintre neuronii creierului uman, aceste sinapse au rolul de a media transportul majoritații neurotransmiterilor excitatorii rapide, reprezentand totodata și centrul de inițiere al proceselor de invațare și memorare.
Disfuncții la nivelul acestor sinapse cauzeaza o serie de boli și leziuni ale sistemului nervos, incluzand depresia, schizofrenia și atacul cerebral.
Rapida eliminare a glutamatului din sinapsa este datorata inaltei afinitați, transportorii dependenți de sodiu fiind necesari in neurotransmitere și in prevenirea excitotoxicitații induse de surplusul glutamat.
Cristalul transportorului glutamat de la Pyrococcus horikoshii are o identitate de 37% identica cu transportorul de aminoacizi excitator 2 (hEAAT2).
Mecanismul tipic de transport al glutamatului este cel de acces alternativ, un situs de legare intramembranar este flancat de 2 porții permițand accesul soluțiilor intra și extracelulare la nivelul substratului.
Proteina aflata la nivelul situsului de legare, ce asigura calea de transport este reprezentata de promotorul GltphH7. Probabil cea mai interesanta trasatura a acestei proteine este reaprezentata de bazinul acvatic ce permite legarea ionilor la substrat, aflat la jumatatea stratului membranar.
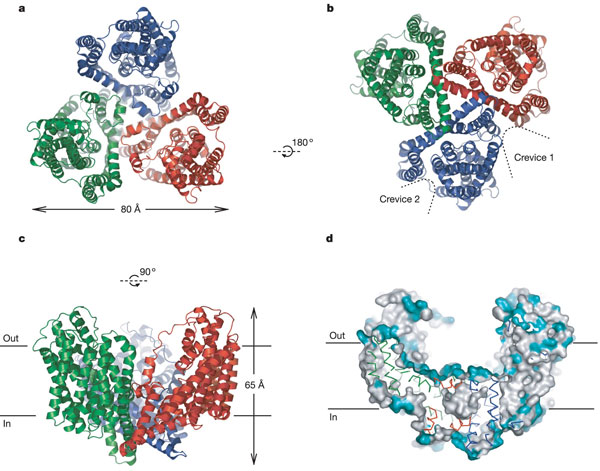
Fig.26. Structura proteinei GltphH7.a. reprezentarea trimerului, vedere extracelulara, b. vedere citoplasmatica a deschiderilor dintre unitați, precum și cea dintre TM1 și TM6, c.vedere asupra trimerului paralel cu planul membranar, d.suprafața secționata a trimerului la nivelul centrului bazinului.
Situsul de legare este situat la aprox. 5Ǻ sub bazin și este prins de varful agrafei HP2 (hairpin).
Imediat sub buzunarul de legare se afla HP1, TM7 și partea C-terminala a TM8, și se presupune ca HP1 formeaza poarta intracelulara deoarece mișcarea coordonata a HP1 cu a TM7 și a parții C-terminale a TM8, ar deschide calea acvatica dinspre situsul de legare spre citoplasma.
Structura GltphH7 reprezinta o stare de legare a transportorului cu ambele porți deschise. Deși porțile HP1 și HP2 au o similaritate structurala, acestea se pare ca aparțin unor contexte proteice diferite, drept urmare schimbarile conformaționale se interpun la deschiderea porților, precum și indicatorii chimici implicați in deschiderea porților, se presupune ca dețin origine distincta.
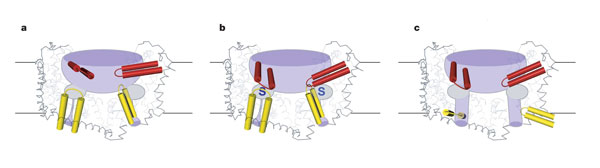
Fig.26. Arhitectura trimerului și mecanismul de transport. Transportorii glutamat au un bazin acvatic larg unde se gasesc cele 3 situsuri de legare. A. HP2 are o conformație deschisa, B. starea de legare a transportorului observat in structura proteinei GltphH7
Pentru deschiderea porții intracelulare, HP1, se mișca vertical fața de citoplasma și lateral fața de deschidere, de aceea se creaza o cale de transport prin substrat de-a lungul feței polare a TM8 și redirecționeaza regiunea de atașare serica a HP1 accesibila doar citoplasmei.
Cand poarta intracelulara este deschisa, HP2 se mișca spre centrul trimerului, ocupand spațiul predestinat HP1, evitand astfel formarea unui por transmembranar.
CAP.4 STRUCTURA MECANISMELOR DE TRANSPORT AL CANALELOR DE K+ - IRK+
4.1. DESCRIERE CANALE DE K+ - IRK+ (INWARD RECTIFIERS K+)
Canalele de K+ sunt responsabile de voltajul membranar in repaos al multor celule. Reglajul acestor canale ionice pe traseul receptorului de cuplare al proteinei G, este semnalizat in controlul ritmului cardiac și in activitatea neurotransmițatorilor la nivelul sistemului nervos. S-a determinat, la o rezoluție de 1.8Ǻ, structura proteinei G, formata din capetele N-terminal și C-terminal, ce "pazește" fluxul reglator al canalului de K+, formand astfel complexul GIRK+.
Un por citoplasmatic conservat in canalul de GIRK+, extinde calea de trecere a ionilor la 60Ǻ, aproape de 2 ori mai lunga, fața de cea a unui canal K+ transmembranar obișnuit.
Canalele de K+ participa in diverse procese, de la volumul celulei la generarea impulsurilor electrice in celulele excitante. (Hille, 2001). Aceste canale prezinta un filtru selectiv, ce permite trecerea ionilor de K+ și expulzarea celor de Na+. Transportul ionilor de K+ prin por, este pasiv, inspre și dinspre celula, depinzand de orientarea gradientului electrochimic.
Pentru majoritatea canalelor de K+, dat fiind gradientul egal dar opus, ionii de K+ curg cu aproape aceeași eficiența kinetica in ambele direcții.
Anumite canale de K+, ce formeaza un subset diferit, cunoscut sub numele de rectificatori interni sau canale IRK, sunt unice prin faptul ca sprijina conducerea ionilor de K+ mai eficient intr-o singura direcție in celula.(Katz.1949)
Rectificator, sau reglator, este un termen folosind in electronica, și se refera la mecanisme ce susțin tranziția intr-o singura direcție.
In biologie, canalele reglatoare IRK, au rolul de a menține un nivel optim al voltajului membranei celulare aflate in stare de repaos.
In repaos, la deschiderea canalelor, voltajul membranei se afla in corelație cu potențialul de K+ Nernst (de la -60mV pana la -90 mV, depinde de celula). In timpul activitații electrice, voltajul membranei devine pozitiv, datorita intruziunii ionilor de Na+ prin porțile neurotransmițatoare și voltaj-dependente ale canalelor de Na+.
Canalele de K+ deschise contravin acestei activitați electrice, rectificand prin inchiderea eficienta a canalelor IRK.
 Fig.27.
Canale de K+.
Fig.27.
Canale de K+.
A. Structura topologica a canalului K+, cu 2 domenii TM și un helix mai scurt.
B. Vedere asupra tetramerului https://hmg.oxfordjournals.org/
Motivul pentru care canalele IRK au rolul de a rectifica, a fost stabilit la nivel farmaceutic, la voltaje ce favorizeaza efluxul de ioni de K+, porul se blocheaza datorita impermeabilitații intracelulara cationica fața de Mg2+ și fața de poliamine.
Acești ioni blocanți intra in por dinspre citoplasma dar nu pot trece prin filtrul selectiv. Canalele de IRK , sunt unice deasemeni deoarece țin cont și de stimulii ce cauzeaza deschiderea porților. De exemplu unele canale IRK se deschid prin legarea unor subunitați de proteina G.
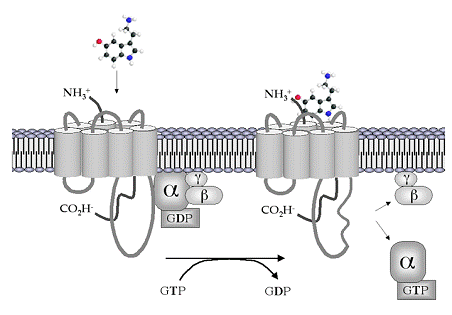 Rectificatorii interni
legați la proteina G sau canalele GIRK, sunt responsabili de scaderea
ritmului cardiac la stimularea nervului vag. Acetilcolina eliberata din
legaturile terminale nervoase spre receptorii muscarinici cuplați ai
proteinei G, prezenți in celulele cardiace, cauzeaza o disociere a
subunitații proteinei G in Gα și G-βγ, de la
receptor spre suprafața membranei intracelulare.
Rectificatorii interni
legați la proteina G sau canalele GIRK, sunt responsabili de scaderea
ritmului cardiac la stimularea nervului vag. Acetilcolina eliberata din
legaturile terminale nervoase spre receptorii muscarinici cuplați ai
proteinei G, prezenți in celulele cardiace, cauzeaza o disociere a
subunitații proteinei G in Gα și G-βγ, de la
receptor spre suprafața membranei intracelulare.
Fig.28. Complexul proteinei G heterotrimerice, alcatuit din subunitațile alpha, beta și gamma alaturi de 7 proteine receptori. In stare inactiva, subunitatea alpha este legata la GDP. In timpul legarii, este indusa o schimbare conformaționala, se realizeaza cuplarea.
GTP inlocuiește GDP, iar subunitatea alpha revine la conformația activa. https://www.heffter.org/review/Review2/chap5.pdf
Complexul G-βγ se leaga la canalele GIRK+, determinand deschiderea lor, ca efect acestea hiperpolarizeaza membrana celulara, incetinand frecvența potențialului de acțiune și ritmul cardiac. Acestea sunt regasite și la nivelul altor celule ale organismului, precum in neuroni, unde mediaza acțiunea inhibitoare a neurotransmițatorilor.
In studiul structurii canalelor, s-a demonstrat existența unui por unic ce ridica valoarea proprietații lor speciale de reglaj intern, precum și modul de legare a subunitaților proteinei G la canalele GIRK+.
Canalele GIRK+ la eucariote sunt tetrameri formați din subunitați identice integrate de membrana, ce inconjoara un por central de conducere ionica.
Fiecare subunitate conține 2 α-helice, un helix al porului și un filtru selectiv comun tuturor canalelor de K+.
Canalele GIRK+ difera de cele simple de K+, prin structura capetelor N și C-terminale, in sensul ca acestea cuprind 2/3 din subunitatea unui canal de K+, acest lucru dand unicitatea acestor canale. La IRK+, aceste capete terminale N și C, formeaza o structura speciala la suprafața intercelulara a membranei.
4.2 STRUCTURA PORULUI CITOPLASMATIC AL PROTEINEI G, MEDIATOARE A TRANSPORTULUI IONILOR DE K+ -GIRK+
Structura de cristal, arata o singura subunitate, cu segmente N și C-terminale, ce formeaza o structura globuloasa, o proteina β-sheet, in principiu, cu subunitațile βA și βN, intre care se interpune un α-helix. Aceasta structura este prezenta in imunoglobuline și in arrestin - o proteina reglatoare a receptorului beta- adrenergic.
Capatul N-terminal interacționeaza cu cel C-terminal printr-o paralela β-sheet formata de subunitați βA și βM.
Interfața tetramerului conține atat aminoacizi polari cat și hidrofobi.
Capatul N-terminal formeaza o cavitate intre domeniile adiacente ale capatului C-terminal.
Tetramerul formeaza un por de 30Ǻ lungime cu un diametru de 7-15Ǻ, porul fiind ușor deschis aaat cat sa permita difuzia ionilor de K+ hidratați, din canalul transmembranar in soluția intracelulara.
 Canalele IRK conțin
și ele aceasta structura cu denumirea de por citoplasmatic al
canalelor IRK, distinct prin tetramerul alcatuit din domeniul TM1 și
subunitați Kvβ, asociate suprafeței intracelulare a
canalelor de K+ voltaj-
dependente. Tetramerul acestor canale nu dețin un por central pentru trecerea
ionilor, rolul lor fiind in aparența, de a media interacțiunile
de tip proteina-proteina și ligand-proteina, in expresia,
reglajul și deschiderea programata a canalelor.
Canalele IRK conțin
și ele aceasta structura cu denumirea de por citoplasmatic al
canalelor IRK, distinct prin tetramerul alcatuit din domeniul TM1 și
subunitați Kvβ, asociate suprafeței intracelulare a
canalelor de K+ voltaj-
dependente. Tetramerul acestor canale nu dețin un por central pentru trecerea
ionilor, rolul lor fiind in aparența, de a media interacțiunile
de tip proteina-proteina și ligand-proteina, in expresia,
reglajul și deschiderea programata a canalelor.
Fig.29.Cavitatea interna a canalelor IRK /
https://www.pubmedcentral.nih.gov/
Porul citoplasmatic IRK este alcatuit din 4 subunitați, fața de β-sheet-ul continuu al porinelor. Acesta intefera cu porul transmembranar, alcatuit de helice aflate in apropierea suprafeței intracelulare.
Prin acești pori citoplasmatici trec mulți aminoacizi polari, cu exces de glutamat și aspartam, incarcate negativ, contribuind la inițierea unui potențial electrostatic negativ.
Aceasta distribuire a incarcaturii va avea ca efect concentrarea ionilor de K+ in aceasta regiune a porului, favorizand o conductanța crescuta și creand, deasemeni, oportunitatea cationilor impermeabili sa intre și sa blocheze porul dinspre interiorul celulei.
4.3 ACTIVITATEA INTRINSECA A RECEPTORILOR 5-HT
In sistemul nervos central, receptorii 5-hidroxitriptaminici 1A (5-HT1A), coexista in 2 populații diferite, cu efecte comportamentale și fiziologice diferite; 1) autoreceptorii somatodendritici localizați presinaptic in neuronul ce conține 5-HT și 2) receptorii localizați postsinaptic in neuroni ce conțin 5-HT.
Studii clinice au aratat ca agoniștii parțiali 5-HT1A, au proprietați anxiolitice, in timp ce antagoniștii autoreceptorilor presinaptici scurteaza timpul de preluare al inhibitorilor selectivi de serotonina (SSRIs).
In studiul activitații pre și postsinaptice al analogilor structurali de buspirona de la mamifere, a fost dezvaluit un model 3D al receptorului 5-HT1A, indicand similaritați in modalitațile de legare a intregii grupe de analogi ai buspironei.
Nu a fost demonstrata insa o relație intre resturile de contact ale receptorilor și receptorii pre și postsinaptici.
Comportamentul antagonistic presinaptic este dat de o deplasare larga a helixului TM7, in momentul legarii, pe cand comportamentul agonistic presinaptic, este datorat deplasarii largi a TM2 și o mica deplasare a TM7. In sistem analog, agonistul postsinaptic este conectat la deplasarea larga a TM4 și TM5, iar printr-o deplasare mai mica a acelorași helice, este corelata și activitatea antagoniștilor postsinaptici.
Proteina G cuplata la receptori (GPCRs), trimite semnalele de-a lungul membranei celulare, la acțiunea unui stimul -ligand pe fața externa, activand totodata o legatura heterotrimerica a proteinei G in interiorul celulei.
Analiza structurala a rhodopsinei de la bovine, cu ajutorul razelor X, este singura cunoscuta la o rezoluție de nivel atomic.
Caracteristicile structurale, funcționale și farmaceutice, au imparțit receptorii 5-HT in 7 familii mari (5-HT 1-7), cu una sau mai multe subdiviziuni. Exceptand 5-HT3, restul 5-HT sunt receptori de cuplare ai proteinei G (GPCRs).
Receptorii 5-HT1A, aparținand clasei de receptori cuplați Go/Gi, inhiba adenilatciclaza, crescand conductanța K+, și descresc activitatea de deschidere a canalelor de Ca2+, voltaj - dependente.
Atat receptorul 5-HT2A, cat și cel 5-HT2C, sunt implicați in reglajul anxietații, iar activitatea corelata a agoniștilor cu cea antagonista, ar avea o mai mare importanța in producerea efectelor anxiolitice, fața de buspirona.
Fig.30. Structura unei gene de receptor al serotoninei, 5-HT2C /structura 3D
https://www.pnas.org/cgi/content/full/250426397v1/F4 / https://www.heffter.org/review/Review2/chap5.pdf
SSRIs, sunt folosiți in prima linie terapeutica in tratamentul antidepresiv. Activitatea lor antidepresiva, se presupune ca ar fi abolita de transmiterea prea rapida a 5-HT. O problema majora asociata SSRIs, o reprezinta acțiunea lor intarziata, datorita creșterii activitatii autoreceptorilor presinaptici 5-HT1A.
Dupa administrarea SSRIs, apare o desensibilizare a autoreceptorilor presinaptici 5-HT1A, și abia dupa 2-6 saptamani efectul antidepresiv devine vizibil.
Receptorii 5-HT se regasesc și la nivel intestinal. Neuronii intrinseci aferenti primari trebuie sa monitorizeze conditiile intraluminale prin intermediul epiteliului mucoasei. Acestia in mod evident indeplinesc acest rol folosind sistemul celulelor enteroendocrine ale mucoasei. Printre cele mai cunoscute celule ale acestui sistem sunt celulele enterocromafine care contin serotonina (5-hidoxitriptamina sau 5-HT). Aceste celule contin aproape 95% din serotonina din organism. Celulele enterocromafine elibereaza 5-HT ca raspuns la cresterea presiunii intraluminale sau la stimuli chimici, iar aceasta 5-HT joaca un rol important in initierea reflexelor secretorii și de peristaltica. S-a descoperit ca neuronii enterici exprima receptori pentru 5-HT de tipul 5-HT1A, 5-HT1P, 5-HT2A, 5-HT2B, 5-HT3, 5-HT4, din care doar 5-HT1P, 5-HT3 și 5-HT4 exercita actiuni excitatorii. Receptorii de tip 5-HT1A sunt cuplati cu proteine G, avand ca efecte inhibarea activitatii adenilatciclazei și deschiderea unor canale de K+. La nivel gastrointestinal, in plexul mienteric, au fost identificati receptori 5-HT1A cu rol de a modula in sens inhibitor potentialele postsinaptice excitatorii. Receptorii de tip 5-HT1P nu au fost identificati la nivelul sistemului nervos central ci doar la nivel intestinal. Acesti receptori initiaza o depolarizare de lunga durata in neuronii enterici, asociata cu o crestere a rezistivitatii membranare. Receptorii de tip 5-HT2A sunt cuplati cu proteina Gq, care stimuleaza fosfolipaza C cu producerea de inozitol trifosfat (determina cresterea concentratiei Ca2+ in citosol) și de diacilglicerol (activeaza proteinkinaza C). Acești receptori mediaza raspunsul contractil in diferite preparate de muschi neted, inclusiv mușchi neted ileal. Receptorii de tip 5-HT2B cuplati tot cu proteine de tip Gq, au fost descrisi initial la nivelul regiunii fundice a stomacului, activarea lor determinand contractia fibrelor musculare netede de la acest nivel. Au fost identificati ulterior și la nivelul intestinului subtire. Receptorii de tip 5-HT3 sunt receptori de tip canal ionic. Activarea acestora produce o depolarizare neuronala rapida, printr-un influx tranzitor, consecutiv deschiderii de canale cationice neselective. Acesti receptori pot fi desensibilizati și resensibilizati foarte rapid. Atat receptorii 5-HT3 de la nivelul tubului digestiv, cat și cei de la nivel central (localizati in area postrema și nucleul tractului solitar) sunt implicati in producerea vomei, mai ales cea produsa de chimioterapiile anticanceroase. (https://www.emcb.ro). Receptorii de tip 5-HT4 sunt receptori cuplati cu proteine Gs, stimuland adenilatciclaza. Favorizeaza contractia fibrelor musculare netede intestinale cu cresterea peristaltismului și stimuleaza secretiile intestinale. Toti acesti receptori detin rol in motilitatea intestinala.
Activarea receptorilor 5-HT1A, conduce la o serie de efecte asupra fiziologiei și comportamentului. La șoareci, studiile experimetale, au aratat o creștere a nivelului de asimilare a nutrimentelor, o modulare de dependenta sexuala in comportament precum și hipotermie.
5. CONCLUZII
Transportul membranar realizat prin plasmalema, se datoreaza permeabilitații selective.
In funcție de consumul de energie dat de ATP, transportul se realizeaza pasiv (fara consum de energie) sau activ (cu consum de energie).
In funcție de marimea moleculelor transportate, transportul se imparte in transport de ioni (micromolecule) și al macromoleculelor, iar in funcție de numarul substanțelor transportate, poate fi uniport sau contraport (antiport sau simport).
TRANSPORTUL PASIV se realizeaza prin difuzie simpla prin bistratul lipidic.
In difuzia simpla mediata de peptide, transportul ionilor se realizeaza prin ionofori.
Difuzia facilitata se desfașoara de la o concentrație mai mare la una mai mica, substanțele transportate trec mult mai rapid decat ar fi de așteptat date fiind dimensiunea și solubilitatea lor in lipide.
Substanțele transportate de proteine specifice, se comporta ca enzime legate de membrana, avand caracteristice comune cu cataliza enzimatica.
Difuziunea simpla mediata de proteine-canal se deosebeste de difuziunea facilitata prin faptul ca viteza transportului poate fi mai mare decat in cazul difuziunii facilitate si transportul nu se satureaza, adica nu exista Vmax. Unele canale de transport sunt deschise in mod continuu, iar altele numai tranzitoriu. Acestea se numesc "canale de poarta". Unele canale se deschid la legarea unui ligand pe un receptor si le numim "canale cu poarta comandate de ligand". Alte canale dependente de potentialul membranei (voltaj) le numim canale cu poarta comandate de voltaj.
Mai exista si canale proteice care se deschid ca raspuns la cresterea concentratiei intracelulare a unor ioni: de exemplu canalele pentru K+ se deschid atunci cand creste concentratia Ca2+ in citosol.
TRANSPORTUL ACTIV este realizat de proteine transportoare cu o inalta specificitate si are si el caractere comune cu cataliza enzimatica: cinetica de tip Michaelis-Mentel. Ceea ce il deosebeste de difuziunea facilitata este consumul de energie. Transportul ionilor prin plasmalema si alte membrane se realizeaza de proteine care folosesc direct energia din ATP, aceste pompe ionice avand si proprietate ATP-azica. In transportul aminoacizilor si glucidelor prin plasmalema se foloseste energia gradientelor ionice (realizate prin ATP), deoarece transportul acestor substante se face cuplat cu transportul de Na+ (cotransport).
Transportul ionilor - pompa de Na+ si K+ din plasmalema si pompa de Ca2+ din plasmalema si din reticulul sarcoplasmic al celulelor musculare. Pompa de Na+ si K+ se afla in plasmalema tuturor celulelor animale si este responsabila de mentinerea potentialului membranar, dar si de controlul volumului si de "intretinerea" transportului activ al aminoacizilor si glucidelor.
Dupa 1957 s-a descoperit ca pompa de Na+
si K+ este aceeasi proteina cu Na+-K+-ATP-aza,
o enzima care scindeaza ATP-ul in ADP si fosfat anorganic (Pi) si
care necesita Na+ si K+ pentru activitatea
optima, fiind inhibata specific de glicozidele
cardiotonice (digitala si oubaina). Pompele de Ca2+ sunt
importante in mentinerea concentratiei scazute de Ca2+
in citosol(10-
Transportul activ cuplat cu gradiente ionice este reprezentat de transportul glucozei. Transportul glucozei prin plasmalema celulelor din mucoasa intestinala si a celulelor din tubii renali prezinta importanta foarte mare.
Transportul aminoacizilor se face tot prin sisteme simport cu Na+, ca și la glucoza, existand cel putin 5 proteine diferite in plasmalema celulelor animale.
Translocarea de grup se intalneste la unele bacterii si consta in fosforilarea unor glucide in cursul trecerii lor prin plasmalema.
TRANSPORTUL DIRECT AL UNOR MACROMOLECULE PRIN MEMBRANE
Exista cazuri speciale cand macromoleculele (ADN sau proteine) pot strabate direct membranele celulare fara a se forma vezicule. Asemenea situatii se intalnesc la bacterii in cursul procesului de transformare genetica, in care molecule de ADN trec atat prin peretele celular cat si prin plasmalema. In celulele eucariote proteinele de secretie trec direct prin membrana reticulului endoplasmic rugos pe masura ce sunt sintetizate. Unele toxine bacteriene trec prin plasmalema celulelor animale si isi exercita efectele in citosol. In cele mai multe cazuri macromoleculele sunt trecute prin membrane prin intermediul veziculelor
BIBLIOGRAFIE
1. Chang Geoffrey & Roth B. Christopher, Structure of MsbA from E.coli: A Homolog of a Multidrug Resistance ATP Binding Cassette (ABC) Transporters, Science, vol.293/2001
2. Chang Geoffrey, Structure of MsbA from Vibrio cholera: A Multidrug Resistance ABC Transporter Homolog in a Close Conformation, J.Mol.Biol, vol. 330, 419-430 / 2002
3. Davidson L. Amy, Not Just Another ABC Transporter, Science,vol. 296/2002
4.Dean Michael, Hamon Yannick & Chimini Giovanna , The human ATP - binding cassette (ABC) transporter superfamily, Journal of Lipid Research, vol. 42, 1007-1014/2001
5. Huang Yafei, Lemieux M. Joanne, Song Jinmei, Auer Manfred, Wang Da-Neng, Structure and Mechanism of the Glycerol-3-Phosphate Transporter from Escherichia coli, Science, vol. 301/2003, www.sciencemag.org
6. Hunte Carola, Screpanti Emanuela, Venturi Miro, Rimon Abraham, Padan Etana & Michel Hartmut, Structure of a Na+ /H+ antiporter and insights into mechanism of action and regulation by pH, Nature Publishing Group,vol.453/2005
7. Lunin V.Vladimir , Dobrovetsky Elena, Khutoreskaya Galina, Zhang Rongguang,, Joachimiak Andrzej, Doyle A. Declan, Bochkarev Alexey, Maguire E. Michael, Edwards M. Aled & Koth M.Christopher, Crystal structure of the CorA Mg2+ transporter, Nature Publishing Group,vol.440 /2006
8. Ma Che & Chang Geoffrey, Structure of the multidrug resistence efflux transporter EmrE from Escherichia coli,PNAS, vol. 101, no 9, 2852-2857,
www.pnsa.org/cgi/doi/10.1073/pnsa.0400137101
9. Nishida Motohiko & MacKinnon Roderick , Structural Basis of Inward Rectification: cytoplasmic Pore of the G Protein-Gated Inward Rectifier GIRK1 at 1.8Ǻ Resolution, Cell Press, vol.111/2002, 957-965
10. Strzelczyk Anna Agnieszka, Jarończyk, Chilmonczyk Zdzislaw, Mazurek Pawel Aleksander, Chojnacka - Wόjcik Ewa, Sylte Ingebrigt, Intrinsec activity and comparative molecular dynamics of buspirone analogues at the 5-HT1A receptors, Biochemical Pharmacology,vol.67/2004, 2219 - 2230
www.elsevier.com/locate/biochempharm
11.Yamashita Atsuko, Singh K. Satinder, Kawate Toshimitsu, Jin Yan & Gouaux Eric, Crystal structure of a bacterial homologue of Na+/Cl- -dependent neurotransmitter transporters, Nature Publishing Group, vol. 437/2005
12.Yernool Dinesh, Boudker Olga, Jin Yan & Gouaux Eric, Structure of a glutamate transporter homologue from Pyrococcus horikoshii , Nature Publishing Group, vol.431 /2004, www.nature.com/nature.
13. Yu W. Edward, McDermott Gerry, Zgurskaya I. Helen, Nikaido Hiroshi, Koshland Jr. E. Daniel, Structural Basis of Multiple Drug-Binding Capacity of the AcrB Multidrug Efflux Pump, Science, vol. 300/2003, 976-980
https://www.abctransporters.com/
https://en.wikipedia.org/wiki/Image:CFTR.jpg
https://ghr.nlm.nih.gov/gene=abcd1
https://www.ibpc.fr/UMR7099/pdf/Pohl05.pdf
https://jb.asm.org/cgi
https://hmg.oxfordjournals.org
https://www.pnas.org
Copyright © 2024 - Toate drepturile rezervate